Đề kiểm tra 1 tiết Hóa học 12 học kì 2 có đáp án (Bài kiểm tra số 2)
Đề kiểm tra 1 tiết Hóa học 12 học kì 2 có đáp án (Bài kiểm tra số 2)
Câu 1: Dãy kim loại nào dưới đây bị thụ động trong axit HNO3 đặc, nguội ?
A. Fe, Al, Cr B. Fe, Al, Ag C. Fe, Al, Cu D. Fe, Zn, Cr
Đáp án: A
Câu 2: Hoà tan Fe vào dung dịch AgNO3 dư, dung dịch thu được chứa chất nào sau đây?
A. Fe(NO3)2 B. Fe(NO3)3
C. Fe(NO2)2, Fe(NO33, AgNO3 D. Fe(NO3)3, AgNO3
Đáp án: D
Câu 3: Cho hỗn hợp bột Fe, Cu vào dung dịch HNO3 loãng, sau phản ứng vần còn bột Fe dư. Dung dịch thu được chứa chất tan là
A. Fe(NO3)3, Cu(NO3)2. B. Fe(NO33)3, HNO3, Cu(NO3)2.
C. Fe(NO3)2. D. Fe(NO3)2, Fe(NO3)3, Cu(NO3)2
Đáp án: C
Câu 4: Hỗn hợp bột X gồm a gam Fe, b gam Cu và c gam Ag. Cho X vào dung dịch chỉ chứa một chất tan Y và khuấy kĩ, sau khi kết thúc phản ứng thu được c gam kim loại. Chất tan Y là
A. AgNO3. B. HCl. C Fe2(SO4)3. D.CuCl2.
Đáp án: C
Câu 5: Hỗn hợp bột rắn X gồm Al, Fe2O3 và Cu có số mol bằng nhau. Hỗn hợp X tan hoàn toàn trong dung dịch
A. HCl (dư). B. NaOH (dư). C. AgNO3 (dư). D. NH(dư),
Đáp án: A
Câu 6: Cho hỗn hợp FeS và FeS2 tác dụng vớí dung dịch HNO3 loãng dư thu dung dịch A chứa các ion nào sau đây ?
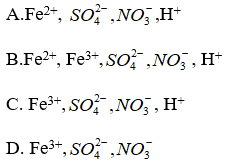
Đáp án: C
Câu 7: Dãy các chất và dung dịch nào sau đây khi tác dụng với Fe dư thu được sản phẩm cuối cùng là Fe(II) ?
A. dung dịch HCl, dung dịch AgNO3, dung dịch HNO3 loãng
B. khí Cl2, dung dịch HNO3, dung dịch H2SO4 loãng
C. dung dịch AgNO3, dung dịch HNO3, dung dịch H2SO4 đặc, nguội
D. dung dịch NaOH, O2 (không khí ẩm), H2SO4 loãng
Đáp án: A
Câu 8: Hai chất nào sau đây tác dụng được với nhau tạo ra được Fe(NO3)3?
A. Fe + HNO3 đặc, nguội B. Fe + Cu(NO3)2
C. Fe(NO3)3 + Cl2 D. Fe + Fe(NO3)2
Đáp án: C
Câu 9: Cho các chất Cu, Fe, Ag vào cốc dung dịch HCl, CuSO4, Fe(NO3)2, FeCl3. Số cặp chất có phản ứng với nhau là:
A. 5 B. 2 C. 3 D. 4
Đáp án: D
Câu 10: Cho dãy các chất : FeO, Fe(OH)2, FeSO4, Fe2(SO4)3, Fe3O4 , Fe23. Số chất trong dãy tác dụng được với dung dịch HNO3 đặc, nóng là
A.3 B. 5. C. 4. D. 6.
Đáp án: B
Câu 11: Cho các sơ đồ phản ứng sau:
Fe + O2 −to→ (A) (1) (C) + NaOH → (E) + (G) (4)
(A) + HCl → (B) + (C) + H2O (2) (D) + ? + ? → (E) (5)
(B) + NaOH → (D) + (G) (3) (E) −to→ (F) + ? (6)
Thứ tự các chất (A), (D), (F) lần lượt là
A. Fe2O3, Fe(OH)3, Fe2O3. B. Fe3O4, Fe(OH)3, Fe2O3.
C. Fe3O4, Fe(OH)2, Fe2O3. D. Fe2O3, Fe(OH)2, Fe2O3.
Đáp án: C
Câu 12: Sơ đồ phản ứng nào sau đây đúng (mỗi mũi tên biểu diễn một phản ứng) ?
A. FeS2 → Fe(NO3)2 →Fe(OH)2 →Fe(OH)3 → Fe2O3 → Fe.
B. FeS2 → FeO → FeSO4 → Fe(OH)2 →FeO → Fe.
C. FeS2 → Fe(NO3)2 → FeCl3→ Fe(OH)2 → Fe2O3→ Fe.
D. FeS2 → Fe(NO3)2 → Fe(NO3)3 → Fe(NO3)3 → Fe(OH)2 → Fe.
Đáp án: C
Câu 13: Hoà tạn hoàn toàn m gam Fe trong dung dịch HNO3 loãng dư, sau khi phàn ứng kết thúc thu được 0,448 lít khí NO duy nhất (đktc). Giá trị của m là
A. 11,2. B.0,56. C. 5,60. D. 1 12.
Đáp án: D
Câu 14: Cho a gam bột sắt tác dụng hết với dung dịch H2SO4 loãng dư, thu được 560 ml một chất khí (đktc). Nếu cho a gam bột sắt tác dụng hết với dung dịch CuSO4 dư thì thu được m gam một chất rắn. Giá trị m là
A. 1,4. B.2,8. C. 1,6. D. 3,2.
Đáp án: C
Câu 15: Nung một mẫu thép thường có khối lượng 10 gam trong O2 dư thu được 0,1568 lít khí CO2 (đktc). Thành phần phần trăm theo khối lượng của cacbon trong mẫu thép đó là
A. 0,82% B. 0,84%. C. 0,88%. D. 0,86%.
Đáp án: B
Câu 16: Cho 40,0 gam hỗn hợp X gồm Fe và Fe3O4 (tỉ lệ mol 3:1) vào dung dịch HNO3 loãng, nỏng thu dược khí NO và còn lại 2,8 gam Fe chưa tan. Thể tích khí NO thoát ra (đktc) là (biết NO là sản phẩm khứ duy nhất của HNO3)
A. 4,48 lít. B. 2,24 lit. C. 6,35 lít. D3,36 lít
Đáp án: B
Câu 17: Cho luồng khí CO dư đi qua ống sứ đựng m gam hỗn hợp FeO và Fe2O3 nung nóng. Sau một thời gian, khối lượng chất rắn còn lại trong ống sứ là 5,5 gam. Cho khí đi ra khỏi ống sứ hấp thụ vào nước vôi trong dư, thu được 5 gam kết tủa. Giá trị của m là:
A.6,30. B 6,50, C. 6.94 D.7,10.
Đáp án: A
Câu 18: Hoà tan hoàn toàn hỗn hợp gồm FeS2 0,24 mol và Cu2S vào dung dich HNO3 vừa đủ thu được dung địch X (chỉ chứa hai muối sunfat) và V lít đktc; khí NO duy nhất. Giá trị của V là
A, 34,048. B. 35,840. C. 31,360. D, 25,088.
Đáp án: B
Gọi số mol CuS2 là a
Bảo toàn mol nguyên tử S:
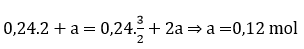
Bảo toàn e:
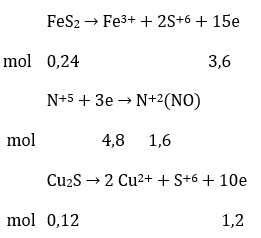
VNO = 22,4.1,6 = 35,84 lít
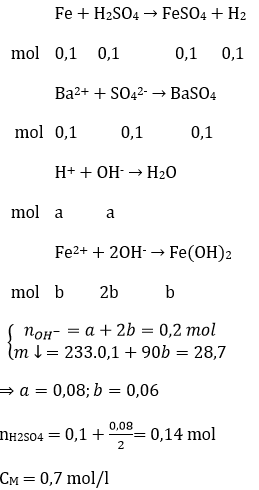
Câu 19: Hoà tan hoàn toàn m gam Fe trong 200 ml dung dịch H2SO4 loãng (dư), thu được dung dịch X và 2,24 lít khí H2 (đktc). Thêm 100 ml dung dịch Ba(OH)2 1M vào X, thu được 28,7 gam kết tủa. Nồng độ mol của dung dịch H2SO4 ban đầu là
A. 0,7M. B. 1,4M. C. 0,8M. D. 1,0M.
Đáp án: A
Câu 20: Cho m gam bột Fe vào dung dịch hỗn hợp chứa 0,16 mol Cu(NO3)2 và 0,4 mol HCl, lắc đều cho phản ứng xảy ra hoàn toàn, thu được hỗn hợp kim loại có khối lượng bằng 0,7m gam và V lít khí nâu đỏ duy nhất (đktc). Giá trị của m và V lần lượt là
A. 33,07 ; 4,48. B. 14,4 ; 4,48. C. 17,45 ; 3,36. D. 35,5 ; 5,6.
Đáp án: B
Fe + 6H+ + 3NO3- → Fe3+ + 3NO2 + 3H2O
Ta có: nH+ = 0,4 mol; nNO3- = 0,32 mol ⇒ NO3- dư
nNO2 = 1/2. nH+ = 0,2 mol ⇒ V = 4,48 lít
Thu được hỗn hợp kim loại ⇒ Fe dư và Cu; muối thu được chỉ gồm Fe2+
Gọi x là số mol của Fe phản ứng
Qúa trình cho e: Fe → Fe2+ + 2e
Qúa trình nhận e: Cu2+ + 2e → Cu
N+5 + 1e → NO2
Bảo toàn e: 2x = 0,16. 2 + 0,2 ⇒ x = 0,26 mol
mc/r sau phản ứng = mFe dư + mCu sinh ra = m – 0,26. 56 + 0,16. 64 = 0,7m
⇒ m = 14,4 g
Câu 21: Crom dễ phản ứng với
A. dung dịch HCl loãng nguội. B. dung dịch HNO3 đặc nguội.
C. dung dịch NaOH đặc nóng. D. dung dịch H2SO2 loãng nóng.
Đáp án: D
Câu 22: Trong phản ứng :
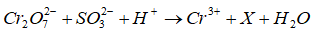
X có thể là chất nào sau đây ?
A. SO2. B. S. C. H2S. D. SO42-
Đáp án: D
Câu 23: Hãy cho biết phản ứng nào sau đây không đúng ?
A. K2Cr2O7 + 2KOH → 2 K2Cr2O4 + H2O
B. K2Cr2O7 + H2SO4 đặc → K2Cr2O4 + 2CrO3 + H2O
C. 2 K2Cr2O4+ H2SO4 loãng → K2Cr2O7 + K2SO4
D. 2 K2Cr2O4 + 2HCl đặc → K2Cr2O7+ 2KCl + H2O
Đáp án: D
Câu 24: Cho sơ đồ sau :
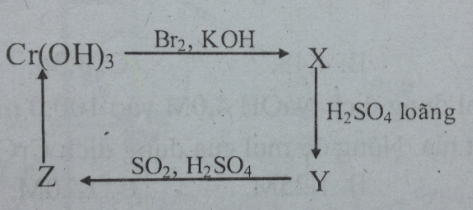
Các chất X, Y, Z lần lượt là
A. K2Cr2O7, K2Cr2O4, Cr2(SO4)3 B. K2Cr2O4, K2Cr2O7, Cr2(SO4)3
C. KCrO2, K2Cr2O7, Cr2(SO4)3 D. KCrO2, K2Cr2O4, CrSO4
Đáp án: B
Câu 25: Hiện tượng nào dưới đây đã mô tả không đúng?
A. Cho chấi rắn CrO3 vào dung dịch NaOH dư thì thu được dung dịch có mầu vàng,
B, Thêm dung dịch H2SO4 dư vào dung dịch K2Cr2O4 thì dung dịch chuyển từ mầu vàng sang màu da cam,
C, Thêm lượng dư NaOH với dung dịch K2Cr2O7 thì dung dịch chuyến từ màu da cam sang màun vàng,
D, Thêm từ từ dung dịch NaOH vào dung dịch CrCl3 thấy xuất hiện kết tủa màu vàng sau đó kết tủa tan dần.
Đáp án: D
Câu 26: Phát biểu nào sau đây không đúng ?
A, Hợp chất Cr(II) có tính khử dặc trưng còn hợp chất Cr(VI) có tính oxi hoá mạnh.
B, Các hợp chất Cr2O3, Cr(OH)3, CrO, Cr(OH)2 đều có tính lưỡng tính.
C, Các hợp chất CrO, Cr(OH)2 tác dụng được với dung dịch HCl còn CrO3 tác dụng được với dung dịch NaOH.
D, Thêm dung dịch kiềm vào muối đicromat, muối này chuyển thành muối cromat.
Đáp án: B
Câu 27: Để oxi hoá hoàn toàn 0,01 mol CrCl3 thành K2Cr2O4 bằng Cl2 khi có mặt KOH, lượng tối thiếu Cl2 và KOH tương ứng là
A. 0,015 mol và 0,04 mol. B. 0,015 mol và 0,08 mol.
C. 0,03 mol và 0,08 mol. D. 0,03 mol và 0,04 mol.
Đáp án: B
Câu 28: Khi cho 41,4 gam hỗn hợp X gồm Fe2O3, Cr2O3 và Al2O3 tác dụng với dung dịch NaOH đặc (dư), sau phản ứng thu được chất rắn có khối lượng 16 gam. Để khử hoàn toàn 41,4 gam X bằng phản ứng nhiệt nhôm phải dùng 10,8 gam Al. Thành phần % theo khối lượng của Cr2O3 trong hỗn hợp X là (giả thiết các phản ứng đều xảy ra hoàn toàn)
A, 20,33%. B. 66,67%. C. 50,67%. D. 36,71%.
Đáp án: D
Gọi số mol 3 oxit lần lượt là a,b,c ⇒ 160a + 152b + 102c = 41,4 (1)
Fe2O3 + NaOH → không phản ứng
Cr2O3 + NaOH → 2NaCrO2 + H2O
Al2O3 + NaOH → 2NaAlO2 + H2O
Chất rắn không tan là Fe2O3 ⇒ 160a = 16 (2)
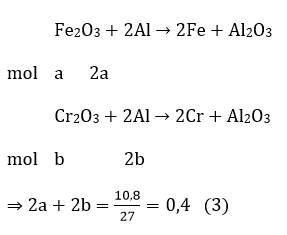
Giải hệ (1), (2) và (3) ta được: a = 0,1; b = 0,1; c= 0,1
⇒ mCr2O3 = 152. 0,1 = 15,2 gam
⇒ %mCr2O3 = (15,2/41,4). 100% = 36,71%
Câu 29: Nung hỗn hợp bột gồm 15,2 gam Cr2O3 và m gam Al ở nhiệt độ cao. Sau khi phản ứng xảy ra hoàn toàn, thu được 23,3 gam hỗn hợp rắn X. Cho toàn bộ hỗn hợp X phản ứng với dung dịch HCl dư thoát ra V lít khí H2 (đktc). Giá trị của V là
A.7,84. B. 4,48. C. 3.36. D. 10,08.
Đáp án: A
mAl pứ = 23,3 - 15,2 = 8,1 gam
nAl = 0,3 mol; nCr2O3 = 0,1 mol
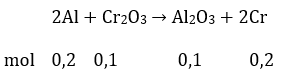
Hỗn hợp X : 0,1 mol Al dư; 0,1 mol Al2O3; 0,2 mol Cr
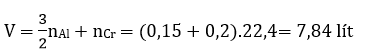
Câu 30: Cho 100,0 ml dung địch NaOH 4,OM vào 100,0 ml dung dịch CrCl3, thu được 10,3 gam kết tủa. Nồng độ mol của dung dịch CrCl3 là
A, 1,00M B. 1.25M. C. 1,20M. D. 1,40M
Đáp án: B
nNaOH = 0,4 > 3nCr(OH)3 = 0,3
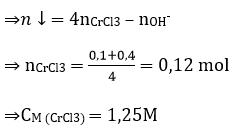
Xem thêm Bài tập & Câu hỏi trắc nghiệm Hóa học 12 có đáp án khác:
- 4 câu trắc nghiệm Thí nghiệm Tính chất hóa học của sắt, crom
- 15 câu trắc nghiệm Nhận biết một số chất vô cơ có đáp án
- 16 câu trắc nghiệm Hóa học và vấn đề môi trường có đáp án
- 36 câu trắc nghiệm Ôn tập Hóa học 12 học kì 2 có đáp án
- Đề thi Hóa học 12 Học kì 2 (có đáp án)
Sách VietJack thi THPT quốc gia 2024 cho học sinh 2k6:
Săn shopee siêu SALE :
- Sổ lò xo Art of Nature Thiên Long màu xinh xỉu
- Biti's ra mẫu mới xinh lắm
- Tsubaki 199k/3 chai
- L'Oreal mua 1 tặng 3
- Soạn Văn 12
- Soạn Văn 12 (bản ngắn nhất)
- Văn mẫu lớp 12
- Giải bài tập Toán 12
- Giải BT Toán 12 nâng cao (250 bài)
- Bài tập trắc nghiệm Giải tích 12 (100 đề)
- Bài tập trắc nghiệm Hình học 12 (100 đề)
- Giải bài tập Vật lý 12
- Giải BT Vật Lí 12 nâng cao (360 bài)
- Chuyên đề: Lý thuyết - Bài tập Vật Lý 12 (có đáp án)
- Bài tập trắc nghiệm Vật Lí 12 (70 đề)
- Luyện thi đại học trắc nghiệm môn Lí (18 đề)
- Giải bài tập Hóa học 12
- Giải bài tập Hóa học 12 nâng cao
- Bài tập trắc nghiệm Hóa 12 (80 đề)
- Luyện thi đại học trắc nghiệm môn Hóa (18 đề)
- Giải bài tập Sinh học 12
- Giải bài tập Sinh 12 (ngắn nhất)
- Chuyên đề Sinh học 12
- Đề kiểm tra Sinh 12 (có đáp án)(hay nhất)
- Ôn thi đại học môn Sinh (theo chuyên đề)
- Luyện thi đại học trắc nghiệm môn Sinh (18 đề)
- Giải bài tập Địa Lí 12
- Giải bài tập Địa Lí 12 (ngắn nhất)
- Giải Tập bản đồ và bài tập thực hành Địa Lí 12
- Bài tập trắc nghiệm Địa Lí 12 (70 đề)
- Luyện thi đại học trắc nghiệm môn Địa (20 đề)
- Giải bài tập Tiếng anh 12
- Giải bài tập Tiếng anh 12 thí điểm
- Giải bài tập Lịch sử 12
- Giải tập bản đồ Lịch sử 12
- Bài tập trắc nghiệm Lịch Sử 12
- Luyện thi đại học trắc nghiệm môn Sử (20 đề)
- Giải bài tập Tin học 12
- Giải bài tập GDCD 12
- Giải bài tập GDCD 12 (ngắn nhất)
- Bài tập trắc nghiệm GDCD 12 (37 đề)
- Luyện thi đại học trắc nghiệm môn GDCD (20 đề)
- Giải bài tập Công nghệ 12









