Axit nitơric và muối nitrat
Chuyên đề: Nitơ - Photpho
Axit nitơric và muối nitrat
A. AXIT NITRIC
I. Cấu tạo phân tử:
- CTPT: HNO3
CTCT: 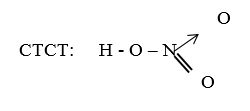
II. Tính chất vật lý
- Là chất lỏng không màu, D = 1.53g/cm3
- Axit nitric không bền, khi có ánh sang phân hủy một phần
4HNO3 → 4NO2 + O2 + 2H2O
- Axit nitric tan vô hạn trong nước.
III. Tính chất hóa học
1. Tính axit: Là một trong số các axit mạnh nhất, trong dung dịch:
HNO3 → H+ + NO3-
- Dung dịch axit HNO3 có đầy đủ tính chất của môt dung dịch axit : làm đỏ quỳ tím , tác dụng với oxit bazơ, bazơ, muối của axit yếu hơn.
2. Tính oxi hóa:
Kim loại hay phi kim khi gặp axit HNO3 đều bị oxi hóa về trạng thái oxi hóa cao nhất.
a) Với kim loại:
HNO3 oxi hầu hết các kim loại( trừ vàng (Au) và platin(Pt) )
Vd:Cu + 4HNO3(đ) → Cu(NO3)2 + 2NO2 + 2H2O.
3Cu + 8HNO3(l)→ 3Cu(NO3)2 + 2NO + 4H2O.
+ Fe, Al, Cr bị thụ động hóa trong dung HNO3 đặc nguội.
b) Với phi kim:
Khi đun nóng HNO3 đặc có thể tác dụng với phi :C, P, S...(trừ N2 và halogen)
S + 6HNO3(đ) → H2SO4 + 6NO2 + 2H2O
c) Với hợp chất:
- H2S, Hl, SO2, FeO, muối sắt (II)... có thể tác dụng với HNO3 nguyên tố bị oxi hoá trong hợp chất chuyển lên mức oxi hoá cao hơn. Ví dụ như :
3FeO + 10HNO3(d) → 3Fe(NO3)3 + NO + 5H2O
3H2S + 2HNO3(d) → 3S + 2NO + 4H2O
- Nhiều hợp chất hữu cơ như giấy, vải, dầu thông... bốc cháy khi tiếp xúc với HNO3 đặc.
V. Điều chế
1-Trong phòng thí nghiệm
NaNO3 (r) + H2SO4 (đ) to→ HNO3 + NaHSO4
Điện phân các muối nitrat của kim loại đứng sau H+ của nước ( sau Al)
M(NO3)x +x/2 H2O đp→ M + x/4 O2 + xHNO3
2- Trong công nghiệp: NH3 → NO → NO2 → HNO3
B. MUỐI NITRAT
I. Tính chất vật lý: Dễ tan trong nước , là chất điện li mạnh trong dung dịch phân ly hoàn toàn thành các ion.
Ca(NO3)2 → Ca2+ + 2NO3-
- Ion NO3- không có
II. Tính chất hóa học:
Các muối nitrat của kim loại kiền và kiềm thổ có môi trường trung tính, muối của kim loại khác có môi trường axit (pH < 7)
1 . Nhiệt phân muối Nitrat
a) Muối nitrat của các kim loaị hoạt động (trước Mg):
Nitrat → Nitrit + O2
vd: 2KNO3 to→ 2KNO2 + O2
b) Muối nitrat của kim loại từ Mg → Cu:
Nitrat → Oxit kim loại + NO2 + O2
vd: 2Cu(NO3)2 to→ 2CuO + 4NO2 + O2
c) Muối của những kim lạo kém hoạt (sau Cu ) :
Nitrat → kim loại + NO2 + O2
vd: 2AgNO3 to→ 2Ag + 2NO2 + O2
2. Ion NO3- trong H+ (axit)
NO3- + 4H+ + 3e → NO + 2H2O
Ví dụ: 3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO↑ + 2H2O
3. Ion NO3- trong OH-(kiềm) : OXH được các kim loại lưỡng tính:
8Al + 3NO3- + 5OH- + 2H2O → 8AlO2- + 3NH3↑
4. Nhận biết ion nitrat (NO3-)
Trong môi trường axit , ion NO3- thể hiện tính oxi hóa giống như HNO3. Do đó thuốc thử dùng để nhận biết ion NO3- là hỗn hợp vụn đồng và dung dịch H2SO4 loãng, đun nóng.
Hiện tượng : dung dịch có màu xanh, khí không màu hóa nâu đỏ trong không khí.
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2 NO↑ + 4H2O
2NO + O2 ( không khí) → 2NO2 ( màu nâu đỏ)
Tham khảo các bài Chuyên đề 2 Hóa 11 khác:
- Nitơ
- Amoniac và muối amoni
- Axit nitoric và muối nitrat
- Axit photphoric và muối photphonat
- Phân bón hóa học
- Hiệu suất trong tổng hợp NH3
- Bài tập trắc nghiệm Hiệu suất trong tổng hợp NH3
- Phản ứng tạo phức của NH3
- Bài tập trắc nghiệm Phản ứng tạo phức của NH3
- Phản ứng muối amoni
- Bài tập trắc nghiệm Phản ứng muối amoni
- Kim loại tác dụng với HNO3
- Bài tập trắc nghiệm Kim loại tác dụng với HNO3
- Oxit kim loại tác dụng với HNO3
- Bài tập trắc nghiệm Oxit kim loại tác dụng với HNO3
- Phản ứng NO3- trong môi trường bazơ
- Bài tập trắc nghiệm Phản ứng NO3- trong môi trường bazơ
- Nhiệt phân muối NO3-
- Bài tập trắc nghiệm Nhiệt phân muối NO3-
- Photpho và hợp chất của photpho
- Bài tập trắc nghiệm Photpho và hợp chất của photpho
- Nhận biết một số chất tiêu biểu của nhóm nitơ
- Bài tập trắc nghiệm Nhận biết một số chất tiêu biểu của nhóm nitơ
Tủ sách VIETJACK shopee lớp 10-11 cho học sinh và giáo viên (cả 3 bộ sách):
Săn shopee siêu SALE :
- Sổ lò xo Art of Nature Thiên Long màu xinh xỉu
- Biti's ra mẫu mới xinh lắm
- Tsubaki 199k/3 chai
- L'Oreal mua 1 tặng 3
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Tin học 11 - CTST
- Giải sgk Công nghệ 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải Giáo dục quốc phòng 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều









