Đề kiểm tra 15p Hóa học 10 Học kì 2 có đáp án (Bài số 1)(8 đề)
Dưới đây là danh sách Đề kiểm tra 15p Hóa học 10 Học kì 2 có đáp án (Bài số 1)(8 đề). Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện & đạt điểm cao trong các bài thi môn Hóa học 10.
Đề kiểm tra 15p Hóa học 10 Học kì 2 có đáp án (Bài số 1)(8 đề)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 1 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Đề kiểm tra 15 phút - Trắc nghiệm
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm Học kì 2
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 1)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 1 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
Câu 1: Dãy đơn chất nào sau đây được sắp xếp đúng theo thứ tự tính oxi hoá giảm dần?
A. Br2, Cl2, F2 , I2.
B. F2 , Cl2, Br2, I2.
C. I2, Br2, Cl2, F2.
D. Cl2, F2, Br2, I2.
Câu 2: Phản ứng hóa học nào sau đây không xảy ra?
A. 2KOH + Cl2 → KClO + KCl + H2O.
B. 2KCl + Br2 → Cl2 + 2KBr.
C. Cl2 + 2KI → 2KCl +I2.
D. Cu + Cl2 → CuCl2.
Câu 3: Cho 8,7 gam MnO2 tác dụng với lượng dư dung dịch HCl đặc, đun nóng. Thể tích khí thoát ra (ở đktc) là
A. 0,56 lít. B. 1,12 lít. C. 2,24 lít. D. 0,112 lít.
Câu 4: Dãy chất nào dưới đây tác dụng được với dd HCl?
A. Fe2O3, KMnO4, Cu.
B. CaCO3, CuO, H2SO4.
C. AgNO3, NaOH, CuO.
D. CuO, KOH, Ag.
Câu 5: Cho 25,6 gam hỗn hợp G gồm: FeCO3 và Mg vào một lượng vừa đủ m gam ddHCl 10%. Sau phản ứng thu được dung dịch A và 6,72 lít khí B ở đktc. % khối lượng của FeCO3 và Mg lần lượt là
A. 90, 625% và 9,375%.
B. 9,375% và 90,625%.
C. 37,235% và 62,765%.
D. 62,765 và 37,235%.
Câu 6: Các nguyên tố halogen có cấu hình electron lớp ngoài cùng là
A. ns2np5. B. 4s24p5. C. 3s23p5. D. 2s22p5.
Câu 7: Kết tủa hoàn toàn m gam NaCl bởi dung dịch AgNO3 dư thấy thu được 2,87 gam kết tủa. Giá trị của m là
A. 11,7 gam. B. 1,71 gam. C. 17,1 gam. D. 1,17 gam.
Câu 8: Thành phần của nước Gia – ven là
A. NaCl, NaClO, H2O.
B. HCl, HClO, Cl2, H2O.
C. CaOCl2, H2O.
D. KClO3, H2O.
Câu 9: Dung dịch axit nào sau đây không thể chứa trong bình thủy tinh?
A. HCl. B. HBr. C. HF. D. H2SO4.
Câu 10: Đổ dung dịch chứa 1 mol NaOH vào dung dịch chứa 1 mol HCl. Nhúng giấy quỳ tím vào dung dịch thu được thì quỳ tím chuyển sang màu nào?
A. Màu đỏ. B. Màu xanh.
C. Không đổi màu. D. Không xác định được
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | B | B | C | C | A | A | D | A | C | C |
Câu 1: Tính oxi hoá giảm dần theo thứ tự F2 , Cl2, Br2, I2. Chọn đáp án B.
Câu 2: KCl + Br2 → không xảy ra do tính oxi hóa Br2 < Cl2. Chọn đáp án B.
Câu 3:
MnO2 + 4HCl → MnCl2 + Cl2 + H2O.
Số mol Cl2 = số mol MnO2 = 0,1 mol. Vậy V = 2,24 lít. Chọn đáp án C.
Câu 4: Dãy chất tác dụng được với dd HCl là AgNO3, NaOH, CuO. Chọn đáp án C.
Câu 5:
FeCO3 + 2HCl → FeCl2 + CO2 + H2O.
a a (mol)
Mg + 2HCl → MgCl2 + H2.
b b (mol)
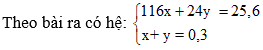
giải hệ có x = 0,2; y = 0,1
→ % khối lượng FeCO3 và Mg lần lượt là 90, 625% và 9,375%. Chọn đáp án A.
Câu 6: Các nguyên tố halogen có cấu hình electron lớp ngoài cùng là ns2np5. Chọn đáp án A.
Câu 7:
NaCl + AgNO3 → NaNO3 + AgCl
0,02 ← 0,02 (mol)
m = 0,02.58,5 = 1,17 gam. Chọn đáp án D.
Câu 8: Thành phần của nước Gia – ven là NaCl, NaClO, H2O. Chọn đáp án A.
Câu 9: Axit HF có tính chất đặc biệt là ăn mòn thủy tinh nên không thể đựng trong bình thủy tinh. Chọn đáp án C.
Câu 10:
NaOH + HCl → NaCl + H2O
1 1 (mol)
Sau phản ứng dung dịch thu được chỉ chứa NaCl, vậy dung dịch sau phản ứng không làm quỳ tím đổi màu. Chọn đáp án C.
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm Học kì 2
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 2)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 1 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
Câu 1: Nguyên tố nào sau đây không thuộc nhóm halogen?
A. F. B. Cl. C. P. D. I.
Câu 2: Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí Cl2 nhiều nhất là
A. KMnO4. B. CaOCl2. C. K2Cr2O7. D. MnO2.
Câu 3: Chất dùng để làm khô khí Cl2 ẩm là
A. dung dịch H2SO4 đậm đặc.
B. Na4SO3 khan.
C. dung dịch NaOH đặc.
D. CaO.
Câu 4: Cho 1,2 gam Mg phản ứng hoàn toàn với lượng dư dung dịch HCl loãng thu được thể tích khí H2 ở đktc là?
A. 1,12 lít. B. 2,24 lít. C. 5,6 lít. D. 6,72 lít.
Câu 5: Cho dung dịch muối X không màu tác dụng với dung dịch AgNO3, sản phẩm thu được có kết tủa màu vàng đậm. Dung dịch muối X là
A. NaI. B. FeCl3. C. KF. D. KBr.
Câu 6: CaOCl2 thuộc loại muối nào trong các loại muối sau?
A. Muối hỗn hợp. B. Muối hỗn tạp.
C. Muối kép. D. Muối axit.
Câu 7: Trong công nghiệp iot chủ yếu được sản xuất từ nguồn nguyên liệu nào?
A. Nước biển. B. Muối ăn.
C. Rong biển. D. Tro.
Câu 8: Ở 20ºC dung dịch HCl đặc nhất có nồng độ là
A. 98%. B. 63%. C. 37%. D. 20%.
Câu 9: Cho 3,184g hỗn hợp NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kì liên tiếp; X, Y khác F) vào dung dịch AgNO3 dư thì thu được 5,734g kết tủa. Công thức của 2 muối là
A. NaBr và NaI. B. NaCl và NaI.
C. NaCl và NaBr. D. Không xác định được.
Câu 10: Nhận xét nào sau đây là đúng?
A. Nhóm halogen gồm các nguyên tố F, Cl, Br, I và Pt.
B. Các nguyên tố halogen có cấu hình electron lớp ngoài cùng là ns2np4.
C. Tính chất hóa học cơ bản của các halogen là tính khử mạnh.
D. Trong tất các các hợp chất, flo chỉ có số oxi hóa -1.
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | C | C | A | A | A | B | C | C | A | D |
Câu 1: P thuộc nhóm VA không thuộc nhóm halogen (VIIA). Chọn đáp án C.
Câu 2:
CaOCl2 + 2HCl → CaCl2 + Cl2 + H2O (1)
1 1 (mol)
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (2)
1 2,5 (mol)
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O (3)
1 3 (mol)
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (4)
1 1 (mol)
Từ 4 PTHH trên nhận thấy nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí Cl2 nhiều nhất là K2Cr2O7. Chọn đáp án C.
Câu 3: Chất có thể dùng để làm khô khí Cl2 ẩm là dung dịch H2SO4 đậm đặc. Chọn đáp án A.
Câu 4:
Mg + 2HCl → MgCl2 + H2
0,05 → 0,05 (mol)
Vậy VH2 = 0,05.22,4 = 1,12 lít. Chọn đáp án A.
Câu 5:
AgNO3 + NaI → AgI (↓ vàng đậm) + NaNO3
3AgNO3 + FeCl3 → 3AgCl (↓ trắng) + Fe(NO3)3
AgNO3 + KF → không phản ứng
AgNO3 + KBr → AgBr (↓ vàng) + KNO3
Chọn đáp án A.
Câu 6: CaOCl2 thuộc loại muối hỗn tạp. Chọn đáp án B.
Câu 7: Trong công nghiệp iot chủ yếu được sản xuất rong biển. Chọn đáp án C.
Câu 8: Ở 20ºC dung dịch HCl đặc nhất có nồng độ là 37%. Chọn đáp án C.
Câu 9:
Theo bài ra: X, Y khác F gọi X, Y là E (điều kiện: 35,5 < ME < 127). Ta có PTHH:
NaE + AgNO3 → AgE + NaNO3
Ta có số mol NaE = số mol AgE
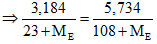
Giải phương trình có ME ≈ 83,13. Vậy hai muối là NaBr và NaI. Chọn đáp án A.
Câu 10: Nhận xét đúng là: Trong tất các các hợp chất, flo chỉ có số oxi hóa -1. Chọn đáp án D.
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm Học kì 2
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 3)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 1 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
Câu 1: Liên kết trong phân tử halogen (X2) có đặc điểm là
A. bền. B. rất bền.
C. không bền lắm. D. rất yếu.
Câu 2: Cho 13,44 lít khí clo (ở đktc) đi qua 2,5 lít dung dịch KOH ở 100ºC. Sau khi phản ứng xảy ra hoàn toàn, thu được 37,25 gam KCl. Dung dịch KOH trên có nồng độ là
A. 0,24M. B. 0,48M. C. 0,4M. D. 0,2M.
Câu 3: Nguyên tố clo không có khả năng thể hiện số oxi hóa là
A. +1. B. +3. C. 0. D. +6.
Câu 4: Cho 2,5 gam CaCO3 tác dụng với dung dịch HCl dư, đun nóng.Thể tích khí thoát ra (ở đktc) là
A. 0,112 lít. B. 0,56 lít. C. 1,12 lít. D. 2,24 lít.
Câu 5: Cho các phản ứng sau:
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O (1)
2HCl + Fe → FeCl2 + H2 (2)
6HCl + 2Al → 2AlCl3 + 3H2 (3)
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (4)
2HCl + Na2SO3 → 2NaCl + SO2 + H2O (5)
Số phản ứng trong đó HCl thể hiện tính oxi hóa là
A. 4. B. 2. C. 3. D. 1.
Câu 6: Thuốc thử nào sau đây có thể phân biệt được các ion: F-, Cl-, Br-, I-?
A. AgNO3. B. NH4NO3. C. NaHSO4. D. Ba(OH)2.
Câu 7: Cho 0,515 gam muối natri halogenua (A) tác dụng với dung dịch AgNO3 dư thu được một kết tủa, kết tủa này sau khi phân hủy hoàn toàn cho 0,54 gam Ag. Muối A là
A. NaF. B. NaCl. C. NaBr. D. NaI.
Câu 8: Khí nào sau đây không bị oxi hoá bởi nước Gia - ven?
A. SO2. B. CO2. C. HCHO. D. H2S.
Câu 9: Đơn chất halogen nào sau đây chỉ có tính oxi hóa?
A. F2. B. Cl2. C. Br2. D. I2.
Câu 10: Nếu lấy khối lượng KMnO4, MnO2, KClO3 bằng nhau để cho tác dụng với dung dịch HCl đặc, dư thì chất nào cho nhiều clo hơn?
A. MnO2 B. KClO3
C. KMnO4 D. Cả 3 chất như nhau
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | C | A | D | B | B | A | C | B | A | B |
Câu 1: Liên kết trong phân tử halogen (X2) không bền lắm. Chọn đáp án C.
Câu 2:
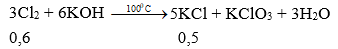
Theo bài ra Cl2 dư, số mol KOH tính theo KCl.
Ta có số mol KOH = 0,6 mol. Vậy CM (KOH) = 0,6 : 2,5 = 0,24M. Chọn đáp án A.
Câu 3: Nguyên tố clo không có khả năng thể hiện số oxi hóa là +6. Chọn đáp án D.
Câu 4:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
0,025 0,025 (mol)
Vkhí = 0,025.22,4 = 0,56 lít. Chọn đáp án B.
Câu 5:
Phản ứng trong đó HCl thể hiện tính oxi hóa là
2HCl + Fe → FeCl2 + H2 (2)
6HCl + 2Al → 2AlCl3 + 3H2 (3)
Chọn đáp án B.
Câu 6: Thuốc thử có thể phân biệt được các ion: F-, Cl-, Br-, I- là AgNO3. Chọn đáp án A.
Câu 7:
Goi CTPT của muối A là NaX. Ta có :
NaX + AgNO3 → AgNO3 + AgX
0,005 ← 0,005
2AgX → 2Ag + X2
0,005 ← 0,005 (mol)
→ MNaX = 0,515 : 0,005 = 103 → MX = 80. Vậy A là NaBr. Chọn đáp án C.
Câu 8:
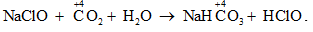
Vậy CO2 không bị oxi hóa bởi nước Gia – ven. Chọn đáp án B.
Câu 9: F2 chỉ có tính oxi hóa. Chọn đáp án A.
Câu 10: Giả sử lấy khối lượng KMnO4, MnO2, KClO3 bằng nhau và bằng 100 gam.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (1)
0,633 1,5825 (mol)
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (2)
1,149 1,149 (mol)
KClO3 + 6HCl → KCl + 3Cl2 + 3H2O (3)
0,816 2,449 (mol)
Từ các PTHH (1), (2) và (3) nếu lấy khối lượng KMnO4, MnO2, KClO3 bằng nhau để cho tác dụng với dung dịch HCl đặc, dư thì KClO3 cho nhiều clo hơn. Chọn đáp án B.
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm Học kì 2
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 4)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 1 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
Câu 1: Tính chất hóa học cơ bản của các halogen là
A. tính oxi hóa.
B. tính khử.
C. tính kim loại.
D. vừa có tính oxi hóa, vừa có tính khử.
Câu 2: Khí Cl2 nặng hơn không khí là
A. 2,5 lần. B. 5,2 lần. C. 1,5 lần. D. 2 lần.
Câu 3: Cho m gam đơn chất halogen X2 tác dụng với Mg dư thu được 3,8g muối. Cũng m gam X2 cho tác dụng với Al dư thu được 3,56g muối. X là
A. F. B. Cl. C. I. D. Br.
Câu 4: Để trung hòa 20 ml dung dịch HCl 0,1M cần 10 ml dung dịch NaOH nồng độ x mol/l. Giá trị của x là
A. 0,3. B. 0,4. C. 0,2. D. 0,1.
Câu 5: Kim loại nào sau đây khi tác dụng với dung dịch HCl loãng và tác dụng với khí Cl2 không cho cùng loại muối clorua kim loại?
A. Mg. B. Zn. C. Fe. D. Al.
Câu 6: Trong muối NaCl có lẫn NaBr và NaI. Để loại hai muối này ra khỏi NaCl người ta có thể
A. nung nóng hỗn hợp.
B. cho hỗn hợp tác dụng với dung dịch HCl đặc.
C. cho hỗn hợp tác dụng với Cl2 sau đó đun nóng.
D. làm lạnh hỗn hợp.
Câu 7: Cho dung dịch chứa 2,01 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 2,87 gam kết tủa. Phần trăm khối lượng của NaX trong hỗn hợp ban đầu là
A. 52,8%. B. 58,2%. C. 47,2%. D. 41,8%.
Câu 8: Nguyên tử của nguyên tố halogen X có tổng số electron ở các phân lớp p là 11. Nguyên tố X là
A. F. B. I. C. Br. D. Cl.
Câu 9: Nguyên tố nào sau đây trong tất cả các hợp chất chỉ có số oxi hóa -1?
A. I. B. Br. C. Cl. D. F.
Câu 10: Nhận định nào sau đây là sai?
A. Nước Gia – ven là dung dịch hỗn hợp muối NaCl và NaClO.
B. Clorua vôi là chất bột màu trắng, xốp.
C. Clorua là muối tạo bởi hai kim loại liên kết với một loại gốc axit.
D. Clorua vôi có tính oxi hóa mạnh tương tự nước Gia – ven.
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | A | A | B | C | C | C | D | D | D | C |
Câu 1: Tính chất hóa học cơ bản của các halogen là tính oxi hóa. Chọn đáp án A.
Câu 2:
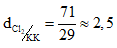
Vậy khí Cl2 nặng hơn không khí là 2,5 lần. Chọn đáp án A.
Câu 3:
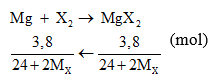
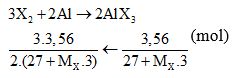
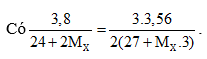
Giải PT được MX = 35,5. Vậy X là Cl. Chọn đáp án B.
Câu 4:
HCl + NaOH → NaCl + H2O
2.10-3 0,01.x (mol)
Có số mol HCl = số mol NaOH → 0,01.x = 2.10-3. Vậy x = 0,2M. Chọn đáp án C.
Câu 5:
2Fe + 3Cl2 → 2FeCl3
Fe + 2HCl → FeCl2 + H2O. Chọn đáp án C.
Câu 6: Cho hỗn hợp tác dụng với Cl2 có phản ứng:
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2NaI → 2NaCl + I2
Khi đun nóng Br2 bay hơi, I2 thăng hoa. Chọn đáp án C.
Câu 7: Trường hợp 1: X là Flo và Y là Clo. Ta có PTHH:
NaCl + AgNO3 → AgCl + NaNO3
0,02 ←0,02 (mol)
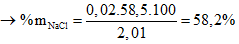
%mNaF = 100 – 58,2 = 41,8% (thỏa mãn).
Trường hợp 2: X khác F gọi X, Y là E (điều kiện: 35,5 < ME < 127). Ta có PTHH:
NaE + AgNO3 → AgE + NaNO3
Ta có số mol NaE = số mol AgE
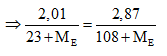
Giải PT → ME = 175,66 (loại). Vậy chọn đáp án D.
Câu 8: Cấu hình e của X: 1s22s22p63s23p5. Có ZX = 17, vậy X là Cl. Chọn đáp án D.
Câu 9: Trong tất cả các hợp chất, flo chỉ có số oxi hóa -1. Chọn đáp án D.
Câu 10: Clorua là muối tạo bởi một kim loại liên kết với hai loại gốc axit. Chọn đáp án C.
Đề kiểm tra 15 phút - Trắc nghiệm + Tự luận
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm tự luận Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 1)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 1 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Dãy axit nào sau đây được sắp xếp theo thứ tự tính axit tăng dần?
A. HF, HI, HBr, HCl.
B. HF, HCl, HBr, HI.
C. HF, HBr, HCl, HI.
D. HCl, HBr, HI, HF.
Câu 2: Trong phòng thí nghiệm, nước gia - ven được điều chế bằng phương pháp nào dưới đây?
A. Cho clo tác dụng với dung dịch NaOH, đun nóng.
B. Cho clo tác dụng với dung dịch NaOH ở điều kiện thường.
C. Cho clo tác dụng với nước
D. Cho clo tác dụng với dung dịch Ca(OH)2 ở 30ºC.
Câu 3: Đổ dung dịch AgNO3 vào dung dịch nào sau đây sẽ không có phản ứng?
A. KF. B. NaBr. C. HCl. D. HI.
Câu 4: Phản ứng nào sau đây là sai?
A. 2F2 + 2H2O → 4HF + O2.
B. Cl2 + H2O ⇔ HCl + HClO.
C. Br2 + H2O ⇔ HBr + HBrO.
D. F2 + H2O ⇔ HF + HFO.
Câu 5: Trong công nghiệp, người ta điều chế khí clo bằng cách nào?
A. Cho dung dịch HCl đặc tác dụng MnO2, đun nóng.
B. Điện phân dung dịch muối NaCl, không có màng ngăn.
C. Cho dung dịch HCl đặc tác dụng KMnO4.
D. Điện phân dung dịch bão hòa NaCl trong nước, có màng ngăn.
Câu 6: Chất nào sau đây không tác dụng với dung dịch HCl?
A. CuO. B. NaOH. C. Fe. D. Ag.
II. Tự luận ( 7 điểm)
Câu 1 ( 1,5 điểm): Dẫn ra phản ứng hóa học chứng minh Cl2 vừa có tính oxi hóa, vừa có tính khử.
Câu 2 ( 2,5 điểm): Cho hỗn hợp X gồm 1,2 gam Mg và 2,8 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HCl thấy thoát ra V lít khí ở đktc. Tính giá trị của V.
Câu 3 ( 3 điểm): Cho 4,39 gam hỗn hợp A gồm: KX, KY (X,Y là hai halogen liên tiếp, nguyên tử khối của X < Y) vào dung dịch AgNO3 dư. Kết thúc phản ứng thu được 2,87gam kết tủa. Xác định hai nguyên tố X, Y và % khối lượng các chất trong A.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đáp án | B | B | A | D | D | D |
Câu 1: Tính axit tăng dần theo thứ tự HF, HCl, HBr, HI. Chọn đáp án B.
Câu 2: Trong phòng thí nghiệm, nước gia - ven được điều chế bằng cách clo tác dụng với dung dịch NaOH ở điều kiện thường. Chọn đáp án B
Câu 3: KF + AgNO3 → không tác dụng. Chọn đáp án A.
Câu 4: F2 oxi hóa nước dễ dàng ngay nhiệt độ thường tạo thành HF và O2. Chọn đáp án D.
Câu 5: Trong công nghiệp, người ta điều chế khí clo bằng cách điện phân dung dịch bão hòa NaCl trong nước, có màng ngăn (hoặc điện phân nóng chảy NaCl). Chọn đáp án D.
Câu 6: Ag đứng sau H trong dãy hoạt động hóa học nên không tác dụng được với HCl. Chọn đáp án D.
II. Tự luận ( 7 điểm)
Câu 1 ( 1,5 điểm):
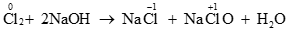
Số oxi hóa của clo giảm từ 0 → -1 nên Cl2 thể hiện tính oxi hóa
Số oxi hóa của clo tăng từ 0 → +1 nên Cl2 thể hiện tính khử
Câu 2 ( 2,5 điểm):
Tính được số mol Mg = 0,05 (mol), số mol Fe = 0,05 (mol) (0,5 điểm)
Mg + 2HCl → MgCl2 + H2 (1) (0,5 điểm)
0,05 → 0,05 (mol)
Fe + 2HCl → FeCl2 + H2 (2) (0,5 điểm)
0,05 → 0,05 (mol)
Từ 2 PTHH (1) và (2) có số mol H2 = 0,1 (mol). (0,5 điểm)
Vậy V = 0,1. 22,4 = 2,24 lít. (0,5 điểm)
Câu 3 ( 3 điểm):
Trường hợp 1: Xét X là Flo và Y là Clo. Ta có PTHH: (0,5 điểm)
KCl + AgNO3 → AgCl + KNO3
0,02 ← 0,02 (mol)
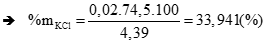
→ %mKF =100 - 33,941 = 66,059 (%) (thỏa mãn) (0,5 điểm)
Trường hợp 2: X khác Flo gọi X, Y là E (điều kiện: 35,5 < ME < 127). Ta có PTHH: (0,5 điểm)
KE + AgNO3 → AgE + KNO3
Có số mol KE = số mol AgE (0,5 điểm)
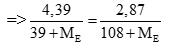
Giải PT được ME < 0 (loại). (0,5 điểm)
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm tự luận Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 2)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 1 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Đặc điểm nào sau đây không là đặc điểm chung của tất cả các halogen?
A. Trong phản ứng hóa học, nguyên tử halogen dễ thu thêm 1 electron.
B. Các nguyên tố halogen đều có các số oxi hóa -1; +1; +3; +5; +7 trong các hợp chất.
C. Halogen là các phi kim điển hình.
D. Liên kết trong phân tử halogen (X2) không bền lắm, chúng dễ bị tách thành hai nguyên tử halogen (X).
Câu 2: Màu của nước clo là
A. màu vàng cam. B. màu nâu đỏ.
C. màu vàng nhạt. D. màu vàng lục.
Câu 3: Trong phản ứng hóa học sau: SO2 + Br2 + 2H2O → H2SO4 + 2HBr. Brom đóng vai trò là
A. chất khử.
B. vừa là chất oxi hóa, vừa là chất khử.
C. chất oxi hóa.
D. không là chất oxi hóa cũng không là chất khử.
Câu 4: Cho các phản ứng sau:
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O (1)
2HCl + Fe → FeCl2 + H2 (2)
2HCl + Na2O → 2NaCl + H2O (3)
2HCl + Na2SO3 → 2NaCl + SO2 + H2O (4)
Số phản ứng trong đó HCl thể hiện tính khử là
A. 4. B. 2. C. 3. D. 1.
Câu 5: Khi cho dung dịch AgNO3 phản ứng với dung dịch nào sau đây sẽ không cho kết tủa?
A. Dung dịch KI. B. Dung dịch KCl.
C. Dung dịch KBr. D. Dung dịch KF.
Câu 6: Chất nào sau đây không có tính tẩy màu?
A. Nước Gia – ven. B. Clorua vôi.
C. Nước clo. D. Axit clohiđric.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Viết phương trình hóa học xảy ra trong các thí nghiệm sau:
a/ Fe tác dụng với Cl2
b/ SiO2 tác dụng với HF
c/ Điều chế Cl2 từ KMnO4
d/ Dẫn khí Cl2 vào dd NaBr.
Câu 2 ( 3 điểm): Hòa tan 6,4g hỗn hợp gồm Mg và MgO vào một lượng vừa đủ dung dịch HCl 10% thì thu được 2,24 lít khí (đktc). Tính nồng độ phần trăm của dung dịch thu được sau phản ứng.
Câu 3 ( 2 điểm): Tại sao khi để lâu nước Gia – ven và clorua vôi ngoài không khí thì khả năng sát trùng và tẩy màu lại kém đi. Viết các PTHH để giải thích.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đáp án | B | C | C | D | D | D |
Câu 1: Flo chỉ có số oxi hóa -1 trong các hợp chất. Chọn đáp án B.
Câu 2: Màu của nước clo là màu vàng nhạt. Chọn đáp án C.
Câu 3:
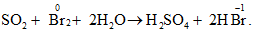
Số oxi hóa brom giảm sau phản ứng, vậy brom đóng vai trò là chất oxi hóa.
Câu 4: Phản ứng trong đó HCl thể hiện tính khử là: 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
Chọn đáp án D.
Câu 5: AgNO3 + KF → không phản ứng. Chọn đáp án D.
Câu 6: Chất không có tính tẩy màu là axit clohiđric. Chọn đáp án D.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
HS viết đúng mối PTHH 0,5 điểm. Thiếu cân bằng trừ ½ số điểm của mỗi PT.
2Fe + 3Cl2 → 2FeCl3
SiO2 + 4HF → SiF4 + H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Cl2 + 2NaBr → 2NaCl + Br2.
Câu 2 ( 3 điểm):
Tính được số mol H2 = 0,1 mol (0,5 điểm)
Theo bài ra có PTHH: (HS viết đúng mỗi PTHH 0,25đ)
Mg + 2HCl → MgCl2 + H2
0,1 ← 0,1 ← 0,1 (mol)
MgO + 2HCl → MgCl2 + H2O
0,1 → 0,1 (mol)
Tính được: mMgO = 6,4 – 0,1.24 = 4 gam → nMgO = 0,1 (mol) (0,5 điểm)
Dung dịch sau phản ứng chỉ chứa MgCl2: 0,2 mol (0,5 điểm)
Tính được nHCl = 0,4 → mHCl = 14,6 gam → mdd HCl = 146 gam.
Áp dụng định luật bảo toàn khối lượng tính được: (0,5 điểm)
mdd sau = m(Mg, MgO) + mdd HCl - mkhí = 6,4 + 146 – 0,1.2 = 152,2 gam
Tính được : (0,5 điểm)
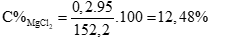
Câu 3 ( 2 điểm):
Do axit HClO < H2CO3 (0,25 điểm)
Nên để lâu ngoài không khí cả nước Gia – ven và clorua vôi bị biến đổi theo PTHH sau đây: (HS viết đúng mỗi PTHH 0,5 điểm)
NaClO + CO2 + H2O → NaHCO3 + HClO
2CaOCl2 + CO2 + H2O → CaCO3 + CaCl2 + 2HClO
HClO sinh ra kém bền và bị phân hủy
2HClO → 2HCl + O2
Kết quả làm giảm nồng độ ion ClO- (0,25 điểm)
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm tự luận Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 3)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 1 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Các đơn chất halogen (F2, Cl2, Br2, I2) có đặc điểm chung là
A. chất khí ở điều kiện thường.
B. có tính oxi hóa mạnh.
C. vừa có tính oxi hóa, vừa có tính khử.
D. Tác dụng mạnh với nước.
Câu 2: Thành phần của nước clo là
A. Cl2, H2O.
B. HCl, HClO.
C. Cl2, H2O, HCl, HClO.
D. NaCl, NaClO, H2O.
Câu 3: Hòa tan hoàn toàn 1,3g kim loại hóa trị II bằng dung dịch HCl vừa đủ. Cô cạn dung dịch sau phản ứng thu được 2,72g muối khan. Kim loại đã dùng là
A. Fe. B. Zn. C. Mg. D. Ba.
Câu 4: Chất khí có thể làm mất màu dung dịch nước brom là
A. SO2. B. CO2. C. O2. D. HCl.
Câu 5: Cấu hình electron lớp ngoài cùng của các ion halogenua (X-) là
A. ns2np4. B. ns2np5
C. ns2np6 D. (n – 1)d10ns2np5.
Câu 6: Halogen nào được ứng dụng để tạo hợp chất chống dính trong xoong, chảo, nồi cơm điện… ?
A. Flo. B. Iot. C. Brom. D. Clo.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Viết phương trình điều chế: Cl2 trong công nghiệp và HCl trong phòng thí nghiệm (theo phương pháp sunfat).
Câu 2 ( 3 điểm): Cho 1,58 gam KMnO4 vào 100 ml dd HCl 1M. Sau phản ứng hoàn toàn, thu được V lít khí Cl2 (đktc) và dd X.
a/ Viết phương trình phản ứng xảy ra và tính V?
b/ Cho toàn bộ dd X ở trên vào dd AgNO3 dư thu được m gam kết tủa. Tính m?
Câu 3 ( 2 điểm): Hãy nêu phương pháp bảo quản muối iot và cách dùng muối iot khi nấu thức ăn nhằm hạn chế sự thất thoát iot.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đáp án | B | C | B | A | C | A |
Câu 1: Các đơn chất halogen (F2, Cl2, Br2, I2) có đặc điểm chung là có tính oxi hóa mạnh. Chọn đáp án B.
Câu 2:
PTHH: Cl2 + H2O ⇔ HCl + HClO.
Thành phần của nước clo là Cl2, H2O, HCl, HClO. Chọn đáp án C.
Câu 3: Đặt kim loại là A.
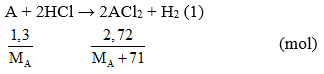 Ta có số mol A = số mol ACl2 →
Ta có số mol A = số mol ACl2 →
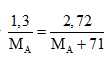 Giải PT được MA = 65. Vậy A là Zn. Chọn đáp án B.
Giải PT được MA = 65. Vậy A là Zn. Chọn đáp án B.
Câu 4:
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Chất khí có thể làm mất màu dung dịch nước brom là SO2. Chọn đáp án A.
Câu 5:
X + 1e → X-
[KH]ns2np5 [KH] ns2 np6
Chọn đáp án C.
Câu 6: Halogen được ứng dụng để tạo hợp chất chống dính trong xoong, chảo, nồi cơm điện… là flo. Chọn đáp án A.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
HS viết đúng 2 PTHH điều chế 1đ/ 1PTHH.
Thiếu điều kiện hoặc không cân bằng PT trừ ½ số điểm của PTHH đó.
- Sản xuất clo trong CN:
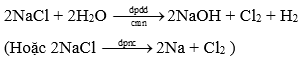
- Điều chế HCl trong PTN theo pp sunfat:
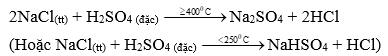
Câu 2 ( 3 điểm):
a/ Tính được: KMnO4 (0,01 mol); HCl (0,1 mol). (0,5 điểm)
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (1) (0,5 điểm)
0,01 0,08 0,01 0,01 0,025
So sánh tỉ lệ thấy HCl dư 0,02 mol, sản phẩm tính theo chất hết là KMnO4
Tính được nClo = 0,025 (mol), Vclo = 0,025.22,4 = 0,56 lít. (0,5 điểm)
b/ Các chất tan có trong dung dịch X gồm: KCl 0,01 (mol); MnCl2 0,01 (mol), HCl dư 0,02 mol. (0,25 điểm)
Cho dung dịch X vào AgNO3 dư, có các PTHH: (0,25đ/ 1pt)
KCl + AgNO3 → KNO3 + AgCl (↓)
0,01 → 0,01 (mol)
MnCl2 + 2AgNO3 → Mn(NO3)2 + 2AgCl (↓)
0,01 → 0,02 (mol)
HCl + AgNO3 → HNO3 + AgCl (↓)
0,02 → 0,02 (mol)
Kết tủa là AgCl 0,05 mol. Vậy m = 0,05.143,5 = 7,175 gam. (0,5 điểm)
Câu 3 ( 2 điểm):
Chú ý: HS trình bày theo ý hiểu, lý luận xác đáng cho điểm tối đa.
Iot có trong muối ăn dạng KI và KIO3. KI trong muối ăn dễ bị oxi hóa thành I2 rồi bay hơi mất nhất là khi có H2O, các chất oxi hóa có trong muối ăn hoặc nhiệt độ cao.
Bảo quản muối iot: Sau khi mua về và khi sử dụng để trong lọ có nắp đậy hoặc túi nilon buộc kín. Không để muối iốt gần bếp lửa nóng hay nơi có ánh nắng chiếu vào. Dùng xong mỗi lần rửa lọ sạch, phơi khô xong lại dùng tiếp đợt khác…
Cách dùng muối iot khi nấu thức ăn nhằm hạn chế sự thất thoát iot: Nên nêm muối iot sau khi đã nấu chín thức ăn và để nguội bớt
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm tự luận Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 4)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 1 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Liên kết trong phân tử halogen (X2) là liên kết
A. ion. B. cộng hóa trị phân cực.
C. cho nhận. D. cộng hóa trị không phân cực.
Câu 2: Phản ứng giữa hiđro và chất nào sau đây là phản ứng thuận nghịch?
A. Flo. B. Clo. C. Iot. D. Brom.
Câu 3: Trong tự nhiên clo có hai đồng vị bền là
A. 35Cl và 37Cl. B. 35Cl và 36Cl. C. 34Cl và 35Cl. D. 34Cl và 36Cl.
Câu 4: Đốt nhôm trong bình chứa khí clo, sau phản ứng thấy lượng khí clo dùng hết 1,008 lít (ở đktc). Khối lượng nhôm đã tham gia phản ứng là
A. 3,24g. B.1,08g. C. 0,81g. D. 0,86g.
Câu 5: Trong hợp chất, nguyên tố flo thể hiện số oxi hóa là
A. 0. B. +1. C. -1. D. +3.
Câu 6: Có 3 khí riêng biệt đựng trong 3 lọ là: Clo, hiđroclorua, oxi. Phương pháp hóa học nào sau đây có thể nhận biết được từng khí trong mỗi lọ?
A. Dùng dung dịch NaOH.
B. Dùng quỳ tím ẩm.
C. Dùng dung dịch AgNO3.
D. Không nhận biết được.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Dẫn ra các phản ứng hóa học chứng minh tính oxi hóa Cl2 > Br2 > I2.
Câu 2 ( 2 điểm): Bằng phương pháp hóa học, hãy phân biệt các dung dịch sau chứa trong các lọ riêng biệt mất nhãn: NaI, FeBr2, KBr.
Câu 3 ( 3 điểm): Cho 2,24 gam hỗn hợp G gồm: CaCO3 và Mg vào một lượng vừa đủ m gam dd HCl 10%. Sau phản ứng thu được dd A và 0,672 lít hỗn hợp khí B ở đktc. Xác định % khối lượng của các chất trong G và khối lượng dung dịch HCl đã dùng.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đáp án | D | C | A | C | C | B |
Câu 1: Liên kết trong phân tử halogen (X2) là liên kết cộng hóa trị không phân cực. Chọn đáp án D.
Câu 2:
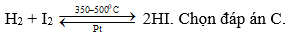
Câu 3: Trong tự nhiên clo có hai đồng vị bền là 35Cl và 37Cl. Chọn đáp án A.
Câu 4:
2Al + 3Cl2 → 2AlCl3
0,03 ← 0,045
mAl =0,03.27 = 0,81 gam. Chọn đáp án C.
Câu 5: Trong hợp chất, nguyên tố flo chỉ thể hiện số oxi hóa là -1. Chọn đáp án C.
Câu 6: Hiện tượng: Clo làm quỳ tím ẩm chuyển sang màu đỏ, sau đó mất màu. Hiđroclorua làm quỳ tím ẩm chuyển sang màu đỏ. Oxi không làm quỳ tím ẩm đổi màu. Chọn đáp án B.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
HS viết được 2 PT đúng, mỗi PT 1 điểm
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
Câu 2 ( 2 điểm):
Đánh số thứ tự từng lọ, trích mẫu thử (0,5 điểm)
Dùng dung dịch NaOH nhận ra FeBr2 nhờ kết tủa (keo, trắng xanh, để lâu trong không khí kết tủa chuyển sang màu nâu đỏ ). (0,25 điểm)
Còn lại là nhóm I gồm: NaI; KBr (không hiện tượng) (0,25 điểm)
PTHH: FeBr2 + 2NaOH → Fe(OH)2(↓) + 2NaBr
Nhỏ dg AgNO3 vào nhóm I: Kết tủa vàng nhạt là KBr còn kết tủa vàng đậm là KI (0,25 điểm)
PTHH:
AgNO3 + KBr → AgBr + KNO3 (0,25 điểm)
AgNO3 + NaI → AgI + NaNO3 (0,25 điểm)
Câu 3 ( 3 điểm):
Tính được số mol khí: 0,03 mol (0,5 điểm)
PTHH: (0,5 điểm)
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
x → x (mol)
Mg + 2HCl → MgCl2 + H2
y → y (mol)
Gọi số mol CaCO3 = x; số mol Mg = y (0,5 điểm)
Lập hệ:
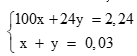
Giải hệ: x = 0,02; y = 0,01 (0,5 điểm)
Tính (0,25 điểm)
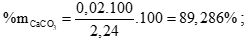
%mMg = 100 - %mCaCO3 = 10,714% (0,25 điểm)
Tính số mol HCl pư = 2(x + y) = 0,06 mol → mHCl = 0,06.36,5 = 2,19g (0,25 điểm)
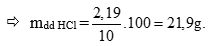
Xem thêm đề thi Hóa học 10 chọn lọc, có đáp án hay khác:
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 1)(3 đề)
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 2)(3 đề)
- Đề kiểm tra Hóa học 10 Giữa học kì 1 có đáp án (3 đề)
- Đề thi Hóa học 10 Giữa kì 1 có đáp án (3 đề)
- Đề thi Hóa học 10 Học kì 1 có đáp án (3 đề)
- Đề kiểm tra 15p Hóa học 10 Học kì 2 có đáp án (Bài số 2)(8 đề)
- Đề kiểm tra Hóa học 10 Giữa học kì 2 có đáp án (5 đề)
- Đề thi Hóa học 10 Giữa kì 2 có đáp án (5 đề)
- Đề thi Hóa học 10 Học kì 2 có đáp án (5 đề)
Đã có lời giải bài tập lớp 10 sách mới:
- (mới) Giải bài tập Lớp 10 Kết nối tri thức
- (mới) Giải bài tập Lớp 10 Chân trời sáng tạo
- (mới) Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 cho học sinh và giáo viên (cả 3 bộ sách):
Săn shopee siêu SALE :
- Sổ lò xo Art of Nature Thiên Long màu xinh xỉu
- Biti's ra mẫu mới xinh lắm
- Tsubaki 199k/3 chai
- L'Oreal mua 1 tặng 3
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Lớp 10 - Kết nối tri thức
- Soạn văn lớp 10 (hay nhất) - KNTT
- Giải Toán lớp 10 - KNTT
- Giải Tiếng Anh lớp 10 - KNTT
- Giải Vật lí lớp 10 - KNTT
- Giải Giáo dục Kinh tế và Pháp luật lớp 10 - KNTT
- Giải Sinh học lớp 10 - KNTT
- Giải Địa lí lớp 10 - KNTT
- Giải Lịch sử lớp 10 - KNTT
- Giải Công nghệ lớp 10 - KNTT
- Giải Hoạt động trải nghiệm lớp 10 - KNTT
- Giải Giáo dục quốc phòng lớp 10 - KNTT
- Giải Tin học lớp 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn lớp 10 (hay nhất) - CTST
- Giải Toán lớp 10 - CTST
- Giải Tiếng Anh lớp 10 - CTST
- Giải Vật lí lớp 10 - CTST
- Giải Hóa học lớp 10 - CTST
- Giải Sinh học lớp 10 - CTST
- Giải Giáo dục Kinh tế và Pháp luật lớp 10 - CTST
- Giải Địa lí lớp 10 - CTST
- Giải Lịch sử lớp 10 - CTST
- Giải Hoạt động trải nghiệm lớp 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn lớp 10 (hay nhất) - CD
- Giải Toán lớp 10 - CD
- Giải Tiếng Anh lớp 10 - CD
- Giải Vật lí lớp 10 - CD
- Giải Hóa học lớp 10 - CD
- Giải Sinh học lớp 10 - CD
- Giải Giáo dục Kinh tế và Pháp luật lớp 10 - CD
- Giải Địa lí lớp 10 - CD
- Giải Lịch sử lớp 10 - CD
- Giải Giáo dục quốc phòng lớp 10 - CD
- Giải Tin học lớp 10 - CD









