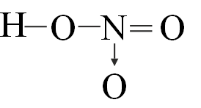
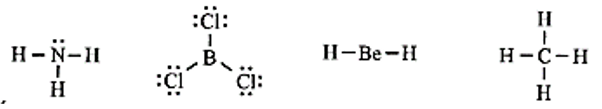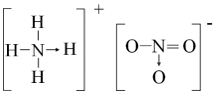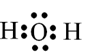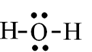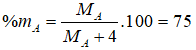Top 30 Đề thi Hóa học 10 Học kì 1 năm 2024 (có đáp án)
Để ôn luyện và làm tốt các bài thi Hóa học 10, dưới đây là Top 30 Đề thi Hóa học 10 Học kì 1 năm 2024 sách mới Kết nối tri thức, Cánh diều, Chân trời sáng tạo có đáp án, cực sát đề thi chính thức. Hi vọng bộ đề thi này sẽ giúp bạn ôn tập & đạt điểm cao trong các bài thi Hóa học 10.
Top 30 Đề thi Hóa học 10 Học kì 1 năm 2024 (có đáp án)
Xem thử Đề HK1 Hóa 10 KNTT Xem thử Đề HK1 Hóa 10 CTST Xem thử Đề HK1 Hóa 10 CD
Chỉ từ 150k mua trọn bộ Đề thi Hóa học 10 Học kì 1 (mỗi bộ sách) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
0711000255837- NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Đề thi Học kì 1 Hóa học 10 Kết nối tri thức có đáp án (9 đề)
Đề thi Học kì 1 Hóa học 10 Chân trời sáng tạo có đáp án (9 đề)
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 1 - Kết nối tri thức
Năm học 2023 - 2024
Môn: Hóa học 10
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Trong các sản phẩm sau, sản phẩm nào không phải là sản phẩm của hóa học?
A. Phân bón hóa học.
B. Thuốc.
C. Dầu gội đầu.
D. Thực phẩm biến đổi gen.
Câu 2: Hạt nhân của nguyên tử nguyên tố A có 24 hạt, trong đó số hạt không mang điện là 12. Số electron trong A là
A. 12. B. 24. C. 13. D. 6.
Câu 3: Số proton và số neutron có trong một nguyên tử aluminium () lần lượt là
A. 13 và 14.
B. 13 và 15.
C. 12 và 14.
D. 13 và 13.
Câu 4: Có những phát biểu sau đây về các đồng vị của một nguyên tố hóa học:
(1) Các đồng vị có tính chất hóa học giống nhau.
(2) Các đồng vị có tính chất vật lí khác nhau.
(3) Các đồng vị có cùng số electron ở vỏ nguyên tử.
(4) Các đồng vị có cùng số proton nhưng khác nhau về số khối.
Trong các phát biểu trên, số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 5: Orbital nguyên tử là
A. đám mây chứa electron có dạng hình cầu.
B. đám mây chứa electron có dạng hình số 8 nổi.
C. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước năng lượng xác định.
Câu 6: Lớp M có số orbital tối đa bằng
A. 3. B. 4. C. 9. D. 18.
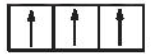
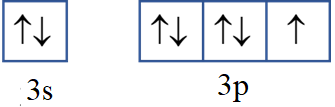
Câu 7: Sự phân bố electron theo ô orbital nào dưới đây là đúng?
A.
B.
C.
D.
Câu 8: Cho các nguyên tố với số hiệu nguyên tử sau: X (Z = 1); Y (Z = 7); E (Z = 12); T (Z = 19). Dãy gồm các nguyên tố kim loại là
A. X, Y, E.
B. X, Y, E, T.
C. E, T.
D. Y, T.
Câu 9: Chu kì 3 của bảng hệ thống tuần hoàn có
A. 2 nguyên tố.
B. 8 nguyên tố.
C. 10 nguyên tố.
D. 18 nguyên tố.
Câu 10: Hạt nhân nguyên tử Y có 15 proton. Vị trí của Y trong bảng tuần hoàn là
A. số thứ tự 15, chu kì 3, nhóm VIIA.
B. số thứ tự 15, chu kì 2, nhóm VA.
C. số thứ tự 15, chu kì 3, nhóm VA.
D. số thứ tự 15, chu kì 4, nhóm VA.
Câu 11: Trong một nhóm, từ trên xuống dưới thì số lớp electron
A. tăng dần.
B. giảm dần.
C. không thay đổi.
D. biến đổi không theo quy luật.
Câu 12: Cấu hình electron nào sau đây ứng với nguyên tố có độ âm điện lớn nhất?
A. 1s22s22p5.
B. 1s22s22p6.
C. 1s22s22p63s1.
D. 1s22s22p63s23p2.
Câu 13: Công thức oxide cao nhất của nguyên tố R (Z = 17) là
A. R2O.
B. R2O3.
C. R2O5.
D. R2O7.
Câu 14: Nguyên tố X ở chu kì 3, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s²2s²2p6.
B. 1s²2s²2p3s²3p¹.
C. 1s²2s²2p3s³.
D. 1s²2s²2p63s².
Câu 15: Nguyên tố K có số hiệu nguyên tử là 19. Phát biểu nào sau đây về K là không đúng?
A. Số electron ở vỏ nguyên tử của nguyên tố K là 19.
B. Vỏ của nguyên tử K có 4 lớp electron và lớp ngoài cùng có 1 electron.
C. Hạt nhân của nguyên tố K có 19 proton.
D. Nguyên tố K là một phi kim.
Câu 16: Nitrogen (N) là nguyên tố thuộc nhóm VA, chu kì 2 của bảng tuần hoàn. Cho các phát biểu sau:
(a) Nguyên tử N có 2 lớp electron và có 5 electron lớp ngoài cùng.
(b) Công thức oxide cao nhất của N có dạng NO2 và là acidic oxide.
(c) Nguyên tố N có tính phi kim mạnh hơn nguyên tố O (Z = 8).
(d) Hydroxide ứng với oxide cao nhất của N có dạng HNO3 và có tính acid.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 17: Liên kết hóa học là
A. sự kết hợp giữa các hạt cơ bản hình thành nguyên tử bền vững.
B. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
C. sự kết hợp của các phân tử hình thành các chất bền vững.
D. sự kết hợp của chất tạo thành vật thể bền vững.
Câu 18: Trong các hợp chất, nguyên tử magnesium đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách
A. cho đi 2 electron
B. nhận vào 1 electron
C. cho đi 3 electron.
D. nhận vào 2 electron.
Câu 19: Công thức electron nào sau đây không đủ electron theo quy tắc octet?
A.
B. 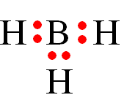
C.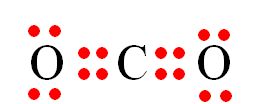
D.
Câu 20: Khi nguyên tử nhường hoặc nhận electron sẽ tạo thành
A. phân tử.
B. ion.
C. cation.
D. anion.
Câu 21: Quá trình tạo thành ion Ca2+ nào sau đây là đúng?
A. Ca → Ca2+ + 2e.
B. Ca → Ca2+ + 1e.
C. Ca + 2e → Ca2+.
D. Ca + 1e → Ca2+.
Câu 22: Liên kết ion là loại liên kết hoá học được hình thành nhờ lực hút tĩnh điện giữa các phần tử nào sau đây?
A. Cation và anion.
B. Các anion.
C. Cation và các electron tự do.
D. Electron và hạt nhân nguyên tử.
Câu 23: Phân tử KCl được hình thành do
A.sự kết hợp giữa nguyên tử K và nguyên tử Cl.
B.sự kết hợp giữa ion K+ và ion Cl2-.
C.sự kết hợp giữa ion K- và ion Cl+.
D.sự kết hợp giữa ion K+ và ion Cl-.
Câu 24: Liên kết tạo thành do sự góp chung electron thuộc loại liên kết
A. ion.
B. cộng hóa trị.
C. kim loại.
D. hydrogen.
Câu 25: Dựa vào hiệu độ âm điện giữa 2 nguyên tố, cho biết liên kết trong phân tử nào sau đây là phân cực nhất?
A. HF.
B.HCl.
C.HBr.
D.HI.
Câu 26: Liên kết σ là liên kết được hình thành do
A. sự xen phủ bên của 2 orbital.
B. cặp electron chung.
C. lực hút tĩnh điện giữa hai ion.
D. sự xen phủ trục của hai orbital.
Câu 27: Tương tác van der Waals được hình thành do
A. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử.
B. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các phân tử.
C. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
D. lực hút tĩnh điện giữa các phân tử phân cực.
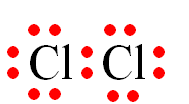
Câu 28: Các liên kết biểu diễn bằng dấu “•••” có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là loại liên kết gì?
A. Liên kết ion.
B. Liên kết cộng hoá trị có cực.
C. Liên kết cộng hoá trị không cực.
D. Liên kết hydrogen.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Vận dụng quy tắc octet để giải thích sự tạo thành liên kết trong phân tử F2. Biết F (Z = 9).
Câu 2 (1 điểm): Biểu diễn sự tạo thành liên kết ion trong phân tử MgO. Biết Mg (Z = 12) và O (Z = 8).
Câu 3 (1 điểm): Trong hai chất ammonia (NH3) và phosphine (PH3), theo em chất nào có nhiệt độ sôi và độ tan trong nước lớn hơn? Giải thích.
Hướng dẫn giải đề số 002
Phần I: Trắc nghiệm
1 - D |
2 - A |
3 - A |
4 - D |
5 - C |
6 - C |
7 - B |
8 - C |
9 - B |
10 - C |
11 - A |
12 - A |
13 - D |
14 - D |
15 - D |
16 - B |
17 - B |
18 - A |
19 - B |
20 - B |
21 - A |
22 - A |
23 - D |
24 - B |
25 - A |
26 - D |
27 - C |
28 - D |
Câu 1:
Đáp án đúng là: D
Thực phẩm biến đổi gen là sản phẩm của sinh học.
Câu 2:
Đáp án đúng là: A
Số electron = số proton = 24 – 12 = 12 (hạt).
Câu 3:
Đáp án đúng là: A
Số proton = số hiệu nguyên tử (Z) = 13.
Số neutron = A – Z = 27 – 13 = 14.
Câu 4:
Đáp án đúng là: D
Cả 4 phát biểu đều đúng.
Câu 5:
Đáp án đúng là: C
Orbital nguyên tử là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
Câu 6:
Đáp án đúng là: C
Lớp M (n = 3) có số orbital tối đa là n2 = 32 = 9.
Câu 7:
Đáp án đúng là: B
Trường hợp A, D sai vì 2 electron trong cùng một ô AO phải có chiều tự quay ngược nhau.
Trường hợp C sai vì số electron độc thân chưa đạt tối đa.
Câu 8:
Đáp án đúng là: C
X (Z = 1): 1s1 Þ X là phi kim (trường hợp đặc biệt hydrogen).
Y (Z = 7): 1s22s22p3 Þ Y là phi kim (do có 5 electron ở lớp ngoài cùng).
E (Z = 12): 1s22s22p63s2 Þ E là kim loại (do có 2 electron ở lớp ngoài cùng).
T (Z = 19): 1s22s22p63s23p64s1 Þ T là kim loại (do có 1 electron ở lớp ngoài cùng).
Câu 9:
Đáp án đúng là: B
Chu kì 3 của bảng hệ thống tuần hoàn có 8 nguyên tố.
Câu 10:
Đáp án đúng là: C
Cấu hình electron nguyên tử Y: 1s22s22p63s23p3
Vậy Y ở:
+ Ô thứ 15 (Z = E = P = 15)
+ Chu kì 3 (do có 3 lớp electron).
+ Nhóm VA (do 5 electron hóa trị, nguyên tố p).
Câu 11:
Đáp án đúng là: A
Trong một nhóm, từ trên xuống dưới thì số lớp electrontăng dần.
Câu 12:
Đáp án đúng là: A
Nguyên tố có độ âm điện lớn nhất là F (Z = 9), có cấu hình electron: 1s22s22p5.
Câu 13:
Đáp án đúng là: D
Cấu hình electron nguyên tử R là: 1s22s22p63s23p5.
Vậy R thuộc nhóm VIIA, công thức oxide cao nhất của R là: R2O7.
Câu 14:
Đáp án đúng là: D
X ở chu kì 3 nên có 3 lớp electron.
X ở nhóm IIA nên có 2 electron ở lớp ngoài cùng.
Cấu hình electron của nguyên tử nguyên tố X: 1s²2s²2p63s².
Câu 15:
Đáp án đúng là: D
Phát biểu A và C đúng vì số electron = số proton = số hiệu nguyên tử = 19.
Phát biểu B đúng vì cấu hình electron của K là: 1s22s22p63s23p64s1 Þ K có 4 lớp electron, lớp ngoài cùng có 1 electron.
Phát biểu D sai vì K là kim loại.
Câu 16:
Đáp án đúng là: B
Các phát biểu đúng:a, d.
Ta có cấu hình electron N (Z = 7): 1s22s22p3
(b) sai vì công thức oxide cao nhất của N có dạng N2O5.
(c) Sai vì N và O cùng chu kì. Trong cùng chu kì theo chiều tăng dần của điện tích hạt nhân tính phi kim tăng dần nên tính phi kim O mạnh hơn N.
Câu 17:
Đáp án đúng là: B
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Câu 18:
Đáp án đúng là: A
Cấu hình electron nguyên tử Mg: 1s22s22p63s2
Mg có 2 electron ở lớp ngoài cùng, có xu hướng nhường đi 2 electron này để đạt được cấu hình electron bền vững của khí hiếm gần nhất.
Câu 19:
Đáp án đúng là: B
Trong công thức 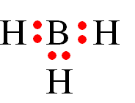
Câu 20:
Đáp án đúng là: B
Khi nguyên tử nhường hoặc nhận electron sẽ tạo thànhion.
Câu 21:
Đáp án đúng là: A
Ca (Z = 20): [Ar]4s2
Ca có 2 electron ở lớp ngoài cùng, có xu hướng nhường 2 electron này để đạt được cấu hình electron bền vững của khí hiếm.
Ca → Ca2+ + 2e.
Câu 22:
Đáp án đúng là: A
Liên kết ion là loại liên kết hoá học được hình thành nhờ lực hút tĩnh điện giữa cation và anion.
Câu 23:
Đáp án đúng là: D
Phân tử KCl được hình thành dosự kết hợp giữa ion K+ và ion Cl-.
Câu 24:
Đáp án đúng là: B
Liên kết tạo thành do sự góp chung electron thuộc loại liên kếtcộng hóa trị.
Câu 25:
Đáp án đúng là: A
Độ âm điện của: F > Cl > Br > I nên liên kết trong phân tử HF là phân cực nhất.
Câu 26:
Đáp án đúng là: D
Liên kết σ là liên kết được hình thành dosự xen phủ trục của hai orbital.
Câu 27:
Đáp án đúng là: C
Tương tác van der Waals được hình thành dotương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
Câu 28:
Đáp án đúng là: D
Liên kết hydrogen thường được biểu diễn bằng dầu “•••”
Phần II: Tự luận
Câu 1:
F (Z = 9): 1s22s22p5.
Khi hình thành liên kết hóa học trong phân tử F2, nguyên tử fluorine có 7 electron hóa trị, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung 1 electron.
Phân tử F2 được biểu diễn: 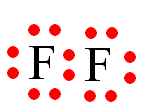
Câu 2:
Câu 3:
- Nhiệt độ sôi của NH3 cao hơn nhiệt độ sôi của PH3 do NH3 tạo được liên kết hydrogen liên phân tử còn PH3 thì không:
- NH3 có độ tan trong nước lớn hơn PH3 do NH3 tạo được liên kết hydrogen với H2O:
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 1 - Cánh diều
Năm học 2023 - 2024
Môn: Hóa học 10
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Phát biểu nào sau đây là không đúng ?
A. Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton, electron, neutron.
B. Trong nguyên tử, số hạt electron bằng số hạt proton.
C. Số khối là tổng số hạt proton (Z) và số hạt neutron (N).
D. Nguyên tử có cấu tạo rỗng.
Câu 2: Số đơn vị điện tích hạt nhân của nguyên tử có kí hiệu là
A. 23. B. 24. C. 25. D. 11.
Câu 3: Cho các kí hiệu nguyên tử: 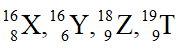
(1) X và Y là 2 đồng vị của nhau
(2) X với Y có cùng số khối.
(3) Có ba nguyên tố hóa học.
(4) Z và T thuộc cùng nguyên tố hóa học.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 4: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của calcium (Z = 20) là
A. 3d2. B. 4s1. C. 4s2. D. 3d1.
Câu 5: Phát biểu nào sau đây đúng?
A. Các nguyên tử của nguyên tố khí hiếm đều có 8 electron lớp ngoài cùng.
B. Các nguyên tố mà nguyên tử có 1, 2 hoặc 3 electron lớp ngoài cùng đều là kim loại.
C. Chỉ các nguyên tố mà nguyên tử có 5, 6 hoặc 7 electron lớp ngoài cùng mới là phi kim.
D. Nguyên tố mà nguyên tử có 4 electron lớp ngoài cùng có thể là kim loại hoặc phi kim
Câu 6: Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
A. proton.
B. neutron.
C. electron.
D. neutron và electron.
Câu 7: Lớp N có số phân lớp là
A. 1. B. 2. C. 3. D. 4.
Câu 8: Ion X2+ có cấu hình electron ở trạng thái cơ bản 1s22s22p6.Nguyên tố X là
A. O (Z = 8).
B. Mg (Z = 12).
C. Na (Z = 11).
D. Ne (Z = 10).
Câu 9: Các nguyên tố trong bảng tuần hoàn hiện tại được sắp xếp không tuân theo nguyên tắc nào sau đây?
A. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
B. Các nguyên tố có cùng số electron hoá trị được xếp vào một cột.
C. Các nguyên tố có cùng số lớp electron được xếp vào một hàng.
D. Các nguyên tố được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
Câu 10: Nguyên tố X thuộc chu kì 4. Nguyên tử X có số lớp electron là
A. 6. B. 5. C. 7. D. 4.
Câu 11: Nhóm A bao gồm các nguyên tố nào?
A. Nguyên tố s.
B. Nguyên tố p.
C. Nguyên tố s và nguyên tố p.
D. Nguyên tố d và nguyên tố f.
Câu 12: Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
A. 1s22s22p63s1.
B. 1s22s22p63s2.
C. 1s22s22p53s1.
D. 1s22s22p43s1.
Câu 13: Nguyên tố R thuộc nhóm VIA. Công thức oxide cao nhất của R là
A. RO2.
B. RO3.
C. R2O5.
D. R2O7.
Câu 14: Nguyên tử X có phân lớp electron ngoài cùng là 3p4. Nhận định nào dưới đây không đúngtrong các câu sau khi nói về nguyên tử X?
A. Lớp ngoài cùng của X có 6 electron.
B. Trong bảng tuần hoàn X nằm ở chu kì 3.
C. Hạt nhân nguyên tử X có 16 electron.
D. X nằm ở nhóm VIA.
Câu 15: Ô nguyên tố trong bảng tuần hoàn không cho biết thông tin nào sau đây?
A. Kí hiệu nguyên tố.
B. Tên nguyên tố.
C. Số hiệu nguyên tử.
D. Số khối của hạt nhân.
Câu 16: Nguyên tố X ở chu kì 3, nhóm IIIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s²2s²2p6.
B. 1s²2s²2p63s²3p¹.
C. 1s²2s²2p3s³.
D. 1s²2s²2p63s².
Câu 17: Liên kết hydrogen là
A. liên kết được hình thành bởi lực hút tĩnh điện giữa các ion trái dấu.
B. liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
C. liên kết mà cặp electron chung được đóng góp từ một nguyên tử.
D. liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
Câu 18: Nguyên tử nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm helium khi tham gia hình thành liên kết hóa học?
A. Fluorine.
B. Oxygen.
C. Hydrogen.
D. Chlorine.
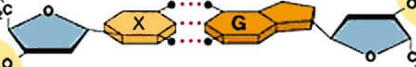
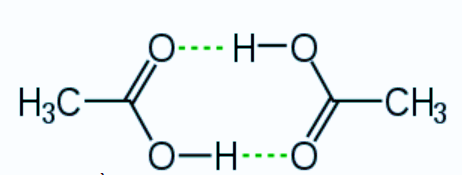
Câu 19: Cho sơ đồ liên kết giữa hai phân tử acid CH3COOH:
Trong sơ đồ trên, đường nét đứt đại diện cho
A. liên kết cộng hóa trị có cực.
B. liên kết ion.
C. liên kết cho – nhận.
D. liên kết hydrogen.
Câu 20: Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung là
A. liên kết ion.
B. liên kết cộng hoá trị.
C. liên kết kim loại.
D. liên kết hydrogen.
Câu 21: Chỉ ra nội dung không đúng khi xét phân tử CO2?
A. Phân tử có cấu tạo góc.
B. Liên kết giữa nguyên tử oxygen và carbon là phân cực.
C. Phân tử CO2 không phân cực.
D. Trong phân tử có hai liên kết đôi.
Câu 22: Nguyên tử X có 11 electron p, còn nguyên tử Y có 5 electron s. Liên kết giữa X và Y là
A. liên kết ion.
B. liên kết cộng hóa trị.
C. liên kết cho - nhận.
D. không xác định được.
Câu 23: Mô tả sự hình thành ion của nguyên tử Ca (Z = 20) theo quy tắc octet là
A. Ca + 2e → Ca2−.
B. Ca→ Ca2+ + 2e.
C. Ca + 6e → Ca6−.
D. Ca + 2e → Ca2+.
Câu 24: Hợp chất nào sau đây có liên kết cộng hóa trị không phân cực?
A. LiCl.
B. CF2Cl2.
C. CHCl3.
D. N2.
Câu 25: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p – p?
A. H2.
B. Cl2.
C. NH3.
D. HCl.
Câu 26: Số hợp chất ion được tạo thành từ các ion F–, K+, O2–, Ca2+ là
A. 1. B. 2. C. 3. D. 4.
Câu 27: Nhóm chất nào sau đây có liên kết “cho – nhận”?
A. NaCl, CO2.
B. HCl, MgCl2.
C. H2S, HCl.
D. NH4NO3, HNO3.
Câu 28: Cho công thức Lewis của các phân tử sau:
Số phân tử mà nguyên tử trung tâm không thoả mãn quy tắc octet là
A.1
B.2
C.3
D.4
Phần II: Tự luận (3 điểm)
Câu 29 (1 điểm):Nêu nội dung quy tắc octet? Trong liên kết hóa học, quy tắc octet giúp giải thích điều gì?
Câu 30 (1 điểm):
a)Viết công thức electron, công thức Lewis và công thức cấu tạo của nước.
b) Viết hai giai đoạn của sự hình thành KF từ các nguyên tử tương ứng (kèm theo cấu hình electron).
Câu 31 (1 điểm): Cho các khí hiếm sau: He (Z = 2), Ne (Z = 10), Ar (Z = 18), Kr (Z = 36), Xe (Z = 54). Khí hiếm nào có nhiệt độ nóng chảy cao nhất. Giải thích.
Hướng dẫn giải đề 002
Phần I: Trắc nghiệm
Câu 1:
Đáp án đúng là: A
Phát biểu A không đúng do hạt nhân của hầu hết nguyên tử được cấu tạo nên bởi các hạt proton và neutron.
Câu 2:
Đáp án đúng là: D
Số đơn vị điện tích hạt nhân = số hiệu nguyên tử (Z) = 11.
Câu 3:
Đáp án đúng là: C
Phát biểu đúng là (2); (3); (4)
Phát biểu (1) sai vì X và Y không phải đồng vị của nhau do khác nhau số proton.
Câu 4:
Đáp án đúng là: C
Cấu hình electron nguyên tử Ca: 1s22s22p63s23p64s2.
Vậy cấu hình electron lớp ngoài cùng là: 4s2.
Câu 5:
Đáp án đúng là: D
A sai vì khí hiếm He chỉ có 2 electron ở lớp ngoài cùng.
B và C sai do He có 2 electron lớp ngoài cùng nhưng là khí hiếm; H có 1 electron lớp ngoài cùng nhưng là phi kim …
Câu 6:
Đáp án đúng là: C
Hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Câu 7:
Đáp án đúng là: D
Lớp N (n = 4) có 4 phân lớp 4s, 4p, 4d, 4f.
Câu 8:
Đáp án đúng là: B
X → X2+ + 2e
Þ Cấu hình electron của X là: 1s22s22p63s2.
Vậy X là Mg (Z = 12).
Câu 9:
Đáp án đúng là: D
Bảng tuần hoàn hiện nay được sắp xếp theo các quy tắc sau:
- Các nguyên tố hóa học được sắp xếp từ trái sang phải và từ trên xuống dưới theo chiều tăng dần điện tích hạt nhân nguyên tử.
- Các nguyên tố mà nguyên tử có cùng số lớp electron được xếp vào cùng một hàng.
- Các nguyên tố mà nguyên tử có cùng số electron hóa trị như nhau được xếp vào cùng một cột.
Câu 10:
Đáp án đúng là: D
Nguyên tố X có số lớp electron = số thứ tự chu kì = 4.
Câu 11:
Đáp án đúng là: C
Nhóm A bao gồm các nguyên tố s và nguyên tố p.
Câu 12:
Đáp án đúng là: A
Cấu hình electron nguyên tử Na (Z = 11): 1s22s22p63s1.
Câu 13:
Đáp án đúng là: B
Nguyên tố R thuộc nhóm VIA nên R có hóa trị cao nhất là VI. Công thức oxide cao nhất của R là RO3.
Câu 14:
Đáp án đúng là: C
Phát biểu C sai vì hạt nhân nguyên tử không chứa electron.
Câu 15:
Đáp án đúng là: D
Ô nguyên tố không cho biết số khối của hạt nhân.
Câu 16:
Đáp án đúng là: D
X ở chu kì 3 nên có 3 lớp electron, nhóm IIIA nên có 3 electron lớp ngoài cùng.
Cấu hình electron của nguyên tử nguyên tố X là 1s²2s²2p63s²3p¹.
Câu 17:
Đáp án đúng là: D
Liên kết hydrogen làliên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
Câu 18:
Đáp án đúng là: C
Nguyên tử hydrogen có 1 electron ở lớp ngoài cùng, có xu hướng đạt cấu hình electron bền vững của khí hiếm helium khi tham gia hình thành liên kết hóa học.
Câu 19:
Đáp án đúng là: D
Trong sơ đồ trên, đường nét đứt đại diện choliên kết hydrogen.
Câu 20:
Đáp án đúng là: B
Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung làliên kết cộng hoá trị.
Câu 21:
Đáp án đúng là: A
Phân tử CO2 có cấu tạo thẳng.
Câu 22:
Đáp án đúng là: A
Cấu hình electron nguyên tử X: 1s22s22p63s23p5 Þ X là phi kim điển hình (nhóm VIIA).
Cấu hình electron nguyên tử Y: 1s22s22p63s1 Þ Y là kim loại điển hình (nhóm IA).
Vậy liên kết giữa X với Y là liên kết ion.
Câu 23:
Đáp án đúng là: B
Cấu hình electron nguyên tử Ca: [Ar]4s2.
Nguyên tử Ca có 2 electron ở lớp ngoài cùng, có xu hướng nhường 2 electron để đạt cấu hình electron bền vững giống khí hiếm.
Ca → Ca2+ + 2e
Câu 24:
Đáp án đúng là: D
Hợp chất cộng hóa trị không phân cực là: N2.
Câu 25:
Đáp án đúng là: B
Ta có:
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
N (Z = 7): 1s22s22p3
Vậy liên kết trong phân tử Cl2 được hình thành bởi sự xen phủ orbital p – p.
Câu 26:
Đáp án đúng là: D
Các hợp chất ion có thể được tạo thành là: KF; K2O; CaF2; CaO.
Câu 27:
Đáp án đúng là: D
NH4NO3:
HNO3:
Câu 28:
Đáp án đúng là: B
Có hai phân tử mà nguyên tử trung tâm không thỏa mãn quy tắc octet là BCl3 và BeH2.
Phần II: Tự luận
Câu 29:
- Quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như khí hiếm.
- Quy tắc octet giúp giải thích một cách định tính (dự đoán) sự hình thành các loại liên kết trong phân tử, đặc biệt là cách viết công thức cấu tạo trong các hợp chất thông thường.
Câu 30:
a)
Công thức phân tử |
Công thức electron |
Công thức Lewis |
H2O |
b)
Quá trình hình thành liên kết ion diễn ra như sau:
- Hình thành các ion trái dấu từ các quá trình nguyên tử kim loại nhường electron và nguyên tử phi kim nhận electron theo quy tắc octet.
K → K+ + 1e
Số electron trên các lớp: 2, 8, 8, 1 2, 8, 8
Cấu hình electron: [Ar]4s1 [Ar]
F + 1e → F-
Số electron trên các lớp: 2, 7 2, 8
Cấu hình electron: [He]2s22p5 [Ne]
- Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion.
K+ + F- → KF
Câu 31:
Theo chiều tăng dần của điện tích hạt nhân nguyên tử trong nhóm VIIIA (nhóm khí hiếm), bán kính nguyên tử tăng đồng thời khối lượng nguyên tử tăng.
⇒ Tương tác van der Waals tăng ⇒ Nhiệt độ nóng chảy tăng.
⇒ Khí hiếm có nhiệt độ nóng chảy cao nhất trong dãy là Xe.
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 1 - Chân trời sáng tạo
Năm học 2023 - 2024
Môn: Hóa học 10
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron và neutron.
B. proton và neutron.
C. neutron và electron.
D. electron, proton và neutron.
Câu 2: Nếu đường kính của nguyên tử khoảng 102 pm thì đường kính của hạt nhân khoảng
A. 102 pm.
B. 10-4 pm.
C. 10-2 pm.
D. 104 pm.
Câu 3: Số neutron (N) trong nguyên tử của một nguyên tố hoá học có thể tính được khi biết số khối (A), số hiệu nguyên tử (Z) theo công thức:
A. A = Z – N.
B. N = A – Z.
C. A = N – Z.
D. Z = N + A.
Câu 4: Nguyên tử Z có 7 neutron và 6 proton. Kí hiệu nguyên tử của Z là
A. .
B. .
C. .
D. .
Câu 5: Hình ảnh dưới đây là hình dạng của loại orbital nguyên tử nào?
A. Orbital s.
B. Orbital p.
C. Orbital d.
D. Orbital f.
Câu 6: Lớp M có bao nhiêu phân lớp?
A. 1. B. 2. C. 3. D. 4.
Câu 7: Cho nguyên tử X có 2 lớp eletron, lớp thứ 2 có 6 electron. Số hiệu nguyên tử X là
A. 8. B. 6. C. 12. D. 16.
Câu 8: Ở trạng thái cơ bản, nguyên tử phosphorus (P) có số electron độc thân là
A. 1. B. 2. C. 3. D. 4.
Câu 9: Nhóm nguyên tố là
A. tập hợp các nguyên tố mà nguyên tử có cùng cấu hình electron giống nhau được xếp ở cùng một cột.
B. tập hợp các nguyên tố mà nguyên tử có cấu hình electron gần giống nhau, do đó có tính chất hóa học giống nhau và được xếp thành một cột.
C. tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp cùng một cột.
D. tập hợp các nguyên tố mà nguyên tử có tính chất hóa học giống nhau và được xếp cùng một cột.
Câu 10: Nguyên tố nào sau đây thuộc nhóm A?
A. [Ne]3s23p3.
B. [Ar]3d14s2.
C. [Ar]3d74s2.
D. [Ar]3d54s2.
Câu 11: Trong các nguyên tố nhóm A, đại lượng nào sau đây không biến đổi tuần hoàn?
A. Bán kính nguyên tử.
B. Tính kim loại.
C. Độ âm điện.
D. Khối lượng nguyên tử.
Câu 12: Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, những yếu tố sẽ tăng dần là
A. bán kính nguyên tử và tính phi kim.
B. độ âm điện và tính phi kim.
C. bán kính nguyên tử và tính kim loại.
D. độ âm điện và tính kim loại.
Câu 13: Nguyên tố R có cấu hình electron: 1s22s22p4. Công thức hợp chất oxide ứng với hóa trị cao nhất của R là
A. RO3.
B. R2O3.
C. R2O7.
D. R2O5.
Câu 14: Dãy nào sau đây sắp xếp thứ tự tăng dần tính acid?
A. H3PO4 ; H2SO4 ; H3AsO4.
B. H2SO4 ; H3AsO4 ; H3PO4.
C. H3PO4; H3AsO4; H2SO4.
D. H3AsO4; H3PO4; H2SO4 .
Câu 15: Nguyên tố X ở chu kì 2, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s²2s²2p2.
B. 1s²2s2.
C. 1s²2s³.
D. 1s²2s²2p63s².
Câu 16: X và Y thuộc cùng một nhóm và ở hai chu kì liên tiếp. Tổng số đơn vị điện tích hạt nhân của X và Y là 18 (biết ZX < ZY). Hai nguyên tố X; Y là
A. Be (Z = 4) và Si (Z = 14).
B. B (Z = 5) và Al (Z = 13).
C. N (Z = 7) và Na (Z = 11).
D. C (Z = 6) và Mg (Z = 12).
Câu 17: Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt tới cấu hình electron bền vững theo quy tắc octet?
A. X (Z = 12).
B. Y (Z = 9).
C. Q (Z = 11).
D. T(Z = 10).
Câu 18: Công thức electron nào sau đây không đủ electron theo quy tắc octet?
A.
B.
C. 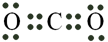
D.
Câu 19: Liên kết ion có bản chất là
A. sự dùng chung các electron.
B. lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
C. lực hút tĩnh điện giữa cation kim loại với các electron tự do.
D. lực hút giữa các phân tử.
Câu 20: Cặp nguyên tố nào sau đây có khả năng tạo thành liên kết ion trong hợp chất của chúng?
A. Nitrogen và oxygen.
B. Carbon và oxygen.
C. Sulfur và oxygen.
D. Calcium và oxygen.
Câu 21: Hợp chất nào sau đây có liên kết cộng hóa trị phân cực?
A. H2.
B. NH3.
C. CH4.
D. N2.
Câu 22: Dãy nào sau đây gồm các chất chỉ có liên kết cộng hóa trị?
A. CaCl2, NaCl, NO2.
B. SO2, CO2, K2O.
C. SO3, H2S, H2O.
D. MgCl2, Na2O, HCl.
Câu 23: Trong phân tử nitrogen (N2), mỗi nguyên tử nitrogen đã góp ba electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử nitrogen đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe.
B. Ne.
C. Ar.
D. Kr.
Câu 24: Phát biểu nào sau đây không đúng?
A.Chỉ có các AO có hình dạng giống nhau mới xen phủ với nhau để tạo liên kết.
B.Khi hình thành liên kết cộng hoá trị giữa hai nguyên tử, luôn có một liên kết δ.
C.Liên kết δ bền vững hơn liên kết π.
D.Có hai kiểu xen phủ hình thành liên kết là xen phủ trục và xen phủ bên.
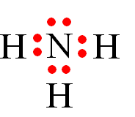
Câu 25: Công thức Lewis của H2O là
A.
B.
C.
D.
Câu 26: Phát biểu nào sau đây đúng với độ bền của một liên kết?
A. Khi nhiều liên kết được hình thành giữa hai nguyên tử, độ bền của liên kết sẽ giảm.
B. Độ bền của liên kết tăng khi độ dài của liên kết tăng.
C. Độ bền của liên kết tăng khi độ dài của liên kết giảm.
D. Độ bền của liên kết không phụ thuộc vào độ dài liên kết.
Câu 27: Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
A. các nguyên tử trong phân tử.
B. các electron trong phân tử.
C. các proton trong hạt nhân.
D. các neutron và proton trong hạt nhân.
Câu 28: Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ với nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do
A. độ âm điện của chlorine nhỏ hơn nitrogen.
B. phân tử NH3 chứa nhiều nguyên tử hydrogen nhỏ hơn phân tử HCl.
C. tổng số nguyên tử trong phân tử NH3 nhiều hơn so với phân tử HCl.
D. kích thước nguyên tử chlorine lớn hơn nguyên tử nitrogen nên mật độ điện tích âm trên chlorine không đủ lớn để hình thành liên kết hydrogen.
Phần II: Tự luận (3 điểm)
Câu 29 (1 điểm): Anion X– có cấu hình electron nguyên tử ở phân lớp ngoài cùng là 3p6.
a) Viết cấu hình electron của nguyên tử X. Cho biết X là nguyên tố kim loại hay phi kim?
b) Giải thích sự hình thành liên kết giữa X với sodium.
Câu 30 (1 điểm): Viết ô orbital của lớp electron ngoài cùng cho nguyên tử H và Cl. Từ đó chỉ ra những AO nào có thể xen phủ tạo liên kết đơn trong các phân tử H2, Cl2 và HCl.
Câu 31 (1 điểm): Giải thích vì sao tetrachloromethane (CCl4) tuy là phân tử không cực nhưng có nhiệt độ sôi cao hơn trichloromethane (CHCl3) là phân tử có cực.
Hướng dẫn giải đề số 002
Phần I: Trắc nghiệm
Câu 1:
Đáp án đúng là: B
Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là proton và neutron.
Câu 2:
Đáp án đúng là: C
Đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 10 000 lần.
Nếu đường kính của nguyên tử khoảng 102 pm thì đường kính của hạt nhân khoảng:
Câu 3:
Đáp án đúng là: B
Số khối kí hiệu là A, bằng tổng số hạt proton và neutron trong hạt nhân.
Vậy N = A – Z.
Câu 4:
Đáp án đúng là: B
Ta có:
- Số hiệu nguyên tử (Z) = số proton = 6.
- Số khối (A) = Z + N = 6 + 7 = 13.
Vậy kí hiệu nguyên tử là: .
Câu 5:
Đáp án đúng là: A
Orbital s có dạng hình cầu.
Câu 6:
Đáp án đúng là: C
Lớp M (n = 3), có 3 phân lớp là 3s, 3p và 3d.
Câu 7:
Đáp án đúng là: A
Cấu hình electron nguyên tử X: 1s22s22p4.
Vậy số hiệu nguyên tử X = số electron = 8.
Câu 8:
Đáp án đúng là: C
Cấu hình electron P theo ô orbital:
Ở trạng thái cơ bản P (Z = 15) có 3 electron độc thân.
Câu 9:
Đáp án đúng là: C
Nhóm nguyên tố làtập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp cùng một cột.
Câu 10:
Đáp án đúng là: A
Nhóm A gồm các nguyên tố khối s, p.
Þ [Ne]3s23p3 thuộc khối p nên thuộc nhóm A.
Câu 11:
Đáp án đúng là: D
Trong các nguyên tố nhóm A, khối lượng nguyên tử không biến đổi tuần hoàn.
Câu 12:
Đáp án đúng là: C
Trong cùng một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần, bán kính nguyên tử tăng dần, độ âm điện giảm dần.
Câu 13:
Đáp án đúng là: A
R thuộc nhóm VIA, hóa trị cao nhất trong hợp chất là VI.
Công thức hợp chất oxide ứng với hóa trị cao nhất của R là RO3.
Câu 14:
Đáp án đúng là: D
VA |
VIA |
|
Chu kì 3 |
H3PO4 |
H2SO4 |
Chu kì 4 |
H3AsO4 |
Theo quy luật biến đổi ta có tính acid tăng dần theo dãy: H3AsO4; H3PO4; H2SO4 .
Câu 15:
Đáp án đúng là: B
X ở chu kì 2 nên có 2 lớp electron.
X ở nhóm IIA nên có 2 electron ở lớp ngoài cùng.
Cấu hình electron của X là: 1s²2s2.
Câu 16:
Đáp án đúng là: B
Theo bài ra ta có hệ phương trình:
Hai nguyên tố X; Y là B (Z = 5) và Al (Z = 13).
Câu 17:
Đáp án đúng là: A
X (Z =12): [Ne]3s2
Nguyên tử X có 2 electron ở lớp ngoài cùng, có xu hướng nhường 2 electron để đạt được cấu hình bền vững giống khí hiếm gần nhất.
Câu 18:
Đáp án đúng là: B
Trong công thức 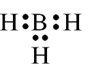
Câu 19:
Đáp án đúng là: B
Liên kết ion có bản chất là lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Câu 20:
Đáp án đúng là: D
Liên kết được tạo thành giữa kim loại điển hình và phi kim điển hình là hợp chất ion.
⇒ Cặp nguyên tố calcium là oxygen có khả năng tạo thành liên kết ion trong hợp chất của chúng.
Câu 21:
Đáp án đúng là: B
NH3: Hợp chất có liên kết cộng hóa trị phân cực.
H2, CH4, N2: Hợp chất có liên kết cộng hóa trị không phân cực.
Câu 22:
Đáp án đúng là: C
Loại A vì CaCl2, NaCl là hợp chất ion.
Loại B vì K2O là hợp chất ion.
Loại D vì MgCl2, Na2O là hợp chất ion.
Câu 23:
Đáp án đúng là: B
N (Z = 7): 1s22s22p3.
N có 5 electron ở lớp ngoài cùng, có xu hướng nhận thêm 3 electron để đạt cấu hình electron bền vững giống với khí hiếm Ne.
Câu 24:
Đáp án đúng là: A
Khi các nguyên tử liên kết với nhau, các AO phải được sắp xếp ở vị trí phù hợp.
Chẳng hạn, khi hình thành phân tử hai nguyên tử, vị trí của các AO như sau:
Khi đó, hai AO pZ nằm dọc trên cùng một trục nên chỉ có thể xen phủ trục với nhau, trong khi hai AO px (cũng như hai AO py) là song song với nhau nên chỉ có thể xen phủ bên với nhau.
Câu 25:
Đáp án đúng là: D
Công thức Lewis của H2O là:
Câu 26:
Đáp án đúng là: C
Độ bền của liên kết tăng khi độ dài của liên kết giảm.
Câu 27:
Đáp án đúng là: B
Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của các electron trong phân tử.
Câu 28:
Đáp án đúng là: D
Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ với nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do kích thước nguyên tử chlorine lớn hơn nguyên tử nitrogen nên mật độ điện tích âm trên chlorine không đủ lớn để hình thành liên kết hydrogen.
Phần II: Tự luận
Câu 29:
a)
Cấu hình electron của ion X-: 1s22s22p63s23p6.
X + 1e → X-
Vậy cấu hình electron của X là: 1s22s22p63s23p5.
X là phi kim do có 7 electron ở lớp ngoài cùng.
b)
Giải thích sự hình thành liên kết giữa X với sodium:
Sodium có 1 electron, có xu hướng nhường đi 1 electron:
Na → Na+ + 1e
X có 7 electron ở lớp ngoài cùng, có xu hướng nhận 1 electron:
X + 1e → X-
Các ion sinh ra mang điện tích trái dấu, hút nhau tạo thành hợp chất ion:
Na+ + X- → NaX.
Câu 30:
- Cấu hình electron nguyên tử H (Z = 1): 1s1.
Ô orbital của lớp electron ngoài cùng:
- Cấu hình electron nguyên tử Cl (Z = 17): 1s22s22p63s23p5.
Ô orbital của lớp electron ngoài cùng:
Nhận xét:
- 1 AO s xen phủ với 1 AO s tạo thành phân tử H2.
- 1 AO p xen phủ với 1 AO p tạo thành phân tử Cl2.
- 1 AO s (H) xen phủ với 1 AO p (Cl) tạo thành phân tử HCl.
Câu 31:
Tetrachloromethane (CCl4) tuy là phân tử không cực nhưng có nhiệt độ sôi cao hơn trichloromethane (CHCl3) là phân tử có cực.
Điều này do phân tử CCl4 có kích thước lớn hơn CHCl3 nên có số electron cũng nhiều hơn CHCl3, do đó tương tác van der Waals giữa các phân tử CCl4 mạnh hơn so với CHCl3 làm cho nhiệt độ sôi của CCl4 cao hơn CHCl3.
Xem thử Đề HK1 Hóa 10 KNTT Xem thử Đề HK1 Hóa 10 CTST
Lưu trữ: Đề thi Hóa học 10 Học kì 1 sách cũ

Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 1)
Bài giảng: Đề thi Học kì 1 Hóa 10 (Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Phần trắc nghiệm
Câu 1: Kí hiệu nào trong số các kí hiệu sau là sai?
A. 2s, 4f B. 1p, 2d C. 2p, 3d D. 1s, 2p
Câu 2: Số hạt p, n, e trong ion 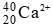
A. 20, 19, 18 B. 18, 18, 20
C. 20, 20, 18 D. 20, 20, 20
Câu 3: Cho 3 nguyên tố X (Z = 14), Y (Z = 17), Z (Z = 15). Dãy các nguyên tố có bán kính nguyên tử tăng dần là:
A. X, Y, Z B. Z, Y, X
C. X, Z, Y D. Y, Z, X
Câu 4: Nguyên tử của nguyên tố X có tổng số hạt là 40. Trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là:
A. 27 B. 26 C. 28 D. 29
Câu 5: Số oxi hóa của nitơ trong các hợp chất HNO3, NO, N2O, NH3 theo thứ tự là
A. -5, -2, +1, -3.
B. +5, +2, +1, -3
C. +5, +2, +1, +3.
D. +5, +2, -1, -3
Câu 6: Nguyên tố X có hai đồng vị, đồng vị thứ nhất 35X chiếm 75%. Nguyên tử khối trung bình của X là 35,5. Đồng vị thứ hai là:
A. 34X B. 36X C. 37X D. 38X
Phần tự luận
Câu 1: (2,5 điểm)
Cho các nguyên tố sau: X (Z = 12); Y (Z = 34); G (Z = 22); H (Z = 29)
a) Viết cấu hình electron nguyên tử (đầy đủ) của 4 nguyên tố trên. (1,0 điểm)
b) Xác định vị trí của 2 nguyên tố X, G trong bảng tuần hoàn. Giải thích? (1,0 điểm)
c) Cho biết tính chất của 2 nguyên tố Y, H (kim loại, phi kim hay khí hiếm). Giải thích? (0,5 điểm)
Câu 2: (1,5 điểm)
Cho các phân tử sau: KCl, H2O, N2 và Na2O.
Biết số hiệu nguyên tử của các nguyên tố lần lượt là: H = 1, N = 7, O = 8, Na = 11, Cl = 17, K = 19.
a) Xác định loại liên kết hoá học trong các phân tử trên (liên kết ion, liên kết cộng hoá trị phân cực hay liên kết cộng hoá trị không cực)? (0,5 điểm)
b) Viết công thức electron và công thức cấu tạo của các phân tử chứa liên kết cộng hoá trị. (1,0 điểm)
Câu 3: (3,0 điểm)
Hoà tan hoàn toàn 16,5 gam hỗn hợp A gồm Fe và Al vào 500 dung dịch HCl 2,5M (d =1,1g/ml) thu được 13,44 lít H2 (đktc) và dung dịch B
a) Tính % khối lượng mỗi kim loại trong hỗn hợp A. (1,5 điểm)
b) Tính C% các chất trong dung dịch B. (1,0 điểm)
c) Thực hiện oxi hoá hỗn hợp A với lượng như trên ngoài không khí sau một thời gian thu được hỗn hợp rắn X gồm Al2O3 và Fe3O4. Hoà tan hết hỗn hợp X bằng dung dịch HCl được dùng dư 10% so với lượng cần thiết thu được dung dịch Y. Tính thể tích dung dịch KOH 5M tối thiểu cần cho vào dung dịch Y để thu được lượng kết tủa không đổi. (0,5 điểm)
(Cho H = 1, O = 16, Cl = 35,5, Fe = 56, Al = 27)
Đáp án và Thang điểm
Phần trắc nghiệm
Câu 1. B
Không có phân lớp 2d.
Câu 2. C
Số hạt p = z = 20
Số hạt n = A – z = 40 – 20 = 20.
Số hạt e = 20 – 2 = 18
Câu 3. D
Ta có X, Y, Z thuộc cùng chu kỳ, ZX < ZZ < ZY
→ Bán kính nguyên tử: Y < Z < X.
Câu 4. A
Gọi số hạt proton, nơtron, electron trong X lần lượt là p, n và e (trong đó p = e)
Theo bài ra có: 2p + n = 40 và 2p – n = 12.
Giải hệ phương trình được p = 13 và n = 14.
Số khối A = 13 + 14 = 27.
Câu 5. B
+) HNO3: Gọi số oxi hóa của N là x có:
(+1) + x + (-2).3 = 0 → x = + 5.
+) NO: Gọi số oxi hóa của N là x có:
x +(-2) = 0 → x = +2.
+) N2O: Gọi số oxi hóa của N là x có:
x.2 +(-2) = 0 → x = +1
+) NH3: Gọi số oxi hóa của N là x có:
x +(+1).3 = 0 → x = -3.
Câu 6. C
Gọi nguyên tử khối trung bình của đồng vị thứ 2 là x
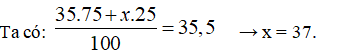
Phần tự luận
Câu 1: (2,5 điểm)
a) Cấu hình electron nguyên tử (đầy đủ) của 4 nguyên tố. (1,0 điểm)
X (Z = 12): 1s22s22p63s2
Y (Z = 34): 1s22s22p63s23p63d104s24p4
G (Z = 22): 1s22s22p63s23p63d24s2
H (Z = 29): 1s22s22p63s23p63d104s1
b) Vị trí của X, G trong bảng tuần hoàn. (1,0 điểm)
X: - Ô: 12 (vì Z = 12)
- Chu kì: 3 (vì có 3 lớp e)
- Nhóm: IIA (vì là nguyên tố s và có 2 electron lớp ngoài cùng)
G: - Ô: 22 (vì Z = 22)
- Chu kì: 4 (vì có 4 lớp e)
- Nhóm: IVB (vì là nguyên tố d và có 4 electron hoá trị)
c) Tính chất của 2 nguyên tố Y, H (kim loại, phi kim hay khí hiếm).
Giải thích. (0,5 điểm)
- Y là phi kim, vì có 6e lớp ngoài cùng.
- H là kim loại vì có 1e lớp ngoài cùng.
Câu 2: (1,5 điểm)
a) Xác định loại liên kết: (0,5 điểm)
KCl: Liên kết ion
H2O: Liên kết cộng hoá trị phân cực
N2: Liên kết cộng hoá trị không phân cực
Na2O: Liên kết ion
b) Viết CT electron và công thức cấu tạo của phân tử chứa liên kết cộng hoá trị: N2 và H2O (1,0 điểm)

Câu 3: (3,0 điểm)
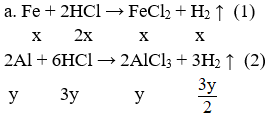
Đặt x, y lần lượt là số mol của Fe và Al
Hệ pt: 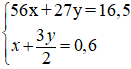
Giải hệ được: x = 0,15 mol; y = 0,3 mol
%Fe = 50,91% và %Al = 49,09%
b. Dung dịch sau phản ứng gồm: FeCl2 0,15 mol; AlCl3 0,3 mol
HCl dư: 1,25 - (2x + 3y) = 0,05 mol
mdd B = mA + mdd HCl – mH = 16,5 + 500 . 1,1 – 0,6 x 2 = 565,3g
C%FeCl2 = 3,37%; C%AlCl3 = 7,08%; C%HCl = 0,32%
c. PTHH:

Để lượng kết tủa không đổi thì KOH cần tối thiểu là vừa đủ để hoà tan hết Al(OH)3. Tổng số mol KOH là: 0,13 + 0,1 + 0,3 + 0,9 + 0,3 = 1,73 mol
Thể tích dung dịch KOH là: 1,73 : 5 = 0,346 lít = 346 ml
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 2)
Bài giảng: Đề thi Học kì 1 Hóa 10 (Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Phần trắc nghiệm
Câu 1: Điều khẳng định nào sau đây là sai?
A. Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton, electron, nơtron.
B. Trong nguyên tử số hạt proton bằng số hạt electron.
C. Số khối A bằng tổng số proton (Z) và tổng số nơtron (N).
D. Nguyên tử được cấu tạo nên bởi các hạt proton, electron, nơtron.
Câu 2: Hòa tan hoàn toàn 6 gam một kim loại M hóa trị II vào dung dịch HCl, sau phản ứng thu được 3,36 lit khí H2 (đktc). Kim loại M là:
A. Zn (65) B. Mg (24)
C. Fe (56) D. Ca (40)
Câu 3: Anion X có phân lớp ngoài cùng là 3p6. Nguyên tố X thuộc:
A. nhóm IIA, chu kì 4
B. nhóm VIIA, chu kì 3
C. nhóm VIIIA, chu kì 3
D. nhóm VIA, chu kì 3
Câu 4: Trong tự nhiên nguyên tố clo có hai đồng vị 35Cl và 37Cl, nguyên tử khối trung bình của Cl là 35,48. Số nguyên tử đồng vị 35Cl có trong 200 nguyên tử clo là?
A. 132 B. 48 C. 76 D. 152
Câu 5: Cho các nguyên tố: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là:
A. K, Mg, N, Si. B. Mg, K, Si, N.
C. K, Mg, Si, N. D. N, Si, Mg, K.
Câu 6: Nhóm hợp chất nào sau đây chỉ có liên kết ion:
A. Na2O, CO, BaO. B. BaO, CaCl2, BaF2.
C. CS2, H2O, HF. D. CaO, CH4, NH3.
Câu 7: Nguyên tử của một nguyên tố R có tổng số các loại hạt bằng 82, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số hiệu nguyên tử của R là:
A. 56 B. 30 C. 26 D. 24
Câu 8: Phát biểu nào sau đây sai:
A. Điện hóa trị có trong hợp chất ion.
B. Điện hóa trị bằng số cặp electron dùng chung.
C. Cộng hóa trị có trong hợp chất cộng hóa trị
D. Cộng hóa trị bằng số cặp electron dùng chung.
Câu 9: Trong phản ứng hóa học: Cl2 + 2NaBr → 2NaCl + Br2. Cl2 đóng vai trò:
A. chất bị khử
B. chất bị oxi hóa
C. chất vừa bị oxi hóa, vừa bị khử
D. chất không bị oxi hóa, không bị khử.
Câu 10: Cation R+ có cấu hình e lớp ngoài cùng là 3p6. Cấu hình electron đầy đủ của R là:
A. 1s22s22p63s23p6
B. 1s22s22p63s23p5
C. 1s22s22p63s23p63d1
D. 1s22s22p63s23p64s1
Phần tự luận
Câu 1: (2 điểm)
Biết nguyên tố R ở chu kì 3, nhóm VA trong bảng tuần hoàn.
a) Viết cấu hình electron và xác định số đơn vị điện tích hạt nhân của R?
b) Viết công thức phân tử và công thức cấu tạo của oxit bậc cao, của hiđroxit và hợp chất khí với hiđro của R?
Câu 2: (2 điểm)
Cân bằng PTHH của các phản ứng oxi hoá- khử sau bằng phương pháp thăng bằng electron (xác định chất khử, chất oxi hoá, quá trình khử, quá trình oxi hóa).
a) Cu + H2SO4 đ, n → CuSO4 + SO2 + H2O
b) Al + HNO3 → Al(NO3)3 + NO + NH4NO3 + H2O
Câu 3: (1 điểm)
Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH4. Trong oxit mà R có hoá trị cao nhất thì oxi chiếm 53,3% về khối lượng. Xác định nguyên tố R ?
Học sinh không sử dụng bảng hệ thống tuần hoàn các nguyên tố hóa học
Đáp án và Thang điểm
Phần trắc nghiệm
Câu 1. A
Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton và nơtron.
Câu 2. D
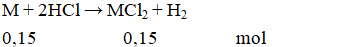
MM = 6 : 0,15 = 40.
Vậy kim loại M là Ca.
Câu 3. B
Cấu hình electron của X là 1s22s22p63s23p5
Vậy X thuộc chu kỳ 3 do có 3 lớp electron, nhóm VII A do có 7 e lớp ngoài cùng, nguyên tố p.
Câu 4. D
Gọi % số nguyên tử của hai đồng vị 35Cl và 37Cl lần lượt là x và y
Ta có x + y = 100.
Theo bài ra ta có:
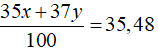
Giải hệ phương trình được x = 76 và y = 24.
Số nguyên tử 35Cl có trong 200 nguyên tử Cl là
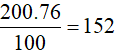
Câu 5. C
N và Si thuộc cùng nhóm IV A có ZN < ZSi → Bán kính Si > N.
Si và Mg thuộc cùng chu kỳ 3 có ZMg < ZSi → bán kính Mg > Si.
Có K và Na thuộc cùng nhóm IA có ZNa < ZK → bán kính K > Na. Có Na và Mg thuộc cùng chu kỳ 3 có ZNa < ZMg → bán kính Na > Mg. Vậy bán kính K > Mg.
Chiều giảm dần bán kính: K > Mg > Si > Mg.
Câu 6. B
Các hợp chất BaO; CaCl2 và BaF2 tạo nên bởi kim loại điển hình và phi kim điển hình nên là hợp chất ion.
Câu 7. C
Gọi số proton, nơtron và electron của R lần lượt là p, n và e trong đó p = e.
Theo bài ra ta có: 2p + n = 82 và 2p – n = 22.
Giải hệ phương trình được p = 26 và n = 30.
Số hiệu nguyên tử của R là 26.
Câu 8. B
Điện hóa trị bằng điện tích ion.
Câu 9. A
Clo có số oxi hóa giảm từ 0 xuống -1 sau phản ứng nên Cl2 là chất oxi hóa hay chất bị khử.
Câu 10. D
R → R+ + 1e
Cấu hình electron của R là 1s22s22p63s23p64s1
Phần tự luận
Câu 1: (2 điểm)
a. Viết cấu hình electron: 1s22s22p63s23p3 , Z+ = 15+
b. CTPT R2O5, H3RO4, RH3 (HS ghi R là P cũng được)
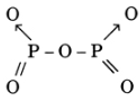
- Viết công thức cấu tạo 3 chất trên.
P2O5 :
H3PO4:
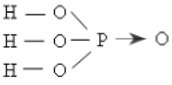
PH3:
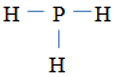
Câu 2: (2 điểm)
Mỗi phản ứng 1 điểm
a) Cu + 2 H2SO4 đ,n → CuSO4 + SO2 + 2H2O
Cu: Chất khử
H2SO4 đ,n: Chất oxi hóa
Cu0 → Cu2+ + 2e quá trình oxi hóa
S+6 + 2e → S+4 quá trình khử
b) 11Al + 42 HNO3 → 11 Al(NO3)3 + 3 NO + 3 NH4NO3 + 15 H2O
Al: chất khử
HNO3: chất oxi hóa
Al0 → Al3+ + 3e quá trình oxi hóa
2N+5 + 11e → N+2 + N-3 quá trình khử
Câu 3: (1 điểm)
Ứng với công thức RH4 ⇒ CT oxit bậc cao là RO2
%O = 53,3% ⇒ %R = 46,7%
Lập tỉ lệ 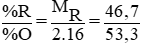
⇒ MR = 28 , R là nguyên tố Si
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 3)
Bài giảng: Đề thi Học kì 1 Hóa 10 (Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Phần trắc nghiệm
Câu 1: Tổng số hạt cơ bản (p, n, e) trong nguyên tử nguyên tố X là 46, biết số hạt mang điện nhiều hơn số hạt không mang điện là 14. Xác định chu kì, số thứ tự ô nguyên tố của X trong bảng tuần hoàn.
A. Chu kì 2, ô 7 B. Chu kì 3 ô 17
C. Chu kì 3 ô 16 D. Chu kì 3, ô 15
Câu 2: Tính chất phi kim của các nguyên tố trong dãy N - P - As - Sb - Bi (nhóm VA) biến đổi theo chiều:
A. Tăng B. Không thay đổi
C. Vừa giảm vừa tăng. D. Giảm
Câu 3: Cho các phân tử N2, HCl, NaCl, MgO. Các phân tử đều có liên kết cộng hóa trị là
A. NaCl và MgO B. HCl và MgO
C. N2 và NaCl D. N2 và HCl
Câu 4: Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
A. ion. B. Cộng hoá trị.
C. Kim loại. D. Cho nhận
Câu 5: Cho biết cấu hình electron của nguyên tố A là 1s22s22p63s23p4 và cấu hình electron của nguyên tố B là 1s22s22p63s1. Phát biểu đúng là
A. Nguyên tố A là KL, nguyên tố B là PK
B. Nguyên tố A là PK, nguyên tố B là KL.
C. Nguyên tố A, nguyên tố B đều là PK
D. Nguyên tố A, nguyên tố B đều là KL.
Câu 6: Hợp chất của một nguyên tố có công thức RH2. Oxit cao nhất của R chiếm 40% khối lượng R. R là:
A. N (M = 14) B. Se (M = 79).
C. S (M = 32) D. Ca (M = 40)
Câu 7: Cho phương trình phản ứng hóa học sau:
8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O. Trong phản ứng trên chất khử là:
A. Fe B. HNO3
C. Fe(NO3)3 D. N2O
Câu 8: Nguyên tố X có Z = 20. Vị trí của X trong hệ thống hoàn:
A. Tất cả đều sai
B. Chu kì 3, nhóm IA
C. Chu kì 4, nhóm IIA
D. Chu kì 4, nhóm IIIA.
Câu 9: Trong các phân tử sau, phân tử có liên kết ba giữa hai nguyên tử là:
A. Khí flo. B. Khí cacbonic.
C. Khí hyđrô. D. Khí nitơ.
Câu 10: Số oxi hóa của lưu huỳnh trong các phân tử và ion sau: SO42-, H2SO4, H2SO3 lần lượt là
A. -2, +4, +6. B. +6, +4, +6.
C. +6, +6, +4. D. +4, +6, +6.
Câu 11: Trong các phản ứng sau, phản ứng nào không phải là phản ứng oxy hóa khử.
A. Fe + 2HCl → FeCl2
B. Fe + CuSO4 → FeSO4 + Cu.
C. 2FeCl3 + Fe → 3FeCl3
D. FeS + 2HCl → FeCl2 + H2S
Câu 12: Trong phản ứng hoá học sau: 3Cl2 + 6KOH → KClO3 + 5KCl + 3H2O. Cl2 đóng vai trò là gì?
A. Chỉ là chất oxi hoá
B. Vừa là chất oxi hoá, vừa là chất khử
C. Chỉ là chất khử.
D. Không phải là chất oxi hoá, không phải là chất khử
Phần tự luận
Câu 1: (2 điểm)
Khi cho 0,9g một kim loại X thuộc nhóm IIA tác dụng với nước thì được 0,504 lít H2 (đkct). Tìm kim loại X.
Câu 2: (2 điểm)
Cho PTH Zn + HNO3 → Zn(NO3)2 + NO2 + H2O
a) Cân bằng PTHH trên?
b) Tính thể tích khí NO2 thu được ở đktc khi cho 13g Zn tác dụng với 400ml HNO3 2,5M.
Đáp án và Thang điểm
Câu 1. D
Gọi số hạt proton, nơtron và electron của X lần lượt là p, n và e.
Theo bài ra ta có: 2p + n = 46 và 2p – n = 14.
Giải hệ phương trình ta được: p = 15 và n = 16.
Vậy X ở ô 15. Cấu hình electron của X là 1s22s22p63s23p3. Vậy X ở chu kỳ 3.
Câu 2. D
Trong một nhóm A, theo chiều từ trên xuống dưới (chiều tăng dần của điện tích hạt nhân) tính phi kim của các nguyên tố giảm dần.
Câu 3. D
Phân tử N2 và HCl được cấu tạo nên từ các phi kim do đó liên kết trong phân tử là liên kết cộng hóa trị.
Câu 4. A
X có 1 e lớp ngoài cùng do đó X là kim loại điển hình.
Y có 7 e lớp ngoài cùng do đó Y là phi kim điển hình.
Vậy liên kết giữa nguyên tử X và Y là liên kết ion.
Câu 5. B
A có 6 e ở lớp ngoài cùng do đó A là phi kim.
B có 1 e ở lớp ngoài cùng do đó B là kim loại.
Câu 6. C
Oxit cao nhất của R có dạng RO3.
Theo bài ra có:
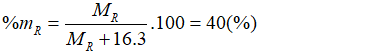
→ R = 32. Vậy R là lưu huỳnh (S).
Câu 7. A
Số oxi hóa của Fe tăng từ 0 lên +3 sau phản ứng. Vậy Fe là chất khử.
Câu 8. C
Cấu hình electron nguyên tử của X là: 1s22s22p63s23p64s1.
Vậy X ở chu kỳ 4, nhóm IIA.
Câu 9. D
Ta có CTCT của các chất:
F – F; O = C = O; H – H; N ≡ N.
Vậy chỉ có phân tử chỉ có liên kết ba giữa hai nguyên tử là N2.
Câu 10. C
SO42-: Gọi số oxi hóa S là x ta có:
x + (-2).4 = -2. Vậy x = +6.
H2SO4: Gọi số oxi hóa S là x ta có:
(+1).2 + x + (-2).4 = 0. Vậy x = +6.
H2SO3: Gọi số oxi hóa S là x ta có:
(+1).2 + x + (-2).3 = 0. Vậy x = +4.
Câu 11. D
FeS + 2HCl → FeCl2 + H2S
Phản ứng này không có sự thay đổi số oxi hóa của các nguyên tố sau phản ứng nên không là phản ứng oxi hóa – khử.
Câu 12. B
Clo có số oxi hóa tăng từ 0 lên +5 và giảm từ 0 xuống -1 sau phản ứng nên Cl2 vừa đóng vai trò là chất oxi hóa vừa đóng vai trò là chất khử.
Phần tự luận
Câu 1: (2 điểm)
nH2 = 0,504/22,4 = 0,0225 mol
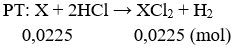
Theo pt: nX = nH2 = 0,0225 mol
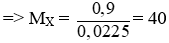
Vậy X là Ca.
Câu 2: (2 điểm)
a. Cân bằng PTHH
Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
b. Số mol của Zn là 13/65 = 0,2 mol
Số mol của HNO3 là 0,4.2,5 = 1 mol
Ta có tỉ lệ: 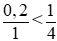
⇒ Số mol NO2 = 2. nZn = 2.0,2= 0,4 mol.
VNO2 = 0,4. 22,4 = 8,96 lit
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 4)
Bài giảng: Đề thi Học kì 1 Hóa 10 (Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Phần trắc nghiệm
Câu 1: Các hạt cấu tạo nên hầu hết các nguyên tử là:
A. Proton và electron.
B. Proton và nơtron.
C. Proton, nơtron và electron.
D. Nơtron và electron.
Câu 2: Nguyên tố X thuộc chu kỳ 3, nhóm IVA trong bảng tuần hoàn. Cấu hình electron nguyên tử của X là:
A. 1s22s22p63s23p4
B. 1s22s22p63s23p2
C. 1s22s22p63s23p63d104s24p2
D. 1s22s22p63s23p6
Câu 3: Hợp chất X tạo ra oxit cao nhất có công thức là AO2.Trong hợp chất khí với hiđro A chiếm 75% về khối lượng. Nguyên tố A là:
A. C (M = 12) B. Si (M = 28)
C. S (M = 32) D. Cl (M = 35,5)
Câu 4: Nguyên tử của các nguyên tố thuộc chu kì 5 có số lớp electron là:
A. 3 B. 4 C. 5 D. 6
Câu 5: Các nguyên tố 16X, 13Y, 9Z, 8T xếp theo thứ tự tính phi kim tăng dần là:
A. Y, X, Z, T B. Y, X, T, Z.
C. Y, T, Z, X. D. X, T, Y, Z.
Câu 6: Hiđro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị 2H trong 10 ml nước (biết trong nước chỉ có đồng vị 1H và 2H; khối lượng riêng của nước là 1 g/ml).
A. 5,35. 1020 B. 5,35. 1021
C. 5,35. 1022 D. 5,35. 1023
Câu 7: Chọn cấu hình electron đúng của ion Fe3+ (Z = 26)
A. 1s22s22p63s23p63d5
B. 1s22s22p63s23p63d6
C. 1s22s22p63s23p63d64s2
D. 1s22s22p63s23p63d34s2
Câu 8: Hòa tan hoàn toàn 0,3 gam hỗn hợp hai kim loại X và Y ở hai chu kì liên tiếp của nhóm IA vào nước thì thu được 0,224 lít khí hiđro ở đktc. Hai kim loại đó là (Biết Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133).
A. Li và Na. B. Na và K.
C. K và Rb. D. Rb và Cs.
Câu 9: Trong tự nhiên Bo có 2 đồng vị là 11B (81%) và 10B (19%). Nguyên tử khối trung bình của Bo là:
A. 81 B. 19 C. 10,18 D. 10,81
Câu 10: Hợp chất A được tạo thành từ ion M+ và ion X2- (được tạo ra từ các nguyên tố M và X tương ứng). Trong phân tử A có tổng số các hạt cơ bản là 92, trong đó số hạt mang điện bằng 65,22% tổng số hạt. Số khối của M lớn hơn của X là 7. Nguyên tố M là:
A. Li B. Na C. K D. H
Câu 11: Chất nào sau đây chỉ chứa các liên kết cộng hóa trị?
A. CaCl2. B. Na2O C. KCl D. H2S
Câu 12: Cho dãy chất sau: NH3 , N2O , N2 , HNO3. Số oxi hóa của nitơ trong các chất lần lượt là:
A. -3, 0, +1, +5 B. +3, +1, 0, +6
C. -3, +1, 0, +5 D. -3, +1, +2, +5
Phần tự luận
Câu 1: (1 điểm)
Nguyên tử của một nguyên tố X có tổng số hạt cơ bản là 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Tìm số p, e, n và số khối của nguyên tử nguyên tố X.
Câu 2: (3 điểm)
a/ Viết cấu hình e nguyên tử của các nguyên tố X, Y, T, Q trong các trường hợp sau: (1 điểm)
- X có Z = 20.
- Nguyên tử Y có tổng số electron trên phân lớp p là 9.
- Q có Z = 29.
- T có cấu hình electron ion T2-: 1s22s22p6.
b/ Xác định vị trí của nguyên tố X, Q trong bảng tuần hoàn. Giải thích. (1 điểm)
c/ Nêu tính chất hóa học cơ bản của nguyên tố X, Y. Giải thích. (1 điểm).
Câu 3: (3 điểm)
Hòa tan hoàn toàn 13,8 gam hỗn hợp A gồm hai kim loại Fe, Al vào 750 ml dung dịch HCl 1,6M (D = 1,1g/ml) thu được 10,08 lít khí (đktc) và dung dịch B.
a/ Tính phần trăm về khối lượng mỗi kim loại trong hỗn hợp A. (1,5 điểm)
b/ Tính nồng độ phần trăm của các chất trong dung dịch B. (1 điểm)
c/ Nhỏ từ từ dung dịch KOH 15% vào dung dịch B đến khi thu được kết tủa có khối lượng không đổi, lọc lấy kết tủa đem nung ngoài không khí được m gam chất rắn. Tính khối lượng dung dịch KOH và m? (0,5 điểm)
(Cho M của các nguyên tố: Al = 27, Fe = 56, O = 16, H = 1, Cl = 35,5)
Đáp án và Thang điểm
Phần trắc nghiệm
Câu 1. C
Các hạt cấu tạo nên hầu hết các nguyên tử là proton, nơtron và electron.
Câu 2. B
X ở chu kỳ 3 nên X có 3 lớp electron; X thuộc nhóm IVA nên X có 4 electron lớp ngoài cùng. Cấu hình electron của nguyên tử X là: 1s22s22p63s23p2
Câu 3. A
Hợp chất khí với H của A có dạng AH4. Theo bài ra ta có:
→ MA = 12. Vậy A là Cacbon.
Câu 4. C
STT chu kỳ = số lớp electron.
Câu 5. B
Z và T thuộc cùng chu kỳ, có ZZ > ZT → tính phi kim Z > T.
X và Y thuộc cùng chu kỳ, có ZX > ZY → tính phi kim X > Y.
T và X thuộc cùng nhóm, có ZX > ZT → tính phi kim của T > X.
Chiều tăng tính phi kim là: Y < X < T < Z.
Câu 6. B
Gọi % số nguyên tử của hai đồng vị 1H và 2H lần lượt là x và y
Ta có x + y = 100.
Ta lại có:
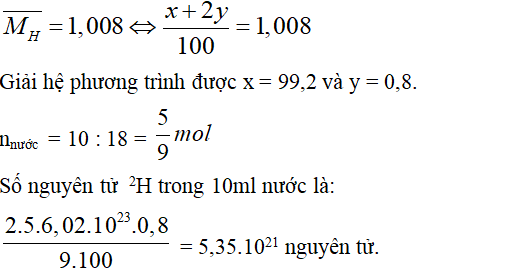
Câu 7. A
Cấu hình electron của Fe là: 1s22s22p63s23p63d64s2
→ Cấu hình electron của Fe3+ là 1s22s22p63s23p63d5
Câu 8. A

Câu 9. D
Nguyên tử khối trung bình của Bo là:
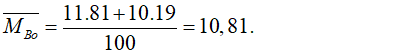
Câu 10. B
Hợp chất A có dạng: M2X
Gọi các hạt proton, nơtron và electron của M trong A lần lượt là pM, nM và eM.
các hạt proton, nơtron và electron của X trong A lần lượt là pX, nX và eX.
Tổng các hạt cơ bản trong A bằng 92
→ 4pM + 2nM + 2pX + nX = 92 (1)
Trong A, số hạt mang điện bằng 65,22% tổng số hạt nên:
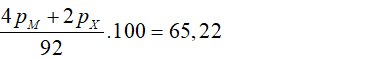
→ 2pM + PX = 30 (2)
Thay (2) vào (1) được 2nM + nX = 32 (3)
Số khối của M lớn hơn số khối của X là 7
→ pM + nM – pX – nX = 7 (4).
Lấy (2) + (3) – (4) ta được: pM + nM = 23.
Vậy M là Na.
Câu 11. D
H2S tạo nên từ hai nguyên tố phi kim → phân tử chứa liên kết cộng hóa trị.
Câu 12. C
Số oxi hóa của N trong NH3, N2O , N2 , HNO3 lần lượt là -3, +1, 0, +5.
Phần tự luận
Câu 1: (1 điểm)
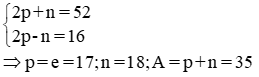
Câu 2: (3 điểm)
a) Cấu hình electron nguyên tử: (1 điểm)
X (Z = 20): 1s22s22p63s23p64s2
Y: 1s22s22p63s23p3
Q (Z = 29): 1s22s22p63s23p63d104s1
T: 1s22s22p4
b) Vị trí của X, Q trong bảng tuần hoàn: (1 điểm)
X: - Ô: 20 (vì Z = 20)
- Chu kì: 4 (vì có 4 lớp e)
- Nhóm: IIA (vì là nguyên tố s và có 2 electron lớp ngoài cùng)
Q: - Ô: 29 (vì Z = 29)
- Chu kì: 4 (vì có 4 lớp e)
- Nhóm: IB (vì là nguyên tố d và có 1 electron hoá trị)
c) Tính chất: (1 điểm)
* X - là kim loại vì có 2e lớp ngoài cùng.
- Hóa trị cao nhất với oxi là II, Hoá trị trong hợp chất khí với hiđro: không có vì là kim loại
- Công thức oxit cao nhất XO ⇒ là oxit bazo; CT hiđroxit tương ứng X(OH)2
⇒ là bazo
* Y - là phi kim vì có 5e lớp ngoài cùng.
- Hóa trị cao nhất với oxi là V, Hoá trị trong hợp chất khí với hiđro là III
- Công thức oxit cao nhất X2O5 ⇒ là oxit axit; CT hiđroxit tương ứng H3XO4
⇒ là axit
- CT hợp chất khí với hiđro là YH3.
Câu 3: (3 điểm)
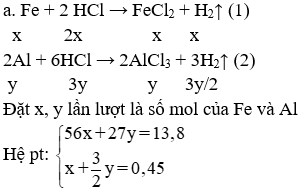
Đặt x, y lần lượt là số mol của Fe và Al
Hệ pt:
Giải hệ được: x = 0,15 mol; y = 0,2 mol
⇒ %Fe = 60,87% và %Al = 39,13%
b. Dd sau phản ứng gồm: FeCl2 0,15 mol; AlCl3 0,2 mol; HCl dư: 1,2 - (2x + 3y) = 0,3 mol
mdd B = mA + mdd HCl – mH2 = 13,8 + 750.1,1 – 0,45.2 = 837,9g
C%FeCl2 = 2,27%; C%AlCl3 = 3,19%; C%HCl = 1,31%
c. PTHH:
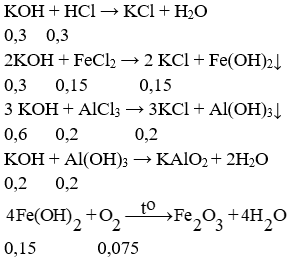
Để lượng kết tủa không đổi thì KOH cần vừa đủ để hoà tan hết Al(OH)3
⇒ Tổng số mol KOH là: 0,3 + 0,3 + 0,6 + 0,2 = 1,4 mol
⇒ Khối lượng dung dịch KOH là: (1,4.56.100) : 15 = 522,67 gam.
⇒ mrắn = 0,075.160 = 12 gam.
Xem thêm bộ đề thi Hóa học 10 năm 2024 chọn lọc khác:
- Đề thi Giữa kì 1 Hóa học 10 có đáp án năm 2024 (3 đề)
- Bộ 20 Đề thi Hóa học 10 Giữa học kì 1 năm 2024 tải nhiều nhất
- Đề thi Hóa học 10 Giữa học kì 1 năm 2024 có ma trận (15 đề)
- Đề kiểm tra Hóa học 10 Giữa học kì 1 có đáp án (3 đề)
- Đề thi Hóa học 10 Giữa kì 1 có đáp án (3 đề)
- Đề kiểm tra Hóa học 10 Giữa học kì 2 có đáp án (5 đề)
- Đề thi Hóa học 10 Giữa kì 2 có đáp án (5 đề)
- Đề thi Hóa học 10 Học kì 2 có đáp án (5 đề)
Đã có lời giải bài tập lớp 10 sách mới:
- (mới) Giải bài tập Lớp 10 Kết nối tri thức
- (mới) Giải bài tập Lớp 10 Chân trời sáng tạo
- (mới) Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 cho học sinh và giáo viên (cả 3 bộ sách):
Săn shopee siêu SALE :
- Sổ lò xo Art of Nature Thiên Long màu xinh xỉu
- Biti's ra mẫu mới xinh lắm
- Tsubaki 199k/3 chai
- L'Oreal mua 1 tặng 3
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Lớp 10 - Kết nối tri thức
- Soạn văn lớp 10 (hay nhất) - KNTT
- Giải Toán lớp 10 - KNTT
- Giải Tiếng Anh lớp 10 - KNTT
- Giải Vật lí lớp 10 - KNTT
- Giải Giáo dục Kinh tế và Pháp luật lớp 10 - KNTT
- Giải Sinh học lớp 10 - KNTT
- Giải Địa lí lớp 10 - KNTT
- Giải Lịch sử lớp 10 - KNTT
- Giải Công nghệ lớp 10 - KNTT
- Giải Hoạt động trải nghiệm lớp 10 - KNTT
- Giải Giáo dục quốc phòng lớp 10 - KNTT
- Giải Tin học lớp 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn lớp 10 (hay nhất) - CTST
- Giải Toán lớp 10 - CTST
- Giải Tiếng Anh lớp 10 - CTST
- Giải Vật lí lớp 10 - CTST
- Giải Hóa học lớp 10 - CTST
- Giải Sinh học lớp 10 - CTST
- Giải Giáo dục Kinh tế và Pháp luật lớp 10 - CTST
- Giải Địa lí lớp 10 - CTST
- Giải Lịch sử lớp 10 - CTST
- Giải Hoạt động trải nghiệm lớp 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn lớp 10 (hay nhất) - CD
- Giải Toán lớp 10 - CD
- Giải Tiếng Anh lớp 10 - CD
- Giải Vật lí lớp 10 - CD
- Giải Hóa học lớp 10 - CD
- Giải Sinh học lớp 10 - CD
- Giải Giáo dục Kinh tế và Pháp luật lớp 10 - CD
- Giải Địa lí lớp 10 - CD
- Giải Lịch sử lớp 10 - CD
- Giải Giáo dục quốc phòng lớp 10 - CD
- Giải Tin học lớp 10 - CD