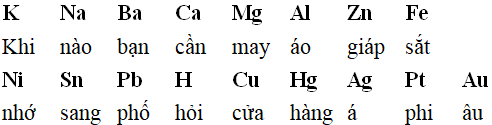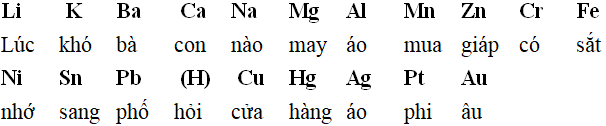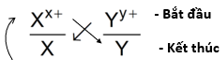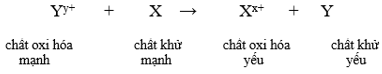Dãy điện hóa của kim loại đầy đủ, chi tiết | Cách nhớ nhanh dãy điện hóa của kim loại
Dãy điện hóa của kim loại đầy đủ, chi tiết (Cách nhớ nhanh dãy điện hóa của kim loại)
Với mục đích giúp học sinh dễ dàng hơn trong việc nhớ dãy điện hóa, VietJack biên soạn bản Dãy điện hóa của kim loại đầy đủ, chi tiết (Cách nhớ nhanh dãy điện hóa của kim loại). Hi vọng loạt bài này sẽ như là cuốn sổ tay kiến thức và công thức giúp bạn học tốt môn Hóa học.
I. DÃY ĐIỆN HÓA CỦA MỘT SỐ KIM LOẠI THÔNG DỤNG VÀ CÁCH GHI NHỚ.
Dãy điện hóa của kim loại là phần nội dung rất quan trọng của hóa học vô cơ. Phải nắm được kiến thức này, bạn mới có thể học tốt phần hóa học vô cơ trong chương trình học.
Tuy nhiên, dãy điện hóa của kim loại tương đối dài và phức tạp. Một trong những cách học thuộc, nhớ lâu dãy điện hóa được các bạn học sinh áp dụng là học thuộc bằng cách biến tấu thành một đoạn thơ.
Chẳng hạn như:
Hay có thể biến tấu rằng:
Hay để nhớ thêm vị trí của các cặp oxi hóa – khử của kim loại sắt có thể nhớ bằng biến tấu thành:
Bạn nào học tốt Văn thì có thể nhớ bài thơ sau: “Mấy lời về dãy điện hóa”
MẤY LỜI VỀ DÃY ĐIỆN HÓA
Dãy điện hóa O sau khử trước (1)
Phản ứng theo quy ước alpha
Nhưng cần phải hiểu sâu xa
Trước sau ý nghĩa mới là thành công
Kali, Can, Nát tiên phong
Ma, Nhôm, Man, Kẽm tiếp không chịu hèn
Sắt rồi Cô đến Niken
Thiếc, Chì dẫu chậm cũng liền theo chân
Hiđro, Đồng, Bạc, Thủy ngân,
Bạch kim, Vàng nữa chịu phần đứng sau.
Ba kim (loại) mạnh nhất ở đầu
Vào dung dịch muối nước đâu “hủy liền”.
Khí bay, muối lại gặp kiềm,
Đổi trao phản ứng là quyền chúng thôi.
Các kim loại khác dễ rồi,
Vào dung dịch muối trước thời đẩy sau.
Với axit, nhớ bảo nhau:
Khử được hát cộng (H+), phải đâu dễ dàng.
Từ Đồng cho đến cuối hàng,
Sau Hiđro đấy, chẳng tan chút nào.
Vài lời bàn bạc, đổi trao,
Vun cây “Vườn Hóa” vui nào vui hơn
(chú ý (1): Kim loại đứng trước có tính khử mạnh hơn kim loại đứng sau, cation phía sau có tính oxi hóa mạnh hơn cation phía trước)
Như vậy, bạn hãy gom những kim loại gần nhau thành một nhóm và biến tấu thành đoạn thơ nào mà mình dễ thuộc để học sẽ dễ nhớ hơn rất nhiều.
II. LÝ THUYẾT VỀ DÃY ĐIỆN HÓA CỦA KIM LOẠI
1. Dãy điện hóa của kim loại là gì?
Trong phản ứng hóa học, cation kim loại có thể nhận electron để trở thành nguyên tử kim loại và ngược lại, nguyên tử kim loại có thể nhường electron để tạo thành cation kim loại.
Cụ thể như:
Cu2+ + 2e 
Ag+ + 1e 
Tổng quát:
Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử (Mn+/M).
Như vậy, dãy điện hóa của kim loại là dãy những cặp oxi hóa - khử của kim loại được sắp xếp theo chiều tăng dần tính oxi hóa của ion kim loại và giảm dần tính khử của kim loại.
2. Ý nghĩa dãy điện hóa của kim loại
a) So sánh tính oxi hóa – khử
- Tính oxi hóa của ion Mn+ càng mạnh thì tính khử của kim loại M càng yếu và ngược lại (tính oxi hóa của ion Mn+ càng yếu thì tính khử của kim loại M càng mạnh).
- Cụ thể như:
+ Kim loại Na có tính khử mạnh do đó ion Na+ có tính oxi hóa yếu.
+ Ion Ag+ có tính oxi hóa mạnh do đó kim loại Ag có tính khử yếu.
Ví dụ 1: Tính oxi hoá của các ion kim loại: Mg2+, Fe3+, Fe2+ giảm dần theo thứ tự nào sau đây?
A. Fe3+, Fe2+, Mg2+.
B. Mg2+, Fe2+, Fe3+.
C. Fe3+, Mg2+, Fe2+.
D. Mg2+, Fe3+, Fe2+.
Hướng dẫn giải:
Chọn A
Các ion được sắp xếp theo đúng trật tự trong dãy điện hóa là:
Mg2+, Fe2+, Fe3+.
Theo chiều từ trái sang phải trong dãy điện hóa tính oxi hóa của ion kim loại tăng dần → chiều giảm dần tính oxi hóa của ion kim loại là: Fe3+, Fe2+, Mg2+.
b) Xác định chiều phản ứng oxi hóa – khử
- Dãy điện hóa của kim loại cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hóa – khử theo quy tắc alpha (α): Phản ứng giữa hai cặp oxi hóa – khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
- Cách xác định chiều của phản ứng oxi hóa – khử theo quy tắc alpha:
Tổng quát
Giả sử có hai cặp oxi hóa khử: Xx+/ X và Yy+/Y (trong đó cặp Xx+/ X đứng trước cặp Yy+/Y trong dãy điện hóa). Xác định chiều của phản ứng oxi hóa khử.
Bước 1: Viết hai cặp oxi hóa – khử theo đúng thứ tự trong dãy điện hóa:
Bước 2: Áp dụng quy tắc alpha (α)
Phản ứng xảy ra theo chiều mũi tên như sau:
Bước 3: Xác định chiều phản ứng
Phản ứng xảy ra như sau:
Ví dụ 2: Xác định chiều phản ứng xảy ra giữa hai cặp Fe2+/ Fe và Cu2+/ Cu.
Hướng dẫn giải:
Bước 1: Theo trật tự dãy điện hóa có cặp Fe2+/ Fe đứng trước cặp Cu2+/ Cu.
Bước 2: Áp dụng quy tắc alpha:
Bước 3: Xác định chiều phản ứng
Cu2+ + Fe → Cu + Fe2+
Phản ứng xảy ra theo chiều ion Cu2+ oxi hóa Fe để tạo ra Fe2+ và Cu.
c) Xét một phản ứng oxi hóa - khử xảy ra hay không
Để xét một phản ứng oxi hóa – khử có xảy ra hay không cần nắm được quy tắc alpha: Chất khử mạnh + chất oxi hóa mạnh → chất oxi hóa yếu hơn + chất khử yếu hơn.
Ví dụ 3: Phản ứng nào sau đây không xảy ra?
A. Cu2+ + Fe → Cu + Fe2+
B. Cu2+ + Mg → Cu + Mg2+
C. Cu + Zn2+ → Cu2+ + Zn
D. Cu + 2Ag+ → Cu2+ + 2Ag
Hướng dẫn giải:
Phản ứng C không xảy ra do tính oxi hóa của Zn2+ yếu hơn Cu2+, do đó Zn2+ không thể oxi hóa được Cu thành Cu2+.
Ví dụ 4: Cho một ít bột Fe vào dung dịch AgNO3 dư. Có phản ứng hóa học xảy ra không? Nếu có phản ứng hóa học xảy ra, hãy viết phương trình hóa học minh họa.
Hướng dẫn giải:
- Ta có Fe có tính khử mạnh hơn Ag, do đó Fe có thể khử được Ag+ thành Ag. Do đó khi cho bột Fe vào dung dịch AgNO3 sẽ có phản ứng hóa học xảy ra.
- Áp dụng quy tắc alpha:
Phản ứng xảy ra như sau:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Sau đó do AgNO3 dư, tiếp tục có phản ứng:
AgNO3 dư + Fe(NO3)2 → Fe(NO3)3 + Ag
- Vậy khi cho bột sắt vào dung dịch AgNO3 dư, chỉ cần viết bằng 1 PTHH như sau:
Fe + 3AgNO3 dư → Fe(NO3)3 + 3Ag
Những ý khi làm bài tập:
- Các kim loại đứng trước hiđro trong dãy điện hóa có thể tác dụng được với axit (HCl, H2SO4 loãng) để giải phóng H2.
- Các kim loại đứng phía trước có tính khử mạnh hơn những kim loại đứng sau nó. Như vậy, phải ứng hóa học xảy ra khi cho kim loại vào dung dịch muối chính là phản ứng của kim loại mạnh hơn đẩy các kim loại yếu hơn ra khỏi muối.
- Khi cho kim loại có tính khử mạnh hơn tác dụng với một dung dịch chứa hỗn hợp các muối tan của nhiều kim loại có tính khử yếu hơn cần lưu ý đến thứ tự các phản ứng: Kim loại sẽ tác dụng với ion kim loại có tính oxi hóa mạnh hơn trước.
Tuy nhiên, có những trường hợp ngoại lệ trong quy tắc α như:
+ Khi cho kim loại kiềm, hoặc 1 số kim loại kiềm thổ (Li, Na, K, Ca …) vào dung dịch muối thì kim loại sẽ phản ứng với nước trước, sau đó bazơ sinh ra sẽ phản ứng với dung dịch muối.
Ví dụ: Cho Na vào dung dịch FeCl3, xảy ra các PTHH sau:
2Na + 2H2O → 2NaOH + H2 ↑
3NaOH + FeCl3 → Fe(OH)3 ↓ + 3NaCl
+ Những kim loại Al, Fe, Cr không phản ứng với axit nitric (HNO3) đặc, nguội và axit sunfuric (H2SO4) đặc, nguội.
+ Những kim loại đứng ở cuối dãy điện hóa như Pt, Au,… sẽ không tác dụng được với axit.
B. BÀI TẬP VẬN DỤNG
Câu 1. Tính oxi hoá của các ion kim loại: Mg2+, Fe3+, Fe2+, Cu2+, Ag+ giảm dần theo thứ tự sau:
A. Ag+, Fe3+, Cu2+, Fe2+, Mg2+.
B. Mg2+, Mg2+, Fe2+, Mg2+, Cu2+, Mg2+, Ag+, Fe3+.
C. Fe3+, Fe2+, Mg2+, Cu2+, Mg2+, Ag+, Mg2+, Mg2+.
D. Mg2+, Mg2+, Fe3+, Fe2+, Mg2+, Cu2+, Mg2+, Ag+.
Hướng dẫn giải:
Chọn A
Các ion được sắp xếp theo đúng trật tự trong dãy điện hóa là:
Mg2+, Fe2+, Cu2+, Fe3+, Ag+.
Theo chiều từ trái sang phải trong dãy điện hóa tính oxi hóa của ion kim loại tăng dần.
→ Chiều giảm dần tính oxi hóa của ion kim loại là:
Ag+, Fe3+, Cu2+, Fe2+, Mg2+.
Câu 2: Tính khử của các kim loại Fe, Al, Cu, Ag, Zn giảm dần theo thứ tự:
A. Al, Cu , Ag , Zn, Fe.
B. Fe, Cu , Ag , Al, Zn.
C. Fe , Al, Cu , Ag , Zn.
D. Al, Zn, Fe, Cu, Ag.
Hướng dẫn giải:
Chọn D
Các kim loại được sắp xếp theo đúng trật tự trong dãy điện hóa là:
Al, Zn, Fe, Cu, Ag.
Theo chiều từ trái sang phải trong dãy điện hóa tính khử của kim loại giảm dần.
→ Chiều giảm dần tính khử của kim loại là:
Al, Zn, Fe, Cu, Ag.
Câu 3: Cho các phản ứng hoá học dưới dạng ion thu gọn:
3Mg + 2Al3+ → 3Mg2+ + 2Al (1)
Al + 3Fe3+ → 3Fe2+ + Al3+ (2)
2Al + 3Fe2+ → 2Al3+ + 3Fe (3)
Tính oxi hoá của các ion kim loại được sắp xếp theo thứ tự giảm dần là
A. Al3+; Fe3+; Fe2+; Mg2+.
B. Fe3+; Fe2+; Al3+; Mg2+.
C. Mg2+; Fe2+; Fe3+; Al3+.
D. Al3+; Mg2+; Fe2+; Fe3+.
Hướng dẫn giải
Chọn B
Ta có: Chất khử mạnh + chất oxi hóa mạnh → chất oxi hóa yếu hơn + chất khử yếu hơn.
Từ phương trình (1) có: Tính oxi hóa Al3+ > Mg2+.
Từ phương trình (2) có: Tính oxi hóa Fe3+ > Al3+; Fe3+ > Fe2+.
Từ phương trình (3) có: Tính oxi hóa của Fe2+ > Al3+.
Vậy chiều giảm dần tính oxi hóa: Fe3+; Fe2+; Al3+; Mg2+.
Câu 4: Cho các kim loại Mg, Al, Zn, Cu. Tính oxi hoá của ion kim loại tăng dần là
A. Cu2+ < Zn2+ < Al3+ < Mg2+.
B. Cu2+ < Mg2+ < Al3+ < Zn2+.
C. Mg2+ < Al3+ < Zn2+ < Cu2+.
D. Cu2+ < Mg2+ < Zn2+ < Al3+.
Hướng dẫn giải:
Chọn C
Dựa vào dãy điện hóa có chiều giảm dần tính khử của kim loại là:
Mg, Al, Zn, Cu.
Ta có: kim loại có tính khử càng yếu thì ion kim loại có tính oxi hóa càng mạnh.
→ Chiều tăng dần tính oxi hóa của ion kim loại là:
Mg2+ < Al3+ < Zn2+ < Cu2+.
Câu 5: Trong các kim loại Fe, Cu, Ag, Mg kim loại khử được ion Cu2+ là:
A. Fe, Mg, Ag.
B. Fe , Ag.
C. Mg, Ag.
D. Mg, Fe.
Hướng dẫn giải:
Chọn D
Theo dãy điện hóa thì Mg và Fe đứng trước Cu, do đó Mg và Fe khử được ion Cu2+.
Câu 6: Trong dãy điện hoá, cặp oxi hoá - khử Fe3+ / Fe2+ đứng sau cặp Cu2+ / Cu0 thì tính oxi hoá:
A. Fe3+ > Cu2+.
B. Fe3+ < Cu2+.
C. Fe2+ > Fe3+.
D. Fe2+ > Cu2+.
Hướng dẫn giải:
Chọn A.
Câu 7: Từ phương trình ion thu gọn sau: Cu + 2Ag+ → Cu2+ + 2Ag.
Kết luận nào dưới đây không đúng?
A. Cu2+ có tính oxi hoá mạnh hơn Ag+.
B. Cu có tính khử mạnh hơn Ag.
C. Ag+ có tính oxi hoá mạnh hơn Cu2+.
D. Cu bị oxi hoá bởi ion Ag+.
Hướng dẫn giải:
Chọn A
Phản ứng xảy ra theo chiều: Chất khử mạnh + chất oxi hóa mạnh → chất oxi hóa yếu hơn + chất khử yếu hơn.
→ A sai vì Ag+ có tính oxi hoá mạnh hơn Cu2+.
Câu 8: Cho một ít bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm các chất tan là
A. Fe(NO3)2.
B. Fe(NO3)2, AgNO3 dư.
C. Fe(NO3)3, AgNO3 dư.
D. Fe(NO3)2, Fe(NO3)3, AgNO3.
Hướng dẫn giải:
Chọn C
Ta có các PTHH xảy ra như sau:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Sau đó tiếp tục có phản ứng:
AgNO3 dư + Fe(NO3)2 → Fe(NO3)3 + Ag
Vậy các chất tan có trong dung dịch sau phản ứng là: Fe(NO3)3, AgNO3 dư.
Câu 9: Ngâm đinh sắt sạch trong 200 ml dung dịch CuSO4. Sau phản ứng kết thúc lấy đinh sắt ra rửa nhẹ và làm khô thấy khối lượng đinh sắt tăng 0,8 gam. Nồng độ CuSO4 ban đầu là
A. 0,52 M.
B. 0,5 M.
C. 5 M.
D. 0,25 M.
Hướng dẫn giải:
Chọn B.
Fe + CuSO4 → FeSO4 + Cu
a → a mol
mđinh sắt tăng = mCu sinh ra (bám vào) – mFe pư
hay 0,8 = 64a – 56a → a = 0,1 mol
CM(CuSO4) = 
Câu 10: Ngâm Cu dư vào dung dịch AgNO3 thu được dung dịch X, sau đó ngâm Fe dư vào dung dịch X thu được dung dịch Y. Dung dịch Y gồm:
A. Fe(NO3)2.
B. Fe(NO3)2, Cu(NO3)2, AgNO3.
C. Fe(NO3)2, Cu(NO3)2.
D. Fe(NO3)3.
Hướng dẫn giải:
Chọn A
Cho Cu dư vào AgNO3:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
→ Dung dịch X là Cu(NO3)2.
Ngâm sắt dư vào dung dịch X:
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu.
Câu 11: Phương trình phản ứng sai là
A. Zn + Pb2+ → Zn2+ + Pb.
B. Cu + 2Fe3+ → 2Fe2+ + Cu2+.
C. Cu + Fe2+ → Cu2+ + Fe.
D. Al + 3Ag+ → Al3+ + Ag.
Hướng dẫn giải:
Chọn C
Các cặp oxi hóa – khử được sắp xếp theo đúng trật tự trong dãy điện hóa:
Vậy phản ứng C sai do cặp Cu2+/ Cu đứng sau cặp Fe2+/ Fe do đó Cu không thể khử được Fe2+ thành Fe.
Câu 12: Cho 5,6g Fe vào 200 ml dung dịch hỗn hợp AgNO3 0,1M và Cu(NO3)2 0,2M. Sau khi kết thúc phản ứng thu được chất rắn có khối lượng là
A. 4,72g.
B. 5,28g.
C. 7,52g.
D. 2,56g.
Hướng dẫn giải:
Chọn C
Ta có: nFe = 0,1 mol; nAg+ = 0,02 mol; nCu2+ = 0,04 mol.
Phản ứng xảy ra theo thứ tự sau:
Chất rắn sau phản ứng gồm: Fe dư: 0,05 mol; Ag: 0,02 mol; Cu: 0,04 mol
Khối lượng chất rắn sau phản ứng: m = 0,05.56 + 0,02.108 + 0,04.64 = 7,52 gam.
Câu 13: Cho 0,01 mol Fe vào 50 ml dung dịch AgNO3 1M. Sau khi phản ứng kết thúc thì lượng Ag thu được là
A. 2,16g
B. 5,4g
C. 3,24g
D. giá trị khác.
Hướng dẫn giải:
Số mol AgNO3: 0,05 mol
Phản ứng xảy ra theo thứ tự sau:
→ nAg = 0,03 mol, mAg = 0,03.108 = 3,24 gam.
Câu 14: Cho thanh Fe vào 100ml dung dịch Cu(NO3)2 0,1M. Khi phản ứng kết thúc thì khối lượng thanh Fe
A. giảm 0,56 g.
B. giảm 0,08 g.
C. tăng 0,08 g.
D. tăng 0,80 g.
Hướng dẫn giải:
Chọn C
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
0,01 ← 0,01 → 0,01 mol
Ta có: mCu sinh ra – mFe pư = (64 – 56).0,01 = 0,08 gam.
Vậy khối lượng thanh sắt tăng 0,08 gam.
Câu 15: Cho một mẩu kim loại kali vào lượng dư dung dịch CuSO4 thì thu được sản phẩm cuối cùng gồm:
A. Cu(OH)2, K2SO4 và H2.
B. Cu(OH)2 và K2SO4.
C. Cu và K2SO4.
D. KOH và H2.
Hướng dẫn giải:
Chọn A
Phản ứng xảy ra như sau:
2K + 2H2O → 2KOH + H2 ↑
2KOH + CuSO4 → K2SO4 + Cu(OH)2 ↓
Vậy sản phẩm cuối cùng gồm: H2; K2SO4, Cu(OH)2.
Xem thêm các bài tổng hợp kiến thức và công thức Hóa học cơ bản đầy đủ và chi tiết khác:
Hệ thống kiến thức, công thức cơ bản Hóa học lớp 8, 9 đầy đủ, chi tiết
Dãy điện hóa của kim loại đầy đủ, chi tiết | Cách nhớ nhanh dãy điện hóa của kim loại
Tủ sách VIETJACK shopee lớp 6-8 cho phụ huynh và giáo viên (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài 500 Công thức, Định Lí, Định nghĩa Toán, Vật Lí, Hóa học, Sinh học được biên soạn bám sát nội dung chương trình học các cấp.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)