200 Đề thi Hóa học 9 năm 2024 (có đáp án)
Bộ 200 Đề thi Hóa học 9 năm học 2023 - 2024 mới nhất đầy đủ Học kì 1 và Học kì 2 gồm đề thi giữa kì, đề thi học kì có đáp án chi tiết, cực sát đề thi chính thức giúp học sinh ôn luyện & đạt điểm cao trong các bài thi Hóa học 9.
Đề thi Hóa học 9 năm 2024 (có đáp án)
Xem thử Đề Hóa 9 GK1 Xem thử Đề Hóa 9 CK1 Xem thử Đề Hóa 9 GK2 Xem thử Đề Hóa 9 CK2
Chỉ từ 150k mua trọn bộ Đề thi Hóa học 9 Giữa/Cuối kì 1 và Giữa/Cuối kì 2 bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
0711000255837- NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Đề thi Giữa kì 1 Hóa học 9
Bộ 20 Đề thi Hóa học 9 Giữa học kì 1 năm 2024 tải nhiều nhất
Đề thi Học kì 1 Hóa học 9
Đề thi Giữa kì 2 Hóa học 9
Đề thi Học kì 2 Hóa học 9
Đề thi Học sinh giỏi Hóa học 9

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 1
Năm học 2023 - 2024
Môn: Hóa học 9
Thời gian làm bài: phút
(Đề thi số 1)
Phần I: Trắc nghiệm khách quan (3 điểm)
Câu 1. Dãy chất nào dưới đây gồm các oxit tác dụng được với nước?
A. CaO, CuO, SO3, Na2O. |
B. CaO, N2O5, K2O, CuO. |
C. Na2O, BaO, N2O, FeO. |
D. SO3, CO2, BaO, CaO. |
Câu 2. Dãy chất nào dưới đây gồm các oxit tác dụng được với dung dịch HCl?
A. CaO, Na2O, SO2 |
B. FeO, CaO, MgO |
C. CO2, CaO, ZnO |
D. MgO, CaO, NO |
Câu 3. Oxit bazơ nào sau đây được dùng để làm khô nhiều nhất?
A. CuO |
B. FeO |
C. CaO |
D. ZnO |
Câu 4. Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng?
A. Ag, Fe, Mg |
B. Fe, Cu, Al |
C. Al, Mg, Zn |
D. Zn, Cu, Mg |
Câu 5. Để làm sạch khí O2 có lẫn tạp chất là khí CO2 và khí SO2 có thể dùng chất nào dưới đây?
A. Ca(OH)2 |
B. CaCl2 |
C. NaHSO3 |
D. H2SO4 |
Câu 6. Nhỏ từ từ dung dịch H2SO4 vào ống nghiệm đựng Cu(OH)2 thấy?
A. Cu(OH)2 không tan
B. Cu(OH)2 tan dần, dung dịch không màu.
C. Cu(OH)2 tan dần, dung dịch màu xanh lam và có khí bay ra
D. Cu(OH)2 tan dần, dung dịch có màu xanh lam.
Câu 7. Chất nào dưới đây không tác dụng được với axit H2SO4 đặc, nguội
A. Cu |
B. Al |
C. Mg |
D. Zn |
Câu 8. Dung dịch kiềm không có những tính chất hóa học nào sau đây?
A. Làm quì tím chuyển sang màu xanh
B. Tác dụng với axit
C. Tác dụng với dung dịch oxit axit
D. Bị nhiệt phân hủy tạo thành oxit bazơ
Câu 9. Cặp chất có thể tồn tại được trong cùng một dung dịch là
A. NaCl và NaOH |
B. KOH và H2SO4 |
C. Ca(OH)2 và HCl |
D. NaOH và FeCl2 |
Câu 10. Loại phân đạm có hàm lượng nitơ cao nhất là
A. (NH4)2SO4 |
B.NH4NO3 |
C.CO(NH2)2 |
D.NH4Cl |
Câu 11. Dãy gồm các phân bón hóa học đơn là
A. KCl, NH4Cl, (NH4)2SO4 và Ca(H2PO4)2
B. KCl, KNO3, Ca3(PO4)2 và Ca(H2PO4)2
C. K2SO4, NH4NO3, (NH4)3PO4 và Ca(H2PO4)2
D. KNO3, KCl, NH4H2PO4 và K2SO4.
Câu 12. Cho các chất: SO2, NaOH, MgCO3, CaO và HCl. Số cặp chất phản ứng được với nhau là
A. 2 |
B. 4 |
C. 3 |
D. 5 |
Phần II: Tự luận (7 điểm)
Câu 1 (2 điểm):
a/ Cho các chất sau: CaO, SO2, HCl, NaOH, P2O5, H2SO3, Na2O, Ca(OH)2.
Hãy cho biết chất nào thuộc oxit bazơ, oxit axit, bazơ, axit, muối?
b/ Hoàn thành sơ đồ phản ứng sau:
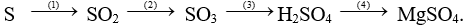
Câu 2 (2 điểm): Trình bày phương pháp hóa học nhận biết các dung dịch đựng trong các lọ mất nhãn sau: HCl, NaOH, Na2SO4, NaCl.
Câu 3 (3 điểm): Biết 8 (gam) CuO phản ứng vừa đủ với 200 gam dung dịch axit clohiđric.
a) Tính khối lượng muối có trong dung dịch thu được sau phản ứng.
b) Tính nồng độ phần trăm dung dịch axit cần dùng.
ĐÁP ÁN:
Phần I: Trắc nghiệm
1 - D |
2 - B |
3 - C |
4 - C |
5 - A |
6 - D |
7 - B |
8 - D |
9 - A |
10 - C |
11 - A |
12 - D |
Câu 4. Đáp án A
Dẫn hỗn hợp khí qua dung dịch nước vôi trong (Ca(OH)2) dư. Khí CO2 và SO2 phản ứng bị giữ lại, khí O2 không phản ứng thoát ra khỏi dung dịch thu được O2 tinh khiết.
CO2 + Ca(OH)2 → CaCO3 (↓) + H2O
SO2 + Ca(OH)2 → CaSO3 (↓) + H2O
Câu 6: Đáp án D
Cu(OH)2(rắn) + H2SO4 (không màu) → CuSO4 + 2H2O
Hiện tượng: Cu(OH)2 tan dần, sau phản ứng thu được dung dịch có màu xanh lam.
Câu 9. Đáp án A
NaCl + NaOH → không phản ứng
2KOH + H2SO4 → K2SO4 + 2H2O
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
2NaOH + FeCl2 → Fe(OH)2 (↓) + 2NaCl
Câu 12. Đáp án D
Các cặp chất xảy ra phản ứng hóa học là: SO2 và NaOH; SO2 và CaO; NaOH và HCl; MgCO3 và HCl; CaO và HCl.
Phần II: Tự luận
Câu 1.
a) Oxit bazơ: CaO; Na2O
Oxit axit: SO2; P2O5
Axit: HCl, H2SO3.
Bazơ: NaOH; Ca(OH)2.
b) 1) S + O2 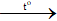 SO2
SO2
2) 2SO2 + O2 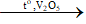 2SO3
2SO3
3) SO3 + H2O → H2SO4
4) Mg + H2SO4 (loãng) → MgSO4 + H2 (↑)
Câu 2:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng quỳ tím:
+ Quỳ tím chuyển sang màu đỏ → HCl
+ Quỳ tím chuyển sang màu xanh → NaOH
+ Quỳ tím không đổi màu → Na2SO4, NaCl (nhóm I)
- Phân biệt nhóm I: Dùng BaCl2
+ Có kết tủa trắng → Na2SO4
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
+ Không hiện tượng → NaCl
Câu 3:
nCuO = 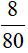 = 0,1mol
= 0,1mol
CuO + 2HCl → CuCl2 + H2O
a) Theo PTHH có: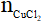 =
= 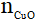 = 0,1 mol
= 0,1 mol
Khối lượng muối có trong dung dịch sau phản ứng là:
mmuối = 0,1. 135 = 13,5 gam.
b) Theo PTHH có: nHCl = 2.nCuO = 0,2 mol
Khối lượng chất tan có trong 200 gam dung dịch axit clohiđric là:
mHCl = 0,2.36,5 = 7,3 gam
Nồng độ phần trăm của dung dịch HCl cần dùng là:
C% = .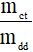 .100% =
.100% = 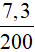 .100% = 3,65%.
.100% = 3,65%.

Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
Năm học 2023 - 2024
Môn: Hóa học 9
Thời gian làm bài: phút
(Đề thi số 1)
Cho biết nguyên tử khối (theo đvC) của các nguyên tố:
Fe = 56; Cu = 64; S = 32; H = 1; O = 16; Zn = 65; Ag = 108; N = 14; Ba = 137; Cl = 35,5
Phần trắc nghiệm
Câu 1. Phương trình hóa học nào sau đây không đúng?
A. 2Fe + 3Cl2 → 2FeCl3
B. 2CO2 + Ca(OH)2 → Ca(HCO3)2
C. 2NaCl + H2SO4 → Na2SO4 + 2HCl
D. Fe + CuSO4 → FeSO4 + Cu
Câu 2. Ngâm một lá Zn dư vào 200 ml dung dịch AgNO3 1M. Khi phản ứng kết thúc khối lượng Ag thu được là:
A. 6,5 gam B. 10,8 gam C. 13 gam D. 21,6 gam
Câu 3. Có các chất đựng riêng biệt trong mỗi ống nghiệm sau đây: Al, Fe, CuO, CO2, FeSO4, H2SO4. Lần lượt cho dung dịch NaOH vào mỗi ống nghiệm trên. Dung dịch NaOH phản ứng với:
A. Al, CO2, FeSO4, H2SO4
B. Fe, CO2, FeSO4, H2SO4
C. Al, Fe, CuO, FeSO4
D. Al, Fe, CO2, H2SO4
Câu 4. Kim loại X có những tính chất hóa học sau:
- Phản ứng với oxit khi nung nóng.
- Phản ứng với dung dịch AgNO3.
- Phản ứng với dung dịch H2SO4 loãng giải phóng khí H2 và muối của kim loại hóa trị II. Kim loại X là:
A. Cu B. Fe C. Al D. Na.
Phần tự luận
Câu 5 (3đ). Viết phương trình hóa học hoàn thành chuỗi biến hóa sau, ghi rõ điều kiện (nếu có)
Al -1→ Fe -2→ FeCl3 -3→ Fe(OH)3 -4→ Fe2O3
Câu 6 (2đ) . Bằng phương pháp hóa học nhận biết các dung dịch sau: NaOH, H2SO4, Na2SO4, HCl. Viết phương trình hóa học (nếu có).
Câu 7 (3đ) . Cho m gam hỗn hợp X gồm Fe và Cu vào dung dịch H2SO4 loãng, dư thu được 4,48 lít khí (đktc) và thấy còn 8,8 gam chất rắn không tan. Lấy phần chất rắn không tan ra thu được 250 ml dung dịch Y.
a. Xác định phần trăm về khối lượng các chất trong X.
b. Dung dịch Y tác dụng vừa đủ với BaCl2 thu được 69,9 gam kết tủa. Tính nồng độ mol các chất trong Y.
c. Nếu cho 12 gam X vào 300 ml dung dịch AgNO3 0,8M. Sau một thời gian thu được 28 gam chất rắn Z. Tính khối lượng của Ag có trong Z?
Đáp án và Thang điểm
Trắc nghiệm (2,0 điểm). Mỗi câu trả lời đúng được 0,5 điểm
Câu 1. C
Dung dịch NaCl không phản ứng với dung dịch H2SO4.
Câu 2. D
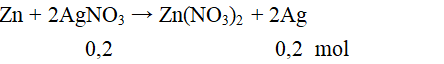
mAg = 0,2.108 = 21,6 gam.
Câu 3. A
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
CO2 + 2NaOH → Na2CO3 + 2H2O
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Câu 4. B
3Fe + 2O2 → Fe3O4
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe + H2SO4 → FeSO4 + H2
Tự luận
Câu 5
Viết đúng mỗi phương trình hóa học được (0.5 điểm); cân bằng đúng mỗi phương trình được (0.25 điểm)
(1) 2Al + 3FeCl2 → 2AlCl3 + 3Fe (0.75 điểm)
(2) 2Fe + 3Cl2 → 2FeCl3 (0.75 điểm)
(3) FeCl3 + 3KOH → Fe(OH)3 + 3KCl (0.75 điểm)
(4) 2Fe(OH)3 → Fe2O3 + 3H2O (0.75 điểm)
Chú ý: Học sinh có thể viết PTHH khác đúng vẫn cho điểm tối đa
Câu 6
Học sinh trình bày được cách nhận biết và viết được PTHH (nếu có) đúng mỗi dung dịch được 0,5 điểm.
Trích mẫu thử và đánh số thứ tự:
- Nhúng quỳ tím vào 4 mẫu thử:
+ 2 mẫu làm quỳ chuyển đỏ là H2SO4 và HCl
+ Mẫu làm quỳ chuyển xanh là NaOH
+ Mẫu không làm quỳ chuyển màu là là Na2SO4
- Nhỏ dd BaCl2 lần lượt vào 2 mẫu H2SO4 và HCl
+ Mẫu có kết tủa trắng là H2SO4
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
+ Mẫu còn lại là HCl
Câu 7
- Theo giả thiết ta có:
nH2 = 4,48/22,4 = 0,2 mol (0.25 điểm)
- Phương trình hóa học: Fe + H2SO4 → FeSO4 + H2 (1) (0.25 điểm)
Theo PTHH (1) ta có: nFe = nH2 = 0,2 mol
⇒ mFe = 0,2.56 ⇒ mFe = 11,2 (gam)
Suy ra, giá trị m là: m = 11,2 + 8,8 ⇒ m = 20 (gam) (0.5 điểm)
a. Vậy thành phần phần trăm về khối lượng các chất trong X là:
%mFe = (11.2/20).100 = 56%
và %mCu = 100 - 56 = 44% (0.5 điểm)
b. Theo bài ra dung dịch Y gồm FeSO4 và H2SO4 dư
Phương trình hóa học:
BaCl2 + FeSO4 → BaSO4 + FeCl2 (2)
BaCl2 + H2SO4 → BaSO4 + 2HCl (3) (0.5 điểm)
Theo giả thiết, ta có:
nBaSO4 = 69,9/233 ⇒ nBaSO4 = 0,3 mol
Khi đó theo PTHH (1), (2), (3) ta có:
nFeSO4(Y) = 0,2 mol và nH2SO4(Y) = 0,1 mol (0.25 điểm)
Vậy nồng độ mol các chất trong Y là:
CM FeSO4 = 0,2/0,25 = 0,8 M
Và CM H2SO4 = 0,1/0,25 = 0,4 M (0.25 điểm)
c. Theo giả thiết và kết quả ở phần (a) ta có:
Trong 20 gam X có 0,2 mol Fe và 0,1375 mol Cu
Vậy trong 12 gam X có 0,12 mol Fe và 0,0825 mol Cu
Và nAgNO3 = 0,3.0,8 = 0,24 mol (0.25 điểm)
- Phương trình hóa học có thể:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (4)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag (5)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag (6)
Giả sử chỉ xảy ra phản ứng (4) và phản ứng (4) diễn ra hoàn toàn:
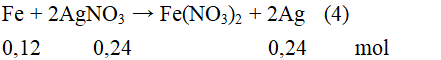
Chất rắn sau phản ứng gồm Ag: 0,24 mol và Cu 0,0825 mol
mchất rắn = 0,24.108 + 0,0825.64 = 31,2 > mZ = 28.
Vậy điều giả sử là sai. Sau một thời gian để thu được 28 gam chất rắn Z phản ứng (4) mới diễn ra 1 phần. Gọi số mol Fe phản ứng trong (4) là x mol. Ta có:
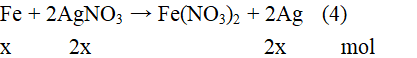
Sau một thời gian, thu được chất rắn Z gồm: Fe: (0,12 – x) mol; Ag: 2x mol; Cu: 0,0825 mol
Có mZ = 28 gam
→ 56(0,12 – x) + 108.2x + 64.0,0825 = 28 → x = 0,1.
Vậy số mol Ag có trong Z là 0,2 mol.
Khối lượng Ag có trong Z là 0,2.108 = 21,6 gam. (0.25 điểm)
Chú ý: Học sinh có thể không cần viết đủ cả 3 PTHH (4), (5), (6) nhưng có cách trình bày đúng để tìm được khối lượng của Ag trong Z là 21,6 gam thì vẫn đạt 0,25 điểm.

Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Năm học 2023 - 2024
Môn: Hóa học 9
Thời gian làm bài: phút
(Đề thi số 1)
Câu 1: Ở điều kiện thường, phi kim có thể tồn tại ở trạng thái
A. Lỏng và khí. B. Rắn và lỏng.
C. Rắn và khí. D. Rắn, lỏng, khí.
Câu 2: Dãy hợp chất nào sau đây chỉ chứa các chất hữu cơ?
A. CH4, C2H6, CO2. B. C6H6, CH4, C2H5OH.
C. CH4, C2H2, CO. D. C2H2, C2H6O, CaCO3.
Câu 3: Hoá trị của cacbon, oxi, hiđro trong hợp chất hữu cơ lần lượt là
A. IV, II, II. B. IV, III, I.
C. II, IV, I. D. IV, II, I.
Câu 4: Nguyên tử cacbon có thể liên kết trực tiếp với nhau tạo thành các dạng mạch cacbon là
A. Mạch vòng.
B. Mạch thẳng, mạch nhánh.
C. Mạch vòng, mạch thẳng, mạch nhánh.
D. Mạch nhánh.
Câu 5: Hiđrocacbon A có phân tử khối là 30 đvC. Công thức phân tử của A là
A. CH4. B. C2H6. C. C3H8. D. C2H4.
Câu 6: Tính chất vật lí cơ bản của metan là
A. Chất lỏng, không màu, tan nhiều trong nước.
B. Chất khí, không màu, tan nhiều trong nước.
C. Chất khí, không màu, không mùi, nặng hơn không khí, ít tan trong nước.
D. Chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
Câu 7: Phản ứng đặc trưng của metan là
A. Phản ứng cộng. B. Phản ứng thế.
C. Phản ứng trùng hợp. D. Phản ứng cháy
Câu 8: Trong phân tử etilen giữa hai nguyên tử cacbon có
A. Một liên kết đơn. B. Một liên kết đôi.
C. Hai liên kết đôi. D. Một liên kết ba.
Câu 9: Khí etilen không có tính chất hóa học nào sau đây?
A. Phản ứng cháy với khí oxi.
B. Phản ứng trùng hợp.
C. Phản ứng cộng với dung dịch brom.
D. Phản ứng thế với clo ngoài ánh sáng.
Câu 10: Liên kết C≡C trong phân tử axetilen có đặc điểm
A. Một liên kết kém bền dễ đứt ra trong các phản ứng hóa học.
B. Hai liên kết kém bền nhưng chỉ có một liên kết bị đứt ra trong phản ứng hóa học.
C. Hai liên kết kém bền dễ đứt lần lượt trong các phản ứng hóa học.
D. Ba liên kết kém bền dễ đứt lần lượt trong các phản ứng hóa học.
Câu 11: Dẫn 0,1 mol khí axetilen qua dung dịch nước brom dư. Khối lượng brom tham gia phản ứng là
A. 16,0 gam. B. 20,0 gam. C. 26,0 gam. D. 32,0 gam.
Câu 12: Hoá chất nào sau đây dùng để phân biệt 2 chất CH4 và C2H4?
A. Dung dịch brom. B. Dung dịch phenolphtalein.
C. Qùy tím. D. Dung dịch bari clorua.
Câu 13: Cho khí metan tác dụng với khí oxi theo phản ứng sau:
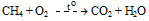
Tổng hệ số cân bằng trong phương trình hoá học là (biết hệ số cân bằng là các số nguyên tối giản)
A. 5. B. 6. C. 7. D. 8.
Câu 13:
CH4 + 2O2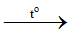 CO2 + 2H2O
CO2 + 2H2O
Tổng hệ số cân bằng: 1 + 2 + 1 + 2 = 6.
Câu 14: Hợp chất hữu cơ không có khả năng tham gia phản ứng cộng là
A. metan. B. benzen. C. etilen. D. axetilen.
Câu 15: Trong các chất sau: CH4, CO2, C2H4, Na2CO3, C2H5ONa có
A. 1 hợp chất hữu cơ và 4 hợp chất vô cơ.
B. 2 hợp chất hữu cơ và 3 hợp chất vô cơ.
C. 4 hợp chất hữu cơ và 1 hợp chất vơ cơ.
D. 3 hợp chất hữu cơ và 2 hợp chất vô cơ.
Câu 16: Dãy các chất nào sau đây đều là hiđrocacbon?
A. C2H6, C4H10, C2H4. B. CH4, C2H2, C3H7Cl.
C. C2H4, CH4, C2H5Cl. D. C2H6O, C3H8, C2H2.
Câu 17: Phương trình hóa học điều chế nước Gia - ven là
A. Cl2 + NaOH → NaCl + HClO
B. Cl2 + NaOH → NaClO + HCl
C. Cl2 + H2O → HCl + HClO
D. Cl2 + 2NaOH → NaCl + NaClO + H2O
Câu 18: Chất khí nào sau đây có thể gây chết người vì ngăn cản sự vận chuyển oxi trong máu?
A. CO. B. CO2. C. SO2. D. NO.
Câu 19: Cho 11,2 lít khí etilen (đktc) phản ứng vừa đủ với dung dịch brom 5%. Khối lượng dung dịch brom tham gia phản ứng là
A. 160 gam. B. 1600 gam.
C. 320 gam. D. 3200 gam.
Câu 20: Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại, đó là
A. metan. B. etilen.
C. axetilen. D. etan.
Câu 21: Khi đốt khí axetilen, số mol CO2 và H2O được tạo thành theo tỉ lệ là
A. 2 : 1. B. 1 : 2.
C. 1 : 3. D. 1 : 1.
Câu 22: Khí X có tỉ khối đối với oxi là 0,8125. Khí X là
A. C2H2. B. C2H4.
C. C2H6. D. CH4.
Câu 23: Phân tử nào sau đây có cấu tạo là mạch vòng sáu cạnh đều, có ba liên kết đơn xen kẽ ba liên kết đôi?
A. Axetilen. B. Propan.
C. Benzen. D. Xiclohexan.
Câu 24: Cho 7,8 gam benzen phản ứng với brom dư (có bột sắt xúc tác) hiệu suất phản ứng là 80%. Khối lượng brombenzen thu được là
A. 12,56 gam. B. 15,70 gam.
C. 19,62 gam. D. 23,80 gam.
Câu 25: Thành phần chính của khí đồng hành là
A. C2H2. B. CH4.
C. C2H4. D. H2.
Câu 26: Trên mũi khoan để khai thác dầu mỏ người ta có gắn
A. thép tốt. B. đá thạch anh.
C. kim cương. D. đá hoa cương.
Câu 27: Trong các loại than dưới đây, loại than già nhất có hàm lượng cacbon trên 90% là
A. than gầy. B. than mỡ.
C. than non. D. than bùn.
Câu 28: Chất làm mất màu dung dịch brom là
A. CH4. B. CH2 = CH – CH3.
C. CH3 – CH3. D. CH3 – CH2 – CH3.
Câu 29: Các trái cây, trong quá trình chín sẽ thoát ra một lượng nhỏ chất khí là
A. metan. B. etan.
C. etilen. D. axetilen.
Câu 30: Khí CH4 và C2H4 có tính chất hóa học giống nhau là
A. tham gia phản ứng cộng với dung dịch brom.
B. tham gia phản ứng cộng với khí hiđro.
C. tham gia phản ứng trùng hợp.
D. tham gia phản ứng cháy với khí oxi sinh ra khí cacbonic và nước.
ĐÁP ÁN ĐỀ THI GIỮA HỌC KÌ 2 MÔN Hóa học 9
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
D |
B |
D |
C |
B |
D |
B |
B |
D |
C |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
D |
A |
B |
B |
D |
A |
D |
A |
B |
C |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
A |
A |
C |
A |
B |
C |
A |
B |
C |
D |
Câu 2:
Hợp chất hữu cơ là hợp chất của cacbon trừ CO; CO2; muối cacbonat; axit cacbonic → chọn B.
Câu 5.
Loại A do phân tử khối của CH4 là 16 đvC.
Loại C do phân tử khối của C3H8 là 44 đvC.
Loại D do phân tử khối của C2H4 là 28 đvC.
Câu 11:
C2H2 + 2Br2 → C2H2Br4
0,1 → 0,2 mol
Khối lượng brom phản ứng: m = 0,2.160 = 32 gam.
Câu 12:
Sử dụng dung dịch brom: C2H4 làm mất màu dung dịch brom còn CH4 thì không.
Câu 15:
Các hợp chất hữu cơ: CH4; C2H4; C2H5ONa
Các hợp chất vô cơ: CO2; Na2CO3.
Câu 19.
C2H4 + Br2 → C2H4Br2
0,5 → 0,5 mol
Khối lượng dung dịch brom 5% tham gia phản ứng là:
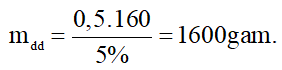
Câu 21.
C2H2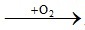 2CO2 + H2O
2CO2 + H2O
2 1 mol
Câu 22:
MX = 0,8125.32 = 26.
Vậy khí X là C2H2.
Câu 24:
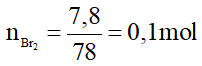
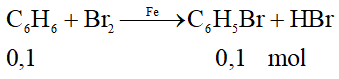
Do hiệu suất của phản ứng là 80% nên:
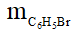 = 0,1.157.80% = 12,56 gam.
= 0,1.157.80% = 12,56 gam.
Câu 28:
CH2 = CH – CH3 có liên kết đôi, nên làm mất màu dung dịch brom.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Năm học 2023 - 2024
Môn: Hóa học 9
Thời gian làm bài: phút
(Đề thi số 1)
Phần trắc nghiệm (Mỗi câu 0,5 điểm)
Câu 1: Dãy các chất làm mất màu dung dịch nước brom là
A. C2H2, C6H6, CH4
B. C2H2, CH4, C2H4
C. C2H2, C2H4
D. C2H2, H2, CH4
Câu 2: Dẫn 0,56 lít khí etilen (đktc) vào 200ml dung dịch Br2 0,2M.
Hiện tượng quan sát được là
A. màu dung dịch Br2 không đổi
B. màu da cam của dung dịch brom nhạt hơn so với ban đầu
C. màu da cam của dung dịch brom đậm hơn so với ban đầu
D. màu da cam của dung dịch brom chuyển thành không màu
Câu 3: Cặp chất nào sau đây tồn tại được trong cùng một dung dịch?
A. K2CO3 và HCl
B. NaNO3 và KHCO3
C. K2CO3 và Ca(OH)2
D. KHCO3 và NaOH
Câu 4: Cho axetilen vào bình dung dịch brom dư. Khối lượng bình tăng lên a gam, a là khối lượng của
A. dung dịch brom
B. khối lượng brom
C. axetilen
D. brom và khí axetilen
Câu 5: Dãy các chất phản ứng với dung dịch NaOH là
A. CH3COOH, (C6H10O5)n
B. CH3COOC2H5, C2H5OH
C. CH3COOH, C6H12O6
D. CH3COOH, CH3COOC2H5
Câu 6: Cho natri tác dụng với rượu etylic, chất tạo thành là
A. H2, CH3CH2ONa
B. H2, NaOH
C. NaOH, H2O
D. CH3CH2ONa, NaOH
Câu 7: Một loại rượu etylic có độ rượu 15°, thể tích C2H5OH chứa trong 1 lít rượu đó là
A. 850 ml B. 150 ml C. 300 ml D. 450 ml
Câu 8: Chỉ dùng dung dịch iot và dung dịch AgNO3 trong NH3 có thể phân biệt được các chất trong mỗi dãy của dãy nào sau đây?
A. axit axetic, glucozo, saccarozo
B. xenlulozo, rượu etylic, saccarozo
C. hồ tinh bột, rượu etylic, glucozo
D. benzene, rượu etylic, glucozo
Phần tự luận (6 điểm)
Câu 9: (2 điểm) Hãy viết phương trình hóa học và ghi rõ điều kiện của các phản ứng sau:
1. Trùng hợp etilen.
2. Axit axetic tác dụng với magie.
3. Oxi hóa rượu etylic thành axit axetic.
4. Đun nóng hỗn hợp rượu etylic và axit axetic có axit sunfuric đặc làm xúc tác
Câu 10: (2 điểm) Viết các phương trình hóa học (ghi rõ điều kiện) biểu diễn những chuyển hóa sau: FeS2 → SO2 → SO3 → H2SO4 → CH3COOH
Câu 11: (2 điểm) Cho 2,24 lít (đktc) hỗn hợp khí axetilen và metan vào dung dịch brom, dung dịch brom bị nhạt màu. Sau phản ứng khối lượng dung dịch tăng 1,3g.
1. Tính khối lượng brom tham gia phản ứng.
2. Xác định thành phần % về thể tích của mỗi khí trong hỗn hợp.
(cho O=16, C=12, H=1)
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp án | C | B | C | C | D | A | B | C |
Câu 1:C
Phân tử của chúng có liên kết ba và liên kết đôi.
Câu 2:B
nC2H4 = 0, 025 mol ; nBr2 = 0,04 lớn hơn số mol C2H4.
Nên còn màu da cam của dung dịch brom chỉ nhạt đi, không mất màu hẳn.
Câu 3:C
NaNO3 không tác dụng với KHCO3.
Câu 4:C
Dung dịch brom dư đã tác dụng và giữ hết axetilen.
Câu 5:D
C2H5OH, ( C6H10O5 )n không phản ứng với dung dịch NaOH.
Câu 6:A
2C2H5OH + 2Na → 2CH3CH2ONa + H2
Câu 7:B
Thể tích C2H5OH = 1000.0,15 = 150 ml.
Câu 8:C
Dùng dung dịch iot nhận ra được hồ tinh bột. dung dịch AgNO3 trong NH3 có thể phân biệt được rượu etylic và glucozo.
Câu 9:
1. Trùng hợp etilen: nCH2=CH2 to, xt, p→ (-CH2-CH2-)n
2. Axit axetic tác dụng với magie: 2CH3COOH + Mg → (CH3COO)2Mg + H2
3. Oxi hóa rượu etylic thành axit axetic:
C2H5OH + O2 men giấm→ CH3COOH + H2O
4. Đun nóng hỗn hợp rượu etylic và axit axetic có axit sunfuric đặc làm xúc tác.
CH3COOH + C2H5OH to, xt⇋ CH3COOC2H5 + H2O
Câu 10:
Viết các phương trình hóa học (ghi rõ điều kiện) biểu diễn những chuyển hóa sau:
4FeS2 + 11O2 to→ 8SO2 + 2Fe2O3
2SO2 + O2 to, xt⇋ 2SO3
SO3 + H2O → H2SO4
H2SO4+ 2CH3COONa → 2CH3COOH + Na2SO4
Câu 11:
Dung dịch brom (dư) nên khối lượng dung dịch tăng bằng khối lượng C2H2 bị giữ lại tức bằng 1,3 gam.
C2H2 + 2Br2 → C2H2Br4
nC2H2 = 1,3/26 = 0,05 mol. Suy ra nBr2 = 0,05 x 2 = 0,1 mol.
Khối lượng brom tham gia phản ứng: 0,1 x 189 = 18 (gam).
Thành phần % về thể tích của C2H2 là 50%.
....................................
....................................
....................................
Trên đây là phần tóm tắt một số đề thi trong các bộ đề thi Hóa học 9 năm học 2023 - 2024 Học kì 1 và Học kì 2, để xem đầy đủ mời quí bạn đọc lựa chọn một trong các bộ đề thi ở trên!
Xem thử Đề Hóa 9 GK1 Xem thử Đề Hóa 9 CK1 Xem thử Đề Hóa 9 GK2 Xem thử Đề Hóa 9 CK2
Lưu trữ: Bộ đề thi Hóa học 9 cũ
Xem thêm bộ đề thi các môn học lớp 9 năm học 2023 - 2024 chọn lọc, có đáp án hay khác:
Loạt bài Đề thi Hóa lớp 9 năm học 2023-2024 học kì 1 và học kì 2 được biên soạn bám sát cấu trúc ra đề thi mới Tự luận và Trắc nghiệm giúp bạn giành được điểm cao trong các bài thi Hóa học lớp 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn Văn 9
- Soạn Văn 9 (bản ngắn nhất)
- Văn mẫu lớp 9
- Đề kiểm tra Ngữ Văn 9 (có đáp án)
- Giải bài tập Toán 9
- Giải sách bài tập Toán 9
- Đề kiểm tra Toán 9
- Đề thi vào 10 môn Toán
- Chuyên đề Toán 9
- Giải bài tập Vật lý 9
- Giải sách bài tập Vật Lí 9
- Đề kiểm tra Vật Lí 9
- Giải bài tập Hóa học 9
- Chuyên đề: Lý thuyết - Bài tập Hóa học 9 (có đáp án)
- Đề kiểm tra Hóa học 9
- Giải bài tập Sinh học 9
- Giải Vở bài tập Sinh học 9
- Chuyên đề Sinh học 9
- Giải bài tập Địa Lí 9
- Giải bài tập Địa Lí 9 (ngắn nhất)
- Giải sách bài tập Địa Lí 9
- Giải Tập bản đồ và bài tập thực hành Địa Lí 9
- Giải bài tập Tiếng anh 9
- Giải sách bài tập Tiếng Anh 9
- Giải bài tập Tiếng anh 9 thí điểm
- Giải sách bài tập Tiếng Anh 9 mới
- Giải bài tập Lịch sử 9
- Giải bài tập Lịch sử 9 (ngắn nhất)
- Giải tập bản đồ Lịch sử 9
- Giải Vở bài tập Lịch sử 9
- Giải bài tập GDCD 9
- Giải bài tập GDCD 9 (ngắn nhất)
- Giải sách bài tập GDCD 9
- Giải bài tập Tin học 9
- Giải bài tập Công nghệ 9









