Một mẫu dung dịch H2SO4 gọi là mẫu A được phân tích bằng cách
Sách bài tập Hóa học 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base
Bài 3.13 trang 12 Sách bài tập Hóa học 11: Một mẫu dung dịch H2SO4 (gọi là mẫu A) được phân tích bằng cách thêm 50,0 mL dung dịch NaOH 0,213 M vào 100 mL dung dịch mẫu A rồi lắc đều. Sau khi phản ứng xảy ra, người ta thấy trong hỗn hợp dung dịch còn dư ion OH–. Phần ion dư này cần 13,21 mL HCl 0,103 M để trung hoà. Tính nồng độ mol L–1 của mẫu A.
Lời giải:
Phương trình hoá học của các phản ứng xảy ra như sau:
2NaOH + H2SO4 ⟶ Na2SO4 + 2H2O
HCl + NaOH ⟶ NaCl + H2O
Số mol NaOH thêm vào 100 mL dung dịch H2SO4 là: 0,05.0,213 = 1,065.10-2 (mol). Số mol NaOH được trung hoà bởi HCl là: 0,01321.0,103 = 1,361.10-3 (mol).
Số mol NaOH được trung hoà bởi 100 mL dung dịch H2SO4 là:
1,065.10-2 – 1,361.10-3 = 9,289.10-3 (mol).
Vậy nồng độ H2SO4 trong mẫu phân tích là:
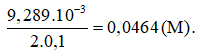
Lời giải SBT Hóa 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base hay khác:
Xem thêm các bài giải sách bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Xem thêm các tài liệu học tốt lớp 11 hay khác:
- Giải sgk Hóa học 11 Cánh diều
- Giải Chuyên đề học tập Hóa 11 Cánh diều
- Giải SBT Hóa học 11 Cánh diều
- Giải lớp 11 Cánh diều (các môn học)
- Giải lớp 11 Kết nối tri thức (các môn học)
- Giải lớp 11 Chân trời sáng tạo (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

