Hóa 10 Bài 19: Luyện tập: Phản ứng oxi hóa - khử
Hóa 10 Bài 19: Luyện tập: Phản ứng oxi hóa - khử
Video Giải bài tập Hóa 10 Bài 19: Luyện tập: Phản ứng oxi hóa - khử - Cô Phạm Thu Huyền (Giáo viên VietJack)
Bài 1 (trang 88 SGK Hóa 10 - Video giải tại 3:13): Loại phản ứng nào sau đây luôn luôn không là loại phản ứng oxi hóa – khử?
A. Phản ứng hóa hợp.
B. Phản ứng phân hủy.
C. Phản ứng thế trong hóa vô cơ
D. Phản ứng trao đổi.
Lời giải:
D đúng.
Bài 2 (trang 89 SGK Hóa 10 - Video giải tại 4:09): Loại phản ứng nào sau đây luôn luôn là phản ứng oxi hóa – khử?
A. Phản ứng hóa hợp.
B. Phản ứng phân hủy.
C. Phản ứng thế trong hóa vô cơ.
D. Phản ứng trao đổi.
Lời giải:
C đúng.
Bài 3 (trang 89 SGK Hóa 10 - Video giải tại 4:58): Cho phản ứng: M2Ox + HNO3 → M(NO3)3 + …
Khi x có giá trị là bao nhiêu thì phản ứng trên không thuộc loại phản ứng oxi hóa – khử?
A. x = 1.
B. x = 2.
C. x= 1 hoặc x = 2.
D. x = 3.
Chọn đáp án đúng.
Lời giải:
D đúng.
Vì x = 3 thì số oxi hóa của M trước và sau phản ứng không thay đổi vẫn là +3
Bài 4 (trang 89 SGK Hóa 10 - Video giải tại 6:46): Câu nào đúng, câu nào sai trong các câu sau đây:
A. Sự oxi hóa một nguyên tố là lấy bớt electron của nguyên tố đó, là làm cho số oxi hóa của nguyên tố đó tăng lên.
B. Chất oxi hóa là chất thu electron, là chất chứa nguyên tố mà số oxi hóa của nó tăng sau phản ứng.
C. Sự khử một nguyên tố là sự thu thêm electron cho nguyên tố đó, làm cho số oxi hóa của nguyên tố đó giảm xuống.
D. Chất khử là chất thu electron, là chất chứa nguyên tố mà số oxi hóa của nó giảm sau phản ứng.
E. Tất cả đều sai
Lời giải:
Câu sai: B, D, E.
Câu đúng: A, C.
Bài 5 (trang 89 SGK Hóa 10 - Video giải tại 10:26): Hãy xác định số oxi hóa của các nguyên tố:
- Nitơ trong NO, NO2, N2O5, HNO3, HNO2, NH3, NH4Cl.
- Clo trong HCl, HClO, HClO2, HClO3, HClO4, CaOCl2.
- Mangan trong MnO2, KMnO4, K2MnO4, MnSO4.
- Crom trong K2Cr2O7, Cr2(SO4)3, Cr2O3.
- Lưu huỳnh trong H2S, SO2, H2SO3, H2SO4, FeS, FeS2.
Lời giải:
- Đặt x là oxi hóa của nguyên tố nitơ trong các hợp chất trên, ta có:
Trong NO: x + (-2) = 0 → x = +2.
Trong NO2: x + 2.(-2) = 0 → x = +4.
Trong N2O5: 2x + 5.(-2) = 0 → x = +5.
Trong HNO3: (+1) + x + 3.(-2) = 0 → x = +5.
Trong HNO2: (+1) + x +2.(-2) = 0 → x = +3.
Trong NH3 : x + 3.(+1) = 0 → x = -3.
Trong NH4Cl: x + 4.(+1) +(-1) = 0 → x = -3.
- Cũng giải tương tự như trên ta có:
Số oxi hóa của Cl trong:
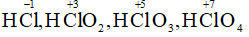
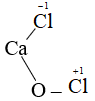
Số oxi hóa của Mn trong :
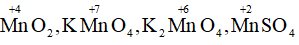
Số oxi hóa của Cr trong :
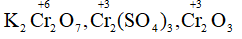
Số oxi hóa của S trong :
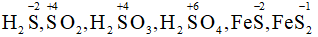
Bài 6 (trang 89 SGK Hóa 10 - Video giải tại 21:39): Cho biết đã xảy ra sự oxi hóa và sự khử những chất nào trong những phản ứng thế sau:
a) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag.
b) Fe + CuSO4 → FeSO4 + Cu.
c) 2Na + 2H2O → 2NaOH + H2.
Lời giải:
Sự oxi hóa và sự khử những chất trong phản ứng thế sau:
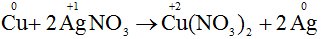
- Sự nhường electron của Cu được gọi là sự oxi hóa nguyên tử đồng: Cu0 → Cu2+ + 2e
- Sự nhận electron của ion bạc được gọi là sự khử ion bạc: Ag+ + 1e → Ag
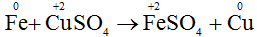
- Sự nhường electron của sắt được gọi là sự oxi hóa nguyên tử sắt: Fe0 → Fe2+ + 2e
- Sự nhận electron của ion đồng được gọi là sự khử ion đồng: Cu2+ + 2e → Cu0
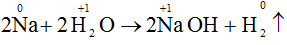
- Sự nhường electron của natri được gọi là sự oxi hóa nguyên tử natri: Na0 → Na+ + 2e
- Sự nhận electron của ion hidro gọi là sự khử ion hiđro: 2H+ + 2e → H2
Bài 7 (trang 89 SGK Hóa 10 - Video giải tại 25:44): Dựa vào sự thay đổi số oxi hóa, tìm chất oxi hóa và chất khử trong những phản ứng sau:
a) 2H2 + O2 → 2H2O.
b) 2KNO3 → 2KNO2 + O2.
c) NH4NO2 → N2 + 2H2O.
d) Fe2O3 + 2Al → 2Fe + Al2O3.
Lời giải:
Chất khử và chất oxi hóa trong các phản ứng sau là:
a) 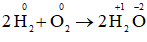
b) 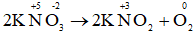
c) 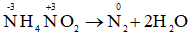
NH4NO2 vừa là chất oxi hóa, vừa là chất khử
d) 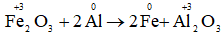
chất khử: Al, chất oxi hóa: Fe2O3
Bài 8 (trang 90 SGK Hóa 10 - Video giải tại 29:17): Dựa vào sự thay đổi số oxi hóa, hãy cho biết vai trò các chất tham gia trong các phản ứng oxi hóa – khử sau:
a) Cl2 + 2HBr → 2HCl + Br2.
b) Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O.
c) 2HNO3 + 3H2S → 3S + 2NO + 4H2O.
d) 2FeCl2 +Cl2 → 2FeCl3.
Lời giải:
Vai trò các chất trong các phản ứng oxi hóa – khử sau là:
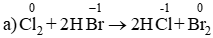
Chất khử 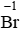
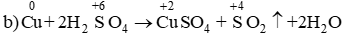
Chất khử Cu, chất oxi hóa 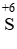
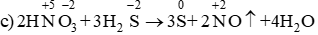
Chất khử 
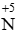
Chất khử 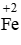
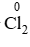
Bài 9 (trang 90 SGK Hóa 10 - Video giải tại 32:56): Cân bằng các phương trình phản ứng oxi hóa – khử sau đây bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hóa ở mỗi phản ứng:
a) Al + Fe3O4 → Al2O3 + Fe
b) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
c) FeS2 + O2 → Fe2O3 + SO3
d) KClO3 → KCl + O2
e) Cl2 +KOH → KCl + KClO3 + H2O
Lời giải:
Cân bằng các phương trình phản ứng oxi hóa – khử:
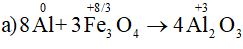
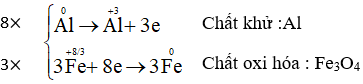
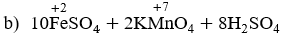
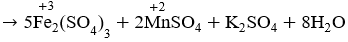

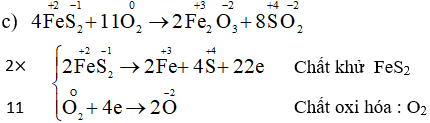

Bài 10 (trang 90 SGK Hóa 10 - Video giải tại 44:55): Có thể điều chế MgCl2 bằng:
- Phản ứng hóa hợp.
- Phản ứng thế.
- Phản ứng trao đổi.
Lời giải:
Điều chế MgCl2 bằng:
- Phản ứng hóa hợp: Mg + Cl2 → MgCl2
- Phản ứng thế: Mg + CuCl2 → MgCl2 + Cu
- Phản ứng trao đổi: Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Bài 11 (trang 90 SGK Hóa 10 - Video giải tại 46:33): Cho những chất sau: CuO, dung dịch HCl, H2, MnO2.
a) Chọn từng cặp trong những chất đã cho để xảy ra phản ứng oxi hóa – khử và viết phương trình phản ứng.
b) Cho biết chất oxi hóa, chất khử, sự oxi hóa và sự khử trong những phản ứng hóa học nói trên.
Lời giải:
a) Những cặp chất xảy ra phản ứng oxi hóa - khử
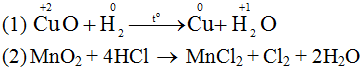
b) Trong phản ứng (1):
- Nguyên tử hiđro nhường electron là chất khử, sự nhường electron của H2 được gọi là sự oxi hóa nguyên tử hiđro.
- Ion Cu nhận electron, là chất oxi hóa. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
Trong phản ứng (2):
- Ion Clo nhường electron là chất khử. Sự nhường electron của Cl- được gọi là sự oxi hóa ion Clo.
- Ion Mn nhận electron là chất oxi hóa. Sự nhận electron của ion Mn được gọi là sự khử ion Mn.
Bài 12 (trang 90 SGK Hóa 10 - Video giải tại 50:27): Hòa tan 1,39g muối FeSO4.7H2O trong dung dịch H2SO4 loãng. Cho dung dịch này tác dụng với dung dịch KMnO4 0,1M. Tính thể tích dung dịch KMnO4 tham gia phản ứng.
Lời giải:
Phương trình hóa học của phản ứng:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
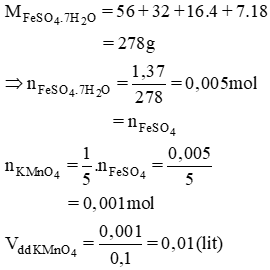
Xem thêm các bài Giải bài tập Hóa học 10 (có video) hay khác:
- Bài 18: Phân loại phản ứng trong hóa học vô cơ
- Bài 20: Bài thực hành số 1: Phản ứng oxi hóa khử
- Bài 21: Khái quát về nhóm halogen
- Bài 22: Clo
- Bài 23: Hiđro clorua - Axit clohiđric và muối clorua
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

