Đề thi Giữa kì 1 Hóa học 10
Đề thi Học kì 1 Hóa học 10
Đề thi Giữa kì 2 Hóa học 10
Sở Giáo dục và Đào tạo .....
Đề thi Giữa học kì 1
năm 2026
Môn: Hóa học 10
Thời gian làm bài: phút
(Đề thi số 1)
Câu 1: Trong tự nhiên H có 3 đồng vị: 1H, 2H, 3H. Oxi có 3 đồng vị 16O, 17O, 18O. Hỏi có bao nhiêu loại phân tử H2O được tạo thành từ các loại đồng vị trên?
A. 3. B. 16. C. 18. D. 9.
Câu 2: Hạt nhân của hầu hết các nguyên tử do các loại hạt sau cấu tạo nên
A. electron, proton và nơtron. B. electron va nơtron.
C. proton và nơtron. D. electron và proton.
Câu 3: Một nguyên tử được đặc trưng cơ bản bằng
A. Số proton và điện tích hạt nhân. B. Số proton và số electron.
C. Số khối A và số nơtron. D. Số khối A và điện tích hạt nhân.
Câu 4: Nguyên tử có số e là 13 thì cấu hình lớp ngoài cùng là
A. 3p14s2. B. 2s22p1. C. 3s23p2. D. 3s23p1.
Câu 5: Trong nguyên tử X các e được phân bố trên 3 lớp, lớp thứ 3 có 8e. Điện tích hạt nhân của nguyên tử X là
A. 16+. B. 10+. C. 18+. D. 8+.
Câu 6: Ở phân lớp 3d số electron tối đa là
A. 14. B. 10. C. 6. D. 18.
Câu 7: Có bao nhiêu electron trong ion 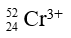 ?
?
A. 21. B. 27. C. 24. D. 49.
Câu 8: Nguyên tử M có cấu hình ở phân mức năng lượng cao nhất là 3d7. Tổng số e trong nguyên tử M là
A. 28. B. 27. C. 26. D. 29.
Câu 9: Nguyên tố hóa học bao gồm các nguyên tử:
A. Có cùng số khối A. B. Có cùng số proton.
C. Có cùng số nơtron. D. Có cùng số proton và số nơtron.
Câu 10: Cho số hiệu nguyên tử của cacbon, nitơ, oxi và flo lần lượt là 6, 7, 8, 9 và số khối của chúng lần lượt là 12, 14, 16, 19. Xét kí hiệu nào sau đây viết sai?
A. 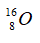 B.
B. 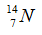 C.
C. 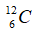 D.
D. 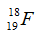
Câu 11: Kí hiệu nào trong số các kí hiệu của các phân lớp sau là sai?
A. 1p, 2d. B. 1s, 2p. C. 2p, 3d. D. 2s, 4f.
Câu 12: A có điện tích hạt nhân là 25. Vậy A là?
A. Nguyên tố d. B. Nguyêt tố f. C. Nguyên tố p. D. Nguyên tố s.
Câu 13: Cho nguyên tử: 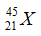 , cấu hình electron của X là
, cấu hình electron của X là
A. 1s22s22p63s23p64s13d2 B. 1s22s22p63s23p63d3
C. 1s22s22p63s23p64s23d1 D. 1s22s22p63s23p63d14s2
Câu 14: Cho 2 kí hiệu nguyên tử: 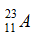 và
và 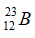 chọn câu trả lời đúng
chọn câu trả lời đúng
A. A và B có cùng điện tích hạt nhân. B. A và B cùng có 23 electron.
C. A và B là đồng vị của nhau. D. Hạt nhân của A và B đều có 23 hạt.
Câu 15: Chọn đáp án đúng?
A. Khối lượng riêng của hạt nhân lớn hơn khối lượng riêng của nguyên tử.
B. Bán kính nguyên tử bằng tổng bán kính e, p, n.
C. Trong nguyên tử các hạt p, n, e xếp khít nhau thành một khối bền chặt.
D. Bán kính nguyên tử bằng bán kính hạt nhân.
Câu 16: Nguyên tử của nguyên tố A có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố B có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của A là 8. Số đơn vị điện tích hạt nhân của A và B là
A. 13 và 17. B. 13 và 21. C. 15 và 19. D. 15 và 23.
Câu 17: Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49, trong đó số hạt không mang điện bằng 0,53125 số hạt mang điện. Điện tích hạt nhân của X là
A. 18+. B. 17+. C. 15+. D. 16+.
Câu 18: Trong nguyên tử một nguyên tố A có tổng số các loại hạt là 58. Biết số hạt proton ít hơn số hạt nơtron là 1 hạt. Kí hiệu của A là
A. 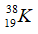 B.
B. 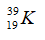 C.
C. 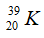 D.
D. 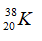
Câu 19: Các đồng vị được phân biệt bởi yếu tố nào sau đây?
A. Số electron hoá trị. B. Số nơtron.
C. Số proton. D. Số lớp electron.
Câu 20: Nguyên tố X có số hiệu nguyên tử là 29. Cấu hình e của X là
A. 1s22s22p63s23p64s23d9. B. 1s22s22p63s23p63d104s1.
C. 1s22s22p63s23p63d94s2. D. 1s22s22p63s23p64s13d10.
Câu 21: Dựa vào thứ tự mức năng lượng, xét xem sự xắp xếp các phân lớp nào sau đây sai?
A. 3d < 4s. B. 3p < 3d. C. 1s < 2s. D. 4s > 3s.
Câu 22: Tổng số hạt cơ bản trong một nguyên tử 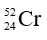 là
là
A. 28. B. 24. C. 76. D. 52.
Câu 23: Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị có % về số nguyên tử tương ứng là 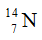 (99,63%) và
(99,63%) và 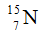 (0,37%). Nguyên tử khối trung bình của nitơ là
(0,37%). Nguyên tử khối trung bình của nitơ là
A. 14,7. B. 14,0. C. 14,4. D. 13,7.
Câu 24: Điều khẳng định nào là sai?
A. Số đơn vị điện tích hạt nhân luôn bằng số proton.
B. Số proton luôn lớn hơn số nơtron.
C. Số proton luôn bằng số electron.
D. Số nơtron luôn lớn hơn hoặc bằng số proton.
Câu 25: Tổng số hạt n, p, e trong một nguyên tử X là 52, trong đó số hạt mang điện bằng 1,889 lần số hạt không mang điện. Kết luận nào không đúng?
A. X có 5 e ở lớp ngoài cùng. B. X là phi kim.
C. X có số khối A là 35. D. X có điện tích hạt nhân X là 17.
Câu 26. Trong nguyên tử, hạt không mang điện là
A. nơtron và proton. B. proton. C. electron. D. nơtron.
Câu 27. Một nguyên tố hoá học có thể có nhiều nguyên tử có khối lượng khác nhau vì lí do nào dưới đây?
A. Hạt nhân có cùng số nơtron nhưng khác nhau về số proton.
B. Hạt nhân có cùng số proton nhưng khác nhau về số nơtron.
C. Hạt nhân có cùng số nơtron nhưng khác nhau về số electron.
D. Hạt nhân có cùng số proton và số electron.
Câu 28. Cho hai nguyên tố M và N có số hiệu nguyên tử lần l¬ượt là 11 và 13. Cấu hình electron của M và N lần l¬ượt là
A. 1s22s22p7 và 1s22s22p63s2.
B. 1s22s22p63s1 và 1s22s22p63s23p1.
C. 1s22s22p63s1 và 1s22s22p63s2.
D. 1s22s22p63s1 và 1s22s22p63s3.
Câu 29. Ở nhiệt độ 20oC, khối lượng riêng của kim loại X bằng 10,48 g/cm3 và bán kính nguyên tử X là 1,446.10-8 cm. Giả thiết trong tinh thể các nguyên tử X có dạng hình cầu và có độ rỗng là 26%. Biết số Avogađro NA = 6,022.1023. Kim loại X là
A. Fe. B. Cu. C. Ag. D. Cr.
Câu 30. Đặc điểm của electron là
A. mang điện tích dương.
B. mang điện tích âm.
C. không mang điện.
D. trung hòa về điện.
Hướng dẫn giải:
Câu 1. C
- Với 16O có thể tạo nên các phân tử nước với 3 đồng vị của H là:
1H16O1H; 2H16O2H; 3H16O3H; 1H16O2H ; 1H16O3H; 2H16O3H.
- Với 17O có thể tạo nên các phân tử nước với 3 đồng vị của H là:
1H17O1H; 2H17O2H; 3H17O3H; 1H17O2H ; 1H17O3H; 2H17O3H.
- Với 18O có thể tạo nên các phân tử nước với 3 đồng vị của H là:
1H18O1H; 2H18O2H; 3H18O3H; 1/H18O2H ; 1H18O3H; 2H18O3H.
Câu 2. C
Câu 3. D
Câu 4. D
Cấu hình electron của nguyên tử đó là: [Ne]3s23p1.
→ Cấu hình electron lớp ngoài cùng là: 3s23p1.
Câu 5. C
Cấu hình electron của X là: 1s22s22p63s23p6
Số hiệu nguyên tử X = số electron = 18.
Điện tích hạt nhân X là 18+.
Câu 6. B
Câu 7. A
Crom có p = e = 24 hạt, Cr3+ có e = 21 (do Cr3+ đã nhường 3 e).
Câu 8. B
Cấu hình electron của M là: 1s22s22p63s23p63d74s2
→ Tổng số electron của nguyên tử M là 27.
Câu 9. B
Câu 10. D
Kí hiệu đúng là 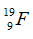 .
.
Câu 11. A
Không có phân lớp 2d.
Câu 12. A
Trật tự phân mức năng lượng: 1s22s22p63s23p64s23d5
Electron cuối cùng được điền vào phân lớp d theo trật tự phân mức năng lượng. Vậy A là nguyên tố d.
Câu 13. D
Câu 14. D
A sai vì điện tích của hạt nhân A là 11+, điện tích của hạt nhân B là 12+.
B sai vì A có 11 electron và B có 12 electron.
C sai vì A và B có số proton khác nhau nên không là đồng vị của nhau.
Câu 15. A
Câu 16. A
Cấu hình electron của A là 1s22s22p63s23p1
→ Số đơn vị điện tích hạt nhân của A là 13.
Số hạt mang điện trong A là 13.2 = 26 → Số hạt mang điện trong B là 26 + 8 = 34.
→ Số đơn vị điện tích hạt nhân của B là 34 : 2 = 17.
Câu 17. D
Gọi số hạt proton, nơtron và electron trong X lần lượt là p, n và e.
Theo bài ra ta có:
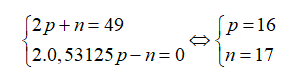
Điện tích hạt nhân nguyên tử X là 16+.
Câu 18. B
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố A là 58:
p + e + n = 58 hay 2p + n = 58 (do p = e) (1)
Số hạt p ít hơn số hạt n là 1 hạt:
n- p =1 (2)
Giải (1), (2) ta có p = e = 19, n = 20
Vậy A có số hiệu nguyên tử = số p = 19; Số khối của A là 19 + 20 = 39.
→ Kí hiệu nguyên tử A là: 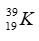
Câu 19. B
Câu 20. B
Câu 21. A
Mức năng lượng ở phân lớp 3d > 4s.
Câu 22. C
Tổng số hạt cơ bản trong Cr = p + n + e = A + e = 52 + 24 = 76.
Câu 23. B
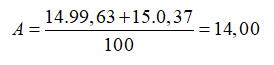
Câu 24. B
Câu 25.
Theo bài ra ta có hệ phương trình:
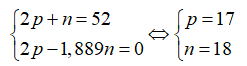
Cấu hình electron của X là [Ne]3s23p5 → X có 7e lớp ngoài cùng nên là phi kim.
Số khối của X là: 18 + 17 = 35.
Điện tích hạt nhân X là 17+.
Câu 26. D
Câu 27. B
Câu 28. B
Câu 29. C
Thể tích 1 nguyên tử X là: 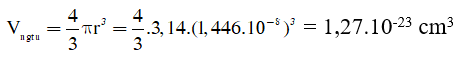
Thể tích nguyên tử (phần đặc) trong 1cm3 tinh thể là: 1.(100%-26%) = 0,74cm3
1cm3 tinh thể có số nguyên tử là: 0,74 : (1,27.10-23) = 5,85.1022 nguyên tử.
Khối lượng 1 nguyên tử: 10,48 : (5,85.1022) = 1,79.10-22 (g)
Khối lượng 1 mol nguyên tử: 1,79.10-22 .6,022.1023 = 108 g/mol
→ X là Ag.
Câu 30. B
Electron mang điện tích âm.
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2026
Môn: Hóa học 10
Thời gian làm bài: phút
(Đề thi số 1)
Phần trắc nghiệm
Câu 1: Tổng số hạt cơ bản (p, n, e) trong nguyên tử nguyên tố X là 46, biết số hạt mang điện nhiều hơn số hạt không mang điện là 14. Xác định chu kì, số thứ tự ô nguyên tố của X trong bảng tuần hoàn.
A. Chu kì 2, ô 7 B. Chu kì 3 ô 17
C. Chu kì 3 ô 16 D. Chu kì 3, ô 15
Câu 2: Tính chất phi kim của các nguyên tố trong dãy N - P - As - Sb - Bi (nhóm VA) biến đổi theo chiều:
A. Tăng B. Không thay đổi
C. Vừa giảm vừa tăng. D. Giảm
Câu 3: Cho các phân tử N2, HCl, NaCl, MgO. Các phân tử đều có liên kết cộng hóa trị là
A. NaCl và MgO B. HCl và MgO
C. N2 và NaCl D. N2 và HCl
Câu 4: Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
A. ion. B. Cộng hoá trị.
C. Kim loại. D. Cho nhận
Câu 5: Cho biết cấu hình electron của nguyên tố A là 1s22s22p63s23p4 và cấu hình electron của nguyên tố B là 1s22s22p63s1. Phát biểu đúng là
A. Nguyên tố A là KL, nguyên tố B là PK
B. Nguyên tố A là PK, nguyên tố B là KL.
C. Nguyên tố A, nguyên tố B đều là PK
D. Nguyên tố A, nguyên tố B đều là KL.
Câu 6: Hợp chất của một nguyên tố có công thức RH2. Oxit cao nhất của R chiếm 40% khối lượng R. R là:
A. N (M = 14) B. Se (M = 79).
C. S (M = 32) D. Ca (M = 40)
Câu 7: Cho phương trình phản ứng hóa học sau:
8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O. Trong phản ứng trên chất khử là:
A. Fe B. HNO3
C. Fe(NO3)3 D. N2O
Câu 8: Nguyên tố X có Z = 20. Vị trí của X trong hệ thống hoàn:
A. Tất cả đều sai
B. Chu kì 3, nhóm IA
C. Chu kì 4, nhóm IIA
D. Chu kì 4, nhóm IIIA.
Câu 9: Trong các phân tử sau, phân tử có liên kết ba giữa hai nguyên tử là:
A. Khí flo. B. Khí cacbonic.
C. Khí hyđrô. D. Khí nitơ.
Câu 10: Số oxi hóa của lưu huỳnh trong các phân tử và ion sau: SO42-, H2SO4, H2SO3 lần lượt là
A. -2, +4, +6. B. +6, +4, +6.
C. +6, +6, +4. D. +4, +6, +6.
Câu 11: Trong các phản ứng sau, phản ứng nào không phải là phản ứng oxy hóa khử.
A. Fe + 2HCl → FeCl2
B. Fe + CuSO4 → FeSO4 + Cu.
C. 2FeCl3 + Fe → 3FeCl3
D. FeS + 2HCl → FeCl2 + H2S
Câu 12: Trong phản ứng hoá học sau: 3Cl2 + 6KOH → KClO3 + 5KCl + 3H2O. Cl2 đóng vai trò là gì?
A. Chỉ là chất oxi hoá
B. Vừa là chất oxi hoá, vừa là chất khử
C. Chỉ là chất khử.
D. Không phải là chất oxi hoá, không phải là chất khử
Phần tự luận
Câu 1: (2 điểm)
Khi cho 0,9g một kim loại X thuộc nhóm IIA tác dụng với nước thì được 0,504 lít H2 (đkct). Tìm kim loại X.
Câu 2: (2 điểm)
Cho PTH Zn + HNO3 → Zn(NO3)2 + NO2 + H2O
a) Cân bằng PTHH trên?
b) Tính thể tích khí NO2 thu được ở đktc khi cho 13g Zn tác dụng với 400ml HNO3 2,5M.
Đáp án và Thang điểm
Câu 1. D
Gọi số hạt proton, nơtron và electron của X lần lượt là p, n và e.
Theo bài ra ta có: 2p + n = 46 và 2p – n = 14.
Giải hệ phương trình ta được: p = 15 và n = 16.
Vậy X ở ô 15. Cấu hình electron của X là 1s22s22p63s23p3. Vậy X ở chu kỳ 3.
Câu 2. D
Trong một nhóm A, theo chiều từ trên xuống dưới (chiều tăng dần của điện tích hạt nhân) tính phi kim của các nguyên tố giảm dần.
Câu 3. D
Phân tử N2 và HCl được cấu tạo nên từ các phi kim do đó liên kết trong phân tử là liên kết cộng hóa trị.
Câu 4. A
X có 1 e lớp ngoài cùng do đó X là kim loại điển hình.
Y có 7 e lớp ngoài cùng do đó Y là phi kim điển hình.
Vậy liên kết giữa nguyên tử X và Y là liên kết ion.
Câu 5. B
A có 6 e ở lớp ngoài cùng do đó A là phi kim.
B có 1 e ở lớp ngoài cùng do đó B là kim loại.
Câu 6. C
Oxit cao nhất của R có dạng RO3.
Theo bài ra có:
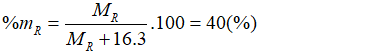
→ R = 32. Vậy R là lưu huỳnh (S).
Câu 7. A
Số oxi hóa của Fe tăng từ 0 lên +3 sau phản ứng. Vậy Fe là chất khử.
Câu 8. C
Cấu hình electron nguyên tử của X là: 1s22s22p63s23p64s1.
Vậy X ở chu kỳ 4, nhóm IIA.
Câu 9. D
Ta có CTCT của các chất:
F – F; O = C = O; H – H; N ≡ N.
Vậy chỉ có phân tử chỉ có liên kết ba giữa hai nguyên tử là N2.
Câu 10. C
SO42-: Gọi số oxi hóa S là x ta có:
x + (-2).4 = -2. Vậy x = +6.
H2SO4: Gọi số oxi hóa S là x ta có:
(+1).2 + x + (-2).4 = 0. Vậy x = +6.
H2SO3: Gọi số oxi hóa S là x ta có:
(+1).2 + x + (-2).3 = 0. Vậy x = +4.
Câu 11. D
FeS + 2HCl → FeCl2 + H2S
Phản ứng này không có sự thay đổi số oxi hóa của các nguyên tố sau phản ứng nên không là phản ứng oxi hóa – khử.
Câu 12. B
Clo có số oxi hóa tăng từ 0 lên +5 và giảm từ 0 xuống -1 sau phản ứng nên Cl2 vừa đóng vai trò là chất oxi hóa vừa đóng vai trò là chất khử.
Phần tự luận
Câu 1: (2 điểm)
nH2 = 0,504/22,4 = 0,0225 mol
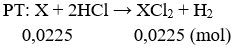
Theo pt: nX = nH2 = 0,0225 mol
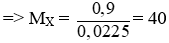
Vậy X là Ca.
Câu 2: (2 điểm)
a. Cân bằng PTHH
Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
b. Số mol của Zn là 13/65 = 0,2 mol
Số mol của HNO3 là 0,4.2,5 = 1 mol
Ta có tỉ lệ: 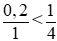 ⇒Zn phản ứng hết
⇒Zn phản ứng hết
⇒ Số mol NO2 = 2. nZn = 2.0,2= 0,4 mol.
VNO2 = 0,4. 22,4 = 8,96 lit
Sở Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
năm 2026
Môn: Hóa học 10
Thời gian làm bài: phút
(Đề thi số 1)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Những nguyên tố ở nhóm nào sau đây có cấu hình electron lớp ngoài cùng là ns2np5?
A. Nhóm IVA. B. Nhóm VB. C. Nhóm VIA. D. Nhóm VIIA.
Câu 2: Chất khí nào sau đây dùng để diệt trùng nước sinh hoạt, nước bể bơi...?
A. Cl2. B. SO2. C. HCl. D. O2.
Câu 3: Cho 0,1 mol K2Cr2O7 tác dụng với lượng dư HCl đặc. Thể tích khí clo thu được ở đktc là?
A. 2,24 lít. B. 3,36 lít. C. 5,6 lít. D. 6,72 lít.
Câu 4: Đổ dung dịch chứa 1 gam NaOH vào dung dịch chứa 1 gam HCl. Nhúng giấy quỳ tím vào dung dịch thu được thì quỳ tím chuyển sang màu nào?
A. Màu đỏ. B. Màu xanh.
C. Không đổi màu. D. Không xác định được.
Câu 5: Cho 0,05 mol halogen X2 tác dụng vừa đủ với đồng kim loại thu được 11,2 gam muối. Nguyên tố halogen là
A. Br. B. Cl. C. F. D. I.
Câu 6: Trong các đơn chất halogen, chất ở trạng thái lỏng là
A. Cl2. B. F2. C. Br2. D. I2.
Câu 7: Công thức của clorua vôi là
A. Ca2OCl. B. CaClO2. C. Ca(OCl)2. D. CaOCl2.
Câu 8: Cho lượng dư dung dịch AgNO3 tác dụng với hỗn hợp gồm 0,2 mol NaF và 0,1 mol NaCl. Khối lượng kết tủa tạo thành là
A. 27,05 gam. B. 39,75 gam. C. 10,8 gam. D. 14,35 gam.
Câu 9: Mức độ phân cực của liên kết hóa học trong các phân tử được sắp xếp theo thứ tự giảm dần từ trái sang phải là
A. HI, HCl, HBr. B. HCl, HBr, HI.
C. HI, HBr, HCl. D. HBr, HI, HCl.
Câu 10: Tổng hệ số nguyên tối giản của phương trình hóa học:
HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O là
A. 35. B. 34. C. 36. D. 33.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Viết các phương trình phản ứng trong các trường hợp sau:
a/ Cl2 tác dụng với nước
b/ I2 tác dụng với H2 (tº, xúc tác Pt)
c/ Fe(OH)3 tác dụng với dd HCl.
d/ Cl2 tác dụng với dd NaBr
Câu 2 ( 2 điểm): Bằng phương pháp hóa học (không dùng chất chỉ thị) hãy phân biệt các dd sau chứa trong các lọ riêng biệt mất nhãn: MgCl2, KBr, HCl. Viết phương trình hóa học xảy ra.
Câu 3 ( 2 điểm): Cho 5,7 gam hỗn hợp X gồm Fe và FeCO3 vào một lượng vừa đủ dung dịch HCl. Kết thúc phản ứng thấy thu được dung dịch A và 1,68 lít khí B ở đktc. Tính % khối lượng mỗi chất có trong hỗn hợp X.
Câu 4 ( 1 điểm): Cho 6,72 lít (đktc) hỗn hợp X gồm O2, Cl2 có dX/H2=22,5 tác dụng vừa đủ với m (g) hỗn hợp Y gồm Al và Zn thu được 31,9 gam hỗn hợp B gồm muối clorua và oxit của 2 kim loại. Tính m và %m mỗi chất trong Y?
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| Đáp án |
D |
A |
D |
A |
A |
C |
D |
D |
B |
A |
Câu 1: Những nguyên tố ở nhóm VIIA có cấu hình electron lớp ngoài cùng là ns2np5. Chọn đáp án D.
Câu 2: Khí Cl2 dùng để diệt trùng nước sinh hoạt, nước bể bơi... Chọn đáp án A.
Câu 3:
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O.
0,1 → 0,3
Vkhí = 0,3.22,4 = 6,72 lít. Chọn đáp án D.
Câu 4:
HCl + NaOH → NaCl + H2O
0,0273 0,025 (mol)
Dung dịch sau phản ứng có HCl dư làm quỳ tím chuyển sang màu đỏ. Chọn đáp án A.
Câu 5:
Cu + X2 → CuX2
0,05 → 0,05 (mol)
Mmuối = 11,2 : 0,05 = 224 → MX = 80. Vậy X là Br. Chọn đáp án A.
Câu 6: Trong các đơn chất halogen, chất ở trạng thái lỏng là Br2. Chọn đáp án C.
Câu 7: Công thức của clorua vôi là CaOCl2. Chọn đáp án D.
Câu 8:
AgNO3 + NaF → không phản ứng
AgNO3 + NaCl → AgCl + NaNO3
0,1 → 0,1 (mol)
m↓ = 0,1.143,5 = 14,35 gam. Chọn đáp án D.
Câu 9:
Δχ= /χX-χH/
(với Δχ: hiệu độ âm điện, χX: hiệu độ âm điện nguyên tố halogen)
Từ Cl đến I độ âm điện các nguyên tố giảm dần → Δχ giảm dần, độ phân cực của liên kết giảm dần. Chọn đáp án B.
Câu 10: PTHH: 16HCl + 2KMnO4 → 2MnCl2 + 5Cl2 + 2KCl + 8H2O.
Tổng hệ số nguyên tối giản của phương trình hóa học: 16 + 2 + 2 +5 + 2 + 8 = 35. Chọn đáp án A.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
HS viết đúng mỗi PTHH 0,5 điểm. Thiếu điều kiện hoặc không cân bằng trừ ½ số điểm của mỗi PT.
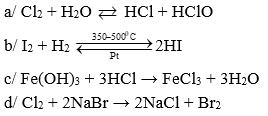
Câu 2 ( 2 điểm):
- Trích mẫu thử, đánh STT (0,5 điểm)
Dùng dd NaOH nhận ra MgCl2 nhờ kết tủa trắng Mg(OH)2 (0,5 điểm)
MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
Dùng dd AgNO3 nhận ra HCl (kết tủa trắng), KBr (kết tủa vàng nhạt) (0,5 điểm)
PTHH: (0,5 điểm)
AgNOc + HCl AgCl + HNO3
AgNO3 + KBr AgBr + KNO3
HS phân biệt theo cách khác, đúng cho điểm tối đa
Câu 3 ( 2 điểm):
Fe + 2HCl → FeCl2 + H2 (0,5 điểm)
a a (mol)
FeCO3 + 2HCl → FeCl2 + CO2 + H2O
b b (mol)
Gọi số mol của Fe là a, số mol FeCO3 là b. Theo bài ra có hệ phương trình: (0,5 điểm)
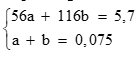
Giải hệ được a = 0,05; b = 0,025 (0,5 điểm)
Tính được (0,5 điểm)
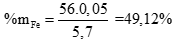
%mFeCO3 = 100 - %mFe = 50,88%.
Câu 4 ( 1 điểm):
Gọi số mol Cl2 là a, số mol O2 là b. Theo bài ra ta có hệ PT: (0,25 điểm)
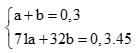
Giải hệ tìm được a = 0,1; b = 0,2 .
Gọi nAl = x, nZn=y (mol) (0,25 điểm)
Sử dụng định luật bảo toàn electron: 3x + 2y = 0,2.4 + 0,1.2 = 1 (1)
Áp dụng bảo toàn khối lượng: (0,25 điểm)
m = 31,9 - 45.0,3 = 18,4 gam nên 27x + 65y = 18,4 (2)
Giải hệ được: x = 0,2 và y = 0,2 → %mAl = 29,35%; %mZn= 70,65% (0,25 điểm)
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 2
năm 2026
Môn: Hóa học 10
Thời gian làm bài: phút
(Đề thi số 1)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Đặc điểm nào sau đây không là đặc điểm chung của tất cả các halogen?
A. Liên kết trong phân tử halogen (X2) không bền lắm.
B. Các nguyên tố halogen đều có các số oxi hóa -1; +1; +3; +5; +7 trong các hợp chất.
C. Halogen là các phi kim điển hình.
D. Trong phản ứng hóa học, nguyên tử halogen dễ thu thêm 1 electron.
Câu 2: Những nguyên tố ở nhóm nào sau đây có cấu hình electron lớp ngoài cùng là ns2np5?
A. Nhóm kim loại kiềm.
B. Nhóm khí hiếm.
C.Nhóm halogen.
D. Nhóm oxi – lưu huỳnh.
Câu 3: Cho các phương trình hóa học sau:
(a) O2 + 4Ag → 2Ag2O
(b) F2 + 2NaCl → 2NaF + Cl2
(c) H2S + FeCl2 → FeS + 2HCl
(d) HCl + AgNO3 → AgCl + HNO3
Số phương trình hóa học viết đúng là
A. 4. B. 1. C. 2. D. 3.
Câu 4: Trong PTN oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây?
A. CaCO3. B. KMnO4. C. BaSO4. D. Na2O.
Câu 5: Các số oxi hóa phổ biến của S trong hợp chất là
A. -2, 0, +2, +4. B. -2, 0, +4, +6.
C. -2, +2, +4. D. -2, +4, +6.
Câu 6: Dãy các muối sunfua tan trong nước là
A. CuS; FeS; ZnS. B. PbS; Ag2S; K2S.
C. FeS; ZnS; Na2S. D. BaS; K2S; Na2S.
Câu 7: Chất khí X tan trong nước tạo ra một dung dịch làm chuyển màu quỳ tím thành đỏ và có thể được dùng làm chất tẩy màu. Khí X là
A. NH3. B. CO2. C. SO2. D. O3.
Câu 8: Kim loại nào sau đây không tác dụng với dd H2SO4 loãng và dd HCl?
A. Na. B. Al. C. Mg. D. Cu.
Câu 9: Phản ứng nào sau đây là sai?
A. 2Fe(OH)2 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 6H2O.
B. Fe2O3 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 4H2O.
C. Fe(OH)2 + H2SO4 loãng → FeSO4 + 2H2O .
D. Fe2O3 + 3H2SO4 loãng → Fe2(SO4)3 + 3H2O.
Câu 10: Cho cân bằng hoá học: N2 (k) + 3H2 (k) ⇔ 2NH3 (k); phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
A. thay đổi áp suất của hệ.
B. thay đổi nồng độ N2.
C. thay đổi nhiệt độ.
D. thêm chất xúc tác Fe.
II. Tự luận ( 7 điểm)
Câu 1 ( 1 điểm): Cho phản ứng sau : HCOOH + Br2 → 2HBr + CO2
Lúc đầu nồng độ hơi Br2 0,04 mol/l. Sau 100 giây, nồng độ hơi Br2 còn lại là 0,012 mol/l. Tính tốc độ trung bình của phản ứng theo Br2 trong khoảng thời gian 100 giây?
Câu 2 ( 2 điểm): Sục từ từ 2,24 lít SO2 (ở đktc) vào 200ml dung dịch KOH 0,85M thu được m gam muối. Tính m?
Câu 3 ( 2 điểm): Cho 4,65 gam hỗn hợp A gồm MgX2 và MgY2 (X, Y là 2 nguyên tố halogen ở 2 chu kỳ kế tiếp, MX < MY) phản ứng hoàn toàn với dd AgNO3 dư, thu được 11,05 gam kết tủa. Xác định hai nguyên tố X, Y và tính khối lượng mỗi muối trong hỗn hợp A?
Câu 4 ( 2 điểm): Cho 15,7 gam hỗn hợp X gồm: Na2CO3, Al2O3 vào 100g dung dịch H2SO4 a% dư đến phản ứng hoàn toàn thu được dung dịch X chứa và 2,24 lít khí Y (ở đktc).
a. Xác định % khối lượng của từng chất trong X?
b. Trung hòa X cần 100 ml NaOH 0,5M. Xác định a?
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| Đáp án |
B |
C |
B |
B |
D |
D |
C |
D |
B |
D |
Câu 1: F chỉ có số o xi hóa -1 trong các hợp chất. Chọn đáp án B.
Câu 2: Các nguyên tố ở nhóm halogen có cấu hình electron lớp ngoài cùng là ns2np5. Chọn đáp án C.
Câu 3: Phương trình hóa học viết đúng là: (d) HCl + AgNO3 → AgCl + HNO3. Chọn đáp án B.
Câu 4: Trong PTN oxi có thể thu được từ phản ứng nhiệt phân KMnO4. Chọn đáp án B.
Câu 5: Các số oxi hóa phổ biến của S trong hợp chất là -2, +4, +6. Chọn đáp án D.
Câu 6: Các muối sunfua BaS; K2S; Na2S tan trong nước. Chọn đáp án D.
Câu 7: Khí SO2 tan trong nước tạo ra dung dịch làm chuyển màu quỳ tím thành đỏ và có thể được dùng làm chất tẩy màu.Chọn đáp án C.
Câu 8: Cu không tác dụng với dd H2SO4 loãng và dd HCl. Chọn đáp án D.
Câu 9: Phản ứng sai là: Fe2O3 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 4H2O. Chọn đáp án B.
Câu 10: Cân bằng hoá học không bị chuyển dịch khi thêm chất xúc tác Fe. Chọn đáp án D.
II. Tự luận ( 7 điểm)
Câu 1 ( 1 điểm):
Áp dụng công thức: (0,5 điểm)
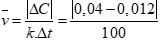
Tính được (0,5 điểm)
Câu 2 ( 2 điểm):
Tính được: nSO2 = 0,1mol, nKOH = 0,17mol (0,25 điểm)
Đặt: (0,25 điểm)
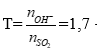
→ sau pư tạo 2 muối KHSO3 (x mol), K2SO3 (y mol)
SO2 + KOH → KHSO3 (0,25 điểm)
x x x (mol)
SO2 + 2KOH → K2SO3 + H2O (0,25 điểm)
y 2y y (mol)
Lập hệ: (0,25 điểm)
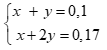
Giải hệ được: x = 0,03, y = 0,07 (0,25 điểm)
→ m = mKHSO3 + mK2SO3 = 14,66 gam. (0,25 điểm)
Câu 3 ( 2 điểm):
TH1: X là F và Y là Cl. Tính được nAgCl ~ 0,077 mol. (0,5 điểm)
PTHH: MgCl2 + 2AgNO3→2AgCl + Mg(NO3)2
0,0385 ← 0,077 (mol)
⇒mMgCl2 = 0,0385. 95 = 3,6575 (0,5 điểm)
⇒mMgF2 = 0,9925g (thỏa mãn)
TH2: X khác F gọi X, Y là R (điều kiện: 35,5 < MR < 127). Ta có PTHH: (0,5 điểm)
MgR2 + 2AgNO3 → 2AgR + Mg(NO3)2
nMgR2=
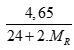
nAgR=
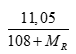
Có nAgR= 2nMgR2⇒
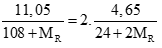
⇒MR = 57,75
⇒ X là Cl; Y là Br
Câu 4 ( 2 điểm):
Tính được số mol CO2 bằng 0,1.
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
0,1 0,1 0,1 (mol)
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
0,05 0,15
→ m Na2CO3 = 106.0,1 = 10,6g
→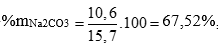
%m Al2O3 = 100 – 67,52 = 32,48%
Tính được nAl2O3 = 0,05
Dựa vào PTHH tính đc nH2SO4 phản ứng = 0,25 mol
Phản ứng trung hòa X:
2NaOH + H2SO4 dư → Na2SO4 + 2H2O
0,05 0,025
Tổng nH2SO4 = 0,275 mol
mH2SO4=26,95g → a=26,95%
....................................
....................................
....................................
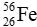
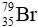
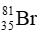

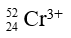 ?
?
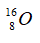 B.
B. 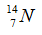 C.
C. 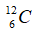 D.
D. 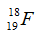
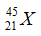 , cấu hình electron của X là
, cấu hình electron của X là
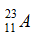 và
và 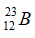 chọn câu trả lời đúng
chọn câu trả lời đúng
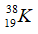 B.
B. 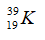 C.
C. 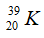 D.
D. 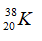
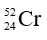 là
là
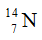 (99,63%) và
(99,63%) và 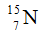 (0,37%). Nguyên tử khối trung bình của nitơ là
(0,37%). Nguyên tử khối trung bình của nitơ là
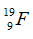 .
.
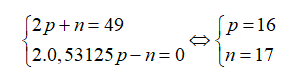
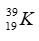
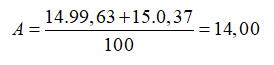
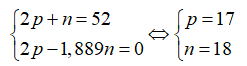
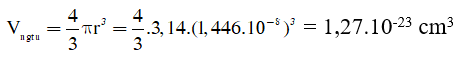
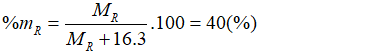
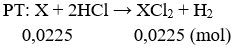
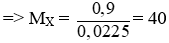
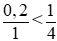 ⇒Zn phản ứng hết
⇒Zn phản ứng hết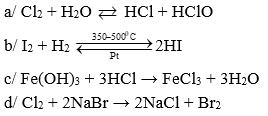
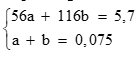
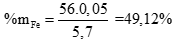
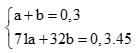
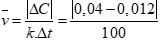
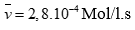
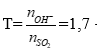
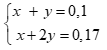
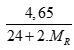
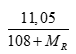
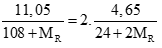
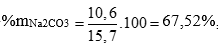



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

