Chuyên đề dạy thêm Hóa học 10 năm 2026 (sách mới)
Tài liệu chuyên đề dạy thêm Hóa học 10 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa 10.
Chuyên đề dạy thêm Hóa học 10 năm 2026 (sách mới)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thử Chuyên đề dạy thêm Hóa 10 Xem thử Các dạng bài tập Hóa 10 Xem thử Vở ghi bài Hóa 10
Chỉ từ 450k mua trọn Chuyên đề dạy thêm Hóa 10; Các dạng bài tập Hóa 10; Vở ghi Hóa 10 bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
Chuyên đề dạy thêm Hóa học 10 Kết nối tri thức
Chuyên đề dạy thêm Hóa học 10 Chân trời sáng tạo
Chuyên đề dạy thêm Hóa học 10 Cánh diều
Xem thử chuyên đề Hóa học 10 KNTT
Chuyên đề Cấu tạo nguyên tử lớp 10
A. PHẦN LÍ THUYẾT
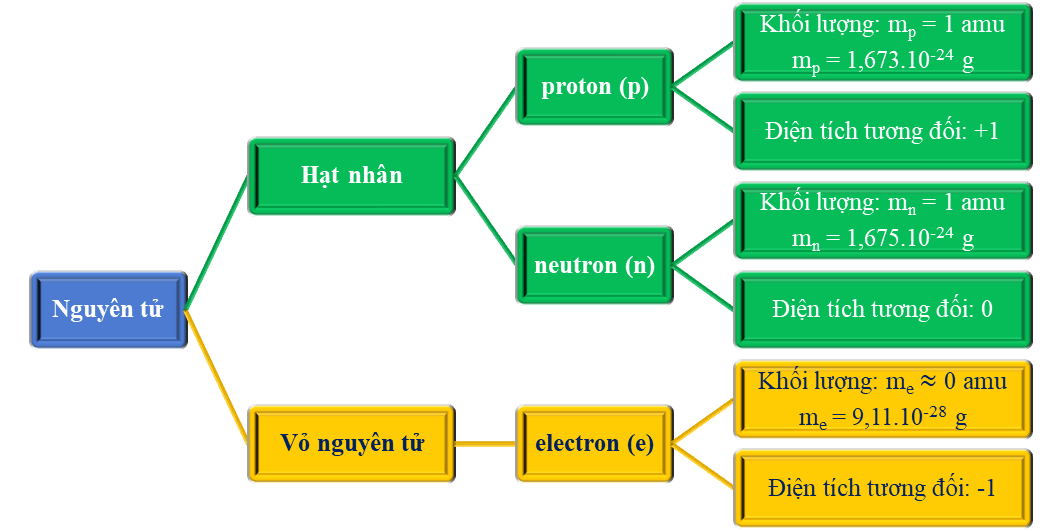
I. LÍ THUYẾT TRỌNG TÂM BÀI 1: THÀNH PHẦN NGUYÊN TỬ
II. ĐỀ TỰ LUYỆN PHẦN LÍ THUYẾT
2.1. Phần tự luận
Câu 1: Tính tổng số electron, proton và neutron trong một phân tử nước (H2O). Biết trong phân tử này, nguyên tử H chỉ tạo nên từ 1 proton và 1 electron; nguyên tử O có 8 neutron và 8 proton.
Câu 2: Nguyên tử oxygen–16 có 8 proton, 8 neutron và 8 electron. Tính khối lượng nguyên tử oxygen theo đơn vị gam và amu?
Câu 3: Một loại nguyên tử nitrogen có 7 proton và 7 neutron trong hạt nhân. Tính khối lượng hạt nhân và khối lượng nguyên tử nitrogen theo đợn vị amu và gam?
Câu 4: Nguyên tử aluminium (Al) gồm 13 proton và 14 neutron. Tính khối lượng proton, neutron và electron có trong 27 gam aluminium.
Câu 5: Trong một nguyên tử sulfur (S) có 16 electron và 16 neutron.
a) Tính khối lượng (gam) electron, proton và neutron trong 1 mol nguyên tử sulfur.
b) Tính khối lượng (gam) 1 mol nguyên tử sulfur. Từ kết quả đó coi khối lượng nguyên tử thực tế bằng khối lượng hạt nhân được không?
2.2. Đáp án phần tự luận
Câu 1: Tính tổng số electron, proton và neutron trong một phân tử nước (H2O). Biết trong phân tử này, nguyên tử H chỉ tạo nên từ 1 proton và 1 electron; nguyên tử O có 8 neutron và 8 proton.
Đáp án:
- H: P = E = 1, N = 0; O: P = E = 8; N = 8.
- Tổng số hạt electron trong H2O: 1.2 + 8 = 10.
- Tổng số hạt proton trong H2O: 1.2 + 8 = 10.
- Tổng số hạt neutron trong H2O: 8.
- Vậy tổng số hạt trong H2O là: 2.2 + 8.3 = 28 hạt.
Câu 2: Nguyên tử oxygen–16 có 8 proton, 8 neutron và 8 electron. Tính khối lượng nguyên tử oxygen theo đơn vị gam và amu?
Đáp án:
Câu 3: Một loại nguyên tử nitrogen có 7 proton và 7 neutron trong hạt nhân. Tính khối lượng hạt nhân và khối lượng nguyên tử nitrogen theo đợn vị amu và gam?
Đáp án:
Câu 4: Nguyên tử aluminium (Al) gồm 13 proton và 14 neutron. Tính khối lượng proton, neutron và electron có trong 27 gam aluminium.
Đáp án:
Câu 5: Trong một nguyên tử sulfur (S) có 16 electron và 16 neutron.
a) Tính khối lượng (gam) electron, proton và neutron trong 1 mol nguyên tử sulfur.
b) Tính khối lượng (gam) 1 mol nguyên tử sulfur. Từ kết quả đó coi khối lượng nguyên tử thực tế bằng khối lượng hạt nhân được không?
Đáp án:
b)
Vậy, khối lượng nguyên tử thực tế gần bằng khối lượng hạt nhân.
2.3. Phần trắc nghiệm (30 câu)
Câu 1: Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là:
A. electron và proton.
B.proton và neutron.
C. neutron và electron.
D. electron, proton và neutron.
Câu 2: Các hạt cấu tạo nên hầu hết các nguyên tử là:
A. electron và proton.
B. proton và neutron.
C. neutron và electron.
D.electron, proton và neutron.
Câu 3: Nguyên tử chứa những hạt mang điện là:
A. proton và α.
B. proton và neutron.
C.proton và electron.
D. electron và neutron.
Câu 4: Khi các nguyên tử tiến lại gần nhau để hình thành liên kết hóa học, sự tiếp xúc đầu tiên giữa hai nguyên tử sẽ xảy ra giữa
A.lớp vỏ với lớp vỏ.
B. lớp vỏ với hạt nhân.
C. hạt nhân với hạt nhân.
D. hạt nhân với nguyên tử.
Câu 5: Nguyên tử trung hòa về điện vì
A. được tạo nên bởi các hạt không mang điện.
B.có tổng số hạt proton bằng tổng số hạt electron.
C. có tổng số hạt electron bằng tổng số hạt neutron.
D. tổng số hạt neutron bằng tổng số hạt proton.
Câu 6: Nguyên tử oxygen (O) có 8 electron. Điện tích hạt nhân của nguyên tử oxygen là:
A. –8.
B.+8.
C. –16.
D. 16.
Câu 7: Nguyên tử sodium (Na) có điện tích hạt nhân là +11. Số proton và số electron trong nguyên tử này lần lượt là:
A.11 và 11.
B. 11 và 12.
C. 11 và 22.
D. 11 và 23.
................................
................................
................................
Chuyên đề Bảng tuần hoàn các nguyên tố hóa học lớp 10
A. PHẦN LÍ THUYẾT
I. LÍ THUYẾT TRỌNG TÂM BÀI 5: CẤU TẠO BẢNG TUẦN HOÀN
CÁC NGUYÊN TỐ HÓA HỌC
* Nguyên tắc sắp xếp
- Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng.
- Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành 1 cột (trừ nhóm VIIIB).
* Cấu tạo bảng tuần hoàn
- Ô nguyên tố: mỗi nguyên tố hóa học được xếp vào 1 ô trong bảng tuần hoàn.
Số thứ tự ô nguyên tố = số hiệu nguyên tử Z
- Chu kì: là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều tăng dần điện tích hạt nhân tăng dần.
Số thứ tự chu kì = số lớp electron
- Nhóm nguyên tố: là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó tính chất hóa học gần giống nhau và được xếp thành 1 cột.
Số thứ tự nhóm nguyên tố = số electron hóa trị
Electron hóa trị = electron lớp ngoài cùng + phân lớp sát ngoài cùng chưa bão hòa.
* Phân loại nguyên tố
- Nguyên tố s: là nguyên tố mà electron cuối cùng được phân bố vào phân lớp s. Gồm nhóm IA, IIA và He.
- Nguyên tố p: là nguyên tố mà electron cuối cùng được phân bố vào phân lớp p. Gồm nhóm IIIA - VIIIA (trừ He).
- Nguyên tố d: là nguyên tố mà electron cuối cùng được phân bố vào phân lớp d. Gồm nhóm IB – VIIIB.
- Nguyên tố f: là nguyên tố mà electron cuối cùng được phân bố vào phân lớp f
II. ĐỀ TỰ LUYỆN PHẦN LÍ THUYẾT
2.1. Phần tự luận
Câu 1: Chu kì 2 gồm các nguyên tố cùng có hai lớp electron. Hỏi các nguyên tố nào sau đây thuộc về chu kì 2? Mg (Z = 12), Li (Z = 3), P (Z = 15), F ( Z= 9).
Câu 2: Nguyên tố X và Y có số hiệu nguyên tử lần lượt là 21 và 35. Viết cấu hình electron, từ đó xác định vị trí của X, Y (số thứ tự ô nguyên tố, chu kì và nhóm) trong bảng tuần hoàn.
Câu 3: Viết cấu hình electron và xác định vị trí của các nguyên tố sau trong bảng tuần hoàn. Cho biết chúng thuộc khối nguyên tố nào (s, p, d, f) và chúng là kim loại, phi kim hay khí hiếm:
a) Neon tạo ra ánh sáng màu đỏ khi sử dụng trong các ống phóng điện chân không, được sử dụng rộng rãi trong các biển quảng cáo. Cho biết Ne có số hiệu nguyên tử là 10.
b) Magnesium (Mg) được sử dụng để làm cho hợp kim bền nhẹ, đặc biệt được sử dụng cho ngành công nghiệp hàng không. Cho biết Mg có số hiệu nguyên tử là 12.
Câu 4: Dãy nào gồm các nguyên tố có tính chất hóa học tương tự nhau? Vì sao?
a) Oxygen (Z = 8), nitrogen (Z = 7), carbon (Z = 6);
b) Lithium (Z = 3), sodium (Z = 11), potassium (Z = 19);
c) Helium (Z = 2), neon ( Z = 10), argon (Z = 18).
Câu 5: Viết cấu hình electron nguyên tử của các nguyên tố sau:
a) Nguyên tố thuộc chu kì 4, nhóm IIA.
b) Nguyên tố khí hiếm thuộc chu kì 3.
Câu 6: Nitrogen là thành phần dinh dưỡng cần thiết cho sự sinh trưởng, phát triển và sinh sản của thực vật. Biết nitrogen có số hiệu nguyên tử là 7.
a) Viết cấu hình electron của nitrogen.
b) Nitrogen là nguyên tố s, p, d hay f?
c) Nitrogen là kim loại, phi kim hay khí hiếm?
Câu 7: Dựa vào bảng tuần hoàn, hãy cho biết: 12Mg, 15P, 26Fe, 18Ar thuộc loại nguyên tố nào sau đây.
a) Nguyên tố s, p, d hay f?
b) Nguyên tố phi kim, kim loại hay khí hiếm?
Câu 8: Nguyên tố phosphorus (P) có Z = 15, có trong thành phần của một loại phân bón, diêm, pháo hoa; nguyên tố calcium (Ca) có Z = 20, đóng vai trò rất quan trọng đối với cơ thể, đặc biệt là xương và răng. Xác định vị trí của hai nguyên tố trên trong bảng tuần hoàn và cho biết chúng thuộc loại nguyên tố s, p hay d; kim loại, phi kim hay khí hiếm.
Câu 9: Sulfur (S) là chất rắn, xốp, màu vàng nhạt ở điều kiện thường. Sulfur và hợp chất của nó được sử dụng trong acquy, bột giặt, thuốc diệt nấm; do dễ cháy nên S còn được dung để sản xuất các loại diêm, thuốc súng, pháo hoa,… Trong bảng tuần hoàn, nguyên tố S nằm ở chu kì 3, nhóm VIA.
a) Nguyên tử của nguyên tố S có bao nhiêu electron thuộc lớp ngoài cùng?
b) Các electron lớp ngoài cùng thuộc những phân lớp nào?
c) Viết cấu hình electron nguyên tử của S.
d) S là nguyên tố kim loại hay phi kim?
Câu 10: Sự phân bố electron trong nguyên tử của ba nguyên tố như sau: X: (2/8/1); Y (2/5); Z (2/8/8/1). Hãy xác định vị trí của các nguyên tố này trong bảng tuần hoàn.
................................
................................
................................
Trên đây tóm tắt một số nội dung miễn phí trong Chuyên đề dạy thêm Hóa 10, để mua tài liệu, mời Thầy/Cô xem thử:
Xem thử chuyên đề Hóa học 10 KNTT
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều

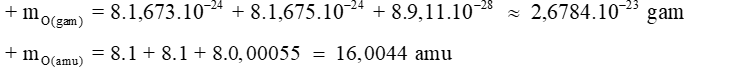
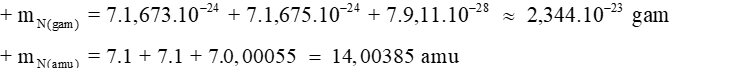

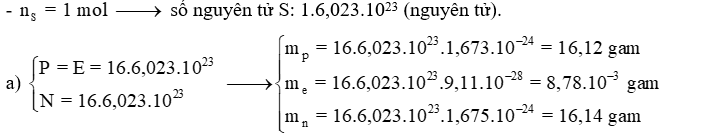



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

