Top 100 Đề thi Hóa học 10 Chân trời sáng tạo (có đáp án)
Bộ 100 Đề thi Hóa học 10 Chân trời sáng tạo năm 2026 theo cấu trúc mới nhất đầy đủ Học kì 1 và Học kì 2 gồm đề thi giữa kì, đề thi học kì có đáp án chi tiết, cực sát đề thi chính thức giúp học sinh ôn luyện & đạt điểm cao trong các bài thi Hóa học 10.
Đề thi Hóa học 10 Chân trời sáng tạo năm 2025 (mới nhất)
Xem thử Đề thi GK1 Hóa 10 Xem thử Đề thi CK1 Hóa 10 Xem thử Đề thi GK2 Hóa 10 Xem thử Đề thi CK2 Hóa 10
Chỉ từ 150k mua trọn bộ đề thi Hóa học 10 Chân trời sáng tạo cả năm theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
- Đề thi Hóa 10 Giữa kì 1 Chân trời sáng tạo
- Đề thi Hóa 10 Học kì 1 Chân trời sáng tạo
- Đề thi Hóa 10 Giữa kì 2 Chân trời sáng tạo
- Đề thi Hóa 10 Học kì 2 Chân trời sáng tạo
Đề cương Hóa học 10 Chân trời sáng tạo
Đề kiểm tra Hóa học 10 Chân trời sáng tạo (theo Chương)
Đề kiểm tra Hóa học 10 Chân trời sáng tạo Chương 1 (có lời giải)
Đề kiểm tra Hóa học 10 Chân trời sáng tạo Chương 2 (có lời giải)
Đề kiểm tra Hóa học 10 Chân trời sáng tạo Chương 3 (có lời giải)
Đề kiểm tra Hóa học 10 Chân trời sáng tạo Chương 4 (có lời giải)
Đề kiểm tra Hóa học 10 Chân trời sáng tạo Chương 5 (có lời giải)
Đề kiểm tra Hóa học 10 Chân trời sáng tạo Chương 6 (có lời giải)
Đề kiểm tra Hóa học 10 Chân trời sáng tạo Chương 7 (có lời giải)
Xem thêm đề thi Hóa 10 cả ba sách:
Top 20 Đề thi Hóa học 10 Giữa kì 1 năm 2026 có đáp án (cả ba sách)
Top 30 Đề thi Hóa học 10 Học kì 1 năm 2026 có đáp án (cả ba sách)
Top 10 Đề thi Hóa học 10 Giữa kì 2 năm 2026 có đáp án (cả ba sách)
Top 10 Đề thi Hóa học 10 Học kì 2 năm 2026 có đáp án (cả ba sách)
Xem thử Đề thi GK1 Hóa 10 Xem thử Đề thi CK1 Hóa 10 Xem thử Đề thi GK2 Hóa 10 Xem thử Đề thi CK2 Hóa 10
Sở Giáo dục và Đào tạo ...
Đề thi Giữa kì 1 - Chân trời sáng tạo
Năm 2025
Môn: Hóa học lớp 10
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của hóa học?
A.Quỹ đạo chuyển động của Trái Đất.
B. Sự phân chia tế bào trong cơ thể.
C. Sự truyền âm trong chân không.
D. Cấu tạo và tính chất của glucose.
Câu 2: Loại liên kết trong phân tử muối ăn là
A. liên kết cộng hóa trị không phân cực.
B. liên kết cộng hóa trị phân cực.
C. liên kết ion.
D. liên kết kim loại.
Câu 3: Hiện tượng nào sau đây là hiện tượng hóa học?
A. Hòa tan muối ăn vào nước thu được dung dịch nước muối.
B. Dẫn khí carbon dioxide vào nước vôi trong, làm nước vôi trong vẩn đục.
C. Nước đá để ngoài không khí bị chảy thành nước lỏng.
D. Nhựa đường nấu ở nhiệt độ cao nóng chảy.
Câu 4: Nhiên liệu nào sau đây được coi là nhiên liệu của tương lai?
A. Than đá.
B. Hydrogen.
C. Dầu mỏ.
D. Oxygen.
Câu 5: Nhận định nào sai khi nói về neutron?
A. Có khối lượng lớn hơn khối lượng electron.
B. Không mang điện.
C. Tồn tại trong hạt nhân nguyên tử.
D. Có khối lượng bằng khối lượng proton.
Câu 6: Nguyên tử N có 7 proton, nguyên tử H có 1 proton. Số lượng hạt proton và electron có trong phân tử NH3 là
A. 8 proton và 8 electron.
B. 11 proton và 11 electron.
C. 10 proton và 11 electron.
D. 10 proton và 10 electron.
Câu 7: Hạt nhân nguyên tử gồm các loại hạt là
A.electron và proton.
B.proton và neutron.
C.electron và neutron.
D.electron, proton và neutron.
Câu 8: Nguyên tử calcium có điện tích hạt nhân là +20. Số hạt mang điện có trong nguyên tử calcium là
A. 20.B. 40.C. 60.D. 30.
Câu 9: Đồng vị là những nguyên tử của cùng một nguyên tố hóa học, nhưng khác nhau về
A. số proton.
B. số electron.
C. tính chất hóa học.
D. khối lượng nguyên tử.
Câu 10: Trong tự nhiên, lithium có hai đồng vị là 6Li và 7Li với tỉ lệ phần trăm số nguyên tử của mỗi đồng vị lần lượt là 7,42% và 92,58%. Nguyên tử khối trung bình của mẫu lithium này (kết quả tính đến hai chữ số thập phân) là
A. 6,07. B. 6,50. C. 6,90. D. 6,93.
Câu 11: Nguyên tử potassium (K) có 19 electron. Điện tích hạt nhân nguyên tử K là
A. 19. B. +19. C. -19. D. 19+.
Câu 12: Cho kí hiệu nguyên tử 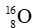
A.Kí hiệu hóa học của nguyên tố là O.
B.Số hiệu nguyên tử là 16.
C.Số proton trong một hạt nhân nguyên tử là 8.
D.Số neutron trong một hạt nhân nguyên tử là 8.
Câu 13: Lớp electron thứ 3 có bao nhiêu phân lớp?
A. 1. B. 2. C. 3. D. 4.
Câu 14: Phát biểu nào đúng khi nói về các orbital trong một phân lớp electron?
A. Khác nhau về mức năng lượng.
B. Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
C. Có cùng sự định hướng không gian.
D. Có cùng mức năng lượng.
Câu 15: Nếu 3 electron được điền vào 3 AO thì số lượng electron độc thân là
A. 0. B. 1. C. 2. D. 3.
Câu 16: Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron. Kí hiệu của các lớp thứ nhất, thứ hai, thứ ba, thứ tư lần lượt là
A.A, B, C, D.
B.V, X, Y, Z.
C.K, L, M, N.
D.M, N, O, P.
Câu 17: Số electron tối đa trong lớp L là
A. 2. B. 8. C. 18. D. 32.
Câu 18: Hình dạng của orbital s là
A. hình tròn.
B. hình cầu.
C. hình số tám nổi.
D. hình elip.
Câu 19: Một orbital chứa tối đa bao nhiêu electron?
A. 1. B. 2. C. 3. D. 4.
Câu 20: Phát biểu đúng khi nói về mô hình nguyên tử hiện đại là
A.Các electron chuyển động theo những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân.
B.Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân theo một quỹ đạo xác định, tạo thành đám mây electron.
C.Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
D.Các electron chuyển động theo những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân, tạo thành đám mây electron.
Câu 21: Lớp electron là
A. tập hợp các electron có mức năng lượng bằng nhau.
B. tập hợp các electron trong toàn bộ nguyên tử.
C. tập hợp các electron có mức năng lượng gần bằng nhau.
D. tập hợp các electron có mức năng lượng cao nhất trong nguyên tử.
Câu 22: Số electron tối đa trong phân lớp d là
A. 2. B. 10. C. 6. D. 14.
Câu 23: Phát biểu nào sau đây không đúng?
A. Lớp M có 9 phân lớp.
B. Lớp L có 4 orbital.
C. Phân lớp p có 3 orbital.
D. Năng lượng của electron trên lớp K là thấp nhất.
Câu 24: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y có một electron ở lớp ngoài cùng 4s. Nguyên tử X và Y có số electron hơn kém nhau là 3. Nguyên tử X, Y lần lượt là
A. khí hiếm và kim loại.
B. kim loại và khí hiếm.
C. kim loại và kim loại.
D. phi kim và kim loại.
Câu 25: Nguyên tử nguyên tố X có cấu hình electron là 1s22s22p63s23p3. Phát biểu nào sau đây là sai?
A. X là một phi kim.
B. X ở ô số 15 trong bảng tuần hoàn.
C. Nguyên tử của nguyên tố X có 9 electron p.
D. Nguyên tử của nguyên tố X có 3 phân lớp electron.
Câu 26: Số hiệu nguyên tử của nguyên tố hoá học bằng
A. số thứ tự của ô nguyên tố.
B. số thứ tự của chu kì.
C. số thứ tự của nhóm.
D. số electron lớp ngoài cùng của nguyên tử.
Câu 27: Nguyên tố Y ở chu kì 3, nhóm VA của bảng tuần hoàn. Cấu hình electron nguyên tử của Y là
A.1s22s22p63s23p5.
B.1s22s22p63s23p3.
C.1s22s22p63s23p63d54s2.
D.1s22s22p63s23p63d34s2.
Câu 28: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là
A.chu kì.
B.ô nguyên tố.
C.nhóm.
D.orbital.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Khối lượng riêng của calcium kim loại là 1,55 g/cm3. Giả thiết rằng, trong tinh thể calcium, các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Cho nguyên tử khối của calcium là 40 amu. Tính bán kính nguyên tử calcium.
Câu 2 (1 điểm): Cho các nguyên tử nguyên tố sau: Mg (Z = 12); S (Z = 16).
a) Viết cấu hình electron của Mg; S và biểu diễn cấu hình electron của chúng theo ô orbital. Xác định số electron độc thân của mỗi nguyên tử này.
b) Từ cấu hình electron, dự đoán tính chất hóa học của Mg; S (có giải thích ngắn gọn).
Câu 3 (1 điểm): Xác định vị trí các nguyên tố O (Z = 8) và P (Z = 15) trong bảng tuần hoàn (có giải thích ngắn gọn cách xác định).
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 1 - Chân trời sáng tạo
Năm 2025
Môn: Hóa học lớp 10
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Phương pháp nghiên cứu lí thuyết là
A. nghiên cứu những vấn đề dựa trên kết quả thí nghiệm, khảo sát, thu thập số liệu, phân tích, định lượng…
B. giải quyết các vấn đề hóa học được ứng dụng trong các lĩnh vực khác nhau.
C. nghiên cứu thành phần, cấu trúc, tính chất và sự biến đổi của chất.
D. sử dụng những định luật, nguyên lí, quy tắc, cơ chế, mô hình … để tiếp tục làm rõ những vấn đề của lí thuyết hóa học.
Câu 2: Nguyên tử aluminium (nhôm) có điện tích hạt nhân là +13. Số hạt mang điện có trong nguyên tử này là
A. 13. B. 26. C. 39. D. 38.
Câu 3: Nguyên tử đồng (copper) có 29 proton và 34 neutron. Số khối của nguyên tử đồng là
A. 63. B. 64. C. 58. D. 68.
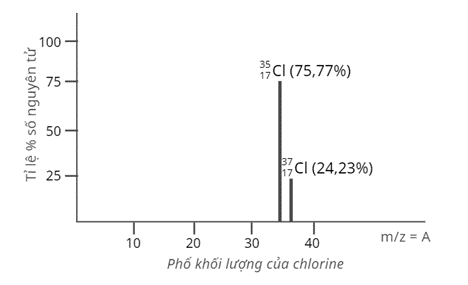
Câu 4: Tỉ lệ phần trăm số nguyên tử các đồng vị tự nhiên của chlorine (Cl) được xác định
theo phổ khối lượng sau:
Nguyên tử khối trung bình của Cl là
A. 34,45.
B. 35,48.
C. 36,48.
D. 36,50.
Câu 5: Sự phân bố electron trong một orbital dựa vào nguyên lí hay quy tắc nào sau đây?
A. Nguyên lí vững bền.
B. Quy tắc Hund.
C. Nguyên lí Pauli.
D. Quy tắc Pauli.
Câu 6: Phát biểu nào sau đây đúng?
A. Electron ở orbital 3p có mức năng lượng thấp hơn electron ở orbital 3s.
B. Các electron trong cùng một lớp có mức năng lượng bằng nhau.
C. Những electron ở lớp K có mức năng lượng thấp nhất.
D. Những electron ở gần hạt nhân có mức năng lượng cao nhất.
Câu 7: Phân lớp 3d có số electron tối đa là
A. 6. B. 18. C. 14. D. 10.
Câu 8: Cấu hình electron của nguyên tử Al (Z = 13) là
A. 1s22s22p63s23p2.
B.1s22s22p63s1.
C.1s22s22p63s23p1.
D.1s22s22p63s23p3.
Câu 9: Nguyên tố X (Z = 19) thuộc chu kì nào trong bảng tuần hoàn?
A. Chu kì 1.
B. Chu kì 2.
C. Chu kì 3.
D. Chu kì 4.
Câu 10: Bảng tuần hoàn hiện nay gồm có bao nhiêu nguyên tố hóa học?
A. 119.
B. 118.
C. 117.
D. 115.
Câu 11: Cho các nguyên tử C (Z = 6); N (Z = 7); Al (Z = 13); P (Z = 15). Nguyên tử có bán kính lớn nhất là
A. N. B. P. C.Al. D. C.
Câu 12: Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử,
A. bán kính nguyên tử tăng, độ âm điện giảm.
B. bán kính nguyên tử giảm, độ âm điện tăng.
C. bán kính nguyên tử và độ âm điện đều giảm.
D. bán kính nguyên tử và độ âm điện đều tăng.
Câu 13: Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, nguyên tố nào sau đây có tính phi kim mạnh nhất?
A. Na. B. Cs. C. F. D. O.
Câu 14: Cấu hình electron nguyên tử của 3 nguyên tố X, Y, T lần lượt là: 1s22s22p63s1, 1s22s22p63s23p64s1, 1s22s22p63s23p1. Thứ tự tăng dần tính kim loại là
A.T < X < Y.
B.T < Y < Z.
C.Y < T < X.
D.Y < X < T.
Câu 15: Nguyên tử của nguyên tố R có cấu hình electron: 1s22s22p3. Công thức hợp chất oxide ứng với hóa trị cao nhất của R là
A. RO2.
B. R2O5.
C. RO3.
D. R2O3.
Câu 16: Nguyên tố X ở ô thứ 17 của bảng tuần hoàn các nguyên tố hóa học. Có các phát biểu sau:
(1) X có độ âm điện lớn nhất và là một phi kim mạnh nhất.
(2) X có thể tạo thành ion bền có dạng X-.
(3) Oxide cao nhất của X có công thức X2O5 và là acidic oxide.
(4) Hydroxide của X có công thức HXO3 và là acid mạnh.
Trong các phát biểu trên, số phát biểu đúng là
A. 1. B. 2. C. 3 D. 0.
Câu 17: Nguyên tử nào sau đây có lớp electron ngoài cùng bền vững?
A. K (Z = 19).
B. Cl (Z = 17).
C. He (Z = 2).
D. Al (Z = 13).
Câu 18: Để đạt được quy tắc octet, nguyên tử nitrogen (Z = 7) phải nhận thêm
A.2 electron.
B. 1 electron.
C. 3 electron.
D. 4 electron.
Câu 19: Cho các ion sau: K+, O2-; Mg2+; N3-. Số ion có cấu hình electron của khí hiếm Ne là
A. 4. B. 3. C. 2. D. 1.
Câu 20: Phân tử K2O được hình thành do
A. sự kết hợp giữa 2 nguyên tử K và nguyên tử O.
B. sự kết hợp giữa 2 ion K+ và ion O2-.
C. sự kết hợp giữa 1 ion K+ và ion O2-.
D. sự kết hợp giữa 1 ion K2+ và ion O-.
Câu 21: Liên kết hóa học trong phân tử Br2 thuộc loại liên kết nào?
A. Liên kết ion.
B. Liên kết hydrogen.
C. Liên kết cộng hóa trị không cực.
D. Liên kết cộng hóa trị có cực.
Câu 22: Chất nào đây trong phân tử có chứa liên kết ba?
A. H2. B. O2. C. SO2. D. N2.
Câu 23: Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là
A. 2. B. 3. C. 4. D. 5.
Câu 24: Chất nào sau đây trong phân tử có chứa liên kết cho - nhận?
A. NH3.
B. N2.
C. O2.
D. CO.
Câu 25: Cho độ âm điện của các nguyên tử sau:
Nguyên tử |
C |
H |
Cl |
N |
Mg |
O |
Độ âm điện |
2,55 |
2,2 |
3,16 |
3,04 |
1,31 |
3,44 |
Dựa vào hiệu độ âm điện, chất có liên kết ion là
A. CH4.
B. HCl.
C. NH3.
D. MgO.
Câu 26: Cho các phân tử sau: Cl2, O2, HCl, N2. Số phân tử có chứa liên kết bội là
A. 1. B. 2. C. 3. D. 4.
Câu 27: Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử?
A. CO2. B. CH4. C. NH3. D. H2S.
Câu 28: Khí hiếm nào dưới đây có nhiệt độ sôi cao nhất?
A. He. B. Ne. C. Ar. D. Kr.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Sodium fluoride (NaF) là thành phần hoạt chất phổ biến nhất trong kem đánh răng để ngăn ngừa sâu răng, hình thành men răng. Giải thích sự hình thành liên kết ion trong phân tử sodium fluoride.
Câu 2 (1 điểm): Vì sao phân tử NH3 có khả năng kết hợp với cation H+? Viết công thức Lewis của ion này.
Câu 3 (1 điểm): Hãy giải thích vì sao ở điều kiện thưởng Br2 ở trạng thái lỏng, còn Cl2 ở trạng thái khí?
Sở Giáo dục và Đào tạo ...
Đề thi Giữa kì 2 - Chân trời sáng tạo
Năm 2025
Môn: Hóa học lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Quy tắc xác định số oxi hoá nào sau đây là sai?
A. Số oxi hoá của nguyên tử trong các đơn chất bằng 0.
B. Trong một phân tử, tổng số oxi hoá của các nguyên tử bằng 0.
C. Số oxi hoá của nguyên tử trong ion đơn nguyên tử bằng điện tích của ion.
D. Trong các hợp chất, kim loại kiềm thổ có số oxi hoá là +1.
Câu 2: Số oxi hoá của nitrogen trong hợp chất NH3 là
A. +3. B. -3.
C. +1. D. -1.
Câu 3: Số oxi hoá của Mn trong ion MnO4- là
A. +6. B. +7.
C. +8. D. +2.
Câu 4: Trong trường hợp nào sau đây, sulfur có số oxi hoá là +6?
A. H2S. B. SO2.
C. D. K2SO4.
Câu 5: Cho các hợp chất sau: CO; CO2; CH4; Na2CO3. Số hợp chất trong đó C có số oxi hoá +4 là
A. 1. B. 2.
C. 3. D. 4.
Câu 6: Cho phản ứng: Cl2 + 2NaOH → NaCl + NaClO + H2O. Trong đó, Cl2 đóng vai trò
A. chất khử.
B. vừa là chất oxi hoá vừa là chất khử.
C. chất oxi hoá.
D. không phải là chất khử, không là chất oxi hoá.
Câu 7: Phát biểu nào dưới đây không đúng?
A. Phản ứng oxi hoá - khử là phản ứng luôn xảy ra đồng thời sự oxi hoá và sự khử.
B. Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của một số nguyên tố.
C. Phản ứng oxi hoá - khử là phản ứng có sự thay đổi số oxi hoá của tất cả các nguyên tố.
D. Phản ứng oxi hoá - khử là phản ứng có sự chuyển electron giữa các chất phản ứng.
Câu 8: Chất oxi hoá là chất
A. nhường electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
B. nhường electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
C. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 9: Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
A. sự khử Fe2+ và sự oxi hóa Cu.
B. sự khử Fe2+ và sự khử Cu2+.
C. sự oxi hóa Fe và sự oxi hóa Cu.
D. sự oxi hóa Fe và sự khử Cu2+.
Câu 10: Ở điều kiện thích hợp xảy ra các phản ứng sau:
(a) 2C + Ca → CaC2.
(b) C + 2H2 → CH4.
(c) C + CO2 → 2CO.
(d) 3C + 4Al → Al4C3.
Trong các phản ứng trên, tính khử của cacbon thể hiện ở phản ứng
A. (c). B. (b).
C. (a). D. (d).
Câu 11: Cho phản ứng hoá học sau: Al + HNO3 → Al(NO3)3 + NO + H2O. Hệ số cân bằng (là số nguyên, tối giản) của các chất trong sản phẩm lần lượt là
A. 8, 3, 15. B. 8, 3, 9.
C. 2, 2, 5. D. 2, 1, 4.
Câu 12: Sulfur trong hợp chất nào sau đây vừa có tính oxi hoá, vừa có tính khử?
A. Na2SO4. B. SO2.
C. H2S. D. H2SO4.
Câu 13: Cho kim loại Zn phản ứng với dung dịch CuSO4. Kim loại Zn phản ứng với CuSO4 theo phương trình hoá học:
Zn + CuSO4 → ZnSO4 + Cu
Nhận xét nào sau đây là đúng?
A. Zn là chất oxi hoá.
B. CuSO4 là chất khử.
C. Quá trình oxi hoá:
D. Quá trình khử:
Câu 14: Sục khí SO2 vào dung dịch KMnO4 (thuốc tím), màu tím nhạt dần rồi mất màu (biết sản phẩm tạo thành là MnSO4, H2SO4 và H2O). Nguyên nhân là do
A. SO2 đã oxi hóa KMnO4 thành MnO2.
B. SO2 đã khử KMnO4 thành Mn2+.
C. KMnO4 đã khử SO2 thành .
D. H2O đã oxi hóa KMnO4 thành Mn2+.
Câu 15: Phản ứng thu nhiệt là
A. phản ứng làm nhiệt độ môi trường xung quanh nóng lên.
B. phản ứng hoá học trong đó có sự giải phóng nhiệt năng ra môi trường.
C. phản ứng hoá học trong đó có sự hấp thụ nhiệt năng từ môi trường.
D. phản ứng đốt cháy nhiên liệu.
Câu 16: Cho các phản ứng sau:
(a) Phản ứng nhiệt nhôm.
(b) Phản ứng trung hoà (acid tác dụng với base).
(c) Phản ứng quang hợp.
(d) Phản ứng đốt cháy nhiên liệu.
Số phản ứng toả nhiệt là
A. 1. B. 2.
C. 3. D. 4.
Câu 17: Khẳng định nào sau đây là đúng?
A. Enthalpy tạo thành chuẩn của các đơn chất đều bằng 0.
B. Enthalpy tạo thành chuẩn của các hợp chất đều bằng 0.
C. Enthalpy tạo thành chuẩn của các đơn chất bền nhất đều bằng 0.
D. Cả A, B và C đều sai.
Câu 18: Cho hai phương trình nhiệt hoá học sau:
(1) H2(g) + F2(g) → 2HF(g)
(2) H2(g) + I2(g) → 2HI(g)
Nhận xét nào sau đây là đúng?
A. Cả hai phản ứng đều thu nhiệt.
B. Phản ứng (2) diễn ra thuận lợi hơn phản ứng (1).
C. Cả hai phản ứng đều toả nhiệt.
D. Phản ứng (1) diễn ra thuận lợi hơn phản ứng (2).
Câu 19: Cho phản ứng nhiệt phân CaCO3 như sau:
CaCO3(s) CaO(s) + CO2(g)
Phát biểu nào sau đây là đúng?
A. Phản ứng toả nhiệt.
B. Nhiệt lượng toả ra của phản ứng là 178,49 kJ.
C. Phản ứng cần cung cấp nhiệt liên tục.
D. Phản ứng xảy ra thuận lợi ở điều kiện thường.
Câu 20: Điều kiện chuẩn là điều kiện ứng với
A. áp suất 1 bar (đối với chất khí).
B. nồng độ 1 mol/ L (đối với chất tan trong dung dịch).
C. nhiệt độ thường được chọn là 298 K (25° C).
D. Cả A, B và C đúng.
Câu 21: Cho phản ứng nhiệt học sau:
2Na (s) + O2 (g) ⟶ Na2O (s) = − 418,0 kJ.
Nếu chỉ có 0,4 mol Na(s) tham gia phản ứng ở điều kiện chuẩn thì lượng nhiệt tỏa ra là
A. 418 kJ.
B. 209 kJ.
C. 836 kJ.
D. 83,6 kJ.
Câu 22: Cho phản ứng nhiệt học sau:
H2(g) + Cl2(g) ⟶ 2HCl(g)
Nhiệt tạo thành chuẩn của HCl(g) là
A. – 184,6 kJ/ mol.
B. + 184,6 kJ/ mol.
C. – 92,3 kJ/ mol.
D. + 92,3 kJ/ mol.
Câu 23: Cho phản ứng tổng hợp ammonia (NH3) như sau:
N2(g) + 3H2(g) → 2NH3(g)
Biết năng lượng liên kết (kJ/mol) của N≡N và H–H lần lượt là 946 và 436. Năng lượng liên kết của N–H trong ammonia là
A. 391 kJ/mol.
B. 361 kJ/mol.
C. 245 kJ/mol.
D. 490 kJ/mol.
Câu 24: Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P) xảy ra như sau: P (s, đỏ) ⟶ P (s, trắng) = 17,6 kJ
Điều này chứng tỏ phản ứng:
A. thu nhiệt, P đỏ bền hơn P trắng.
B. thu nhiệt, P trắng bền hơn P đỏ.
C. toả nhiệt, P đỏ bền hơn P trắng.
D. toả nhiệt, P trắng bền hơn P đỏ.
Câu 25: Cho phản ứng hoá học sau: 2NaCl(s) → 2Na(s) + Cl2(g). Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức là
Câu 26: Cho giản đồ sau:
Nhận xét nào sau đây là sai?
A. Phản ứng toả nhiệt.
B. Nhiệt lượng toả ra của phản ứng là 1450 kJ.
C. Phản ứng cần cung cấp nhiệt liên tục.
D. Phản ứng xảy ra thuận lợi ở điều kiện thường.
Câu 27: Cho phản ứng nhiệt nhôm sau: 2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
Biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm là
Biết:
|
Chất |
Al (s) |
Fe2O3 (s) |
Fe (s) |
Al2O3 (s) |
|
(kJmol-1) |
0 |
-825,5 |
0 |
-1676,0 |
A. +850,5 kJ.
B. - 850,5 kJ.
C. -839 kJ.
D. +839 kJ.
Câu 28: Cho các phát biểu sau:
(a) Sự phá vỡ các liên kết cần cung cấp năng lượng.
(b) Sự đốt cháy của nhiên liệu luôn sinh nhiệt.
(c) Phản ứng quang hợp là phản ứng thu nhiệt.
(d) Nước lỏng bay hơi là quá trình toả nhiệt.
Số phát biểu đúng là
A. 1. B. 2.
C. 3. D. 4.
Phần II: Tự luận (3 điểm)
Câu 1 (1,5 điểm): Để điều chế khí chlorine trong phòng thí nghiệm người ta tiến hành cho dung dịch HCl đặc tác dụng với tinh thể KMnO4. Phản ứng xảy ra theo sơ đồ sau:
KMnO4 + HCl KCl + MnCl2 + Cl2 + H2O
a) Cân bằng phản ứng trên theo phương pháp thăng bằng electron và chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) Giả sử hiệu suất phản ứng đạt 100%. Tính khối lượng KMnO4 cần dùng để điều chế được 2,479 lít khí Cl2 ở điều kiện chuẩn.
Câu 2 (1 điểm): Muối ammonium bicarbonate (NH4HCO3) được sử dụng làm bột nở, giúp cho bánh nở to, xốp và mềm. Dựa vào phản ứng và các dữ kiện sau hãy lựa chọn cách bảo quản ammonium bicarbonate đúng?
NH4HCO3 (s) NH3 (g) + CO2 (g) + H2O (g)
|
Chất |
NH4HCO3 (s) |
NH3 (g) |
CO2 (g) |
H2O (g) |
|
(kJmol-1) |
–849,40 |
–46,11 |
–393,51 |
–241,82 |
Câu 3 (0,5 điểm): Cho phương trình nhiệt hóa học của phản ứng:
Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng trên.
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 2 - Chân trời sáng tạo
Năm 2025
Môn: Hóa học lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của chlorine trong hợp chất HClO là
A. +1. B. -1.
C. +2. D. -2.
Câu 2: Nhận định nào sau đây là sai?
A. Số oxi hoá được đặt ở phía trên kí hiệu của nguyên tố.
B. Số oxi hoá của nguyên tử trong các đơn chất bằng 0.
C. Oxygen trong mọi hợp chất đều có số oxi hoá là -2.
D. Hydrogen trong hydride có số oxi hoá là -1.
Câu 3: Cho phản ứng hoá học sau:
2H2S + 3O2 → 2SO2 + 2H2O
Trong phản ứng này, chất khử là
A. H2S. B. O2.
C. SO2. D. H2O.
Câu 4: Trong phản ứng tạo thành calcium chloride từ đơn chất: Ca + Cl2 → CaCl2.
Kết luận nào sau đây đúng?
A. Mỗi nguyên tử calcium nhường 1 electron.
B. Mỗi nguyên tử chlorine nhận 2 electron.
C. Mỗi phân tử chlorine nhận 1 electron.
D. Mỗi nguyên tử calcium nhường 2 electron.
Câu 5: Cho phương trình nhiệt hóa học của phản ứng:
Phản ứng trên là phản ứng
A. thu nhiệt.
B. tỏa nhiệt.
C. không có sự thay đổi năng lượng.
D. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
Câu 6: Phản ứng nào sau đây là phản ứng thu nhiệt?
A. Phản ứng xảy ra khi đốt cháy cồn.
B. Phản ứng phân hủy đá vôi (CaCO3).
C. Phản ứng đốt cháy khí hydrogen trong không khí.
D. Phản ứng đốt cháy khí methane (CH4).
Câu 7: Cho các phát biểu sau:
(1). Tất cả các phản ứng cháy đều thu nhiệt.
(2). Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(3). Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều toả nhiệt.
(4). Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
Số phát biểu sai là
A. 1. B. 2.
C. 3. D. 4.
Câu 8: Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất được kí hiệu là
A. . B. ∆fH.
C. . D. ∆rH.
Câu 9: Cho phản ứng tổng quát: aA + bB → mM + nN. Phương án tính đúng của phản ứng là
Câu 10: Cho phản ứng sau:
4Na(s) + O2(g) → 2Na2O(s)
Enthalpy tạo thành của Na2O rắn ở điều kiện chuẩn là
A. – 836 kJ/ mol.
B. + 836 kJ/ mol.
C. – 418 kJ/ mol.
D. + 418 kJ/ mol.
Câu 11: Tốc độ trung bình của phản ứng là
A. tốc độ được tính tại một thời điểm nào đó.
B. tốc độ được tính trong một khoảng thời gian phản ứng.
C. tốc độ được tính theo định luật tác dụng khối lượng.
D. tốc độ của phản ứng sau 1 phút.
Câu 12: Cho phản ứng tổng quát sau: aA + bB → cC + dD.
Biểu thức tính tốc độ trung bình của phản ứng đúng là
A.
B.
C.
D.
Câu 13: Phản ứng 3H2(g) + N2(g) → 2NH3(g) có tốc độ mất đi của N2 so với tốc độ hình thành NH3 là
A. bằng .
B. bằng .
C. bằng .
D. bằng .
Câu 14: Cho phản ứng đơn giản xảy ra trong bình kín: 3H2(g) + N2(g) ⟶ 2NH3(g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ N2 không đổi và nồng độ H2 tăng 2 lần?
A. Tăng 2 lần.
B. Tăng 4 lần.
C. Tăng 8 lần.
D. Tăng 6 lần.
Câu 15: Khi nồng độ chất tham gia phản ứng càng lớn thì
A. tốc độ phản ứng càng lớn.
B. tốc độ phản ứng càng giảm.
C. tốc độ phản ứng không thay đổi.
D. tốc độ phản ứng biến thiên liên tục.
Câu 16: Chất xúc tác là
A. chất làm giảm tốc độ phản ứng hoá học.
B. chất làm tăng tốc độ phản ứng và bị tiêu biến sau khi phản ứng kết thúc.
C. chất làm tăng tốc độ phản ứng nhưng vẫn được bảo toàn về chất và lượng khi kết thúc phản ứng.
D. chất làm giảm tốc độ phản ứng nhưng vẫn được bảo toàn về chất và lượng khi kết thúc phản ứng.
Câu 17: Nhận định nào sau đây là đúng?
A. Khi đốt than trong lò, đậy nắp lò sẽ khiến than cháy nhanh hơn.
B. Que đóm cháy trong bình khí oxygen chậm hơn so với cháy ngoài không khí.
C. Khi nhóm bếp củi, dùng củi được chẻ nhỏ sẽ nhóm bếp nhanh hơn.
D. Thêm MnO2 vào quá trình nhiệt phân KClO3 sẽ làm giảm lượng O2 thu được.
Câu 18: Một phản ứng có hệ số nhiệt độ Van’t Hoff bằng 3. Ở 25°C, tốc độ của phản ứng này bằng 0,2 M s-1. Tốc độ của phản ứng ở 45°C là
A. 0,6 M s-1.
B. 1,2 M s-1.
C. 1,8 M s-1.
D. 2,4 M s-1.
Câu 19: Nguyên tố halogen nào sau đây là nguyên tố phóng xạ?
A. Fluorine.
B. Chlorine.
C. Bromine.
D. Astatine.
Câu 20: Số electron lớp ngoài cùng của nguyên tử các nguyên tố halogen là
A. 5. B. 7.
C. 1. D. 3.
Câu 21: Chất nào sau đây được dùng làm chất tẩy màu và sát trùng?
A. Hydrochloric acid.
B. Sodium chloride.
C. Nước Javel.
D. Iodine.
Câu 22: Cho các phương trình hóa học sau:
(a) Cl2 + 2NaBr → 2NaCl + Br2
(b) F2 + 2NaCl → 2NaF + Cl2
(c) HF + AgNO3 → AgF + HNO3
(d) HCl + AgNO3 → AgCl + HNO3
Số phương trình hóa học viết đúng là
A. 4. B. 1.
C. 2. D. 3.
Câu 23: Trong y tế, đơn chất halogen nào được hòa tan trong ethanol để dùng làm chất sát trùng vết thương?
A. Cl2. B. F2.
C. I2. D. Br2.
Câu 24: Kim loại tác dụng được với acid HCl và khí chlorine cho cùng một loại muối chloride kim loại là
A. iron (Fe).
B. magnesium (Mg).
C. copper (Cu).
D. silver (Ag).
Câu 25: Hoá chất dùng để nhận biết 4 dung dịch: NaF, NaCl, NaBr, NaI là
A. NaOH.
B. H2SO4.
C. AgNO3.
D. Ag.
Câu 26: Cho dãy dung dịch acid sau: HF, HCl, HBr, HI. Dung dịch có tính acid mạnh nhất là
A. HF . B. HCl.
C. HBr. D. HI.
Câu 27: Phản ứng chứng tỏ HCl có tính khử là
A. HCl + NaOH → NaCl + H2O.
B. 2HCl + Mg → MgCl2 + H2 .
C. MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.
D. NH3 + HCl → NH4Cl.
Câu 28: Cho phản ứng: NaX(khan) + H2SO4 (đậm đặc) NaHSO4 + HX(khí).
Các hydrogen halide có thể điều chế theo phản ứng trên là
A. HCl, HBr và HI .
B. HBr và HI.
C. HF và HCl.
D. HF, HCl, HBr và HI.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Lập phương trình hoá học của phản ứng oxi hoá – khử sau theo phương pháp thăng bằng electron (chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử).
a) Cl2 + KOH KCl + KClO3 + H2O.
b) KI + H2SO4 I2 + S + K2SO4 + H2O.
Câu 2 (1 điểm): Cho hỗn hợp X gồm 1,4 gam Fe và 1,6 gam Cu phản ứng hoàn toàn với một lượng khí Cl2 dư. Kết thúc phản ứng thấy thu được m gam muối. Tính m và thể tích khí Cl2 ở đkc cần dùng để phản ứng hết với lượng kim loại trên.
Câu 3 (1 điểm): Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch HCl 10%, thu được 2,479 lít khí H2 (ở đkc).
a/ Xác định % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b/ Tính nồng độ % các muối có trong dung dịch sau phản ứng.
Xem thử Đề thi GK1 Hóa 10 Xem thử Đề thi CK1 Hóa 10 Xem thử Đề thi GK2 Hóa 10 Xem thử Đề thi CK2 Hóa 10
Xem thêm đề thi lớp 10 các môn học có đáp án hay khác:
Tài liệu giáo án lớp 10 các môn học chuẩn khác:
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 10 (các môn học)
- Giáo án điện tử lớp 10 (các môn học)
- Giáo án Ngữ văn 10
- Giáo án Toán 10
- Giáo án Tiếng Anh 10
- Giáo án Vật Lí 10
- Giáo án Hóa học 10
- Giáo án Sinh học 10
- Giáo án Lịch Sử 10
- Giáo án Địa Lí 10
- Giáo án Kinh tế Pháp luật 10
- Giáo án Tin học 10
- Giáo án Công nghệ 10
- Giáo án Giáo dục quốc phòng 10
- Giáo án Hoạt động trải nghiệm 10
- Đề thi lớp 10 (các môn học)
- Đề thi Ngữ Văn 10 (có đáp án)
- Chuyên đề Tiếng Việt lớp 10
- Đề cương ôn tập Văn 10
- Đề thi Toán 10 (có đáp án)
- Đề thi cương ôn tập Toán 10
- Đề thi Toán 10 cấu trúc mới (có đáp án)
- Đề thi Tiếng Anh 10 (có đáp án)
- Đề thi Vật Lí 10 (có đáp án)
- Đề thi Hóa học 10 (có đáp án)
- Đề thi Sinh học 10 (có đáp án)
- Đề thi Lịch Sử 10 (có đáp án)
- Đề thi Địa Lí 10 (có đáp án)
- Đề thi Kinh tế & Pháp luật 10 (có đáp án)
- Đề thi Tin học 10 (có đáp án)
- Đề thi Công nghệ 10 (có đáp án)
- Đề thi Giáo dục quốc phòng 10 (có đáp án)

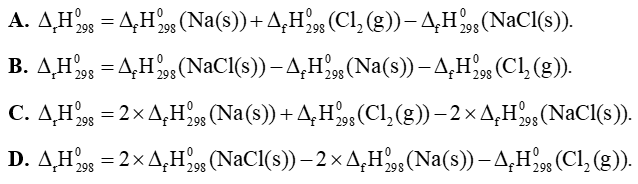





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

