3 Đề thi Cuối kì 2 Hóa học 10 Kết nối tri thức năm 2026 (có đáp án)
Với bộ 3 đề thi cuối Học kì 2 Hóa học 10 Kết nối tri thức năm 2026 có đáp án theo cấu trúc mới được biên soạn và chọn lọc từ đề thi Hóa học 10 của các trường THPT trên cả nước. Hi vọng bộ đề thi này sẽ giúp học sinh ôn tập và đạt kết quả cao trong các bài thi Hóa 10 Cuối Học kì 2.
Đề thi Học kì 2 Hóa 10 Kết nối tri thức có đáp án (3 đề)
Chỉ từ 60k mua trọn bộ Đề thi Hóa 10 Cuối kì 2 Kết nối tri thức theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 2 - Kết nối tri thức
năm 2025
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của carbon trong hợp chất CH4 là
A. +1. B. -1.
C. +4. D. -4.
Câu 2: Cho các hợp chất sau: SO2; H2SO4; Na2SO4; Na2S; CaSO3. Số hợp chất trong đó sulfur có số oxi hoá +4 là
A. 1. B. 2.
C. 3. D. 4.
Câu 3: Cho các phản ứng hoá học sau, phản ứng oxi hoá - khử là
A. NaOH + HCl → NaCl + H2O.
B. CuO + H2SO4 → CuSO4 + H2O.
C. K2CO3 + 2HCl → 2KCl + CO2 + H2O.
D. 2KClO3 2KCl + 3O2.
Câu 4: Cho phản ứng hoá học sau: Fe + 2HCl → FeCl2 + H2. Chất bị oxi hoá là
A. Fe. B. HCl.
C. FeCl2. D. H2.
Câu 5: Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:
Ở điều kiện chuẩn, nếu đốt cháy 12,395 L khí CO thì nhiệt lượng toả ra là
A. – 852,5 kJ.
B. – 426,25 kJ.
C. 852,5 kJ.
D. 426,25 kJ.
Câu 6: Cho các phương trình nhiệt hoá học sau:
(1) C2H4(g) + H2(g) → C2H6(g)
(2) Fe2O3(s) + 2Al(s) → Al2O3(s) + 2Fe(s)
Nhận xét nào sau đây là đúng?
A. Cả hai phản ứng đều toả nhiệt.
B. Cả hai phản ứng đều thu nhiệt.
C. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
D. Phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
Câu 7: Cho phương trình nhiệt hoá học sau:
N2(g) + O2(g) → 2NO(g)
Nhiệt tạo thành chuẩn của NO(g) là
A. +180,6 kJ/ mol.
B. –180,6 kJ/ mol.
C. +90,3 kJ/mol.
D. -90,3 kJ/mol.
Câu 8: Nhiệt lượng tỏa ra hay thu vào của phản ứng ở một điều kiện xác định được gọi là
A. biến thiên nhiệt lượng của phản ứng.
B. biến thiên enthalpy của phản ứng.
C. enthalpy của phản ứng.
D. biến thiên năng lượng của phản ứng.
Câu 9: Công thức tính biến thiên enthalpy chuẩn của phản ứng theo năng lượng liên kết là
A.
B.
C.
D.
Câu 10: Cho phản ứng: 2NaCl(s) → 2Na(s) + Cl2(g).
Biết . Biến thiên enthalpy chuẩn của phản ứng này là
A. -822,4 kJ.
B. +822,4 kJ.
C. -411,2 kJ.
D. +411,2 kJ.
Câu 11: Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
A. Tốc độ phản ứng.
B. Cân bằng hóa học.
C. Phản ứng một chiều.
D. Phản ứng thuận nghịch.
Câu 12: Cho phản ứng phân hủy N2O5 như sau: 2N2O5(g) → 4NO2(g) + O2(g).
Tại thời điểm ban đầu, nồng độ của N2O5 là 0,02M; Sau 100s, nồng độ N2O5 còn 0,0169M. Tốc độ trung bình của phản ứng phân hủy N2O5 trong 100s đầu tiên là
A. 1,55.10-5 (mol/ (L.s)).
B. 1,55.10-5 (mol/ (L.min)).
C. 1,35.10-5 (mol/ (L.s)).
D. 1,35.10-5 (mol/ (L.min)).
Câu 13: Cho phản ứng đơn giản sau: 2NO + O2 → 2NO2. Mối liên hệ giữa tốc độ phản ứng và nồng độ các chất tham gia phản ứng là
A.
B.
C.
D.
Câu 14: Việc làm nào dưới đây thể hiện sự ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng: CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)?
A. Pha loãng dung dịch HCl.
B. Nghiền nhỏ đá vôi (CaCO3).
C. Sử dụng chất xúc tác.
D. Tăng nhiệt độ của phản ứng.
Câu 15: Xét phản ứng của acetone với iodine:
CH3COCH3 + I2 → CH3COCH2I + HI
Phản ứng có hệ số nhiệt độ γ trong khoảng từ 30oC đến 50oC là 2,5. Nếu ở 35oC phản ứng có tốc độ là 0,036 mol/ (L.h) thì ở 45oC phản ứng có tốc độ là
A. 0,060 mol/ (L.h).
B. 0,090 mol/ (L.h).
C. 0,030 mol/ (L.h).
D. 0,036 mol/ (L.h).
Câu 16: Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ tăng lên bao nhiêu lần khi nâng nhiệt độ từ 20oC lên 50oC?
A. 2 lần. B. 8 lần.
C. 16 lần. D. 32 lần.
Câu 17: Năng lượng hoạt hóa là
A. năng lượng cần cung cấp cho phản ứng hóa học.
B. năng lượng tối đa có thể cung cấp cho các hạt (nguyên tử, phân tử hoặc ion) để gây ra phản ứng hóa học.
C. năng lượng tối thiểu cần cung cấp cho các hạt (nguyên tử, phân tử hoặc ion) để va chạm giữa chúng gây ra phản ứng hóa học.
D. lượng nhiệt tỏa ra hoặc thu vào khi hình thành phản ứng hóa học.
Câu 18: Hãy cho biết yếu tố nồng độ đã được áp dụng cho quá trình nào sau đây?
A. Khi ủ bếp than, người ta đậy nắp bếp lò làm cho phản ứng cháy của than chậm lại.
B. Phản ứng oxi hóa SO2 thành SO3 diễn ra nhanh hơn khi có mặt V2O5.
C. Bột nhôm (aluminum) phản ứng với dung dịch HCl nhanh hơn so với dây nhôm.
D. Người ta chẻ nhỏ củi để bếp lửa cháy mạnh hơn.
Câu 19: Tính chất hóa học đặc trưng của các đơn chất halogen là
A. tính khử.
B. tính base.
C. tính acid.
D. tính oxi hóa.
Câu 20: Halogen nào sau đây thể lỏng ở điều kiện thường?
A. Fluorine.
B. Chlorine.
C. Bromine.
D. Iodine.
Câu 21: Chlorine vừa là chất oxi hoá, vừa là chất khử trong phản ứng hoá học nào sau đây?
A. H2 + Cl2 2HCl.
B. HCl + NaOH → NaCl + H2O.
C. 2KMnO4 + 16HCl 2MnCl2 + 2KCl + 5Cl2 + 8H2O.
D. Cl2 + 2NaOH → NaCl + NaClO + H2O.
Câu 22: Thể tích khí Cl2 (ở điều kiện chuẩn) vừa đủ để tác dụng hết với dung dịch KI thu được 2,54 gam I2 là
A. 247,9 ml.
B. 495,8 ml.
C. 371,85 ml.
D. 112 ml.
Câu 23: Đính một mẩu giấy màu ẩm vào dây kim loại gắn với nút đậy bình tam giác. Sau đó, đưa mẩu giấy vào bình tam giác có chứa khí chlorine. Hiện tượng quan sát được là
A. mẩu giấy đậm màu hơn.
B. mẩu giấy bị nhạt màu dần đến mất màu.
C. không có hiện tượng gì.
D. mẩu giấy chuyển màu xanh.
Câu 24: Hydrogen halide nào sau đây có nhiệt độ sôi cao nhất?
A. HF. B. HCl.
C. HBr. D. HI.
Câu 25: Dung dịch silver nitrate không tác dụng với dung dịch nào sau đây?
A. KI.
B. NaF.
C. HCl.
D. NaBr.
Câu 26: Hòa tan 12,8 gam hỗn hợp gồm Fe, FeO bằng dung dịch HCl vừa đủ, thu được 2,479 lít (đkc). Thành phần phần trăm theo khối lượng của FeO trong hỗn hợp là
A. 56,25%. B. 43,75%.
C. 66,67%. D. 33,33%.
Câu 27: Hoàn thiện phát biểu sau: “Trong dãy hydrogen halide, từ HF đến HI, độ bền liên kết …”
A. tăng dần.
B. giảm dần.
C. không đổi
D. tuần hoàn.
Câu 28: Phát biểu nào sau đây không đúng?
A. Từ fluorine đến iodine nhiệt độ nóng chảy tăng dần, nhiệt độ sôi giảm dần.
B. Fluorine chỉ có số oxi hoá -1 trong hợp chất.
C. Hầu hết các muối halide đều dễ tan trong nước.
D. HF là acid yếu.
Phần II: Tự luận (3 điểm)
Câu 1 (2 điểm): Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc, dư. Dẫn khí thoát ra vào 500 mL dung dịch KOH 4M ở điều kiện thường.
a) Viết phương trình hoá học của các phản ứng xảy ra, chỉ rõ chất khử, chất oxi hoá.
b) Xác định nồng độ mol/ L của các chất có trong dung dịch sau phản ứng. Biết rằng thể tích của dung dịch sau phản ứng thay đổi không đáng kể.
Câu 2 (1 điểm): Cho 6,56 gam hỗn hợp A gồm hai muối NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kỳ kế tiếp, MX < MY) phản ứng hoàn toàn và vừa đủ với 50 ml dung dịch AgNO3 1 M, thu được hai chất kết tủa. Xác định hai nguyên tố X, Y.
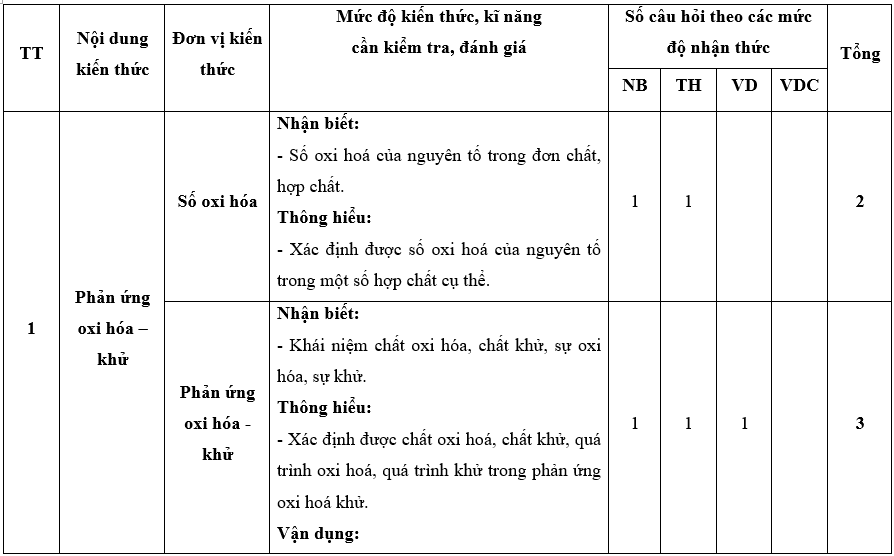
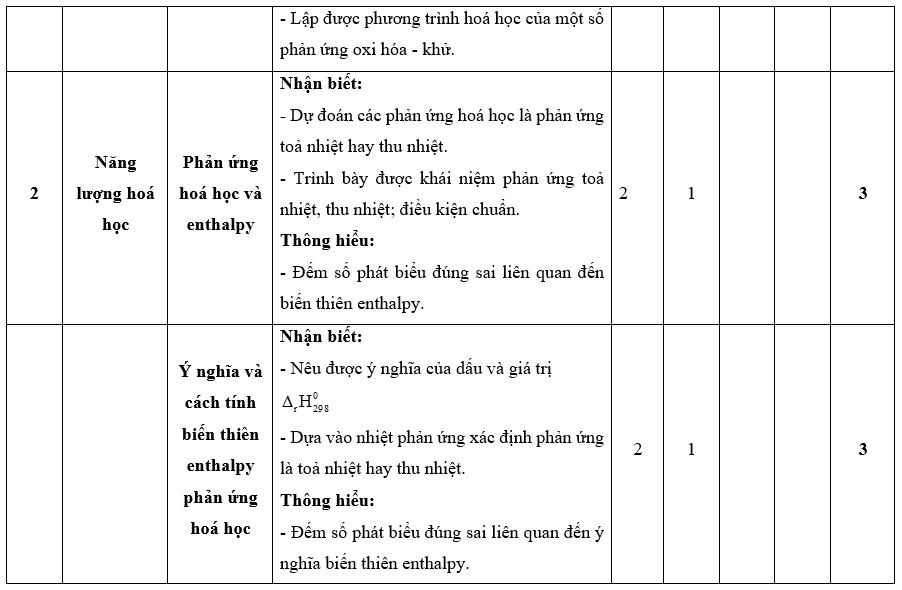
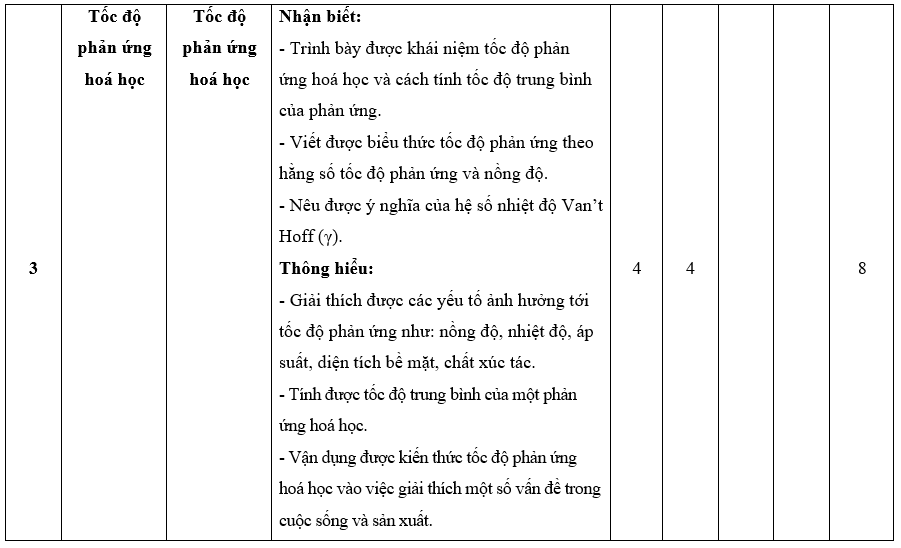
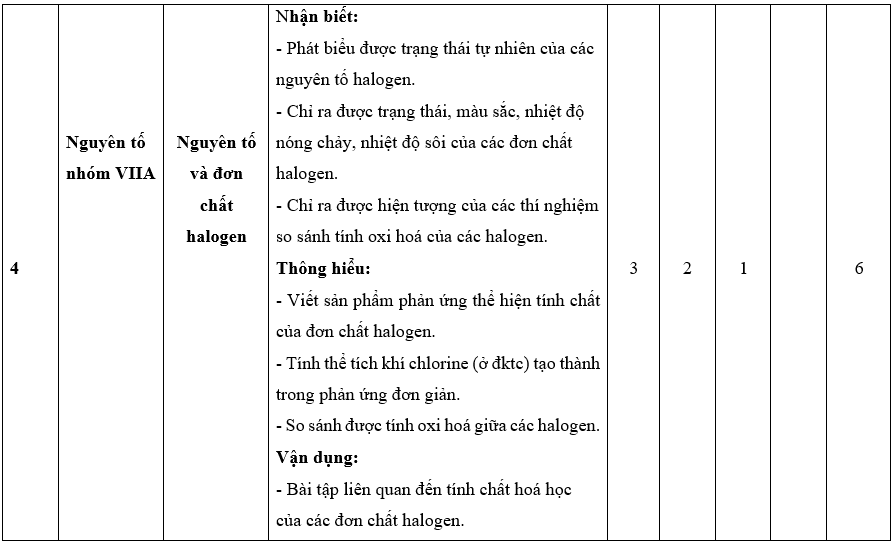
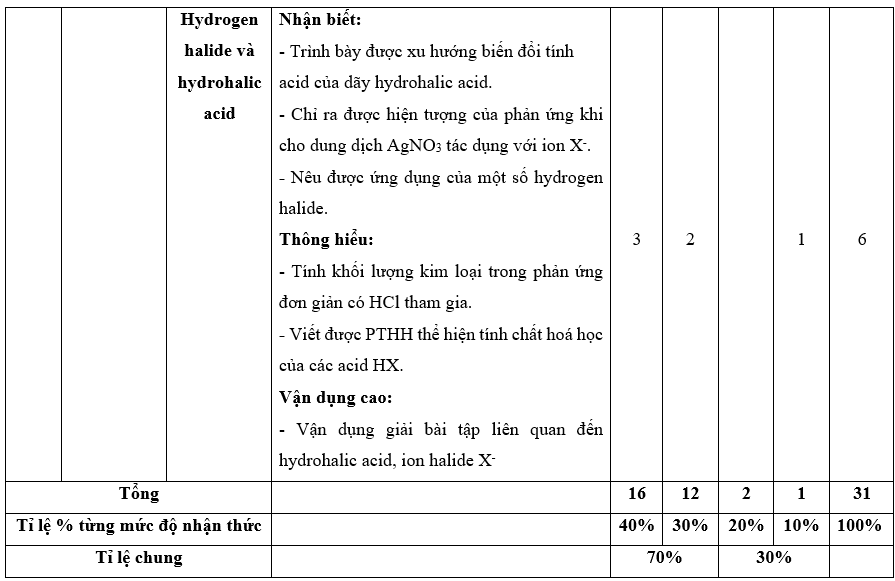
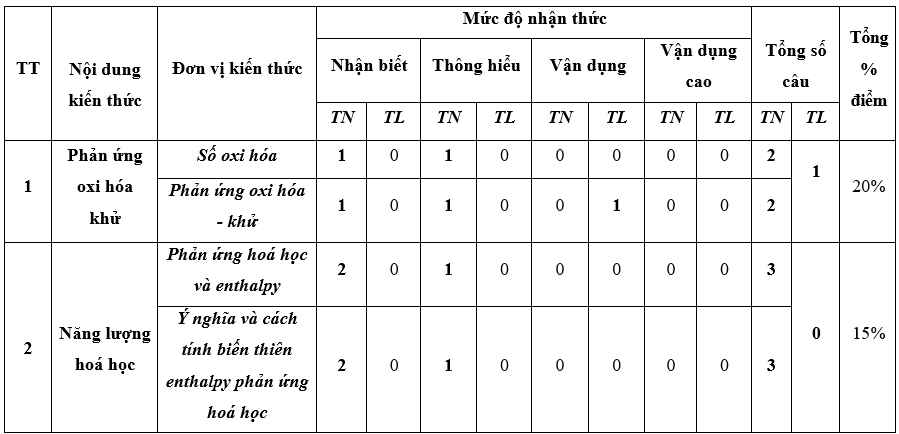
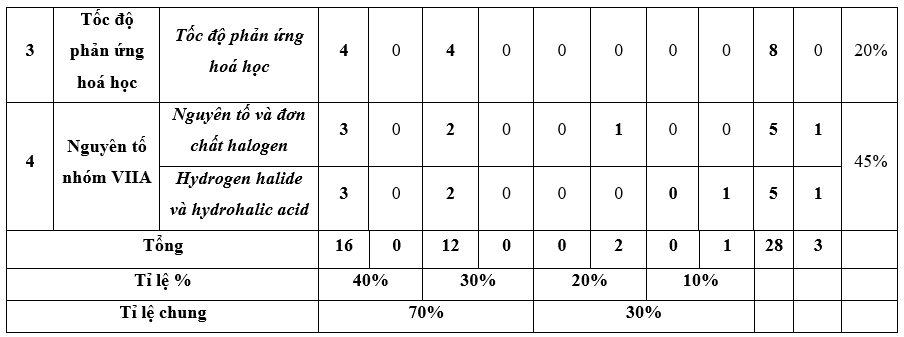
I. Bảng đặc tả kĩ thuật đề kiểm tra cuối kì 2 - Hóa học 10 – Kết nối tri thức.
Lưu ý:
- Các câu hỏi ở cấp độ nhận biết và thông hiểu là các câu hỏi trắc nghiệm khách quan 4 lựa chọn, trong đó có duy nhất 1 lựa chọn đúng.
- Các câu hỏi ở cấp độ vận dụng và vận dụng cao là các câu hỏi tự luận.
- Số điểm tính cho 1 câu trắc nghiệm là 0,25 điểm/câu; số điểm của câu tự luận được quy định trong hướng dẫn chấm nhưng phải tương ứng với tỉ lệ điểm được quy định trong ma trận.
II. Ma trận đề kiểm tra cuối kì 2 - Hóa học 10 – Kết nối tri thức
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 2 - Kết nối tri thức
năm 2025
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 2)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của Fe trong hợp chất Fe2O3 là
A. +2. B. +3.
C. -2. D. -3.
Câu 2: Hợp chất trong đó nitrogen có số oxi hoá -3 là
A. N2O. B. KNO3.
C. N2O3. D. NH4Cl.
Câu 3: Quá trình Ostwald dùng để sản xuất nitric acid từ ammonia được đề xuất vào năm 1902. Ở giai đoạn đầu của quá trình, ammonia bị oxi hoá bởi oxygen ở nhiệt độ cao khi có chất xúc tác:
4NH3 + 5O2 4NO + 6H2O
Chất bị oxi hoá trong quá trình trên là
A. NH3. B. O2.
C. NO. D. H2O.
Câu 4: Trong phản ứng oxi hoá – khử, chất khử là chất
A. nhận electron.
B. nhường proton.
C. nhường electron.
D. nhận neutron.
Câu 5: Phản ứng nào sau đây là phản ứng thu nhiệt?
A. Phản ứng đốt cháy than trong không khí.
B. Phản ứng tạo gỉ sắt.
C. Phản ứng oxi hóa glucose trong cơ thể.
D. Phản ứng trong lò nung clinker xi măng.
Câu 6: Phản ứng đốt cháy hoàn toàn 1 mol carbon graphite trong khí oxygen dư (ở điều kiện chuẩn) tạo ra 1 mol CO2, nhiệt lượng toả ra là 393,5 kJ. Nhiệt tạo thành chuẩn của CO2(g) là
A. + 393,5 kJ/ mol.
B. –393,5 kJ/ mol.
C. +196,75 kJ/ mol.
D. –196,75 kJ/ mol.
Câu 7: Enthalpy tạo thành chuẩn của một đơn chất bền là
A. biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với hydrogen.
B. là biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với oxygen.
C. bằng 0.
D. được xác định từ nhiệt độ nóng chảy của nguyên tố đó.
Câu 8: Cho phương trình nhiệt hóa học của phản ứng:
Nhận xét nào sau đây là đúng?
A. Phản ứng tỏa nhiệt mạnh.
B. Phản ứng xảy ra thuận lợi ở điều kiện thường.
C. Phản ứng xảy ra dưới điều kiện nhiệt độ thấp.
D. Phản ứng thu nhiệt.
Câu 9: Cho phản ứng sau: CaCO3(s) → CaO(s) + CO2(g)
Biến thiên enthalpy chuẩn của phản ứng được tính theo công thức là
Câu 10: Cho phản ứng tạo thành propene từ propyne:
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C – H |
C – C |
C = C |
C ≡ C |
H - H |
|
Eb (kJ/mol) |
413 |
347 |
614 |
839 |
432 |
Biến thiên enthalpy chuẩn của phản ứng là
A. -169 kJ.
B. +169 kJ.
C. -196 kJ.
D. +196 kJ.
Câu 11: Sự thay đổi lượng chất trong khoảng thời gian vô cùng ngắn được gọi là
A. tốc độ phản ứng hoá học.
B. tốc độ trung bình của phản ứng.
C. tốc độ tức thời của phản ứng.
D. vận tốc trung bình của phản ứng.
Câu 12: Cho phương trình phản ứng tổng quát sau: 2A + B → C.
Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức:.
Hằng số tốc độ k phụ thuộc vào yếu tố nào sau đây?
A. Nồng độ của chất.
B. Nồng độ của chất B.
C. Nhiệt độ của phản ứng.
D. Thời gian xảy ra phản ứng.
Câu 13: Cho bột Fe vào dung dịch HCl loãng. Sau đó đun nóng hỗn hợp này. Phát biểu nào sau đây không đúng?
A. Khí H2 thoát ra nhanh hơn.
B. Bột Fe tan nhanh hơn.
C. Lượng muối thu được nhiều hơn.
D. Nồng độ HCl giảm nhanh hơn.
Câu 14: Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Trộn đều bột potassium chlorate và xúc tác.
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu khí oxygen.
(4) Nghiền nhỏ potassium chlorate.
Số biện pháp dùng để tăng tốc độ phản ứng là
A. 2. B. 3.
C. 4. D. 5.
Câu 15: Hydrogen peroxide phân hủy theo phản ứng sau: 2H2O2 → 2H2O + O2.
Tại thời điểm ban đầu, thể tích khí oxygen là 0 cm3, sau thời gian 15 phút thể tích khí oxygen là 16 cm3. Tốc độ trung bình của phản ứng trong 15 phút đầu tiên là
A. 1,067 M/ s.
B. 1,067 M/ phút.
C. 1,067 cm3/ s.
D. 1,067 cm3/ phút.
Câu 16: Ở 35oC, phản ứng có tốc độ là 0,036 mol/ (L.h); ở 45oC, phản ứng có tốc độ là 0,09 mol/ (L.h). Hệ số nhiệt độ γ của phản ứng là
A. 1,5. B. 2.
C. 2,5. D. 3.
Câu 17: Cho phản ứng đơn giản sau (xảy ra trong bình kín):
2NO(g) + O2(g) → 2NO2(g)
Ở nhiệt độ không đổi, nồng độ NO tăng hai lần, nồng độ O2 không đổi thì
A. tốc độ phản ứng không thay đổi.
B. tốc độ phản ứng tăng 2 lần.
C. tốc độ phản ứng tăng 4 lần.
D. tốc độ phản ứng giảm 2 lần.
Câu 18: Nhận xét nào sau đây là sai?
A. Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng tăng.
B. Với mọi phản ứng, khi tăng áp suất, tốc độ phản ứng tăng.
C. Chất xúc tác làm tăng tốc độ phản ứng.
D. Đối với phản ứng có sự tham gia của chất khí, khi áp suất tăng, tốc độ phản ứng tăng.
Câu 19: Trong bảng tuần hoàn các nguyên tố hóa học, các nguyên tố halogen thuộc nhóm
A. IA. B. IIA.
C. VIIA. D. VIIIA.
Câu 20: Halogen nào được dùng trong sản xuất nhựa Teflon?
A. Chlorine.
B. Iodine.
C. Fluorine.
D. Bromine.
Câu 21: Trong phản ứng hóa học sau: SO2 + Br2 + 2H2O → 2HBr + H2SO4. Bromine đóng vai trò
A. chất khử.
B. vừa là chất oxi hóa, vừa là chất khử.
C. chất oxi hóa.
D. không là chất oxi hóa, không là chất khử.
Câu 22: Cho các phản ứng hóa học sau, phản ứng nào chứng minh Cl2 có tính oxi hoá mạnh hơn Br2?
A. Br2 + 2NaCl → 2NaBr + Cl2.
B. Cl2 + 2NaOH → NaCl + NaClO + H2O.
C. Br2 + 2NaOH → NaBr + NaBrO + H2O.
D. Cl2 + 2NaBr → 2NaCl + Br2.
Câu 23: Phương trình hóa học nào sau đây viết sai?
A. Br2 + Cu → CuBr2.
B. 2HCl + Na2CO3 → 2NaCl + CO2 + H2O.
C. NaBr + AgNO3 → AgBr + NaNO3.
D. Cl2 + Fe → FeCl2.
Câu 24: Nguyên nhân dẫn tới nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen tăng từ fluorine đến iodine là do từ fluorine đến iodine,
A. khối lượng phân tử và tương tác van der Walls đều tăng.
B. tính phi kim giảm và tương tác van der Walls tăng.
C. khối lượng phân tử tăng và tương tác van der Walls giảm.
D. độ âm điện và tương tác van der Walls tăng giảm.
Câu 25: Phát biểu nào sau đây không đúng?
A. Trong các hợp chất, ngoài số oxi hoá –1, fluorine còn có các số oxi hoá +1, +3, +5, +7.
B. Muối AgI không tan trong nước, muối AgF tan trong nước.
C. Fluorine có tính oxi hóa mạnh hơn chlorine.
D. Dung dịch HF hòa tan được SiO2.
Câu 26: Cho lượng dư dung dịch AgNO3 tác dụng với 100 ml dung dịch hỗn hợp NaF 0,05M và NaCl 0,1M. Khối lượng kết tủa thu được là
A. 1,345 gam.
B. 3,345 gam.
C. 2,875 gam.
D. 1,435 gam.
Câu 27: Cho 10 gam CaCO3 tác dụng hết với dung dịch HCl dư, thu được V lít khí CO2 (đkc). Giá trị của V là
A. 2,24 L. B. 2,479 L.
C. 3,36 L. D. 3,719 L.
Câu 28: Nhỏ vài giọt dung dịch nào sau đây vào dung dịch AgNO3 thu được kết tủa màu vàng nhạt.
A. HCl. B. NaBr.
C. NaCl. D. HF.
Phần II: Tự luận
Câu 1 (1 điểm): Hãy viết phương trình hóa học để chứng minh chlorine có tính oxi hóa mạnh hơn bromine.
Câu 2 (1 điểm): Cho sodium iodide (NaI) tác dụng với potassium permanganate (KMnO4) trong dung dịch sulfuric acid (H2SO4) thu được 3,02 gam manganese(II) sulfate (MnSO4), I2; K2SO4 và Na2SO4.
a) Viết phương trình hoá học xảy ra, chỉ rõ chất khử, chất oxi hoá, quá trình khử, quá trình oxi hoá.
b) Tính khối lượng I2 tạo thành.
Câu 3 (1 điểm): Bằng phương pháp hóa học, hãy phân biệt các dung dịch sau chứa trong các lọ riêng biệt mất nhãn: HCl, NaCl, NaI.
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 2 - Kết nối tri thức
năm 2025
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 3)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Quy tắc xác định số oxi hoá nào sau đây là không đúng?
A. Trong hợp chất, tổng số oxi hoá của các nguyên tử trong phân tử bằng 0.
B. Trong ion đơn nguyên tử, số oxi hoá của nguyên tử bằng điện tích ion.
C. Trong hợp chất, số oxi hoá của kim loại kiềm thổ là +1.
D. Thông thường số oxi hoá của hydrogen trong hợp chất là +1.
Câu 2: Số oxi hoá của phosphorus trong hợp chất P2O5 là
A. – 5. B. +5.
C. – 3. D. +3.
Câu 3: Trong các phản ứng hoá học sau, phản ứng oxi hoá – khử là
A. HCl + KOH → KCl + H2O.
B. H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O.
C. Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O.
D. FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O.
Câu 4: Cho phản ứng khử Fe2O3 bằng CO để sản xuất gang và thép như sau:
Fe2O3 + 3CO 2Fe + 3CO2
Trong phản ứng này, chất khử là
A. Fe2O3. B. CO.
C. Fe. D. CO2.
Câu 5: Cho các phản ứng sau:
(1) Phản ứng nung vôi: CaCO3(s) → CaO(s) + CO2(g).
(2) Phản ứng trung hoà: KOH(aq) + HCl(aq) → KCl(aq) + H2O(l).
Nhận xét đúng là
A. cả hai phản ứng đều toả nhiệt.
B. cả hai phản ứng đều thu nhiệt.
C. phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
D. phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
Câu 6: Cho phương trình nhiệt hoá học sau:
2H2(g) + O2(g) → 2H2O(l)
Nhiệt tạo thành của H2O(l) ở điều kiện chuẩn là
A. – 571,6 kJ/ mol.
B. 571,6 kJ/ mol.
C. – 285,8 kJ/ mol.
D. 285,8 kJ/ mol.
Câu 7: Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) 2NO(g) = +180kJ
Kết luận nào sau đây đúng?
A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
B. Phản ứng tỏa nhiệt.
C. Phản ứng xảy ra thuận lợi ở điều kiện thường.
D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
Câu 8: Cho phương trình nhiệt hóa học đốt cháy acetylene (C2H2):
2C2H2(g) + 5O2(g) → 4CO2(g) + 2H2O(l)
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) lần lượt là -393,5 kJ/mol và -285,8 kJ/mol. Nhiệt tạo thành chuẩn của acetylene (C2H2) là
A. + 259 kJ/ mol.
B. – 259 kJ/ mol.
C. + 227,4 kJ/ mol.
D. – 227,4 kJ/ mol.
Câu 9: Phản ứng tổng hợp ammonia:
N2(g) + 3H2(g) → 2NH3(g)
Biết năng lượng liên kết (kJ/mol) của N ≡ N và H – H lần lượt là 946 và 436. Năng lượng liên kết của trong ammonia là
A. 391 kJ/mol.
B. 361 kJ/mol.
C. 245 kJ/mol.
D. 490 kJ/mol.
Câu 10: Cho các phát biểu sau:
(a) Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(b) Biến thiên enthalpy càng lớn thì nhiệt lượng toả ra của phản ứng càng nhiều.
(c) Nhiệt tạo thành chuẩn là nhiệt tạo thành ở điều kiện chuẩn.
(d) Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng không.
Số phát biểu đúng là
A. 1. B. 2.
C. 3. D. 4.
Câu 11: Yếu tố nào sau đây không làm ảnh hưởng đến tốc độ phản ứng?
A. Nồng độ.
B. Nhiệt độ.
C. Áp suất.
D. Khối lượng chất rắn.
Câu 12: Thực hiện 2 thí nghiệm theo hình vẽ sau.
Ở thí nghiệm nào xuất hiện kết tủa trước?
A. Thí nghiệm 1 có kết tủa xuất hiện trước.
B. Thí nghiệm 2 có kết tủa xuất hiện trước.
C. Không xác định được.
D. Không có kết tủa xuất hiện.
Câu 13: Cho phản ứng đơn giản xảy ra trong bình kín: 3H2(g) + N2(g) ⟶ 2NH3(g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 không đổi và nồng độ N2 tăng 2 lần?
A. Tăng 2 lần.
B. Tăng 4 lần.
C. Tăng 8 lần.
D. Tăng 6 lần.
Câu 14: Cho phản ứng hóa học sau: Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g).
Sau 40 giây, nồng độ của dung dịch HCl giảm tử 0,6 M về còn 0,4 M. Tốc độ trung bình của phản ứng theo HCl trong 40 giây là
A. 5 × 10-3 (M/s).
B. 5 × 103 (M/s).
C. 2,5 × 10-3 (M/s).
D. 2,5 × 103 (M/s).
Câu 15: Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
A. Nhiệt độ.
B. Chất xúc tác.
C. Nồng độ
D. Áp suất.
Câu 16: Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng lên 2 lần. Để tốc độ phản ứng đó (đang tiến hành ở 20oC) tăng lên 32 lần thì cần thực hiện phản ứng ở nhiệt độ bao nhiêu?
A. 40oC. B. 50oC.
C. 60oC. D. 70oC.
Câu 17: Chất xúc tác là chất
A. làm tăng tốc độ phản ứng và bị mất đi sau phản ứng.
B. làm giảm tốc độ phản ứng và không bị mất đi sau phản ứng.
C. làm giảm tốc độ phản ứng và bị mất đi sau phản ứng.
D. làm tăng tốc độ phản ứng và không bị mất đi sau phản ứng.
Câu 18: Tốc độ của một phản ứng hóa học lớn nhất khoảng thời điểm nào?
A. Bắt đầu phản ứng.
B. Khi phản ứng được một nửa lượng chất so với ban đầu.
C. Gần cuối phản ứng.
D. Không xác định được.
Câu 19: Nguyên tố nào sau đây không thuộc nhóm halogen?
A. Fluorine.
B. Chlorine.
C. Chromium.
D. Bromine.
Câu 20: Cấu hình electron lớp ngoài cùng của các halogen có dạng
A. ns2np1.
B. ns2np3.
C. ns2np5.
D. ns2np7.
Câu 21: Phương trình hoá học nào sau đây không đúng?
A. Fe + Cl2 FeCl2.
B. H2 + F2 → 2HF.
C. Cl2 + H2O ⇄ HCl + HClO.
D. Br2 + 2NaI → 2NaBr + I2.
Câu 22: Cho 1,2395 lít halogen X2 (ở điều kiện chuẩn) tác dụng vừa đủ với kim loại đồng (copper) thu được 11,2 gam muối CuX2. Nguyên tố halogen là
A. fluorine.
B. chlorine.
C. bromine.
D. iodine.
Câu 23: Trong các đơn chất: F2, Cl2, Br2, I2, chất có nhiệt độ nóng chảy và nhiệt độ sôi cao nhất là
A. F2. B. Cl2.
C. Br2. D. I2.
Câu 24: Phản ứng giữa cặp chất nào sau đây không xảy ra?
A. KI và Br2.
B. AgNO3 và HCl.
C. AgNO3 và NaF.
D. KI và Cl2.
Câu 25: Hydrohalic acid nào sau đây không được bảo quản trong lọ thủy tinh?
A. HCl. B. HF.
C. HBr. D. HI.
Câu 26: Hai chất nào sau đây được cho vào muối ăn để bổ sung nguyên tố iodine, phòng ngừa bệnh bướu cổ ở người?
A. I2, HI.
B. HI, HIO3.
C. KI, KIO3.
D. I2, AlI3.
Câu 27: Để trung hòa 200 ml dung dịch NaOH 1M thì thể tích dung dịch HCl 0,5M cần dùng là
A. 0,5 lít.
B. 0,4 lít.
C. 0,3 lít.
D. 0,6 lít.
Câu 28: Chọn phát biểu đúng?
A. Các hydrogen halide không tan trong nước.
B. Ion F- và Cl- bị oxi hóa bởi dung dịch H2SO4 đặc.
C. Các hydrohalic acid làm quỳ tím hóa đỏ.
D. Tính acid của các hydrohalic acid giảm dần từ HF đến HI.
Phần II: Tự luận (3 điểm)
Câu 1 (2 điểm): Trong phòng thí nghiệm, chlorine có thể được điều chế bằng cách cho KMnO4 rắn tác dụng với HCl đặc.
a) Viết phương trình hoá học xảy ra và chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) Giả sử lượng chlorine sinh ra phản ứng vừa đủ với 200 mL dung dịch chứa NaI 0,1M. Tính khối lượng KMnO4 đã phản ứng để thu được lượng chlorine trên.
Câu 2 (1 điểm): X và Y là hai nguyên tố halogen thuộc hai chu kì liên tiếp trong bảng hệ thống tuần hoàn. Hỗn hợp A có chứa 2 muối của X và Y với sodium.
a) Để kết tủa hoàn toàn 2,2 gam hỗn hợp A, phải dùng 150 mL dung dịch AgNO3 0,2M. Tính khối lượng kết tủa thu được.
b) Xác định hai nguyên tố X, Y.
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 2 - Kết nối tri thức
năm 2025
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 4)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của nitrogen trong hợp chất NH3 là
A. +1. B. -1.
C. +3. D. -3.
Câu 2: Trong trường hợp nào sau đây, sulfur có số oxi hoá là +4?
A. H2S. B. S.
C. Na2SO4. D.
Câu 3: Chất bị khử là
A. chất nhường electron.
B. chất có số oxi hoá tăng lên sau phản ứng.
C. chất nhận electron.
D. chất có số oxi hoá không thay đổi sau phản ứng.
Câu 4: Trong phản ứng hoá học: Cl2 + 2KBr → 2KCl + Br2. Chất oxi hoá là
A. Cl2. B. KBr.
C. KCl. D. Br2.
Câu 5: Phản ứng toả nhiệt là
A. phản ứng giải phóng năng lượng dưới dạng nhiệt.
B. phản ứng hấp thụ năng lượng dưới dạng nhiệt.
C. phản ứng làm nhiệt độ môi trường xung quanh lạnh đi.
D. phản ứng không làm thay đổi nhiệt độ môi trường xung quanh.
Câu 6: Cho hai phương trình nhiệt hoá học sau:
(1) C(s) + H2O(g) → CO(g) + H2(g)
(2) CuSO4(aq) + Zn(s) → ZnSO4(aq) + Cu(s)
Nhận xét nào sau đây là đúng?
A. Cả hai phản ứng đều toả nhiệt.
B. Cả hai phản ứng đều thu nhiệt.
C. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
D. Phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
Câu 7: Cho phản ứng nhiệt học sau:
4Na(s) + O2(g) ⟶ 2Na2O(s) = − 836,0 kJ.
Nhiệt tạo thành chuẩn của Na2O(s) là
A. – 836 kJ/ mol.
B. + 836 kJ/ mol.
C. – 418 kJ/ mol.
D. + 418 kJ/ mol.
Câu 8: Cho phản ứng nhiệt nhôm sau: 2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
Biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm là
Biết:
|
Chất |
Al (s) |
Fe2O3 (s) |
Fe (s) |
Al2O3 (s) |
|
(kJmol-1) |
0 |
-825,5 |
0 |
-1676,0 |
A. +850,5 kJ.
B. - 850,5 kJ.
C. -839 kJ.
D. +839 kJ.
Câu 9: Cho phản ứng sau: H2(g) + Cl2(g) → 2HCl(g). Biến thiên enthalpy chuẩn của phản ứng là (Cho: Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/ mol)
A. +158 kJ.
B. -158 kJ.
C. +185 kJ.
D. -185 kJ.
Câu 10: Cho các phát biểu sau:
(1) Phản ứng trung hoà acid – base là phản ứng thu nhiệt.
(2) Dấu của biến thiên enthalpy cho biết phản ứng là toả nhiệt hay thu nhiệt.
(3) Biến thiên enthalpy càng âm, phản ứng toả ra càng nhiều nhiệt.
Phát biểu đúng là
A. (1), (2), (3).
B. (2), (3).
C. (2).
D. (3).
Câu 11: Tốc độ phản ứng là
A. đại lượng đặc trưng cho sự tăng nồng độ của chất phản ứng.
B. đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
C. đại lượng đặc trưng cho sự thay đổi khối lượng của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
D. đại lượng đặc trưng cho sự thay đổi nhiệt độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
Câu 12: Thông thường đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng
A. giảm.
B. không đổi.
C. tăng.
D. không xác định được.
Câu 13: Tốc độ phản ứng tính theo định luật tác dụng khối lượng là
A. tốc độ phản ứng trung bình.
B. tốc độ tức thời của phản ứng tại một thời điểm.
C. tốc độ phản ứng trung bình tại một thời điểm.
D. tốc độ phản ứng tức thời trong một khoảng thời gian.
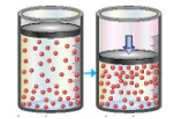
Câu 14: Hình ảnh dưới đây minh họa ảnh hưởng của yếu tố nào tới tốc độ phản ứng:
A. Diện tích bề mặt tiếp xúc.
B. Nhiệt độ.
C. Áp suất.
D. Chất xúc tác.
Câu 15: Cho phản ứng hóa học sau: 2SO2(g) + O2(g) → 2SO3(g).
Trong khoảng thời gian 420 giây, nồng độ SO2 giảm từ 0,027 M xuống 0,0194 M. Tốc độ trung bình của phản ứng tính theo nồng độ SO2 trong khoảng thời gian trên là
A. 9 × 10-2 M/s.
B. 9 × 10-3 M/s.
C. 9 × 10-5 M/s.
D. 9 × 10-6 M/s.
Câu 16: Một phản ứng có hệ số nhiệt độ Van’t Hoff bằng 3. Ở 25°C, tốc độ của phản ứng này bằng 0,2 M s-1. Tốc độ của phản ứng ở 45°C là
A. 0,6 M s-1.
B. 1,2 M s-1.
C. 1,8 M s-1.
D. 2,4 M s-1.
Câu 17: Cho phản ứng hóa học sau:
Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
Yếu tố nào sau đây không làm ảnh hưởng đến tốc độ phản ứng?
A. Diện tích bề mặt iron (Fe).
B. Nồng độ dung dịch hydrochloric acid.
C. Thể tích dung dịch hydrochloric acid.
D. Nhiệt độ của dung dịch hydrochloric acid.
Câu 18: Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 4 lần. Tốc độ phản ứng sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70oC xuống 40oC?
A. 8. B. 16.
C. 32. D. 64.
Câu 19: Nguyên tố halogen nào sau đây là nguyên tố phóng xạ?
A. Fluorine.
B. Chlorine.
C. Bromine.
D. Astatine.
Câu 20: Halogen nào sau đây là chất lỏng ở điều kiện thường?
A. Fluorine.
B. Chlorine.
C. Bromine.
D. Iodine.
Câu 21: Đặc điểm chung của các nguyên tố nhóm halogen là
A. chất khí ở điều kiện thường.
B. có tính oxi hóa mạnh.
C. vừa có tính oxi hóa vừa có tính khử
D. phản ứng mãnh liệt với nước.
Câu 22: Thể tích khí Cl2 (ở điều kiện chuẩn) vừa đủ để tác dụng hết với dung dịch KI thu được 2,54 gam I2 là
A. 247,9 ml.
B. 495,8 ml.
C. 371,85 ml.
D. 112 ml.
Câu 23: Phản ứng hoá học nào sau đây là không đúng?
A. H2 + Br2 2HBr.
B. Cl2 + H2O ⇄ HCl + HClO.
C. 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O.
D. I2 + H2O ⇄ HI + HIO.
Câu 24: Hóa chất dùng để phân biệt các dung dịch: NaF, NaCl, NaBr, NaI là
A. dung dịch HCl.
B. quỳ tím.
C. dung dịch AgNO3.
D. dung dịch BaCl2.
Câu 25: Phản ứng giữa chất nào sau đây với dung dịch H2SO4 đặc, nóng không phải là phản ứng oxi hóa – khử?
A. KBr.
B. KI.
C. NaCl.
D. NaBr.
Câu 26: Hòa tan 1,3 gam Zinc (Zn) trong dung dịch HCl dư. Sau phản ứng thu được thể tích khí H2 ở điều kiện chuẩn là
A. 0,2479 lít.
B. 0,4958 lít.
C. 0,5678 lít.
D. 1,487 lít.
Câu 27: Cho dung dịch A chứa 1,17g NaCl tác dụng với dung dịch B chứa 5,1g AgNO3 thu được m gam kết tủa. Giá trị của m là
A. 28,70 gam.
B. 43,05 gam.
C. 2,87 gam.
D. 4,31 gam.
Câu 28: Liên kết trong hợp chất hydrogen halide là
A. liên kết cộng hóa trị có cực.
B. liên kết cho – nhận.
C. liên kết ion.
D. liên kết cộng hóa trị không cực.
Phần II: Tự luận (3 điểm)
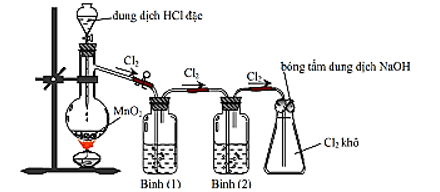
Câu 1 (2 điểm): Trong phòng thí nghiệm, khí chlorine được điều chế theo sơ đồ sau:
a) Viết phương trình hoá học của phản ứng xảy ra trong bình cầu, chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) Biết bình (1) đựng dung dịch NaCl bão hoà; bình (2) đựng dung dịch H2SO4 đặc. Giải thích vai trò của bình (1); bình (2) và nút bông tẩm dung dịch NaOH ở bình tam giác.
c) Giả sử lượng chlorine sinh ra phản ứng vừa đủ với 200 mL dung dịch chứa NaI 0,1M. Tính khối lượng MnO2 đã phản ứng để thu được lượng chlorine trên.
Câu 2 (1 điểm): Cho 1,03 gam muối sodium halide (A) tác dụng với dung dịch AgNO3 dư thì thu được một kết tủa. Kết tủa sau khi phân huỷ hoàn toàn cho 1,08 gam silver (bạc). Xác định tên muối (A).
Xem thêm bộ đề thi Hóa học 10 Kết nối tri thức năm 2025 hay khác:
Đề thi Giữa kì 1 Hóa học 10 Kết nối tri thức có đáp án (3 đề)
Đề thi Học kì 1 Hóa học 10 Kết nối tri thức có đáp án (12 đề)
Đề thi Giữa kì 2 Hóa học 10 Kết nối tri thức có đáp án (3 đề)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 10 (các môn học)
- Giáo án điện tử lớp 10 (các môn học)
- Giáo án Ngữ văn 10
- Giáo án Toán 10
- Giáo án Tiếng Anh 10
- Giáo án Vật Lí 10
- Giáo án Hóa học 10
- Giáo án Sinh học 10
- Giáo án Lịch Sử 10
- Giáo án Địa Lí 10
- Giáo án Kinh tế Pháp luật 10
- Giáo án Tin học 10
- Giáo án Công nghệ 10
- Giáo án Giáo dục quốc phòng 10
- Giáo án Hoạt động trải nghiệm 10
- Đề thi lớp 10 (các môn học)
- Đề thi Ngữ Văn 10 (có đáp án)
- Chuyên đề Tiếng Việt lớp 10
- Đề cương ôn tập Văn 10
- Đề thi Toán 10 (có đáp án)
- Đề thi cương ôn tập Toán 10
- Đề thi Toán 10 cấu trúc mới (có đáp án)
- Đề thi Tiếng Anh 10 (có đáp án)
- Đề thi Vật Lí 10 (có đáp án)
- Đề thi Hóa học 10 (có đáp án)
- Đề thi Sinh học 10 (có đáp án)
- Đề thi Lịch Sử 10 (có đáp án)
- Đề thi Địa Lí 10 (có đáp án)
- Đề thi Kinh tế & Pháp luật 10 (có đáp án)
- Đề thi Tin học 10 (có đáp án)
- Đề thi Công nghệ 10 (có đáp án)
- Đề thi Giáo dục quốc phòng 10 (có đáp án)

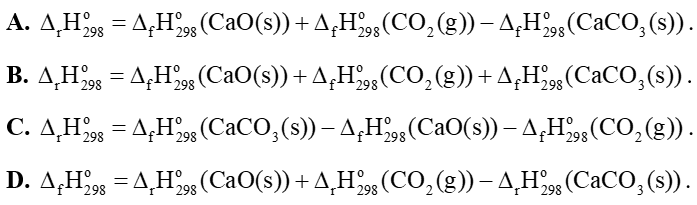




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

