Top 100 Đề thi Hóa học 10 Cánh diều (có đáp án)
Bộ 100 Đề thi Hóa học 10 Cánh diều năm 2026 theo cấu trúc mới nhất đầy đủ Học kì 1 và Học kì 2 gồm đề thi giữa kì, đề thi học kì có đáp án chi tiết, cực sát đề thi chính thức giúp học sinh ôn luyện & đạt điểm cao trong các bài thi Hóa học 10.
Đề thi Hóa học 10 Cánh diều năm 2025 (mới nhất)
Xem thử Đề thi GK1 Hóa 10 Xem thử Đề thi CK1 Hóa 10 Xem thử Đề thi GK2 Hóa 10 Xem thử Đề thi CK2 Hóa 10
Chỉ từ 150k mua trọn bộ đề thi Hóa học 10 Cánh diều cả năm theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
- Đề thi Hóa 10 Giữa kì 1 Cánh diều
- Đề thi Hóa 10 Học kì 1 Cánh diều
- Đề thi Hóa 10 Giữa kì 2 Cánh diều
- Đề thi Hóa 10 Học kì 2 Cánh diều
Đề cương Hóa học 10 Cánh diều
Đề kiểm tra Hóa học 10 Cánh diều (theo Chủ đề)
Xem thêm đề thi Hóa 10 cả ba sách:
Top 20 Đề thi Hóa học 10 Giữa kì 1 năm 2026 có đáp án (cả ba sách)
Top 30 Đề thi Hóa học 10 Học kì 1 năm 2026 có đáp án (cả ba sách)
Top 10 Đề thi Hóa học 10 Giữa kì 2 năm 2026 có đáp án (cả ba sách)
Top 10 Đề thi Hóa học 10 Học kì 2 năm 2026 có đáp án (cả ba sách)
Xem thử Đề thi GK1 Hóa 10 Xem thử Đề thi CK1 Hóa 10 Xem thử Đề thi GK2 Hóa 10 Xem thử Đề thi CK2 Hóa 10
Sở Giáo dục và Đào tạo ...
Đề thi Giữa kì 1 - Cánh Diều
Năm 2025
Môn: Hóa học 10
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nội dung nào dưới đây là đối tượng nghiên cứu của hóa học?
A. Sự lớn lên và sinh sản của tế bào.
B. Tốc độ của ánh sáng trong chân không.
C. Ứng dụng của chất.
D. Sự hình thành hệ Mặt Trời.
Câu 2: Phương pháp nghiên cứu lí thuyết là
A. sử dụng những định luật, nguyên lí, quy tắc, cơ chế, mô hình … để tiếp tục làm rõ những vấn đề của lí thuyết hóa học.
B. nghiên cứu những vấn đề dựa trên kết quả thí nghiệm, khảo sát, thu thập số liệu, phân tích, định lượng…
C. giải quyết các vấn đề hóa học được ứng dụng trong các lĩnh vực khác nhau.
D. nghiên cứu thành phần, cấu trúc, tính chất và sự biến đổi của chất.
Câu 3: Trong các chất: magnesium, nitrogen, oxygen, sodium chloride. Hợp chất là
A.magnesium.
B.nitrogen.
C.oxygen.
D.sodium chloride.
Câu 4: Thứ tự các bước trong phương pháp nghiên cứu hóa học là
A.xác định vấn đề nghiên cứu; nêu giả thuyết khoa học; thực hiện nghiên cứu; viết báo cáo: thảo luận kết quả và kết luận vấn đề.
B.nêu giả thuyết khoa học; xác định vấn đề nghiên cứu; thực hiện nghiên cứu; viết báo cáo: thảo luận kết quả và kết luận vấn đề.
C.xác định vấn đề nghiên cứu; nêu giả thuyết khoa học; viết báo cáo: thảo luận kết quả và kết luận vấn đề; thực hiện nghiên cứu.
D.nêu giả thuyết khoa học; xác định vấn đề nghiên cứu; viết báo cáo: thảo luận kết quả và kết luận vấn đề; thực hiện nghiên cứu.
Câu 5: Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron và neutron.
B. proton và neutron.
C. neutron và electron.
D. electron, proton và neutron.
Câu 6: Phát biểu nào sai khi nói về neutron?
A. Tồn tại trong hạt nhân nguyên tử.
B. Có khối lượng bằng khối lượng proton.
C. Có khối lượng lớn hơn khối lượng electron.
D. Không mang điện.
Câu 7: Nguyên tử aluminium có 13 proton và 14 neutron. Số hạt mang điện có trong nguyên tử này là
A. 13. B. 14. C. 27. D. 26.
Câu 8: Hạt electron có điện tích là
A. 1,602 × 10-19 C.
B. -1,602 × 10-19 C.
C. +1,602 × 10-19 C.
D. -1,602 × 1019 C.
Câu 9: Nguyên tử carbon có điện tích hạt nhân là +6. Số electron của nguyên tử này là
A. 6. B. 12. C. 18. D. 24.
Câu 10: Nếu xem nguyên tử như một quả cầu, có bán kính khoảng 10-10 m thì bán kính hạt nhân nguyên tử vào khoảng
A. 10-8 m.
B. 10-14 m.
C. 10-12 m.
D. 104 m.
Câu 11: Đơn vị khối lượng nguyên tử kí hiệu là
A. meV.
B. amu.
C. nanometre.
D. angstrom.
Câu 12: Số đơn vị điện tích hạt nhân nguyên tử (kí hiệu là Z) của một nguyên tố gọi là
A. số khối.
B. nguyên tử khối.
C. số hiệu nguyên tử.
D. số neutron.
Câu 13: Số hạt electron của nguyên tử có kí kiệu 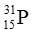
A. 31. B. 16. C. 15. D. 30.
Câu 14: Cho các nguyên tử sau:
A. A và B.
B. B và C
C. C và D.
D. A và D.
Câu 15: Từ hai đồng vị hydrogen (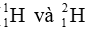
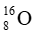
A. 1. B. 2. C. 3. D. 4.
Câu 16: Nguyên tử carbon có hai đồng vị bền: 
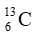
A. 12,50.
B. 12,02.
C. 12,01.
D. 12,06.
Câu 17: Orbital s có dạng
A. hình tròn.
B. hình số 8 nổi.
C. hình cầu.
D. hình bầu dục.
Câu 18: Lớp M có số electron tối đa bằng
A. 3. B. 4. C. 9. D. 18.
Câu 19: Sự phân bố electron theo ô orbital nào dưới đây là đúng?
Câu 20: Cấu hình electron của nguyên tử Cl (Z = 17) là
A. 1s22s22p63s23p6.
B. 1s22s22p63s23p5.
C. 1s22s22p63s23p3.
D. 1s22s22p63s23p4.
Câu 21: Nguyên tố X có số hiệu nguyên tử bằng 14. Electron cuối cùng của nguyên tử nguyên tố X điền vào lớp, phân lớp nào sau đây?
A. K, s.
B. L, p.
C. M, p.
D. N, d.
Câu 22: Phân lớp chứa đủ số electron tối đa được gọi là
A. phân lớp bão hòa.
B. phân lớp bán bão hòa.
C. phân lớp nửa bão hòa.
D. phân lớp chưa bão hòa.
Câu 23: Ô nguyên tố trong bảng tuần hoàn không cho biết thông tin nào sau đây?
A. Kí hiệu nguyên tố.
B. Tên nguyên tố.
C.Số hiệu nguyên tử.
D. Số khối của hạt nhân.
Câu 24: Chu kì 4 của bảng tuần hoàn có số nguyên tố là
A. 2 nguyên tố.
B. 18 nguyên tố.
C. 32 nguyên tố.
D. 8 nguyên tố.
Câu 25: Nguyên tử X có cấu hình electron [Ne]3s23p1. Vị trí của X trong bảng hệ thống tuần hoàn là
A. số thứ tự 3, chu kì 3, nhóm IIIA.
B. số thứ tự 11, chu kì 3, nhóm IIIA.
C. số thứ tự 13, chu kì 2, nhóm IA.
D. số thứ tự 13, chu kì 3, nhóm IIIA.
Câu 26: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố X là 3s2. Số thứ tự nguyên tố X trong bảng tuần hoàn là
A. 12. B. 13. C. 11. D. 14.
Câu 27: Cho cấu hình electron các nguyên tố sau đây: Na: [Ne]3s1; Cr: [Ar]3d54s1;Br: [Ar]3d104s24p5; F: 1s22s22p5; Cu: [Ar]3d104s1. Số nguyên tố thuộc khối s trong các nguyên tố trên là
A. 0. B. 1. C. 2. D. 3.
Câu 28: Bảng tuần hoàn hiện nay có số cột, số nhóm A và số nhóm B lần lượt là
A. 18, 8, 8.
B. 18, 8, 10.
C. 18, 10, 8.
D. 16, 8, 8.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt.
a) Xác định thành phần các hạt cấu tạo nên nguyên tử X.
b) Viết kí hiệu nguyên tử X.
Câu 2 (1 điểm): Nguyên tử của nguyên tố A có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố B có một electron ở lớp ngoài cùng 4s. Nguyên tử A và B có số electron hơn kém nhau là 3.
a) Viết cấu hình electron nguyên tử A, B.
b) Biểu diễn cấu hình electron A, B theo ô orbital và cho biết số electron độc thân có trong mỗi nguyên tử này.
Câu 3 (1 điểm): Hai nguyên tố X và Y đứng kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn, có tổng số điện tích hạt nhân bằng 25. Biết ZX < ZY, hãy xác định vị trí của X, Y trong bảng tuần hoàn (có giải thích ngắn gọn cách xác định).
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 1 - Cánh diều
Năm 2025
Môn: Hóa học lớp 10
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Loại liên kết có trong phân tử nước là
A. liên kết ion.
B. liên kết cộng hóa trị.
C. liên kết kim loại.
D. liên kết van der Waals.
Câu 2: Phát biểu nào sau đây không đúng?
A. Proton mang điện tích dương, nằm trong hạt nhân, khối lượng gần bằng 1 amu.
B. Electron mang điện tích âm, nằm trong hạt nhân, khối lượng gần bằng 0 amu.
C. Neutron không mang điện, khối lượng gần bằng 1 amu.
D. Nguyên tử trung hòa điện, có kích thước lớn hơn nhiều so với hạt nhân, nhưng có khối lượng gần bằng khối lượng hạt nhân.
Câu 3: Nguyên tử T có 11 proton và 12 neutron. Kí hiệu nguyên tử của T là
A. 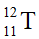
B. 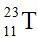
C. 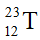
D. 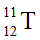
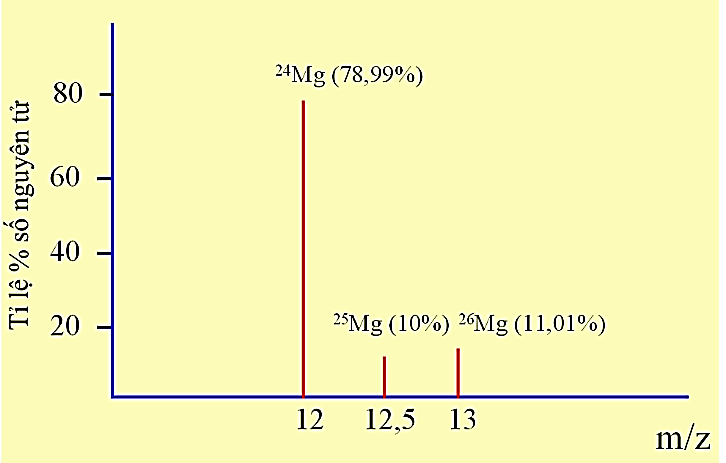
Câu 4: Tỉ lệ phần trăm số nguyên tử các đồng vị của magnesium được xác định theo phổ khối lượng như hình dưới đây (biết rằng điện tích z của các ion đồng vị của magnesium đều bằng +2):
Nguyên tử khối trung bình của magnesium là
A. 24,32.
B. 23,42.
C. 25,32.
D. 22,32.
Câu 5: Lớp electron thứ tư được gọi là
A. lớp K.
B. lớp M.
C. lớp L.
D. lớp N.
Câu 6: Số electron tối đa có trong một orbital là
A. 1. B. 2. C. 3. D. 4.
Câu 7: Cấu hình electron nào sau đây là của fluorine (Z = 9)
A. 1s22s22p3.
B. 1s22s22p4.
C. 1s22s32p4.
D. 1s22s22p5.
Câu 8: Phát biểu nào sau đây không đúng?
A. Lớp M có 9 phân lớp.
B. Lớp L có 4 orbital.
C. Phân lớp p có 3 orbital.
D. Năng lượng electron trên lớp K là thấp nhất.
Câu 9: Ô nguyên tố trong bảng tuần hoàn không cho biết thông tin nào sau đây?
A. Kí hiệu nguyên tố.
B. Tên nguyên tố.
C. Số hiệu nguyên tử.
D. Số khối của hạt nhân.
Câu 10: Nguyên tử nguyên tố X có cấu hình electron 1s22s22p63s23p3. X thuộc nhóm
A. IIIA.
B. IIIB.
C. VA.
D. VB.
Câu 11: Trong một chu kì, theo chiều từ trái sang phải, bán kính nguyên tử của các nguyên tố thuộc nhóm A
A. tăng dần.
B. giảm dần.
C. không thay đổi.
D. biến đổi không theo quy luật.
Câu 12: Xu hướng biến đổi độ âm điện của các nguyên tố trong bảng tuần hoàn tương tự như xu hướng biến đổi của yếu tố nào sau đây?
A. Tính kim loại.
B. Tính phi kim.
C. Bán kính nguyên tử.
D. Tính kim loại và bán kính nguyên tử.
Câu 13: Trong các chất dưới đây, chất nào có tính acid yếu nhất?
A. H2SO4.
B. HClO4.
C. H3PO4.
D. H2SiO3.
Câu 14: Nguyên tố X ở chu kì 3, nhóm IA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s²2s²2p6.
B. 1s²2s²2p3s²3p¹.
C. 1s²2s²2p3s³.
D. 1s²2s²2p63s1.
Câu 15: Nguyên tố X thuộc nhóm IVA trong bảng tuần hoàn. Trong oxide tương với hóa trị cao nhất của X có chứa 53,3 % oxygen về khối lượng. Nguyên tố X là
A. carbon.
B. silicon.
C. sulfur.
D. phosphorus.
Câu 16: X và Y thuộc cùng một nhóm A và ở hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số đơn vị điện tích hạt nhân của X và Y là 18 (biết ZX < ZY). Hai nguyên tố X; Y là
A. Be (Z = 4) và Si (Z = 14).
B. B (Z = 5) và Al (Z = 13).
C. N (Z = 7) và Na (Z = 11).
D. C (Z = 6) và Mg (Z = 12).
Câu 17: Để đạt quy tắc octet, nguyên tử của nguyên tố potassium (Z = 19) phải nhường đi
A. 2 electron.
B. 3 electron.
C. 1 electron.
D. 4 electron.
Câu 18: Nguyên tử trong phần tử nào dưới đây ngoại lệ với quy tắc octet?
A. H2O.
B. NH3.
C. HCl
D. BF3.
Câu 19: Khi nguyên tử nhường electron sẽ tạo thành
A. phân tử.
B. ion.
C. cation.
D. anion.
Câu 20: Tính chất nào sau đây là tính chất của hợp chất ion?
A. Hợp chất ion có nhiệt độ nóng chảy thấp.
B. Hợp chất ion có nhiệt độ nóng chảy cao.
C. Hợp chất ion dễ hoá lỏng.
D. Hợp chất ion có nhiệt độ sôi không xác định.
Câu 21: Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H (2,20); Na (0,93). Hợp chất nào sau đây là hợp chất ion?
A. NaF.
B. CO2.
C. CH4.
D. H2O.
Câu 22: Liên kết hóa học giữa các nguyên tử trong phân tử NH3 là
A. liên kết cộng hóa trị không cực.
B. liên kết cộng hóa trị phân cực.
C. liên kết ion.
D. liên kết hydrogen.
Câu 23: Dãy gồm các hợp chất đều có liên kết cộng hóa trị là
A. NaCl, CaO.
B. HCl, CO2.
C. KCl, Al2O3.
D. MgCl2, Na2O.
Câu 24: Trong phân tử HCl, số cặp electron dùng chung và cặp electron hoá trị riêng của nguyên tử Cl lần lượt là:
A. 1 và 3.
B. 2 và 2.
C. 3 và 1.
D. 1 và 4.
Câu 25: Liên kết hydrogen là loại liên kết hóa học được hình thành giữa các nguyên tử nào sau đây?
A. Phi kim và hydrogen trong hai phân tử khác nhau.
B. Phi kim và hydrogen trong cùng một phân tử.
C. Phi kim có độ âm điện lớn và nguyên tử hydrogen.
D. F, O, N,… có độ âm điện lớn, đồng thời có cặp electron hóa trị chưa liên kết và nguyên tử hydrogen linh động.
Câu 26: Giữa H2O và CH3OH có thể tạo ra ít nhất bao nhiêu kiểu liên kết hydrogen?
A. 2. B. 3. C. 4. D. 5.
Câu 27: Dãy được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử là
A. HCl, Cl2, NaCl.
B. Cl2, HCl, NaCl.
C. NaCl, Cl2, HCl.
D. Cl2, NaCl, HCl.
Câu 28: Thứ tự nào sau đây thể hiện độ mạnh giảm dần của các loại liên kết?
A. Liên kết ion > liên kết cộng hoá trị > liên kết hydrogen > tương tác van der Waals.
B. Liên kết ion > liên kết cộng hoá trị > tương tác van der Waals > liên kết hydrogen.
C. Liên kết cộng hoá trị > liên kết ion > liên kết hydrogen > tương tác van der Waals.
D. Tương tác van der Waals > liên kết hydrogen > liên kết cộng hoá trị > liên kết ion.
Phần II: Tự luận (3 điểm)
Câu 29 (1 điểm): Chlorine có Z = 17, cho biết xu hướng cơ bản của nguyên tử chlorine khi hình thành liên kết hóa học. Hãy vẽ sơ đồ minh họa quá trình đó.
Câu 30 (1 điểm): Cho các chất sau: O2, NaF, H2S.
(a) Phân loại các chất trên theo liên kết (ion, cộng hóa trị phân cực, cộng hóa trị không phân cực).
(b) Biểu diễn sự hình thành liên kết ion đối với hợp chất ion; viết công thức electron, công thức Lewis, công thức cấu tạo đối với hợp chất cộng hóa trị.
Câu 31 (1 điểm): Hãy giải thích sự biến đổi về nhiệt độ nóng chảy của dãy hydrogen halide sau:
Halogen halide |
HF |
HCl |
HBr |
HI |
Nhiệt độ nóng chảy (oC) |
-83,1 |
-114,8 |
-88,5 |
-50,8 |
Sở Giáo dục và Đào tạo ...
Đề thi Giữa kì 2 - Cánh diều
Năm 2025
Môn: Hóa học lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hóa của iron, oxygen, hydrogen, sodium trong Fe, O2, H2, Na lần lượt là
A. +3, -2, +1, +1.
B. 0, 0, 0, 0.
C. +2, -2, +1, +1.
D. +3, -2, 0, 0.
Câu 2: Số oxi hoá của một nguyên tử một nguyên tố trong hợp chất là
A. hoá trị của nguyên tử nguyên tố đó.
B. giá trị điện tích của nguyên tử nguyên tố đó.
C. điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất cộng hoá trị.
D. điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất ion.
Câu 3: Số oxi hóa của manganese (Mn) trong KMnO4 là
A. +1.
B. +5.
C. +7.
D. -2.
Câu 4: Kim loại trong hợp chất nào sau đây có số oxi hoá là +2 ?
A. Al2O3
B. Na2O.
C. MgO.
D. KCl.
Câu 5: Khi tham gia các phản ứng đốt cháy nhiên liệu, oxygen đóng vai trò là
A. chất khử.
B. chất oxi hóa.
C. acid.
D. base.
Câu 6: Trong phản ứng oxi hóa – khử:
A. chất bị oxi hóa nhận electron và chất bị khử cho electron.
B. quá trình oxi hóa và quá trình khử xảy ra đồng thời.
C. chất chứa nguyên tố số oxi hóa cực đại luôn là chất khử.
D. quá trình nhận electron gọi là quá trình oxi hóa.
Câu 7: Dẫn khí chlorine vào dung dịch KBr xảy ra phản ứng hoá học:
Cl2 + 2KBr → 2KCl + Br2
Trong phản ứng hoá học trên, xảy ra quá trình oxi hoá chất nào?
A. KCl.
B. Br2.
C. Cl2.
D. KBr.
Câu 8: Cho phản ứng: FeO + HNO3 Fe(NO3)3 + NO + H2O. Trong phản ứng này có bao nhiêu phân tử HNO3 đóng vai trò là chất oxi hóa?
A. 1.
B. 4.
C. 8.
D. 10.
Câu 9: Copper(II) oxide (CuO) bị khử bởi ammonia (NH3) theo phản ứng sau:
Tổng hệ số cân bằng (tối giản) của phản ứng là?
A. 11.
B. 12.
C. 13.
D. 14.
Câu 10: Sodium peroxide (Na2O2), potassium superoxide (KO2) được sử dụng trong bình lặn để hấp thụ khí carbon dioxide và cung cấp khí oxygen cho con người theo các phản ứng sau:
Na2O2 + CO2 Na2CO3 + O2↑
KO2 + CO2 < K2CO3 + O2↑
Để thể tích khí carbon dioxide hấp thụ bằng thể tích khí oxygen sinh ra cần trộn Na2O2 và KO2 theo tỉ lệ số mol là
A. 1 : 2.
B. 1 : 3.
C. 1 : 4.
D. 3 : 1.
Câu 11: Cho 8,4 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HNO3, thể tích khí NO (đkc) bay ra là (coi NO là sản phẩm khử duy nhất)
A. 2,2400 lít.
B. 3,3600 lít.
C. 3,7185 lít .
D. 5,6360 lít.
Câu 12: Phản ứng thu nhiệt là
A. phản ứng giải phóng năng lượng dưới dạng nhiệt.
B. phản ứng hấp thụ năng lượng dưới dạng nhiệt.
C. phản ứng có biến thiên enthalpy có giá trị âm.
D. phản ứng có biến thiên enthalpy bằng không.
Câu 13: Cho các phản ứng sau:
(a) Phản ứng phân huỷ NH4Cl(s) tạo ra HCl(g) và NH3(g).
(b) Phản ứng thuỷ phân collagen thành gelatin diễn ra khi hầm xương động vật.
(c) Phản ứng nung clinker xi măng.
(d) Phản ứng oxi hoá glucose trong cơ thể.
Số phản ứng toả nhiệt là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 14: Để thuận tiện cho việc so sánh lượng nhiệt kèm theo, người ta sử dụng điều kiện chuẩn và quy định là
A. Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (đối với chất khí), nồng độ 1 mol L (đối với chất tan trong dung dịch) và nhiệt độ thường chọn là 25K.
B. Điều kiện chuẩn là điều kiện ứng với áp suất 1 atm (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường chọn là 298K.
C. Điều kiện chuẩn là điều kiện ứng với áp suất 1 mmHg (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường chọn là 25K.
D. Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường chọn là 298K.
Câu 15: Biến thiên enthalpy chuẩn của một phản ứng hoá học, kí hiệu là
A.
B.
C.
D.
Câu 16: Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất là
A. nhiệt kèm theo của một phản ứng hoá học ở áp suất không đổi.
B. lượng nhiệt toả ra của phản ứng ở điều kiện chuẩn.
C. lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất.
D. lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
Câu 17: Cho phản ứng sau:
H2(g) + I2(s) → 2HI(g)
Enthalpy tạo thành chuẩn của hydrogen iodide (HI) ở thể khí là
A. +53 kJ/ mol.
B. -53 kJ/ mol.
C. -26,5 kJ/ mol.
D. +26,5 kJ/ mol.
Câu 18: Cho hai phản ứng cùng xảy ra ở điều kiện chuẩn:
(1) N2(g) + O2(g) → 2NO(g)
(2)
Phát biểu nào sau đây không đúng?
A. Enthalpy tạo thành chuẩn của NO(g) là .
B. Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol N2(g) với 1 mol O2(g) tạo thành 2 mol NO (g) là .
C. Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol khí NO(g) với 0,5 mol khí O2(g) tạo thành 1 mol khí NO2(g) là .
D. Enthalpy tạo thành chuẩn của NO2 (g) là: .
Câu 19: Đốt cháy hoàn toàn 1 gam C2H2(g) ở điều kiện chuẩn, thu được CO2(g) và H2O(l), giải phóng 50,01 kJ. Biến thiên enthalpy chuẩn của phản ứng đốt cháy 1 mol C2H2 là
A. – 1300,26 kJ.
B. 1300,26 kJ.
C. 650,13 kJ.
D. – 650,13 kJ.
Câu 20: Cho các phản ứng sau:
(a) C(s) + O2(g) → CO2(g)
(b)
(c) CH4(g) + H2O(l) → CO(g) + 3H2(g)
(d) H2(g) + Cl2(g) → 2HCl(g)
Số phản ứng thu nhiệt là
A. 4.
B. 3.
C. 2.
D. 1.
Câu 21: Phản ứng hoá học nào sau đây không cần phải khơi mào?
A. Phản ứng nung vôi.
B. Phản ứng đốt than.
C. Phản ứng tạo gỉ sắt.
D. Phản ứng phân huỷ thuốc tím.
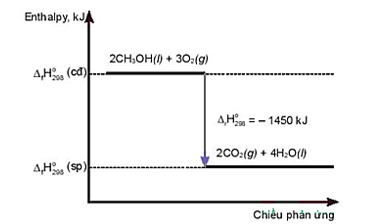
Câu 22: Cho giản đồ sau:
Nhận xét nào sau đây là sai?
A. Phản ứng toả nhiệt.
B. Phản ứng thu nhiệt.
C. Nhiệt lượng toả ra của phản ứng là 1450 kJ.
D. Phương trình hoá học của phản ứng là: 2CH3OH(l) + 3O2(g) → 2CO2(g) + 4H2O(l).
Câu 23: Cho phản ứng sau: 2SO2(g) + O2(g) → 2SO3(l). Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức là
Câu 24: Cho phản ứng nhiệt nhôm sau: 2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
Biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm là
Biết:
|
Chất |
Al (s) |
Fe2O3 (s) |
Fe (s) |
Al2O3 (s) |
|
(kJmol-1) |
0 |
-825,5 |
0 |
-1676,0 |
A. +850,5 kJ.
B. - 850,5 kJ.
C. -839 kJ.
D. +839 kJ.
Câu 25: Muối ammonium bicarbonate (NH4HCO3) được sử dụng làm bột nở, giúp cho bánh nở to, xốp và mềm. Dựa vào phản ứng và các dữ kiện sau hãy lựa chọn cách bảo quản ammonium bicarbonate đúng?
NH4HCO3 (s) NH3 (g) + CO2 (g) + H2O (g)
|
Chất |
NH4HCO3 (s) |
NH3 (g) |
CO2 (g) |
H2O (g) |
|
(kJmol-1) |
–849,40 |
–46,11 |
–393,51 |
–241,82 |
A. Bảo quảnnơi thoáng mát, tránh ánh sáng Mặt Trời và tránh nhiệt độ cao.
B. Bảo quản nơi kín gió, có ánh sáng Mặt Trời.
C. Bảo quản nơi thoáng mát, khô ráo, có nhiệt độ cao, nhiều ánh nắng Mặt Trời.
D. Bảo quản nơi thoáng mát, khô ráo, nhiều ánh sáng Mặt Trời.
Câu 26: Cho phản ứng tổng quát: aA + bB → mM + nN. Hãy chọn phương án tính đúng của phản ứng:
Câu 27: Cho phản ứng hóa học sau: H2C=CH2(g) + H2(g) → H3C-CH3(g)
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C – H |
C – C |
C = C |
H - H |
|
Eb (kJ/mol) |
418 |
346 |
612 |
436 |
Biến thiên enthalpy chuẩn của phản ứng là
A. +134 kJ.
B. -134 kJ.
C. +478 kJ.
D. +284 kJ.
Câu 28: Cho phương trình nhiệt hóa học của phản ứng:
Nhận xét nào sau đây là đúng?
A. Phản ứng tỏa nhiệt mạnh.
B. Phản ứng xảy ra thuận lợi ở điều kiện thường.
C. Phản ứng xảy ra dưới điều kiện nhiệt độ thấp.
D. Phản ứng thu nhiệt.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Thực hiện thí nghiệm xác định công thức của một oxide của kim loại sắt bằng nitric acid đặc, nóng thu được 2,479 lít (đkc) khí màu nâu là nitrogen dioxide. Phần dung dịch đem cô cạn thu được 72,6 gam Fe(NO3)3. Giả sử phản ứng không tạo thành các sản phẩm khác (biết 1 mol khí chiếm 24,79 lít đo ở đkc 25oC, 1bar).Xác định công thức của oxide.
Câu 2 (1 điểm): Cho phản ứng:
Xác định giá trị của khi:
a. Lấy gấp 3 lần khối lượng của các chất phản ứng.
b. Lấy một nửa khối lượng của các chất phản ứng
c. Đảo chiều của phản ứng.
Câu 3 (1 điểm): Xác định năng lượng liên kết H–Clcủa khí HCltừ các giá trị sau:
EH–H = 436 kJ mol-1;
ECl–Cl = 242 kJ mol-1;
HCl (g) = –92,31 kJ mol-1.
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 2 - Cánh diều
Năm 2025
Môn: Hóa học lớp 10
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nhận định nào dưới đây là sai?
A. Số oxi hoá của hydrogen trong các hydride kim loại là -1.
B. Số oxi hoá của nguyên tử nguyên tố trong đơn chất bằng 0.
C. Số oxi hoá của kim loại kiềm trong hợp chất là +2.
D. Trong hầu hết các hợp chất, số oxi hoá của O là -2.
Câu 2: Số oxi hoá của phosphorus trong ion là
A. +2. B. +3.
C. +4. D. +5.
Câu 3: Cho các phản ứng hoá học sau:
(a) 2Na + Cl2 → 2NaCl.
(b) HCl + NaOH → NaCl + H2O.
(c) Fe + 2HCl → FeCl2 + H2.
(d) K2CO3 + 2HCl → 2KCl + CO2 + H2O.
Số phản ứng là phản ứng oxi hoá – khử là
A. 4. B. 3.
C. 2. D. 1.
Câu 4: Cho phản ứng hoá học sau: 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O. Vai trò của Cl2 trong phản ứng này là
A. chất oxi hoá.
B. chất khử.
C. vừa là chất oxi hoá, vừa là chất khử.
D. không là chất oxi hoá, không là chất khử.
Câu 5: Điều kiện chuẩn là điều kiện ứng với
A. áp suất 1 atm (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường chọn là 298 K.
B. áp suất 1 atm (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường chọn là 25 oC.
C. áp suất 1 atm (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường chọn là 298 oC.
D. áp suất 1 bar (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường chọn là 298 K.
Câu 6: Cho các phản ứng hoá học sau:
(1) Phản ứng trung hoà: KOH(aq) + HCl(aq) → KCl(aq) + H2O(l).
(2) Phản ứng nhiệt phân thuốc tím: 2KMnO4(s) → K2MnO4(s) + MnO2(s) + O2(g).
Nhận xét nào sau đây là đúng?
A. Cả hai phản ứng đều toả nhiệt.
B. Cả hai phản ứng đều thu nhiệt.
C. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
D. Phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
Câu 7: Cho các phát biểu sau:
(a) Các phản ứng hoá học khi xảy ra luôn kèm theo sự giải phóng hoặc hấp thụ năng lượng.
(b) Phản ứng giải phóng năng lượng dưới dạng nhiệt là phản ứng toả nhiệt.
(c) Enthalpy tạo thành chuẩn của một chất kí hiệu là
(d) Enthalpy tạo thành chuẩn của I2(g) bằng 0.
Số phát biểu đúng là
A. 4. B. 3.
C. 2. D. 1.
Câu 8: Cho các phương trình nhiệt hóa học sau:
Phản ứng toả nhiệt là
A. (1) và (3).
B. (2) và (4).
C. (1) và (2).
D. (3) và (4).
Câu 9: Cho phản ứng hóa học xảy ra ở điều kiện chuẩn như sau:
2NO2(g) (đỏ nâu) → N2O4(g) (không màu)
Biết NO2 và N2O4 có nhiệt tạo thành chuẩn tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Phát biểu nào sau đây là đúng?
A. Phản ứng tỏa nhiệt, N2O4 bền vững hơn NO2.
B. Phản ứng thu nhiệt, N2O4 bền vững hơn NO2.
C. Phản ứng tỏa nhiệt, NO2 bền vững hơn N2O4.
D. Phản ứng thu nhiệt, NO2 bền vững hơn N2O4.
Câu 10: Cho phản ứng tổng quát: aA + bB → mM + nN. Hãy chọn phương án tính đúng của phản ứng:
Câu 11: Nội dung định luật tác dụng khối lượng là
A. Tốc độ phản ứng tỉ lệ nghịch với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
B. Tốc độ phản ứng tỉ lệ thuận với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
C. Tốc độ phản ứng của một phản ứng hoá học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
D. Tốc độ trung bình của phản ứng là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
Câu 12: Chất xúc tác là
A. chất làm giảm tốc độ phản ứng, nhưng không bị tiêu hao trong phản ứng.
B. chất làm tăng tốc độ phản ứng, nhưng bị tiêu hao trong phản ứng.
C. chất làm tăng tốc độ phản ứng nhưng không bị thay đổi cả lượng và chất sau khi phản ứng kết thúc.
D. chất làm thay đổi tốc độ phản ứng, nhưng bị tiêu hao không nhiều trong phản ứng.
Câu 13: Cho cùng một lượng kẽm (zinc) vào các cốc khác nhau chứa cùng một lượng dung dịch hydrochloric acid, trường hợp nào sẽ có tốc độ phản ứng nhanh nhất?
A. Kẽm ở dạng viên tròn nhỏ.
B. Kẽm ở dạng lá mỏng.
C. Kẽm ở dạng bột mịn, khuấy đều.
D. Kẽm ở dạng sợi, mảnh.
Câu 14: Nhận xét nào sau đây là không đúng về hằng số tốc độ phản ứng?
A. Giá trị của hằng số tốc độ phản ứng chỉ phụ thuộc vào nhiệt độ và bản chất các chất tham gia phản ứng.
B. Hằng số tốc độ của phản ứng càng lớn thì tốc độ của phản ứng đó càng lớn.
C. Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1M.
D. Hằng số tốc độ của phản ứng càng lớn thì tốc độ của phản ứng đó càng nhỏ.
Câu 15: Khi đun nấu thức ăn, nếu củi được chẻ nhỏ thì quá trình cháy xảy ra nhanh hơn. Vậy người ta đã dựa vào yếu tố nào sau đây để tăng tốc độ phản ứng?
A. Nồng độ.
B. Nhiệt độ.
C. Diện tích tiếp xúc.
D. Áp suất.
Câu 16: Cho phương trình hóa học sau: A + B → C. Lúc đầu nồng độ chất A là 0,8M. Sau khi phản ứng 20 giây thì nồng độ của chất A là 0,78M. Tốc độ trung bình tính theo chất A trong khoảng thời gian trên là
A. 0,001 M s-1.
B. 0,78 M s-1.
C. 0,01 M s-1.
D. 0,8 M s-1.
Câu 17: Một phản ứng có hệ số nhiệt độ Van’t Hoff bằng 3,5. Ở 20°C, tốc độ của phản ứng này bằng 0,2 M s-1. Tốc độ của phản ứng ở 45°C là
A. 2,3 M s-1.
B. 4,6 M s-1.
C. 2,0 M s-1.
D. 4,0 M s-1.
Câu 18: Cho phản ứng đơn giản xảy ra trong bình kín: 3H2(g) + N2 (g) ⟶ 2NH3 (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 và N2 đều tăng 2 lần?
A. Tăng 4 lần.
B. Tăng 6 lần.
C. Tăng 8 lần.
D. Tăng 16 lần.
Câu 19: Quặng/ khoáng vật nào sau đây thành phần chính có chứa chlorine?
A. Quặng fluorite.
B. Quặng cryolite.
C. Quặng fluorapatite.
D. Khoáng vật carnallite.
Câu 20: Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen là
A. ns2np3.
B. ns2np4.
C. ns2np5.
D. ns2np6.
Câu 21: Phương trình hoá học nào sau đây là sai?
A. Mg(s) + Cl2(g) → MgCl2(s).
B. H2(g) + Br2(g) → 2HBr(g).
C. Cl2(aq) + 2NaBr(aq) → 2NaCl(aq) + Br2(aq).
D. F2(aq) + H2O(l) → HF(aq) + HFO(aq).
Câu 22: Phát biểu nào dưới đây không đúng?
A. Phân tử halogen tồn tại ở dạng phân tử X2.
B. Trong hợp chất, các halogen luôn có số oxi hóa là -1.
C. Các nguyên tố halogen có độ âm điện tương đối lớn.
D. Tính chất hóa học cơ bản của các halogen là tính oxi hóa mạnh.
Câu 23: Đốt cháy 4,8 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư, sau khi các phản ứng xảy ra hoàn toàn thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đkc) đã phản ứng là
A. 9,916 lít.
B. 7,437 lít.
C. 19,832 lít.
D. 12,395 lít.
Câu 24: Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao vượt trội so với các hydrogen halide còn lại là do
A. fluorine có nguyên tử khối nhỏ nhất.
B. năng lượng liên kết H – F bền vững làm cho HF khó bay hơi.
C. các nhóm phân tử HF được tạo thành do có liên kết hydrogen giữa các phân tử.
D. fluorine là phi kim mạnh nhất.
Câu 25: Cho các phát biểu sau:
(a). Dùng dung dịch silver nitrate sẽ phân biệt được các ion F-, Cl-, Br-, I-.
(b). Với sulfuric acid đặc, các ion Cl-, Br-, I- thể hiện tính khử, ion F- không thể hiện tính khử.
(c). Tính khử của các ion halide tăng theo dãy: Cl-, Br-, I-.
(d). Ion Cl- kết hợp ion Ag+ tạo AgCl là chất không tan, màu vàng.
Số phát biểu đúng là
A. 1. B. 2.
C. 3. D. 4.
Câu 26: Phản ứng giữa cặp chất nào sau đây không xảy ra?
A. NaI và Br2.
B. AgNO3 và KCl.
C. AgNO3 và NaF.
D. NaBr và Cl2.
Câu 27: Cho phản ứng: NaX(s) + H2SO4(l) → NaHSO4(s) + HX(g). Các hydrogen halide (HX) có thể điều chế theo phản ứng trên là
A. HCl, HBr và HI.
B. HBr và HI.
C. HF và HCl.
D. HF, HCl, HBr và HI.
Câu 28: Hydrochloric acid đặc thể hiện tính khử khi tác dụng với chất nào sau đây?
A. NaCl. B. CaCO3.
C. Al. D. MnO2.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Để điều chế khí chlorine (Cl2) trong phòng thí nghiệm, người ta có thể cho MnO2 (manganese dioxide) tác dụng với hydrogen chloride (HCl).
a) Lập phương trình hóa học của phản ứng hóa học trên bằng phương pháp thăng bằng electron.
b) Giả sử lượng khí chlorine sinh ra phản ứng vừa đủ vào dung dịch chứa 9,96 muối KX (X là một nguyên tố halogen) thu được 4,47 gam một muối duy nhất. Xác định công thức phân tử của muối KX.
Câu 2 (1 điểm): Bằng phương pháp hóa học, hãy phân biệt các dung dịch sau chứa trong các lọ riêng biệt mất nhãn: HBr, NaCl, NaI.
Câu 3 (1 điểm): Cho 3,28 gam hỗn hợp A gồm hai muối NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kỳ kế tiếp, MX < MY) phản ứng hoàn toàn và vừa đủ với 50 ml dung dịch AgNO3 0,5M, thu được hai chất kết tủa. Xác định hai nguyên tố X, Y.
Xem thử Đề thi GK1 Hóa 10 Xem thử Đề thi CK1 Hóa 10 Xem thử Đề thi GK2 Hóa 10 Xem thử Đề thi CK2 Hóa 10
Xem thêm đề thi lớp 10 các môn học có đáp án hay khác:
Tài liệu giáo án lớp 10 các môn học chuẩn khác:
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 10 (các môn học)
- Giáo án điện tử lớp 10 (các môn học)
- Giáo án Ngữ văn 10
- Giáo án Toán 10
- Giáo án Tiếng Anh 10
- Giáo án Vật Lí 10
- Giáo án Hóa học 10
- Giáo án Sinh học 10
- Giáo án Lịch Sử 10
- Giáo án Địa Lí 10
- Giáo án Kinh tế Pháp luật 10
- Giáo án Tin học 10
- Giáo án Công nghệ 10
- Giáo án Giáo dục quốc phòng 10
- Giáo án Hoạt động trải nghiệm 10
- Đề thi lớp 10 (các môn học)
- Đề thi Ngữ Văn 10 (có đáp án)
- Chuyên đề Tiếng Việt lớp 10
- Đề cương ôn tập Văn 10
- Đề thi Toán 10 (có đáp án)
- Đề thi cương ôn tập Toán 10
- Đề thi Toán 10 cấu trúc mới (có đáp án)
- Đề thi Tiếng Anh 10 (có đáp án)
- Đề thi Vật Lí 10 (có đáp án)
- Đề thi Hóa học 10 (có đáp án)
- Đề thi Sinh học 10 (có đáp án)
- Đề thi Lịch Sử 10 (có đáp án)
- Đề thi Địa Lí 10 (có đáp án)
- Đề thi Kinh tế & Pháp luật 10 (có đáp án)
- Đề thi Tin học 10 (có đáp án)
- Đề thi Công nghệ 10 (có đáp án)
- Đề thi Giáo dục quốc phòng 10 (có đáp án)

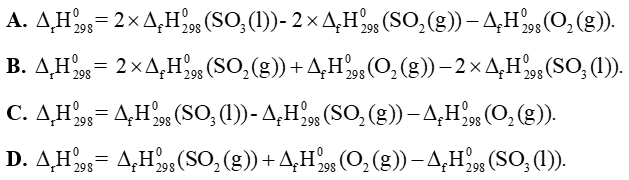
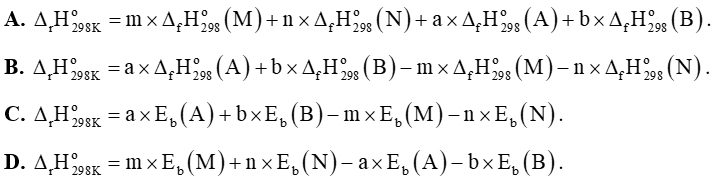
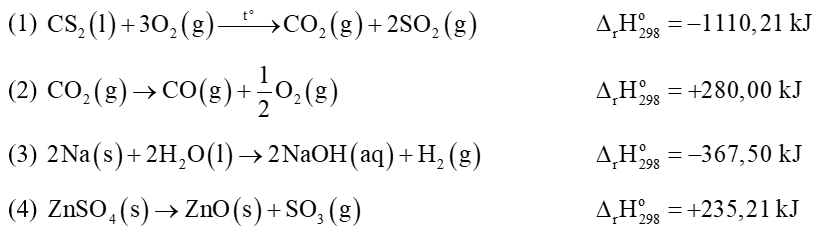
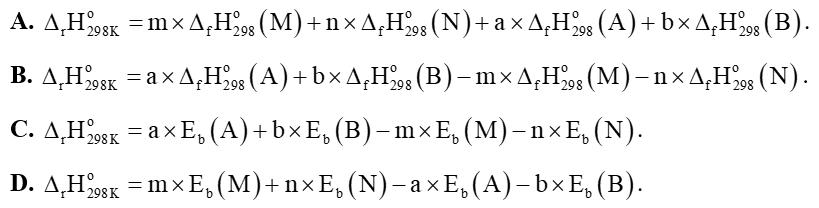



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

