Đề cương ôn tập Giữa kì 2 Hóa học 10 Chân trời sáng tạo
Bộ đề cương ôn tập Giữa kì 2 Hóa học 10 Chân trời sáng tạo với bài tập trắc nghiệm, tự luận đa dạng có lời giải chi tiết giúp học sinh lớp 10 nắm vững kiến thức cần ôn tập để đạt điểm cao trong bài thi Hóa 10 Giữa kì 2.
Đề cương ôn tập Giữa kì 2 Hóa học 10 Chân trời sáng tạo
Chỉ từ 80k mua bộ Đề cương ôn tập Hóa 10 Chân trời sáng tạo theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
Đề cương ôn tập Hóa học 10 Giữa kì 2 Hóa học 10 có 2 Chương trong đó gồm hai phần: tóm tắt lý thuyết và nội dung ôn tập của các chương:
- Chương 4: 25 câu hỏi trắc nghiệm;
- Chương 5: 20 câu hỏi trắc nghiệm và 12 bài tập tự luận;
- Đề minh họa: 28 câu hỏi trắc nghiệm và 3 bài tập tự luận;
PHẢN ỨNG OXI HOÁ – KHỬ
Câu 1.Số oxi hóa là một số đại số đặc trưng cho đại lượng nào sau đây của nguyên tử trong phân tử?
A. Hóa trị.
B. Điện tích.
C. Khối lượng.
D. Số hiệu.
Câu 2. Trong hợp chất SO3, số oxi hóa của sulfur (lưu huỳnh) là
A. +2.
B. +3.
C. + 5.
D. +6.
Câu 3.Trong phản ứng oxi hoá – khử, chất nhường electron được gọi là
A. chất khử.
B. chất oxi hoá.
C. acid.
D. base.
Câu 4. Phản ứng kèm theo sự cho và nhận electron được gọi là phản ứng
A. đốt cháy.
B. phân huỷ.
C. trao đổi.
D. oxi hoá – khử.
Câu 5. Dẫn khí H2 đi qua ống sứ đựng bột CuO nung nóng để thực hiện phản ứng hóa học sau: CuO + H2 Cu + H2O. Trong phản ứng trên, chất đóng vai trò chất khử là
A. CuO.
B. H2.
C. Cu.
D. H2O.
Câu 6. Phản ứng nào sau đây là phản ứng oxi hóa – khử?
A.
B.
C.
D.
Câu 7. Chlorine vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử trong phản ứng nào sau đây?
A. .
B. .
C. .
D. .
Câu 8. Số oxi hóa của Cl trong các hợp chất NaClO, NaClO2, NaClO3, NaClO4 là
A. -1, +3, +5, +7.
B.+1,-3,+5,-2.
C. +1, +3, +5, +7.
D.+1,+3,-5,+7.
Câu 9. Cho các phân tử có công thức cấu tạo sau:
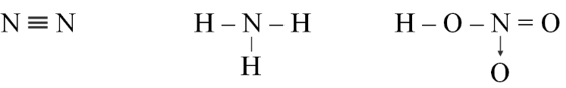
Số oxi hóa của nguyên tử N trong phân tử các chất trên lần lượt là
A. 0; -3; -4.
B. 0; -3; +5.
C. -3; -3; +4.
D. 0; -3; +5.
Câu 10. Cho phương trình hóa học: aFe + bH2SO4 → cFe2(SO4)3 + dSO2 ↑ + eH2O
Tỉ lệ a: b là
A. 1: 3.
B. 1: 2.
C. 2: 3.
D. 2: 9
................................
................................
................................
NĂNG LƯỢNG HOÁ HỌC
Câu 1. Quy ước về dấu của nhiệt phản ứng () nào sau đây là đúng?
A. Phản ứng tỏa nhiệt có > 0.
B. Phản ứng thu nhiệt có < 0.
C. Phản ứng tỏa nhiệt có < 0.
D. Phản ứng thu nhiệt có = 0.
Câu 2. Điều kiện nào sau đây là điều kiện chuẩn đối với chất khí?
A. Áp suất 1 bar và nhiệt độ 25 oC hay 298K.
B. Áp suất 1 bar và nhiệt độ 298K.
C. Áp suất 1 bar và nhiệt độ 25 oC.
D. Áp suất 1 bar và nhiệt độ 25K.
Câu 3. Kí hiệu enthalpy tạo thành (nhiệt tạo thành) của phản ứng ở điều kiện chuẩn là
A.
B.
C.
D.
Câu 4. Phản ứng chuyển hóa giữa hai dạng đơn chất của phosphorus (P):
P (s, đỏ) P (s, trắng)
Điều này chứng tỏ phản ứng:
A. thu nhiệt, P đỏ bền hơn P trắng.
B. thu nhiệt, P trắng bền hơn P đỏ.
C. tỏa nhiệt, P đỏ bền hơn P trắng.
D. tỏa nhiệt, P trắng bền hơn P đỏ.
Câu 5. Phát biểu nào sau đây không đúng?
A. Các phản ứng phân hủy thường là phản ứng thu nhiệt.
B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra.
C. Các phản ứng oxi hóa chất béo cung cấp nhiệt cho cơ thể.
D. Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Câu 6. Nung nóng hai ống nghiệm chứa NaHCO3 và P, xảy ra các phản ứng sau:
2NaHCO3(s) Na2CO3(s) + CO2(g) + H2O(g) (1)
4P(s) + 5O2(g) 2P2O5(s) (2)
Khi ngừng đun nóng, phản ứng (1) dừng lại còn phản ứng (2) tiếp tục xảy ra, chứng tỏ
A. phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
B. phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
C. cả 2 phản ứng đều toả nhiệt.
D. cả 2 phản ứng đều thu nhiệt.
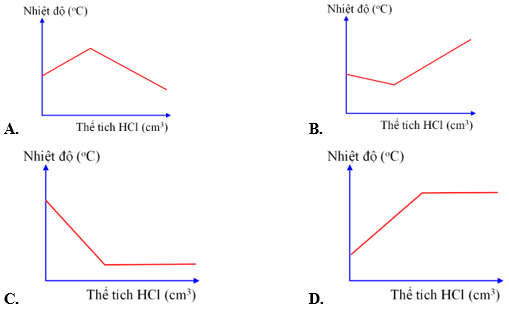
Câu 7. Đồ thị nào say đây thể hiện đúng sự thay đổi nhiệt độ khi dung dịch hydrochloric acid được cho vào dung dịch sodium hydroxide tới dư?
Câu 8. Phương trình nhiệt hóa học:
3H2(g) + N2(g) NH3(g) = -91,80kJ
Lượng nhiệt tỏa ra khi dùng 9 g H2(g) để tạo thành NH3(g) là
A. -275,40 kJ.
B. -137,70 kJ.
C. -45,90 kJ.
D. -183,60 kJ.
Câu 9. Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
A. 2C (than chì)
B. C (than chì) +
C. C (than chì)
D. C (than chì)
Câu 10. Cho phương trình nhiệt hóa học của phản ứng:
N2(g) + O2(g) 2NO(l) = +179,20kJ
Phản ứng trên là phản ứng
A. thu nhiệt.
B. không có sự thay đổi năng lượng.
C. tỏa nhiệt.
D. có sự giải phóng nhiệt lượng ra môi trường.
................................
................................
................................
3. Đề minh hoạ
ĐỀ MINH HOẠ THI GIỮA HỌC KÌ 2
Câu 1: Quá trình khử là quá trình
A. cho electron.
B. nhường electron.
C. tặng electron.
D. nhận electron.
Câu 2: Điều kiện chuẩn là điều kiện ứng với
A. áp suất 1 bar (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
B. áp suất 1 bar (đối với chất khí), nồng độ 2 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
C. áp suất 2 bar (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
D. áp suất 2 bar (đối với chất khí), nồng độ 2 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
Câu 3: Trong các phản ứng sau, phản ứng nào là phản ứng thu nhiệt ?
A. Đốt cháy cồn.
B. Tạo gỉ sắt.
C. Nung vôi.
D. Đốt cháy than.
Câu 4: Enthalpy tạo thành chuẩn ( nhiệt tạo thành chuẩn) là lượng nhiệt kèm theo của phản ứng tạo thành
A. 1 lít chất đó từ các hợp chất ở dạng bền nhất trong điều kiện chuẩn.
B. 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
C. 1 mol chất đó từ các hợp chất ở dạng bền nhất trong điều kiện chuẩn.
D. 1 gam chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
Câu 5: Cho phản ứng có dạng : aA(g) + bB(g) → mM(g) + nN(g)
Công thức tính biến thiên enthalpy chuẩn của phản ứng theo năng lượng liên kết là
A. = a´Eb(A) + b´Eb(B) - m´Eb(M) - n´En(N).
B. = Eb(A) + Eb(B) - Eb(M) - En(N).
C. = Eb(M) + Eb(N) - Eb(A) - En(B).
D. = m´Eb(M) + n´Eb(N) - a´Eb(A) - b´En(B).
Câu 6: Kí hiệu của biến thiên enthalpy chuẩn của phản ứng hóa học là
A.
B.
C.
D.
Câu 7: Trong phản ứng tỏa nhiệt, biến thiên enthalpy của phản ứng có giá trị âm. Biến thiên enthalpy càng âm thì lượng nhiệt mà phản ứng tỏa ra
A. càng giảm.
B. càng nhiều.
C. càng ít.
D. không thay đổi
Câu 8: Phản ứng oxi hóa - khử là phản ứng hóa học trong đó
A. chỉ xảy ra quá trình khử.
B. chỉ xảy ra quá trình oxi hóa.
C. có sự thay đổi số oxi hóa của tất cả các nguyên tố hóa học.
D. có sự thay đổi số oxi hóa của ít nhất một nguyên tố hóa học.
Câu 9: Đơn vị của enthalpy tạo thành chuẩn ( nhiệt tạo thành chuẩn ) là
A. kJ.
B. kcal.
C. molkJ-1.
D. kJmol-1.
Câu 10: Số oxi hóa của S trong phân tử H2SO4 là
A. -2.
B. +4.
C. +6.
D. 0.
................................
................................
................................
Xem thêm đề cương Hóa học 10 Chân trời sáng tạo có lời giải hay khác:
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 10 (các môn học)
- Giáo án điện tử lớp 10 (các môn học)
- Giáo án Ngữ văn 10
- Giáo án Toán 10
- Giáo án Tiếng Anh 10
- Giáo án Vật Lí 10
- Giáo án Hóa học 10
- Giáo án Sinh học 10
- Giáo án Lịch Sử 10
- Giáo án Địa Lí 10
- Giáo án Kinh tế Pháp luật 10
- Giáo án Tin học 10
- Giáo án Công nghệ 10
- Giáo án Giáo dục quốc phòng 10
- Giáo án Hoạt động trải nghiệm 10
- Đề thi lớp 10 (các môn học)
- Đề thi Ngữ Văn 10 (có đáp án)
- Chuyên đề Tiếng Việt lớp 10
- Đề cương ôn tập Văn 10
- Đề thi Toán 10 (có đáp án)
- Đề thi cương ôn tập Toán 10
- Đề thi Toán 10 cấu trúc mới (có đáp án)
- Đề thi Tiếng Anh 10 (có đáp án)
- Đề thi Vật Lí 10 (có đáp án)
- Đề thi Hóa học 10 (có đáp án)
- Đề thi Sinh học 10 (có đáp án)
- Đề thi Lịch Sử 10 (có đáp án)
- Đề thi Địa Lí 10 (có đáp án)
- Đề thi Kinh tế & Pháp luật 10 (có đáp án)
- Đề thi Tin học 10 (có đáp án)
- Đề thi Công nghệ 10 (có đáp án)
- Đề thi Giáo dục quốc phòng 10 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

