Top 20 Đề thi Hóa học 10 Học kì 1 có đáp án, cực hay
Top 20 Đề thi Hóa học 10 Học kì 1 có đáp án, cực hay
Dưới đây là danh sách Top 20 Đề thi Hóa học 10 Học kì 1 có đáp án, cực hay gồm đề kiểm tra 15 phút, Đề thi Giữa kì, đề thi học kì 1. Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện & đạt điểm cao trong các bài thi môn Hóa học 10.
Đề kiểm tra Hóa học 10 Học kì 1
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 1)(3 đề)
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 2)(3 đề)
- Đề kiểm tra Hóa học 10 Giữa học kì 1 có đáp án (3 đề)
- Đề thi Hóa học 10 Giữa kì 1 có đáp án (3 đề)
- Đề thi Hóa học 10 Học kì 1 có đáp án (3 đề)
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 15 phút
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Lần 1 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Câu 1. Nhận định nào sau đây đúng khi nói về 3 nguyên tử: 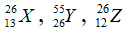
A. X và Z có cùng số khối.
B. X, Z là 2 đồng vị của cùng một nguyên tố hoá học.
C. X, Y thuộc cùng một nguyên tố hoá học.
D. X và Y có cùng số nơtron.
Câu 2. Một nguyên tử của nguyên tố X có tổng số hạt proton, nơtron, electron là 52 và có số khối là 35. Số hiệu nguyên tử của nguyên tố X là
A. 18. B. 23. C. 17. D. 15.
Câu 3. Cho cấu hình electron của ion X2+ là 1s22s22p63s23p63d6. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X thuộc
A. chu kì 4, nhóm VIIIB. B. chu kì 4, nhóm VIIIA.
C. chu kì 3, nhóm VIB. D. chu kì 4, nhóm IIA.
Câu 4. Dãy các nguyên tố sắp xếp theo chiều tăng dần tính phi kim từ trái sang phải là
A. N, P, O, F. B. P, N, F, O.
C. N, P, F, O. D. P, N, O, F.
Câu 5. Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của nguyên tố X với hiđro, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxit cao nhất là
A. 27,27%. B. 40,00%. C. 60,00%. D. 50,00%.
Câu 6. Phát biểu nào sau đây là sai?
A. Nguyên tử kim loại thường có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
B. Các nhóm A bao gồm các nguyên tố s và nguyên tố p.
C. Trong một chu kì, bán kính nguyên tử kim loại nhỏ hơn bán kính nguyên tử phi kim.
D. Các kim loại thường có ánh kim do các electron tự do phản xạ ánh sáng nhìn thấy được
Câu 7. Nguyên tử X và Y có hiệu số nguyên tử lần lượt là 19 và 15. Nhận xét nào sau đây đúng?
A. X và Y đều là phi kim.
B. X là 1 phi kim còn Y là 1 kim loại.
C. X là kim loại còn Y là phi kim .
D. X và Y đều là kim loại
Câu 8. Phát biểu sau đây là sai?
A. Số nguyên tố trong chu kì 2 và 3 lần lượt là 8 và 18.
B. Bảng tuần hoàn có 8 nhóm A và 8 nhóm B.
C. Các nhóm A bao gồm các nguyên tố s và nguyên tố p.
D. Bảng tuần hoàn gồm có các ô nguyên tố, các chu kì và các nhóm.
Câu 9. Các hạt cấu tạo nên nguyên tử là
A. electron, proton.
C. nơtron, electron.
B. proton, nơtron.
D. electron, proton, nơtron.
Câu 10. Số electron tối đa phân bố trên lớp thứ 3 trong vỏ nguyên tử là
A. 16. B. 32. C. 50. D. 18.
Hướng dẫn giải:
Câu 1. Chọn A
A đúng vì X và Z có cùng số khối là 26
B sai vì X và Z có số proton khác nhau nên không phải là đồng vị của cùng một nguyên tố.
C sai vì X là nhôm còn Y là sắt.
D sai vì X có 13 nơtron còn Y có 29 nơtron.
Câu 2. Chọn C
Gọi số hạt proton, nơtron, electron trong X lần lượt là p, n, e.
Ta có: 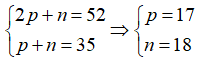
Vậy số hiệu nguyên tố của X là 17.
Câu 3. Chọn A
Cấu hình electron của X là 1s22s22p63s23p63d64s2
Vậy X ở chu kỳ 4 do có 4 lớp electron, nhóm VIIIB do có 8 electron hóa trị, nguyên tố d.
Câu 4. Chọn D
F có tính phi kim mạnh nhất → Loại B và C.
N và P thuộc cùng một nhóm, zN < zP nên tính phi kim của N > P → Loại A.
Câu 5. Chọn B
Công thức hợp chất khí là XH2
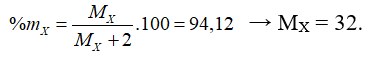
Công thức oxit cao nhất là SO3
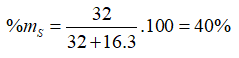
Câu 6. Chọn C
C sai vì trong một chu kỳ , bán kính nguyên tử kim loại lớn hơn bán kính nguyên tử phi kim.
Câu 7. Chọn C
Cấu hình electron nguyên tử của X là 1s22s22p63s23p64s1
→ X là kim loại vì có 1e ở lớp ngoài cùng.
Cấu hình electron nguyên tử của Y là 1s22s22p63s23p3
→ Y là phi kim vì có 5e ở lớp ngoài cùng.
Câu 8. Chọn A
A sai vì Số nguyên tố trong chu kì 2 và 3 đều là 8.
Câu 9. Chọn D
Các hạt cấu tạo nên nguyên tử là electron, proton, nơtron.
Câu 10. Chọn D
Số electron tôí đa trên lớp thứ 3 là 2.32 = 18.
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút lần 2 Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 15 phút
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Lần 2 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Câu 1. Chỉ ra nội dung sai khi nói về ion?
A. Ion là phần tử mang điện.
B. Ion âm gọi là cation, ion dương gọi là anion.
C. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử.
D. Ion đơn nguyên tử được hình thành khi nguyên tử nhường hay nhận electron.
Câu 2. Trong các phản ứng hoá học, nguyên tử kim loại có khuynh hướng
A. nhận thêm electron.
B. Nhận hay nhường electron phụ thuộc vào từng phản ứng cụ thể
C. Nhường bớt electron.
D. Nhận hay nhường electron phụ thuộc vào từng kim loại cụ thể.
Câu 3. Liên kết hóa học trong phân tử Br2 thuộc loại liên kết ?
A. cộng hoá trị không cực. B. hiđro.
C. cộng hoá trị có cực. D. ion
Câu 4. Hợp chất mà nguyên tố clo có số oxi hoá +3 là
A. NaClO. B. NaClO2. C. NaClO3. D.NaClO4.
Câu 5. Cho giá trị độ âm điện của các nguyên tố: F (3,98), O (3,44), C (2,55), H (2,20), Na (0,93), Hợp chất nào sau đây là hợp chất ion?
A. NaF. B. CH4. C. H2O. D. CO2.
Câu 6. Loại phản ứng hoá học nào sau đây luôn luôn là phản ứng oxi hóa-khử ?
A. Phản ứng hoá hợp. B. Phản ứng phân huỷ.
C . Phản ứng thế. D. Phản ứng trung hoà.
Câu 7. Cho phản ứng sau: 2FeCl3 + H2S -> 2FeCl2 + S + 2HCl.
Vai trò của H2S là
A. Chất oxi hóa. B. Chất khử.
C. Axit. D. Vừa oxi hóa vừa khử.
Câu 8. Cho sơ đồ phản ứng:
KMnO4 + FeSO4 + H2SO4 Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
A. 5 và 2. B. 2 và 10. C. 2 và 5. D. 5 và 1.
Câu 9. Hòa tan hoàn toàn 2,4 gam kim loại Mg vào dung dịch HNO3 loãng, giả sử chỉ thu được V lít khí N2 là sản phẩm khử duy nhất (đktc). Giá trị của V là
A. 0,672 lít. B. 6,72 lít. C. 0,448 lít. D. 4,48 lít.
Câu 10. Trong phản ứng oxi hóa – khử, chất oxi hóa là
A. chất nhận electron. B. chất nhường electron.
C. chất làm tăng số oxi hóa. D. chất không thay đổi số oxi hóa.
Hướng dẫn giải:
Câu 1. B
Ion âm gọi là anion, ion dương gọi là cation.
Câu 2. C
Kim loại thường có 1,2,3 electron lớp ngoài cùng nên sẽ có khuynh hướng nhường electron.
Câu 3. A
Liên kết hình thành giữa hai nguyên tử phi kim giống nhau là liên kết cộng hóa trị không cực.
Câu 4. B
Gọi số oxi hóa của Cl là x.
Ta có số oxi hóa của Na = +1, O = - 2
Áp dụng quy tắc ta có: (+1).1 + x.1 + (-2).2 => x = +3
Câu 5. A
Liên kết ion là liên kết mà hiệu độ âm điện giữa hai nguyên tử tham gia liên kết ≥ 1,7.
| Phân tử | NaF | CH4 | H2O | CO2 |
| Hiệu độ âm điện | 3,05 | 0,35 | 1,24 | 0,89 |
Câu 6. C
Phản ứng thế luôn là phản ứng oxi hóa – khử.
Một số ví dụ phản ứng không là phản ứng oxi hóa - khử:
CaO + CO2 →CaCO3 là phản ứng hóa hợp nhưng không là phản ứng oxi hóa – khử.
CaCO3 →CaO + CO2 là phản ứng phân hủy nhưng không là phản ứng oxi hóa – khử.
HCl + NaOH → NaCl + H2O là phản ứng trung hòa nhưng không là phản ứng oxi hóa - khử.
Câu 7. B.
Số oxi hóa của S tăng từ -2 lên 0, Vậy H2S đóng vai trò là chất khử.
Câu 8. B
Chất oxi hóa và chất khử lần lượt là KMnO4 và FeSO4.
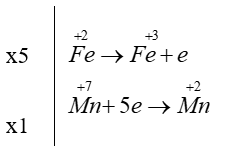
2KMnO4 + 10FeSO4 + 8H2SO4 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Câu 9. C
nMg = 0,1 (mol)
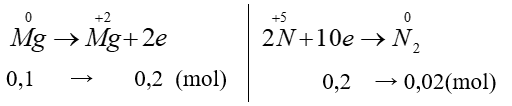
VN2 = 0,02.22,4 = 0,448(l)
Câu 10. A.
Chất oxi hóa là chất nhận electron và có sự giảm số oxi hóa.
Sở Giáo dục và Đào tạo .....
Đề thi Giữa học kì 1
Môn: Hóa học 10
Thời gian làm bài: 45 phút
Bài giảng: Đề kiểm tra 1 tiết Hóa học 10 Học kì 1 có đáp án (Lần 1 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Câu 1: Số electron tối đa của các phân lớp s, p, d, f lần lượt là?
A. 1; 3; 5; 7. B. 1; 2; 3; 4.
C. 2; 6; 10; 14. D. 2; 4; 6; 8.
Câu 2: Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron, nơtron, proton. B. electron, proton.
C. nơtron, electron. D. proton, nơtron.
Câu 3: Nguyên tử O (Z = 8) nhận thêm 2e thì cấu hình e tương ứng của nó là
A. 1s22s22p63s1. B. 1s22s22p6.
C. 1s22s22p63s23p6. D. 1s22s22p4.
Câu 4: Cho cấu hình electron của Al (Z = 13): 1s22s22p63s23p1. Hỏi Al thuộc loại nguyên tố gì?
A. Nguyên tố d. B. Nguyên tố s. C. Nguyên tố f. D. Nguyên tố p.
Câu 5: Trong tự nhiên Kali có ba đồng vị: 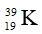
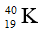
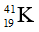
A. 0,484% và 6,258%. B. 0,012% và 6,73% .
C. 0,484% và 6,73%. D. 0,012% và 6,258%.
Câu 6: Ở trạng thái cơ bản S (Z = 16) có bao nhiêu electron ở phân lớp ngoài cùng?
A. 1. B. 2. C. 3. D. 4.
Câu 7: Trong tự nhiên, Clo có 2 đồng vị 35Cl và 37Cl, trong đó đồng vị chiếm 35Cl 75% về số đồng vị. Phần trăm khối lượng của 35Cl trong KClO4 là (cho nguyên tử khối: K=39, O=16)
A. 21,43%. B. 7,55%. C. 18,95%. D. 64,29%.
Câu 8: Số e tối đa trong phân lớp p là
A. 2. B. 10. C. 6. D. 14.
Câu 9: Nguyên tử Na (Z = 11) bị mất đi 1e thì cấu hình e tương ứng của nó là
A. 1s22s22p63s23p64s1. B. 1s22s22p63s1.
C. 1s22s22p6. D. 1s22s22p63s3.
Câu 10: Nguyên tử của nguyên tố nào sau đây có số hạt nơtron nhỏ nhất ?
A. 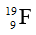
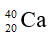
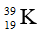
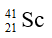
Câu 11: Ở trạng thái cơ bản,cấu hình electron nguyên tử nitơ (Z = 7) có bao nhiêu phân lớp?
A. 3. B. 5. C. 1. D. 2.
Câu 12: Cho Mg có hai đồng vị 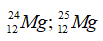
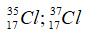
A. 6. B. 4. C. 8. D. 12.
Câu 13: Đồng có hai đồng vị 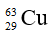
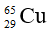
A. Cấu hình electron. B. Số electron.
C. Số proton. D. Số khối.
Câu 14: Nguyên tử Ca (Z = 20) có số e ở lớp ngoài cùng là
A. 6. B. 2. C. 10. D. 8.
Câu 15: Nguyên tử X có tổng số hạt proton, nơtron và electron là 115. Ngoài ra số khối của X là 80. Số lớp electron và số electron lớp ngoài của X cùng lần lượt là
A. 3 & 7. B. 4 & 7. C. 4 & 1. D. 3 & 5.
Câu 16: Chọn câu phát biểu sai?
A. Trong 1 nguyên tử số proton = số electron = số đơn vị điện tích hạt nhân.
B. Số khối bằng tổng số hạt proton và số nơtron.
C. Số proton bằng số electron.
D. Tổng số proton và số electron được gọi là số khối.
Câu 17: Cho nguyên tử nguyên tố X có 12 proton và 12 nơtron. Kí hiệu nguyên tử đúng của X là?
A. 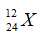
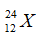
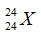
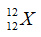
Câu 18: Các hạt cấu tạo nên nguyên tử của hầu hết các nguyên tố là
A. proton, nơtron. B. electron, proton.
C. nơtron, electron. D. electron, nơtron, proton.
Câu 19: Cho cấu hình electron của Fe (Z = 26): 1s22s22p63s23p63d64s2 . Hỏi Fe thuộc loại nguyên tố gì?
A. Nguyên tố s. B. Nguyên tố d. C. Nguyên tố f. D. Nguyên tố p.
Câu 20: Nguyên tử của nguyên tố R có 3 lớp e, lớp ngoài cùng có 5e. Vậy số hiệu nguyên tử của nguyên tố R là
A. 19. B. 16. C. 14. D. 15.
Câu 21: Một nguyên tố X có 2 đồng vị có tỉ lệ số nguyên tử là 27/23. Hạt nhân của X có 35 proton. Đồng vị thứ nhất có 44 nơtron. Đồng vị thứ hai có nhiều hơn đồng vị thứ nhất là 2 nơtron. Nguyên tử khối trung bình của nguyên tố X là
A. 78,90. B. 79,20. C. 79,92. D. 80,5.
Câu 22: Trong tự nhiên, nguyên tố đồng có hai đồng vị là 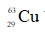
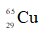
A. 27%. B. 50%. C. 73%. D. 54%.
Câu 23: Có các nguyên tố hóa học: Cr (Z = 24), Fe (Z = 26), P (Z = 15), Al (Z = 13). Nguyên tố mà nguyên tử của nó có số electron lớp ngoài cùng lớn nhất ở trạng thái cơ bản là
A. Al. B. Fe. C. Cr. D. P.
Câu 24: Cấu hình electron nào sau đây là của kim loại
A. 1s22s22p63s23p5 . B. 1s22s22p63s23p4 .
C. 1s22s22p63s23p6. D. 1s22s22p63s2.
Câu 25: Có 3 nguyên tử: 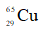
A. X & Y. B. Y & Z. C. X & Z. D. X,Y & Z.
Câu 26. Trong nguyên tử, hạt không mang điện là
A. nơtron và proton B. proton C. electron D. nơtron
Câu 27. Ion có 18 electron và 16 proton mang điện tích là
A. 16+. B. 2−. C. 18−. D. 2+.
Câu 28. Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hoá học vì nó cho biết
A. số khối A B. số hiệu nguyên tử Z
C. nguyên tử khối của nguyên tử D. số khối A và số hiệu nguyên tử Z
Câu 29. Một nguyên tố hoá học có thể có nhiều nguyên tử có khối lượng khác nhau vì lí do nào dưới đây?
A. Hạt nhân có cùng số nơtron nhưng khác nhau về số proton.
B. Hạt nhân có cùng số proton nhưng khác nhau về số nơtron.
C. Hạt nhân có cùng số nơtron nhưng khác nhau về số electron.
D. Hạt nhân có cùng số proton và số electron.
Câu 30. Trên vỏ nguyên tử, các electron chuyển động xung quanh hạt nhân................ Hãy chọn cụm từ thích hợp đối với chỗ trống ở trên.
A. với vận tốc rất lớn trên những quỹ đạo xác định
B. với vận tốc rất lớn không theo quỹ đạo xác định
C. một cách tự do
D. với vận tốc rất lớn có quỹ đạo hình elip hay hình tròn
Hướng dẫn giải:
Câu 1. C
Câu 2. D
Câu 3. B
Cấu hình electron của Oxi: 1s22s22p4.
Sau khi O nhận thêm 2e được ion có cấu hình electron là: 1s22s22p6.
Câu 4. D
Theo trật tự phân mức năng lượng, electron cuối cùng được điền vào phân lớp p.
Câu 5. A
Theo bài ra ta có hệ phương trình:
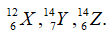
Câu 6. D
Cấu hình electron của S là: [Ne]3s23p4 → Số electron ở phân lớp ngoài cùng là 4.
Câu 7. C
Nguyên tử khối trung bình của Cl là :
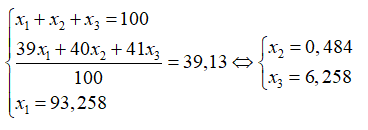
Giả sử có 1 mol KClO4 → Số mol Cl = 1; số mol 35Cl là 0,75.
Phần trăm khối lượng của 35Cl trong KClO4 là
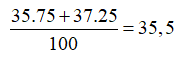
Câu 8. C
Câu 9. C
Cấu hình electron của Na là [Ne]3s1. → Cấu hình electron của Na khi mất 1 electron là : 1s22s22p6.
Câu 10. A
Số nơtron của F là 19 – 9 = 10.
Số nơtron của Ca, K và Sc đều là 20.
Câu 11. A
Cấu hình electron của N là: 1s22s22p3. Vậy cấu hình electron nguyên tử N gồm 3 phân lớp.
Câu 12. A
Các công thức có thể có là: 24Mg35Cl2; 24Mg37Cl2; 24Mg35Cl37Cl; 25Mg35Cl2; 25Mg37Cl2; 25Mg35Cl37Cl;
Câu 13. D
Câu 14. B
Cấu hình electron nguyên tử Ca là: [Ar]4s2. Vậy số e lớp ngoài cùng là 2.
Câu 15. B
Gọi số proton, nơtron và electron trong X lần lượt là p, n và e.
Theo bài ra ta có hệ phương trình:
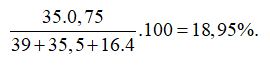
Cấu hình electron nguyên tử X là: [Ar]3d104s24p5. Vậy X có 4 lớp electron và 7electron lớp ngoài cùng.
Câu 16. D
Số khối bằng tổng số hạt proton và số nơtron.
Câu 17. B
Số khối A = 12 + 12 = 24.
Số hiệu nguyên tử Z = số proton = 12.
Kí hiệu nguyên tử là 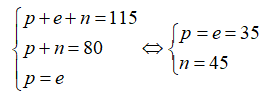
Câu 18. D
Câu 19. B
Theo trật tự phân mức năng lượng, electron cuối cùng điến vào phân lớp d.
Câu 20. D
Cấu hình electron của R là [Ne]3s23p3.
Vậy số hiệu nguyên tử của R = số electron của R = 15.
Câu 21. C
Số khối của đồng vị thứ nhất là: 79
Số khối của đồng vị thứ hai là: 79 + 2 = 81.
Một cách gần đúng, coi số khối xấp xỉ nguyên tử khối.
Nguyên tử khối trung bình của X là: 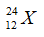
Câu 22. A
Gọi x và y lần lượt là % số nguyên tử của hai đồng vị và .
Ta có:
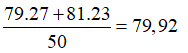
Câu 23.
Ta có cấu hình electron nguyên tử của các nguyên tố là:
Cr: [Ar]3d54s1 → 1e lớp ngoài cùng.
Fe: [Ar]3d64s2 → 2e lớp ngoài cùng.
P: [Ne]3s23p3→ 5e lớp ngoài cùng.
Al: [Ne]3s23p1→ 3e lớp ngoài cùng.
Nguyên tố có số electron lớp ngoài cùng lớn nhất ở trạng thái cơ bản là P.
Câu 24. D
Nguyên tử có 1,2, 3 electron lớp ngoài cùng là nguyên tử của nguyên tố kim loại.
Ta có cấu hình e: 1s22s22p63s2 → 2 e lớp ngoài cùng.
Câu 25. C
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số nơtron.
X và Z cùng số proton.
Câu 26. D
Câu 27. B
Ion có số electron > số proton → mang điện tích âm.
Số đơn vị điện tích âm là 18 – 16 = 2.
Vậy ion mang điện tích 2-.
Câu 28. D
Câu 29. B
Sự khác nhau về số nơtron tạo ra các đồng vị của cùng một nguyên tố.
Câu 30. B.
Các electron chuyển động xung quanh hạt nhân với vận tốc lớn và không theo quỹ đạo xác định.
Xem thêm đề thi Hóa học 10 chọn lọc, có đáp án hay khác:
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 10 (các môn học)
- Giáo án điện tử lớp 10 (các môn học)
- Giáo án Ngữ văn 10
- Giáo án Toán 10
- Giáo án Tiếng Anh 10
- Giáo án Vật Lí 10
- Giáo án Hóa học 10
- Giáo án Sinh học 10
- Giáo án Lịch Sử 10
- Giáo án Địa Lí 10
- Giáo án Kinh tế Pháp luật 10
- Giáo án Tin học 10
- Giáo án Công nghệ 10
- Giáo án Giáo dục quốc phòng 10
- Giáo án Hoạt động trải nghiệm 10
- Đề thi lớp 10 (các môn học)
- Đề thi Ngữ Văn 10 (có đáp án)
- Chuyên đề Tiếng Việt lớp 10
- Đề cương ôn tập Văn 10
- Đề thi Toán 10 (có đáp án)
- Đề thi cương ôn tập Toán 10
- Đề thi Toán 10 cấu trúc mới (có đáp án)
- Đề thi Tiếng Anh 10 (có đáp án)
- Đề thi Vật Lí 10 (có đáp án)
- Đề thi Hóa học 10 (có đáp án)
- Đề thi Sinh học 10 (có đáp án)
- Đề thi Lịch Sử 10 (có đáp án)
- Đề thi Địa Lí 10 (có đáp án)
- Đề thi Kinh tế & Pháp luật 10 (có đáp án)
- Đề thi Tin học 10 (có đáp án)
- Đề thi Công nghệ 10 (có đáp án)
- Đề thi Giáo dục quốc phòng 10 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

