Top 31 Đề thi Hóa học 10 Học kì 2 có đáp án, cực hay
Top 31 Đề thi Hóa học 10 Học kì 2 có đáp án, cực hay
Dưới đây là danh sách Top 31 Đề thi Hóa học 10 Học kì 2 có đáp án, cực hay gồm đề kiểm tra 15 phút, Đề thi Giữa kì, đề thi học kì 2. Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện & đạt điểm cao trong các bài thi môn Hóa học 10.
Đề kiểm tra Hóa học 10 Học kì 2
- Đề kiểm tra 15p Hóa học 10 Học kì 2 có đáp án (Bài số 1)(8 đề)
- Đề kiểm tra 15p Hóa học 10 Học kì 2 có đáp án (Bài số 2)(8 đề)
- Đề kiểm tra Hóa học 10 Giữa học kì 2 có đáp án (5 đề)
- Đề thi Hóa học 10 Giữa kì 2 có đáp án (5 đề)
- Đề thi Hóa học 10 Học kì 2 có đáp án (5 đề)
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm Học kì 2
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 1)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 1 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
Câu 1: Dãy đơn chất nào sau đây được sắp xếp đúng theo thứ tự tính oxi hoá giảm dần?
A. Br2, Cl2, F2 , I2.
B. F2 , Cl2, Br2, I2.
C. I2, Br2, Cl2, F2.
D. Cl2, F2, Br2, I2.
Câu 2: Phản ứng hóa học nào sau đây không xảy ra?
A. 2KOH + Cl2 → KClO + KCl + H2O.
B. 2KCl + Br2 → Cl2 + 2KBr.
C. Cl2 + 2KI → 2KCl +I2.
D. Cu + Cl2 → CuCl2.
Câu 3: Cho 8,7 gam MnO2 tác dụng với lượng dư dung dịch HCl đặc, đun nóng. Thể tích khí thoát ra (ở đktc) là
A. 0,56 lít. B. 1,12 lít. C. 2,24 lít. D. 0,112 lít.
Câu 4: Dãy chất nào dưới đây tác dụng được với dd HCl?
A. Fe2O3, KMnO4, Cu.
B. CaCO3, CuO, H2SO4.
C. AgNO3, NaOH, CuO.
D. CuO, KOH, Ag.
Câu 5: Cho 25,6 gam hỗn hợp G gồm: FeCO3 và Mg vào một lượng vừa đủ m gam ddHCl 10%. Sau phản ứng thu được dung dịch A và 6,72 lít khí B ở đktc. % khối lượng của FeCO3 và Mg lần lượt là
A. 90, 625% và 9,375%.
B. 9,375% và 90,625%.
C. 37,235% và 62,765%.
D. 62,765 và 37,235%.
Câu 6: Các nguyên tố halogen có cấu hình electron lớp ngoài cùng là
A. ns2np5. B. 4s24p5. C. 3s23p5. D. 2s22p5.
Câu 7: Kết tủa hoàn toàn m gam NaCl bởi dung dịch AgNO3 dư thấy thu được 2,87 gam kết tủa. Giá trị của m là
A. 11,7 gam. B. 1,71 gam. C. 17,1 gam. D. 1,17 gam.
Câu 8: Thành phần của nước Gia – ven là
A. NaCl, NaClO, H2O.
B. HCl, HClO, Cl2, H2O.
C. CaOCl2, H2O.
D. KClO3, H2O.
Câu 9: Dung dịch axit nào sau đây không thể chứa trong bình thủy tinh?
A. HCl. B. HBr. C. HF. D. H2SO4.
Câu 10: Đổ dung dịch chứa 1 mol NaOH vào dung dịch chứa 1 mol HCl. Nhúng giấy quỳ tím vào dung dịch thu được thì quỳ tím chuyển sang màu nào?
A. Màu đỏ. B. Màu xanh.
C. Không đổi màu. D. Không xác định được
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | B | B | C | C | A | A | D | A | C | C |
Câu 1: Tính oxi hoá giảm dần theo thứ tự F2 , Cl2, Br2, I2. Chọn đáp án B.
Câu 2: KCl + Br2 → không xảy ra do tính oxi hóa Br2 < Cl2. Chọn đáp án B.
Câu 3:
MnO2 + 4HCl → MnCl2 + Cl2 + H2O.
Số mol Cl2 = số mol MnO2 = 0,1 mol. Vậy V = 2,24 lít. Chọn đáp án C.
Câu 4: Dãy chất tác dụng được với dd HCl là AgNO3, NaOH, CuO. Chọn đáp án C.
Câu 5:
FeCO3 + 2HCl → FeCl2 + CO2 + H2O.
a a (mol)
Mg + 2HCl → MgCl2 + H2.
b b (mol)
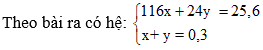
giải hệ có x = 0,2; y = 0,1
→ % khối lượng FeCO3 và Mg lần lượt là 90, 625% và 9,375%. Chọn đáp án A.
Câu 6: Các nguyên tố halogen có cấu hình electron lớp ngoài cùng là ns2np5. Chọn đáp án A.
Câu 7:
NaCl + AgNO3 → NaNO3 + AgCl
0,02 ← 0,02 (mol)
m = 0,02.58,5 = 1,17 gam. Chọn đáp án D.
Câu 8: Thành phần của nước Gia – ven là NaCl, NaClO, H2O. Chọn đáp án A.
Câu 9: Axit HF có tính chất đặc biệt là ăn mòn thủy tinh nên không thể đựng trong bình thủy tinh. Chọn đáp án C.
Câu 10:
NaOH + HCl → NaCl + H2O
1 1 (mol)
Sau phản ứng dung dịch thu được chỉ chứa NaCl, vậy dung dịch sau phản ứng không làm quỳ tím đổi màu. Chọn đáp án C.
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 1)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 2 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
Câu 1: Trong phòng thí nghiệm, người ta thường điều chế oxi bằng cách
A. nhiệt phân KClO3 có xúc tác MnO2.
B. nhiệt phân Cu(NO3)2.
C. điện phân nước.
D. chưng cất phân đoạn không khí lỏng.
Câu 2: Khi nhiệt phân 24,5 gam KClO3 theo phản ứng: 2KClO3 -MnO2→ 2KCl + 3O2. Thể tích khí oxi thu được (đktc) là
A. 4,48 lít. B. 6,72 lít. C. 2,24 lít. D. 8,96 lít.
Câu 3: Các số oxi hóa phổ biến của S là
A. -2, 0, +2, +4. B. -2, 0, +4, +6.
C. -2, 0, +3, +5. D. -1, 0, +1, +3, +5.
Câu 4: Phương pháp để loại bỏ tạp chất HCl có lẫn trong khí H2S là: Cho hỗn hợp khí lội từ từ qua một lượng dư dung dịch
A. NaHS. B. Pb(NO3)2 C. NaOH. D. AgNO3.
Câu 5: Đốt hoàn toàn m gam FeS2 trong oxi dư thu được 2,24 lít khí SO2 (đktc). Giá trị của m là
A. 6g. B. 1,2g. C. 12g. D. 60g.
Câu 6: Dung dịch H2SO4 loãng có thể tác dụng với cả 2 chất nào sau đây?
A. Cu và Cu(OH)2. B. Fe và Fe(OH)3.
C. C và CO2. D. S và H2S.
Câu 7: H2SO4 đặc khi tiếp xúc với đường, vải, giấy có thể làm chúng hóa đen do tính chất nào dưới đây?
A. Oxi hóa mạnh. B. Háo nước.
C. Axit mạnh. D. Khử mạnh.
Câu 8: Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10%, thu được 2,24 lít khí H2 (ở đktc). Khối lượng dung dịch thu được sau phản ứng là
A. 101,68 gam. B. 88,20 gam. C. 101,48 gam. D. 97,80 gam.
Câu 9: Phát biểu nào sau đây là không đúng?
A. Trong y học, ozon được dùng để chữa sâu răng.
B. SO2 được dùng để tẩy trắng giấy, bột giấy, chất chống nấm mốc trong lương thực, thực phẩm.
C. Để phân biệt khí SO2 và khí CO2 ta dùng dung dịch brom.
D. Tính axit của H2CO3 < H2S < H2SO3 < H2SO4.
Câu 10: Ứng dụng nào sau đây không phải của ozon?
A. Tẩy trắng tinh bột, dầu ăn.
B. Chữa sâu răng.
C. Điều chế oxi trong phòng thí nghiệm.
D. Sát trùng nước sinh hoạt.
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | A | B | B | A | A | B | B | C | D | C |
Câu 1: Trong phòng thí nghiệm, người ta thường điều chế oxi bằng cách nhiệt phân KClO3 có xúc tác MnO2. Chọn đáp án A.
Câu 2:
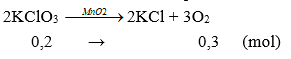
Vkhí = 0,3.22,4 = 6,72 lít. Chọn đáp án B.
Câu 3: Các số oxi hóa phổ biến của S là -2, 0, +4, +6. Chọn đáp án B.
Câu 4: HCl + NaHS → NaCl + H2S ↑. Chọn đáp án A.
Câu 5:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
0,05 ← 0,1 (mol)
m = 0,05. 120 = 6 gam. Chọn đáp án A.
Câu 6:
Fe + H2SO4 (loãng) → FeSO4 + H2
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Chọn đáp án B.
Câu 7: H2SO4 đặc khi tiếp xúc với đường, vải, giấy có thể làm chúng hóa đen do tính háo nước. Chọn đáp án B.
Câu 8:
Áp dụng ĐL bảo toàn nguyên tố cho H có số mol H2SO4 = số mol H2 = 0,1 mol.
maxit = 0,1.98 = 9,8 gam
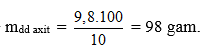
Áp dụng định luật bảo toàn khối lượng: mdd sau = mKL + mdd axit - mkhí = 3,68 + 98 – 0,2 = 101,48 gam. Chọn đáp án C.
Câu 9: Tính axit H2CO3 > H2S. Chọn đáp án D.
Câu 10: Ozon không đươc ứng dụng để điều chế oxi trong phòng thí nghiệm. Chọn đáp án C.
Sở Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 1)
Bài giảng: Đề kiểm tra 1 tiết Hóa học 10 Học kì 2 có đáp án (Lần 1 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Phát biểu nào sau đây là sai?
A. Bán kính nguyên tử của clo lớn hơn bán kính nguyên tử của flo.
B. Độ âm điện của brom lớn hơn độ âm điện của iot.
C. Tính khử của ion Br- lớn hơn tính khử của ion Cl-.
D. Tính axit của HF mạnh hơn tính axit của HCl.
Câu 2: Dãy gồm các chất đều tác dụng được với dung dịch HCl loãng là
A. Ag, CaCO3, CuO.
B. FeS, BaSO4, KOH.
C. AgNO3, (NH4)2CO3, Cu.
D. Mg(HCO3)2, AgNO3, CuO.
Câu 3: Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách
A. điện phân nóng chảy NaCl.
B. cho dung dịch HCl đặc tác dụng với MnO2, đun nóng.
C. điện phân dung dịch NaCl có màng ngăn.
D. cho F2 đẩy Cl2 ra khỏi dung dịch NaCl.
Câu 4: Cho kim loại M tác dụng với Cl2 được muối X; cho kim loại M tác dụng với dung dịch HCl được muối Y. Nếu cho kim loại M tác dụng với dung dịch muối X ta cũng được muối Y. Kim loại M có thể là
A. Mg. B. Zn. C. Al. D. Fe.
Câu 5: Khi cho dung dịch AgNO3 phản ứng với dung dịch nào sau đây sẽ cho kết tủa màu vàng đậm nhất?
A. Dung dịch HI. B. Dung dịch HCl.
C. Dung dịch HBr. D. Dung dịch HF.
Câu 6: Trong phản ứng: Cl2 + H2O ↔ HCl + HClO, clo đóng vai trò
A. không là chất oxi hóa, không là chất khử.
B. là chất oxi hóa.
C. là chất khử.
D. vừa là chất oxi hóa, vừa là chất khử.
Câu 7: Trong phòng thí nghiệm, dung dịch HF không được bảo quản trong bình làm bằng chất liệu nào?
A. Nhựa. B. Gốm sứ.
C. Thủy tinh. D. Polime.
Câu 8: Cho 5,4 gam Al phản ứng hoàn toàn với dung dịch HCl loãng, dư thu được bao nhiêu lít khí H2 (đktc)?
A. 4,48 lít. B. 2,24 lít. C. 6,72 lít. D. 7,84 lít.
Câu 9: Cho 0,1 mol KMnO4 tác dụng với dung dịch HCl dư, đun nóng. Thể tích khí thoát ra (ở đktc) là
A. 0,56 lít. B. 5,6 lít. C. 2,24 lít. D. 0,112 lít.
Câu 10: Khi cho mẩu quỳ tím ẩm vào bình đựng khí Cl2, hiện tượng thu được là
A. quỳ tím chuyển sang màu đỏ.
B. quỳ tím không chuyển màu.
C. quỳ tím chuyển sang màu đỏ, sau đó mất màu.
D. quỳ tím chuyển sang màu xanh.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Bằng phương pháp hóa học (không dùng chất chỉ thị) hãy phân biệt các dd sau chứa trong các lọ riêng biệt mất nhãn: MgCl2, KBr, KCl.
Câu 2 ( 2 điểm): Cho m gam hỗn hợp G gồm: CaCO3 và Al vào một lượng vừa đủ V lít dung dịch HCl 2M. Sau phản ứng thu được dung dịch A và 8,96 lít khí B ở đktc. Cô cạn A thu được 37,8 gam muối khan.
1/ Xác định % khối lượng của các chất trong G.
2/ Tính CM của các chất trong A.
Câu 3 ( 2 điểm): Cho 5,965gam hỗn hợp A gồm: NaX, NaY (X,Y là hai halogen liên tiếp, nguyên tử khối của X < Y) vào dung dịch AgNO3 dư. Kết thúc phản ứng thu được 1,435gam kết tủa. Xác định hai nguyên tố X, Y.
Câu 4 ( 1 điểm): Sục V lít Cl2 ở đktc vào 100ml dung dịch C gồm: NaF 1M; NaBr 3M và KI 2M thu được dung dịch D. Cô cạn D thu được 41,1 gam chất rắn khan E. Xác định V.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | D | D | B | D | A | D | C | C | B | C |
Câu 1: Tính axit của HF yếu hơn tính axit của HCl. Chọn đáp án D.
Câu 2: Dãy gồm các chất đều tác dụng được với dung dịch HCl loãng là Mg(HCO3)2, AgNO3, CuO. Chọn đáp án D.
Câu 3: Điều chế clo trong PTN bằng cách cho axit HCl đặc tác dụng với chất oxi hóa mạnh như MnO2 rắn hoặc KMnO4 rắn … Chọn đáp án B.
Câu 4: Chọn đáp án D. PTHH minh họa:
2Fe + 3Cl2 → 2FeCl3 (X)
Fe + 2HCl → FeCl2 (Y) + H2
Fe + 2FeCl3 (X) → 3FeCl2 (Y).
Câu 5: Ta có: AgF (dung dịch); AgCl (kết tủa trắng); AgBr (kết tủa vàng); AgI (kết tủa vàng đậm). Chọn đáp án A.
Câu 6: Vậy Cl2 vừa đóng vai trò là chất oxi hóa, vừa đóng vai trò là chất khử.
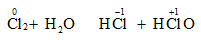
Câu 7: Axit HF có tính chất đặc biệt là ăn mòn thủy tinh nên không thể đựng trong bình thủy tinh. Chọn đáp án C.
Câu 8:
2Al + 6HCl → 2AlCl3 + 3H2
0,2 → 0,3 (mol)
V = 0,3.22,4 = 6,72 lít. Chọn đáp án C.
Câu 9:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
0,1 → 0,25 (mol)
V = 0,25.22,4 = 5,6 lít. Chọn đáp án B.
Câu 10: Khi cho mẩu quỳ tím ẩm vào bình đựng khí Cl2 có phản ứng: Cl2 + H2O ↔ HCl + HClO. Phản ứng sinh ra hai axit làm quỳ tím chuyển sang màu đỏ. Tuy nhiên HClO có tính oxi hóa mạnh có thể phá hủy các hợp chất màu. Vậy hiện tượng thu được là quỳ tím chuyển sang màu đỏ, sau đó mất màu.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
Đánh số thứ tự từng lọ, trích mẫu thử. (0,5 điểm)
Dùng dd NaOH nhận ra MgCl2 nhờ kết tủa trắng (0,5 điểm)
PTHH: MgCl2 + 2NaOH → Mg(OH)2 (↓) + 2NaCl.
Dùng dd AgNO3 nhận ra KCl (kết tủa trắng), KBr (kết tủa vàng nhạt). (0,5 điểm)
PTHH: (0,5 điểm)
AgNO3 + KCl → AgCl + KNO3
AgNO3 + KBr → AgBr + KNO3.
(viết đúng mỗi PTHH 0,25 điểm)
Câu 2 ( 2 điểm):
1. Gọi số mol CaCO3 = x; số mol Al = y; tính số mol khí = 0,4 mol. (0,25 điểm)
CaCO3 + 2HCl → CaCl2 + CO2 + H2O (0,5 điểm)
x → x (mol)
2Al + 6HCl → 2AlCl3 + 3H2
y → 1,5y (mol)
(mỗi PTHH đúng 0,25 điểm)
Lập hệ: (0,25 điểm)
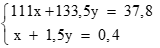
Giải hệ: x = 0,1; y = 0,2
Tính được %mCaCO3 = 64,935%; %mAl = 35,065%.
2. Tính số mol HCl pư = 0,8 mol và tính V = 0,4 lít. (0,25 điểm)
Tính số mol các chất tan trong A: CaCl2 0,1 mol và AlCl3 = 0,2 mol. (0,25 điểm)
Tính được: CMCaCl2 = 0,1:0,4 = 0,25M; CMAlCl3 = 0,2:0,4 = 0,5M. (0,25 điểm)
Câu 3 ( 2 điểm):
Trường hợp 1: X là Flo và Y là Clo. Ta có PTHH: (0,25 điểm)
Tính được số mol AgCl = 0,01 mol
NaCl + AgNO3 → AgCl + NaNO3 (0,5 điểm)
0,01 ← 0,01 (mol)
→ mNaCl = 0,01.58,5 = 0,585 < 5,965 (thỏa mãn) (0,25 điểm)
Trường hợp 2: X khác F gọi X, Y là E (điều kiện: 35,5 < ME < 127). Ta có PTHH: (0,25 điểm)
NaE + AgNO3 → AgE + NaNO3
Ta có số mol NaE = số mol AgE (0,5 điểm)
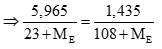
Giải PT → ME < 0 (loại). (0,25 điểm)
Câu 4 ( 1 điểm):
Các pư có thể xảy ra theo thứ tự: (0,25 điểm)
Cl2 + 2KI → 2KCl + I2 (1)
0,1← 0,2 → 0,2 (mol)
Cl2 + 2NaBr → 2NaCl + Br2 (2)
0,3 → 0,3 (mol)
npư: x → 2x → 2x (mol)
Số mol các chất: NaF 0,1 mol; NaBr 0,3 mol; KI 0,2 mol
- Giả sử Cl2 phản ứng vừa đủ ở phản ứng 1. (0,25 điểm)
Theo pư 1: Chất rắn E gồm: NaF 0,1 mol; KCl 0,2 mol; NaBr 0,3 mol
m1 = 0,1.42 + 0,2.74,5 + 0,3.103 = 50 gam.
- Giả sử Cl2 phản ứng vừa đủ ở phản ứng 2. (0,25 điểm)
Theo phản ứng 1,2: Chất rắn E gồm: NaF 0,1 mol; KCl 0,2 mol; NaCl 0,3 mol
m2 = 0,1.42 + 0,2.74,5 + 0,3.58,5 = 36,65 gam.
Nhận xét: m2 < mE < m1 → Pư 2 mới xảy ra 1 phần
Gọi số mol Cl2 pư ở 2 là x mol: Theo pư 1,2: (0,25 điểm)
- E gồm: NaF 0,1 mol; KCl 0,2 mol; NaCl 2x mol; NaBr (0,3-2x) mol
Ptr: 0,1.42 + 0,2.74,5 + 2x.58,5 + (0,3-2x).103 = 41,1 x = 0,1
- Số mol Cl2 đã dùng = 0,1+x = 0,2 mol → V = 0,2.22,4 = 4,48 lít
Xem thêm đề thi Hóa học 10 chọn lọc, có đáp án hay khác:
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 10 (các môn học)
- Giáo án điện tử lớp 10 (các môn học)
- Giáo án Ngữ văn 10
- Giáo án Toán 10
- Giáo án Tiếng Anh 10
- Giáo án Vật Lí 10
- Giáo án Hóa học 10
- Giáo án Sinh học 10
- Giáo án Lịch Sử 10
- Giáo án Địa Lí 10
- Giáo án Kinh tế Pháp luật 10
- Giáo án Tin học 10
- Giáo án Công nghệ 10
- Giáo án Giáo dục quốc phòng 10
- Giáo án Hoạt động trải nghiệm 10
- Đề thi lớp 10 (các môn học)
- Đề thi Ngữ Văn 10 (có đáp án)
- Chuyên đề Tiếng Việt lớp 10
- Đề cương ôn tập Văn 10
- Đề thi Toán 10 (có đáp án)
- Đề thi cương ôn tập Toán 10
- Đề thi Toán 10 cấu trúc mới (có đáp án)
- Đề thi Tiếng Anh 10 (có đáp án)
- Đề thi Vật Lí 10 (có đáp án)
- Đề thi Hóa học 10 (có đáp án)
- Đề thi Sinh học 10 (có đáp án)
- Đề thi Lịch Sử 10 (có đáp án)
- Đề thi Địa Lí 10 (có đáp án)
- Đề thi Kinh tế & Pháp luật 10 (có đáp án)
- Đề thi Tin học 10 (có đáp án)
- Đề thi Công nghệ 10 (có đáp án)
- Đề thi Giáo dục quốc phòng 10 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

