Đề kiểm tra 15p Hóa học 10 Học kì 2 có đáp án (Bài số 2)(8 đề)
Dưới đây là danh sách Đề kiểm tra 15p Hóa học 10 Học kì 2 có đáp án (Bài số 2)(8 đề). Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện & đạt điểm cao trong các bài thi môn Hóa học 10.
Đề kiểm tra 15p Hóa học 10 Học kì 2 có đáp án (Bài số 2)(8 đề)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 2 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Đề kiểm tra 15 phút - Trắc nghiệm
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 1)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 2 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
Câu 1: Trong phòng thí nghiệm, người ta thường điều chế oxi bằng cách
A. nhiệt phân KClO3 có xúc tác MnO2.
B. nhiệt phân Cu(NO3)2.
C. điện phân nước.
D. chưng cất phân đoạn không khí lỏng.
Câu 2: Khi nhiệt phân 24,5 gam KClO3 theo phản ứng: 2KClO3 -MnO2→ 2KCl + 3O2. Thể tích khí oxi thu được (đktc) là
A. 4,48 lít. B. 6,72 lít. C. 2,24 lít. D. 8,96 lít.
Câu 3: Các số oxi hóa phổ biến của S là
A. -2, 0, +2, +4. B. -2, 0, +4, +6.
C. -2, 0, +3, +5. D. -1, 0, +1, +3, +5.
Câu 4: Phương pháp để loại bỏ tạp chất HCl có lẫn trong khí H2S là: Cho hỗn hợp khí lội từ từ qua một lượng dư dung dịch
A. NaHS. B. Pb(NO3)2 C. NaOH. D. AgNO3.
Câu 5: Đốt hoàn toàn m gam FeS2 trong oxi dư thu được 2,24 lít khí SO2 (đktc). Giá trị của m là
A. 6g. B. 1,2g. C. 12g. D. 60g.
Câu 6: Dung dịch H2SO4 loãng có thể tác dụng với cả 2 chất nào sau đây?
A. Cu và Cu(OH)2. B. Fe và Fe(OH)3.
C. C và CO2. D. S và H2S.
Câu 7: H2SO4 đặc khi tiếp xúc với đường, vải, giấy có thể làm chúng hóa đen do tính chất nào dưới đây?
A. Oxi hóa mạnh. B. Háo nước.
C. Axit mạnh. D. Khử mạnh.
Câu 8: Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10%, thu được 2,24 lít khí H2 (ở đktc). Khối lượng dung dịch thu được sau phản ứng là
A. 101,68 gam. B. 88,20 gam. C. 101,48 gam. D. 97,80 gam.
Câu 9: Phát biểu nào sau đây là không đúng?
A. Trong y học, ozon được dùng để chữa sâu răng.
B. SO2 được dùng để tẩy trắng giấy, bột giấy, chất chống nấm mốc trong lương thực, thực phẩm.
C. Để phân biệt khí SO2 và khí CO2 ta dùng dung dịch brom.
D. Tính axit của H2CO3 < H2S < H2SO3 < H2SO4.
Câu 10: Ứng dụng nào sau đây không phải của ozon?
A. Tẩy trắng tinh bột, dầu ăn.
B. Chữa sâu răng.
C. Điều chế oxi trong phòng thí nghiệm.
D. Sát trùng nước sinh hoạt.
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | A | B | B | A | A | B | B | C | D | C |
Câu 1: Trong phòng thí nghiệm, người ta thường điều chế oxi bằng cách nhiệt phân KClO3 có xúc tác MnO2. Chọn đáp án A.
Câu 2:
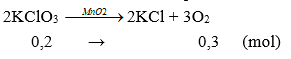
Vkhí = 0,3.22,4 = 6,72 lít. Chọn đáp án B.
Câu 3: Các số oxi hóa phổ biến của S là -2, 0, +4, +6. Chọn đáp án B.
Câu 4: HCl + NaHS → NaCl + H2S ↑. Chọn đáp án A.
Câu 5:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
0,05 ← 0,1 (mol)
m = 0,05. 120 = 6 gam. Chọn đáp án A.
Câu 6:
Fe + H2SO4 (loãng) → FeSO4 + H2
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Chọn đáp án B.
Câu 7: H2SO4 đặc khi tiếp xúc với đường, vải, giấy có thể làm chúng hóa đen do tính háo nước. Chọn đáp án B.
Câu 8:
Áp dụng ĐL bảo toàn nguyên tố cho H có số mol H2SO4 = số mol H2 = 0,1 mol.
maxit = 0,1.98 = 9,8 gam
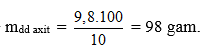
Áp dụng định luật bảo toàn khối lượng: mdd sau = mKL + mdd axit - mkhí = 3,68 + 98 – 0,2 = 101,48 gam. Chọn đáp án C.
Câu 9: Tính axit H2CO3 > H2S. Chọn đáp án D.
Câu 10: Ozon không đươc ứng dụng để điều chế oxi trong phòng thí nghiệm. Chọn đáp án C.
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 2)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 2 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
Câu 1: Khí oxi điều chế được có lẫn hơi nước. Dẫn khí oxi ẩm đi qua chất nào sau đây để được khí oxi khô?
A. Al2O3 . C. dung dịch Ca(OH)2.
B. CaO. D. dung dịch HCl.
Câu 2: Một hỗn hợp khí O2 và CO2 có tỷ khối so với hiđro là 19. Khối lượng mol trung bình của hỗn hợp khí trên và tỷ lệ % theo thể tích của O2 là
A. 40 g/mol và 40%. B. 38 g/mol và 40%.
C. 38 g/mol và 50%. D. 36 g/mol và 50%.
Câu 3: Nhận định nào sau đây không đúng khi nói về tính chất của ozon?
A. Có tính oxi hóa mạnh nhưng không có tính khử.
B. Là chất khí màu xanh nhạt, khi hóa lỏng có màu xanh đậm.
C. Khử được KI thành I2 và H2O2 thành O2.
D. Không bền, dễ bị phân hủy thành O2.
Câu 4: Lưu huỳnh thể hiện tính oxi hóa khi tác dụng với chất nào dưới đây?
A. O2. B. Al. C. H2SO4 đặc. D. F2.
Câu 5: Để phân biệt CO2 và SO2 chỉ cần dùng thuốc thử là
A. nước brom. B. CaO.
C. dung dịch Ba(OH)2. D. dung dịch NaOH.
Câu 6: Sục từ từ 2,24 lít SO2 (đktc) vào 100 ml dd NaOH 2M. Khối lượng muối tạo thành sau phản ứng là
A. 10,4 gam. B. 12,6 gam. C. 20,8 gam. D. 16,2 gam.
Câu 7: Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
A. Na. B. Al. C. Mg. D. Cu.
Câu 8: Cho 1,3g Zn và 0,56g Fe tác dụng với dung dịch H2SO4 loãng, dư thu được V lít khí (đktc). Giá trị của V là
A. 0,448l. B. 0,224l. C. 6,72l. D. 0,672l.
Câu 9: Cho 0,96g Cu phản ứng hoàn toàn với dung dịch H2SO4 đặc, nóng, dư thu được V lít khí SO2 (đktc, sản phẩm khử duy nhất). Giá trị của V là
A. 0,448 lít. B. 0,336 lít. C. 0,112 lít. D. 0,224 lít.
Câu 10: Chất nào sau đây có liên kết cộng hóa trị không cực?
A. H2S. B. O2. C. Al2S3. D. SO2.
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | B | C | C | B | A | B | D | D | B | B |
Câu 1: Dẫn khí oxi ẩm đi qua CaO để được khí oxi khô. Chọn đáp án B.
Câu 2: Gọi số mol O2 là x, số mol CO2 là y.
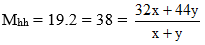
⇔ x = y → %Voxi = 50%. Chọn đáp án C.
Câu 3: Ozon oxi hóa được KI thành I2 và H2O2 thành O2. Chọn đáp án C.
Câu 4: Chọn đáp án B.
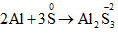
Câu 5: Phân biệt CO2 và SO2 dùng thuốc thử là nước brom. Khí nào làm nước brom mất màu là SO2, không hiện tượng là CO2. Chọn đáp án A.
Câu 6: nkhí = 0,1 mol, nOH- = 0,2 mol.
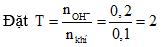
→ sau phản ứng thu được Na2SO3, hai chất tham gia phản ứng hết.
2NaOH + SO2 → Na2SO3 + H2O
0,2 0,1 0,1 (mol)
mmuối = 0,1.126 = 12,6 gam. Chọn đáp án B.
Câu 7: Kim loại không tác dụng với dung dịch H2SO4 loãng là Cu. Chọn đáp án D.
Câu 8:
Áp dụng định luật bảo toàn electron có:
nZn.2 + nFe.2 = nkhí.2 → nH2 = 1,3 : 65 + 0,56 : 56 = 0,03 (mol).
⇒ Vkhí = 0,03.22,4 = 0,672 lít. Chọn đáp án D.
Câu 9:
Áp dụng định luật bảo toàn electron ta có:
nCu.2 = nkhí.2 → nkhí = nCu = 0,015 (mol) → Vkhí = 0,015.22,4 = 0,336 lít. Chọn đáp án B.
Câu 10: Chất có liên kết cộng hóa trị không cực là O2. Chọn đáp án B.
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 3)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 2 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
Câu 1: Các khí có thể cùng tồn tại trong một hỗn hợp là
A. H2S và Cl2. B. Cl2 và O2.
C. NH3 và HCl. D. HI và O3.
Câu 2: Thể tích của 4,8g khí O2 ở điều kiện tiêu chuẩn là
A. 4,48 lít. B. 3,36 lít. C. 5,6 lít. D. 6,72 lít.
Câu 3: Hãy chọn phát biểu đúng về oxi và ozon?
A. Oxi và ozon đều có tính oxi hóa mạnh như nhau.
B. Oxi và ozon đều có số proton và số nơtron giống nhau trong phân tử.
C. Oxi và ozon đều là các dạng thù hình của nguyên tố oxi.
D. Oxi và ozon đều phản ứng được với: Ag, KI, PbS ở nhiệt độ thường.
Câu 4: Hơi thuỷ ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thuỷ ngân thì chất bột được dùng để rắc lên thuỷ ngân rồi gom lại là
A. vôi sống. B. cát.
C. muối ăn. D. lưu huỳnh.
Câu 5: Phản ứng hóa học chứng tỏ SO2 là chất oxi hóa là
A. 2H2S + SO2 → 3S + 2H2O .
B. SO2 + CaO → CaSO3.
C. SO2 + Cl2 + 2H2O → 2HCl + H2SO4.
D. SO2 + NaOH → NaHSO3.
Câu 6: Sục từ từ 2,24 lít SO2 (đktc) vào 100 ml dd NaOH 3M. Khối lượng muối tạo thành sau phản ứng là
A. 12,6 gam. B. 10,4 gam. C. 18,9 gam. D. 15,6 gam.
Câu 7: Công thức của oleum là
A. H2SO4.SO3. B. H2SO4.nH2O.
C. H2SO4.nSO3. D. H2SO4.nSO2.
Câu 8: Cho 20 gam hỗn hợp Cu và Al phản ứng với dung dịch H2SO4 loãng, dư thấy thu được 13,44 lít khí (đktc). % theo khối lượng Al và Cu trong hỗn hợp lần lượt là
A. 44% và 66%. B. 54% và 46%.
C. 50% và 50%. D. 94% và 16%.
Câu 9: Có các thí nghiệm sau:
(I) Nhúng thanh sắt vào dung dịch H2SO4 loãng, nguội.
(II) Sục khí SO2 vào nước brom.
(III) Sục khí CO2 vào nước Gia-ven.
(IV) Nhúng lá nhôm vào dung dịch H2SO4 đặc, nguội.
Số thí nghiệm xảy ra phản ứng hoá học là
A. 2. B. 1. C. 3. D. 4.
Câu 10: Hòa tan hoàn toàn 6,5 gam Zn bằng dung dịch H2SO4 đặc, nóng, dư thấy thu được V lít SO2 (đktc). Giá trị của V là
A. 2,24. B. 3,36. C. 1,12. D. 4,48.
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | B | B | C | D | A | A | C | B | C | A |
Câu 1: Cl2 + O2 → không phản ứng. Chọn đáp án B.
Câu 2: noxi = 4,8 : 32 = 0,15 (mol) → Voxi = 0,15.22,4 = 3,36 lít. Chọn đáp án B.
Câu 3: Oxi và ozon đều là các dạng thù hình của nguyên tố oxi. Chọn đáp án C.
Câu 4: Khi làm vỡ nhiệt kế thuỷ ngân thì dùng bột lưu huỳnh để rắc lên thuỷ ngân rồi gom lại. Chọn đáp án D.
Câu 5: Phản ứng hóa học chứng tỏ SO2 là chất oxi hóa là
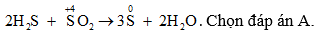
Câu 6: nkhí = 0,1 mol, nOH- = 0,3 mol.
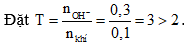
Sau phản ứng thu được Na2SO3, NaOH dư.
2NaOH + SO2 → Na2SO3 + H2O
0,1 0,1 (mol)
mmuối = 0,1. 126 = 12,6 gam. Chọn đáp án A.
Câu 7: Công thức của oleum là H2SO4.nSO3. Chọn đáp án C.
Câu 8:
Cu + H2SO4 (loãng) → không phản ứng
2Al + 3H2SO4 (loãng) → Al2(SO4)3 + 3H2
0,4 ← 0,6 (mol)
mAl = 0,4.27 = 10,8 gam → %mAl = 54%. Chọn đáp án B.
Câu 9: Thí nghiệm xảy ra phản ứng hoá học là:
(I) Nhúng thanh sắt vào dung dịch H2SO4 loãng, nguội.
(II) Sục khí SO2 vào nước brom.
(III) Sục khí CO2 vào nước Gia-ven.
Chọn đáp án C.
Câu 10:
Zn + 2H2SO4 đặc → ZnSO4 + SO2 + 2H2O
0,1 → 0,1 (mol)
Vkhí = 0,1.22,4 = 2,24 lít. Chọn đáp án A.
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm Học kì 1
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 4)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 2 - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
Câu 1: Khi nhiệt phân hoàn toàn 100 gam mỗi chất sau: KClO3 (xúc tác MnO2), KMnO4, KNO3. Chất tạo ra lượng O2 lớn nhất là
A. KClO3. B. KMnO4.
C. KNO3. D. không xác định được.
Câu 2: Nguyên tử oxi có cấu hình electron là 1s22s22p4. Ion O2- có cấu hình electron là
A. 1s22s22p4. B. 1s22s22p43s2.
C. 1s22s22p6. D. 1s22s22p63s2.
Câu 3: Tầng ozon nằm ở tầng nào của khí quyển trái đất?
A. Tầng đối lưu. B. Tầng trung lưu.
C. Tầng bình lưu. D. Tầng điện li
Câu 4: Cho phản ứng: S + 2H2SO4 đặc → 3SO2 + 2H2O. Tỉ lệ số nguyên tử S bị khử và số nguyên tử S bị oxi hóa là
A. 1 : 2. B. 1 : 3. C. 3 : 1. D. 2 : 1.
Câu 5: Chất khí X tan trong nước tạo ra một dung dịch làm chuyển màu quỳ tím thành đỏ và có thể được dùng làm chất tẩy màu. Khí X là
A. NH3. B. CO2. C. SO2. D. O3.
Câu 6: Sục từ từ 2,24 lít H2S (đktc) vào 100 ml dd KOH 3M. Khối lượng muối tạo thành sau phản ứng là
A. 11 gam. B. 7,2 gam. C. 16,6 gam. D. 10,8 gam.
Câu 7: Hoà tan 5,6 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là
A. 80. B. 40. C. 20. D. 60.
Câu 8: Dung dịch H2SO4 loãng phản ứng được với tất cả các chất trong dãy nào sau đây?
A. Al2O3, Ba(OH)2, Ag. B. CuO, NaCl, CuS.
C. FeCl3, MgO, Cu. D. BaCl2, Na2CO3, FeS.
Câu 9: Trường hợp không xảy ra phản ứng hóa học là
A. O2 + 2H2S → 2H2O + 2S.
B. FeCl2 + H2S → FeS + 2HCl.
C. O2 + 2KI + H2O → 2KOH + I2 + O2.
D. Cl2 + 2NaOH → NaCl + NaClO + H2O.
Câu 10: Hòa tan hết 0,2 mol Fe(OH)2 bằng dung dịch H2SO4 đặc, nóng (dư), thu được V lít (đktc) khí SO2 (sản phẩm khử duy nhất). Giá trị của V là
A. 2,24 lít. B. 3,36 lít. C. 4,48 lít. D. 6,72 lít.
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | A | C | C | D | C | A | B | D | B | A |
Câu 1:
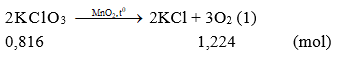
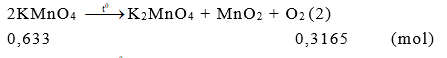
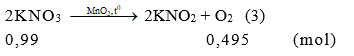
Từ (1), (2), (3) khi nhiệt phân hoàn toàn 100 gam mỗi chất sau: KClO3 (xt: MnO2), KMnO4, KNO3. Chất tạo ra lượng O2 lớn nhất là KClO3. Chọn đáp án A.
Câu 2:
O + 2e → O2-
1s22s22p4 1s22s22p6
Chọn đáp án C.
Câu 3: Tầng ozon nằm ở tầng bình lưu. Chọn đáp án C.
Câu 4:
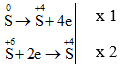
Tỉ lệ số nguyên tử S bị khử và số nguyên tử S bị oxi hóa là 2 : 1. Chọn đáp án D.
Câu 5: Chất khí X tan trong nước tạo ra một dung dịch làm chuyển màu quỳ tím thành đỏ và có thể được dùng làm chất tẩy màu. Khí X là SO2. Chọn đáp án C.
Câu 6:
nkhí = 0,1 mol, nOH- = 0,3 mol.
Đặt
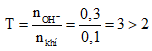
Sau phản ứng thu được K2S, KOH dư.
2KOH + H2S → K2S + 2H2O
0,1 0,1 (mol)
mmuối = 0,1. 110 = 11 gam. Chọn đáp án A.
Câu 7:
Dung dịch X gồm FeSO4 và H2SO4 dư.
Áp dụng ĐL bảo toàn nguyên tố với Fe có số mol FeSO4 = số mol Fe = 0,1 mol.
Áp dụng ĐL bảo toàn electron có: nFeSO4 = 5.nKMnO4 → nKMnO4 = 0,02 (mol).
V = 0,02 : 0,5 = 0,04 lít = 40ml. Chọn đáp án B.
Câu 8: Dung dịch H2SO4 loãng phản ứng được với tất cả các chất trong dãy: BaCl2, Na2CO3, FeS. Chọn đáp án D.
Câu 9: FeCl2 + H2S → không phản ứng. Chọn đáp án B.
Câu 10:
2Fe(OH)2 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 6H2O
0,2 0,1 (mol)
Vkhí = 0,1.22,4 = 2,24 lít. Chọn đáp án A.
Đề kiểm tra 15 phút - Trắc nghiệm + Tự luận
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm tự luận Học kì 2
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 1)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 2 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Vị trí của nguyên tố X (Z = 16) trong bảng hệ thống tuần hoàn là
A. ô thứ 16, chu kì 3, nhóm VA.
B. ô thứ 16, chu kì 3, nhóm VIA.
C. ô thứ 16, chu kì 2, nhóm VIA.
D. ô thứ 16, chu kì 3, nhóm VIIA.
Câu 2: Dãy các muối sunfua không tan trong nước là
A. CuS; FeS; ZnS. B. PbS; Ag2S; K2S.
C. FeS; ZnS; Na2S. D. Ag2S; K2S; Na2S.
Câu 3: Phát biểu nào sau đây là đúng về phản ứng:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl?
A. H2S là chất oxi hóa, Cl2 là chất khử.
B. H2S là chất khử, H2O là chất oxi hóa.
C. Cl2 là chất oxi hóa, H2O là chất khử.
D. Cl2 là chất oxi hóa, H2S là chất khử.
Câu 4: Sục từ từ 2,24 lít SO2 (đktc) vào 100 ml dd NaOH 3M. Muối tạo thành sau phản ứng là
A. Na2SO3. B. NaHSO3.
C. Na2SO4. D. Na2SO3 và NaHSO3.
Câu 5: Cách pha loãng H2SO4 đặc an toàn là?
A. Rót nước vào axit, khuấy đều.
B. Rót từ từ nước vào axit, khuấy đều.
C. Rót từ từ axit vào nước, khuấy đều.
D. Rót nhanh axit vào nước, khuấy đều.
Câu 6: Dãy đơn chất nào dưới đây vừa có tính oxi hóa, vừa có tính khử?
A. Cl2; O3; S. B. S; Cl2; Br2.
C. Na; F2; S. D. Br2; O2; Ca.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Viết phương trình hóa học điều chế H2S trong phòng thí nghiệm và sản xuất SO2 trong công nghiệp?
Câu 2 ( 3 điểm): Cho 10,55 gam hỗn hợp A gồm Zn và ZnO vào một lượng vừa đủ dung dịch H2SO4 10% thì thấy thoát ra 2,24 lít khí H2 ở đktc.
a/ Tính khối lượng mỗi chất trong A.
b/ Tính khối lượng dung dịch H2SO4 đã dùng.
Câu 3 ( 2 điểm): Dẫn V lít khí SO2 ở đktc vào dung dịch Ba(OH)2 thấy tạo ra 10,85 gam kết tủa. Lọc bỏ kết tủa, phần dung dịch còn lại đem đun nóng lại thu được 10,85 gam kết tủa. Tính giá trị của V.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đáp án | B | A | D | A | C | B |
Câu 1: X (Z = 16): 1s22s22p63s23p4. X thuộc ô 16, chu kì 3, nhóm VIA. Chọn đáp án B.
Câu 2: Các muối sunfua không tan trong nước là: CuS; FeS; ZnS. Chọn đáp án A.
Câu 3:
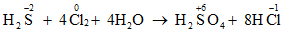
Vậy Cl2 là chất oxi hóa, H2S là chất khử. Chọn đáp án D.
Câu 4:
nkhí = 0,1 mol, nOH- = 0,3 mol.
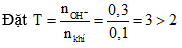
→ sau phản ứng thu được Na2SO3. Chọn đáp án A.
Câu 5: Cách pha loãng H2SO4 đặc an toàn là rót từ từ axit vào nước, khuấy đều. Chọn đáp án C.
Câu 6: Dãy đơn chất vừa có tính oxi hóa, vừa có tính khử là: S; Cl2; Br2. Chọn đáp án B.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
HS viết đúng 2PT mỗi PT 1 điểm, thiếu cân bằng trừ ½ số điểm mỗi PT
- Điều chế H2S trong PTN: FeS + 2HCl → FeCl2 + H2S
- Sản xuất SO2 trong CN: 4FeS2 + 11O2 → (tº) 2 Fe2O3 + 8 SO2
Câu 2 ( 3 điểm):
Tính được nkhí = 0,1 mol
Zn + H2SO4 → ZnSO4 + H2
0,1 ← 0,1 (mol)
ZnO + H2SO4 → ZnSO4 + H2O
mzn = 0,1.65 = 6,5 gam
mZnO = 10,55 – 6,5 = 4,05 gam
nZnO = 0,05 mol → naxit = nZn + nZnO = 0,15 mol
maxit = 0,15.98 = 14,7 gam.
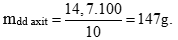
Câu 3 ( 2 điểm):
Theo bài ra ta có các PTHH:
Ba(OH)2 + SO2 → BaSO3 + H2O (1)
0,05 ← 0,05 (mol) (0,5 điểm)
Ba(OH)2 + 2SO2 → Ba(HSO3)2 (2) (0,5 điểm)
0,1← 0,05 (mol)
Ba(HSO3)2 → (tº) BaSO3 + SO2 + H2O (3) (0,5 điểm)
0,05 ← 0,05 (mol)
Từ (1), (2), (3) có nkhí = 0,15 mol → V khí = 0,15.22,4 = 3,36 lít. (0,5 điểm)
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm tự luận Học kì 2
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 2)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 2 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Nguyên tố oxi trong hợp chất nào sau đây có số oxi hóa khác với các hợp chất còn lại?
A. Na2O. B. OF2. C. H2SO4. D. KClO3.
Câu 2: Nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 10. Nguyên tố X là
A. Na. B. Cl. C. O. D. S.
Câu 3: SO2 luôn thể hiện tính khử trong các phản ứng với
A. H2S, O2, nước Br2.
B. dung dịch NaOH, O2, dung dịch KMnO4.
C. dung dịch KOH, CaO, nước Br2.
D. O2, nước Br2, dung dịch KMnO4.
Câu 4: Hòa tan hoàn toàn 6,5 gam Zn bằng dung dịch H2SO4 loãng, thu được V lít H2 (đktc). Giá trị của V là
A. 2,24. B. 3,36. C. 1,12. D. 4,48.
Câu 5: Axit sunfuric đặc thường được dùng để làm khô các chất khí ẩm. Khí nào sau đây có thể được làm khô nhờ axit sunfuric đặc?
A. Khí CO2. B. Khí H2S.
C. Khí NH3. D. Khí SO3.
Câu 6: Thuốc thử dùng để phân biệt 3 dung dịch H2SO4 loãng, Ba(OH)2, HCl là
A. Cu. B. dung dịch NaOH.
C. dung dịch NaNO3. D. dung dịch BaCl2.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Viết các phương trình hóa học xảy ra trong các trường hợp sau:
a/ Điều chế O2 từ KClO3
b/ Lưu huỳnh tác dụng với Al
c/ Sục khí H2S vào bình đựng NaOH dư
d/ Cu tác dụng với H2SO4 đặc, nóng
Câu 2 ( 3 điểm): Cho m gam hỗn hợp X gồm Na2CO3 và Zn phản ứng với một lượng vừa đủ V lít H2SO4 1M. Sau phản ứng thu được dung dịch A và 6,72 lít hỗn hợp khí B ở đktc. Cô cạn A được 46,4 gam muối khan.
a/ Xác định % khối lượng các chất trong X
b/ Tính CM các chất có trong A.
Câu 3 ( 2 điểm): Dẫn V lít khí SO2 ở đktc vào dung dịch chứa 0,15 mol Ba(OH)2 thấy tạo ra 21,7 gam kết tủa. Tính giá trị của V.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đáp án | B | D | D | A | A | D |
Câu 1:
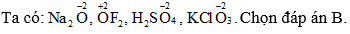
Câu 2: Cấu hình electron của X: 1s22s22p63s23p4. Vậy ZX = 16. X là S. Chọn đáp án D.
Câu 3: SO2 luôn thể hiện tính khử trong các phản ứng với O2, nước Br2, dung dịch KMnO4. Chọn đáp án D.
Câu 4:
Zn + H2SO4 → ZnSO4 + H2
0,1 → 0,1 (mol)
Vkhí = 0,1.22,4 = 2,24 lít. Chọn đáp án A.
Câu 5: CO2 + H2SO4 đặc → không phản ứng. Chọn đáp án A.
Câu 6: Dùng BaCl2 nhận ra H2SO4 nhờ hiện tượng kết tủa trắng BaSO4. Dùng H2SO4 vừa nhận biết được cho vào hai dung dịch còn lại, có kết tủa trắng là Ba(OH)2, không hiện tượng là HCl. Chọn đáp án D.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
HS viết đúng mỗi PTHH được 0,5 điểm. Thiếu cân bằng PT trừ ½ số điểm mỗi PT.
a/ 2KClO3 →(xt, tº) 2KCl + 3O2
b/ 2Al + 3S → Al2S3
c/ H2S + 2NaOH dư → Na2S + 2H2O
d/ Cu + 2H2SO4 đặc →(tº) CuSO4 + SO2 + 2H2O
Câu 2 ( 3 điểm):
Tính được nB = 0,3 mol (0,25 điểm)
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O (0,5 điểm)
a a a (mol)
Zn + H2SO4 → ZnSO4 + H2
b b b (mol)
Gọi số mol Na2CO3 là a, số mol Zn là b. Ta có hệ pt: (0,5 điểm)
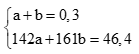
Giải hệ được a = 0,1; b = 0,2 (0,5 điểm)
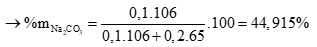
%mZn = 100 – 44,915 = 55,085%
naxit = a + b = 0,3 mol → Vaxit = 0,3 lít (0,5 điểm)
Coi thể tích dung dịch không đổi sau phản ứng.
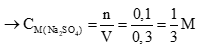
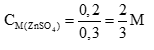
Câu 3 ( 2 điểm):
Trường hợp 1: Ba(OH)2 dư. Ta có PTHH: (0,5 điểm)
SO2 + Ba(OH)2 → BaSO3 + H2O
0,1 ← 0,1 (mol)
→ Vkhí = 0,1.22,4 = 2,24 lít. (0,5 điểm)
Trường hợp 2: Ba(OH)2 hết, sau phản ứng thu được hai muối (0,5 điểm)
Ba(OH)2 + SO2 → BaSO3 + H2O
0,1 ← 0,1 ← 0,1 (mol)
Ba(OH)2 + 2SO2 → Ba(HSO3)2
0,05 → 0,1 (mol)
Tính theo PTHH có số mol SO2 = 0,2 → V = 4,48 lít. (0,5 điểm)
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm tự luận Học kì 2
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 3)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 2 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Hỗn hợp khí gồm: O2, Cl2, SO2, CO2 để thu được O2 tinh khiết người ta xử lý bằng cho hồn hợp khí trên tác dụng với hóa chất thích hợp, hóa chất đó là
A. nước brom. B. dung dịch HCl.
C. dung dịch NaOH. D. nước clo.
Câu 2: Nhận định nào sau về lưu huỳnh là sai?
A. S là chất rắn màu vàng.
B. S không tan trong nước.
C. S dẫn điện, dẫn nhiệt kém.
D. S không tan trong các dung môi hữu cơ.
Câu 3: Để chứng minh SO2 là một oxit axit, người ta cho SO2 phản ứng với chất nào sau đây?
A. Dung dịch brom.
B. Dung dịch kiềm.
C. Dung dịch KMnO4.
D. Dung dịch axit sunfuhiđric.
Câu 4: Phản ứng nào sau đây là sai?
A. 2FeO + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 4H2O.
B. Fe2O3 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 4H2O.
C. FeO + H2SO4 loãng → FeSO4 + H2O .
D. Fe2O3 + 3H2SO4 loãng → Fe2(SO4)3 + 3H2O.
Câu 5: Phát biểu nào sau đây là đúng?
A. Để pha loãng axit H2SO4 đặc ta rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh.
B. Oxi và ozon đều có tính oxi hóa mạnh nhưng tính oxi hóa của oxi mạnh hơn ozon.
C. Fe tác dụng với Cl2 và H2SO4 loãng đều tạo ra muối sắt (II).
D. H2S chỉ có tính oxi hóa và H2SO4 chỉ có tính khử.
Câu 6: Có thể phân biệt 3 dung dịch: KOH, HCl, H2SO4 (loãng) bằng một thuốc thử là
A. giấy quỳ tím. B. Zn.
C. Al. D. BaCO3.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Viết phương trình hóa học điều chế O2 trong phòng thí nghiệm và sản xuất SO2 trong công nghiệp.
Câu 2 ( 3 điểm): Nung nóng 5,8 gam hỗn hợp gồm bột Fe và bột S trong điều kiện không có không khí dến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp Y. Hòa tan hoàn toàn Y bằng H2SO4 loãng dư thu được hỗn hợp khí Z có tỉ khối của Z so với H2 là 19/3. Xác định % khối lượng của Fe trong hỗn hợp ban đầu.
Câu 3 ( 2 điểm): Sục từ từ 2,24 lít SO2 (ở đktc) vào 100 ml Ba(OH)2 0,75M. Kết thúc thí nghiệm thu được b gam chất rắn A và dung dịch B chứa c gam chất tan. Xác định b, c.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đáp án | C | D | B | B | A | D |
Câu 1: Dẫn hỗn hợp khí O2, Cl2, SO2, CO2 qua dung dịch NaOH chỉ có O2 không phản ứng. Chọn đáp án C
Câu 2: S tan tốt trong các dung môi hữu cơ. Chọn đáp án D
Câu 3: Để chứng minh SO2 là một oxit axit, cho SO2 phản ứng với dung dịch kiềm. Chọn đáp án B.
Câu 4: Fe2O3 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 4H2O.. Chọn đáp án B.
Câu 5: Phát biểu đúng: Để pha loãng axit H2SO4 đặc ta rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh. Chọn đáp án A.
Câu 6:
Dùng BaCO3
- Nhận ra HCl nhờ có khí thoát ra (BaCO3 + 2HCl → BaCl2 + CO2 ↑ + H2O)
- Nhận ra H2SO4 nhờ vừa có khí thoát ra vừa có kết tủa (BaCO3 + H2SO4 → BaSO4↓ + CO2 ↑ + H2O)
- KOH không hiện tượng.
Chọn đáp án D.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
HS viết đúng mỗi PTHH 1 điểm, không cân bằng PT hoặc thiếu điều kiện phản ứng trừ ½ số điểm mỗi PT.
- Điều chế oxi trong PTN:
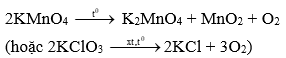
- Sản xuất SO2 trong CN:
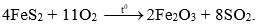
Câu 2 ( 3 điểm):
Fe + S → FeS
Theo bài ra → Y có FeS (x mol) và Fe dư ( y mol)
Cho Y vào H2SO4 loãng có phản ứng:
FeS + H2SO4 → FeSO4 + H2S
x x (mol)
Fe + H2SO4 → FeSO4 + H2
y y (mol)
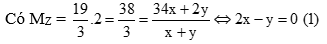
Hỗn hợp X gồm Fe(x +y mol) và S (x mol) → 88x + 56y = 5,8 (2)
Từ (1) và (2) → x = 0,029 mol, y = 0,058 mol
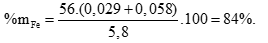
Câu 3 ( 2 điểm):
Tính được số mol SO2 = 0,1; số mol Ba(OH)2 = 0,075 (0,25 điểm)
→ sau phản ứng thu được 2 muối
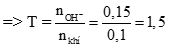
→ sau phản ứng thu được 2 muối (0,25 điểm)
PTHH:
2SO2 + Ba(OH)2 → Ba(HSO3)2 (1) (0,25 điểm)
2x → x → x (mol)
SO2 + Ba(OH)2 → BaSO3 + H2O (2) (0,25 điểm)
y → y → y (mol)
Từ (1) và (2) có hpt: (0,5 điểm)
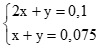
Giải hệ được x = 0,025, y = 0,05 (0,5 điểm)
→ b = 217.0,05 = 10,85 gam và c = 0,025. 299 = 7,475 gam.
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút trắc nghiệm tự luận Học kì 2
Môn: Hóa học 10
Thời gian làm bài: 15 phút
(Đề 4)
Bài giảng: Đề kiểm tra 15 phút Hóa học 10 Học kì 2 có đáp án (Lần 2 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Khi cho O3 tác dụng lên giấy có tẩm KI và hồ tinh bột, thấy tờ giấy xuất hiện màu xanh. Hiện tượng màu xanh này xảy ra do nguyên nhân nào?
A. Sự oxi hóa tinh bột tạo hợp chất bọc màu xanh.
B. Sự oxi hóa kali tạo hợp chất bọc màu xanh.
C. Sự oxi hóa iotua sinh ra I2, I2 kết hợp với hồ tinh bột tạo hợp chất bọc màu xanh.
D. Sự oxi hóa ozon tạo hợp chất bọc màu xanh.
Câu 2: Trong PTN oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây?
A. CaCO3. B. KMnO4. C. (NH4)2SO4. D. NaHCO3.
Câu 3: Nhận định nào sau đây là sai?
A. S vừa có tính oxi hoá vừa có tính khử.
B. Hg phản ứng với S ngay nhiệt độ thường.
C. Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và thể hiện tính oxi hóa.
D. Ở nhiệt độ cao, S tác dụng với nhiều kim loại và thể hiện tính oxi hoá.
Câu 4: Sục từ từ 2,24 lít SO2 (đktc) vào 100 ml dd KOH 2,5M. Khối lượng muối tạo thành sau phản ứng là
A. 15,80 gam. B. 12,00 gam. C. 19,75 gam. D. 15,00 gam.
Câu 5: Trường hợp nào sau đây không xảy ra phản ứng hoá học?
A. Sục khí Cl2 vào dung dịch FeCl2.
B. Sục khí H2S vào dung dịch CuCl2.
C. Sục khí H2S vào dung dịch FeCl2.
D. Cho Fe vào dung dịch H2SO4 loãng, nguội.
Câu 6: Chọn phát biểu đúng về SO2?
A. SO2 là chất khí, màu vàng lục.
B. SO2 làm xanh quỳ tím ẩm.
C. SO2 không làm mất màu dd Br2.
D. SO2 có thể oxi hóa H2S thành S.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Viết các phương trình hóa học xảy ra trong các trường hợp sau:
a/ Đốt cháy magie với O2
b/ Lưu huỳnh tác dụng với sắt
c/ Đốt cháy H2S trong oxi dư
d/ Sục khí SO2 vào bình đựng dd Br2
Câu 2 ( 3 điểm): Cho 11,0 gam hỗn hợp A gồm: Al và Fe vào dung dịch H2SO4 10% loãng vừa đủ, thu được dung dịch B và 8,96 lít khí C (ở đktc).
Câu 3 ( 2 điểm): Cho 3,6 gam FeO phản ứng với H2SO4 đặc, tới khi phản ứng xảy ra hoàn toàn thấy thu được V lít khí SO2 là sản phẩm khử duy nhất ở đktc. Hãy viết PTHH xảy ra và tính giá trị của V.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đáp án | C | B | C | A | C | D |
Câu 1: Khi cho O3 tác dụng lên giấy có tẩm KI và hồ tinh bột, thấy tờ giấy xuất hiện màu xanh. Hiện tượng này xảy ra do sự oxi hóa iotua sinh ra I2, I2 kết hợp với hồ tinh bột tạo hợp chất bọc màu xanh. Chọn đáp án C.
Câu 2: Trong PTN oxi có thể thu được từ phản ứng nhiệt phân KMnO4. Chọn đáp án B.
Câu 3: Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và thể hiện tính khử. Chọn đáp án C.
Câu 4:
Tính được số mol SO2 = 0,1; số mol KOH = 0,25
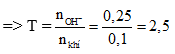
→ sau phản ứng thu được K2SO3 và KOH dư. PTHH:
SO2 + 2KOH → K2SO3 + H2O
0,1 → 0,1 (mol)
mmuối = 0,1. 158 = 15,8 gam. Chọn đáp án A.
Câu 5: H2S + FeCl2 → không xảy ra phản ứng. Chọn đáp án C.
Câu 6:
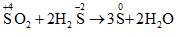
Phát biểu đúng là SO2 có thể oxi hóa H2S thành S. Chọn đáp án D.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
HS viết đúng mỗi PTHH 0,5 điểm, thiếu cân bằng PT trừ ½ số điểm mỗi PTHH.
a/ 2Mg + O2 → 2MgO
b/ Fe + S → FeS
c/ 2H2S + 3O2 dư → 2SO2 + 2H2O
d/ SO2 + Br2 + 2H2O → 2HBr + H2SO4
Câu 2 ( 3 điểm):
Tính được nC = 0,4 mol (0,25 điểm)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (0,5 điểm)
x 0,5x 1,5x (mol)
Fe + H2SO4 → FeSO4 + H2
y y y (mol)
Gọi số mol Al và Fe lần lượt là x, y. Theo bài ra có hpt: (0,5 điểm)
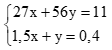
Giải hệ được x = 0,2 mol; y = 0,1 mol (0,5 điểm)
Tính:
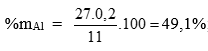
%mFe = 100 – 49,1 = 50,9%
Tính số mol H2SO4 pư = 0,4 mol → maxit = 0,4.98 = 39,2 gam (0,5 điểm)
→ mdd axit = 392 gam.
Áp dụng định luật bảo toàn KL: (0,25 điểm)
mdd B = m dd H2SO4 + mA – mC = 392 + 11 – 0,8 = 402,2 gam
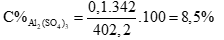
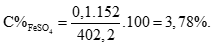
Câu 3 ( 2 điểm):
Tính được số mol FeO = 0,05 mol (0,5 điểm)
PTHH: (0,5 điểm)
2FeO + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 4H2O
0,05 0,025
Tính được số mol SO2 = 0,025 (0,5 điểm)
V = 0,025.22,4 = 0,56 lít (0,5 điểm)
Xem thêm đề thi Hóa học 10 chọn lọc, có đáp án hay khác:
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 1)(3 đề)
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 2)(3 đề)
- Đề kiểm tra Hóa học 10 Giữa học kì 1 có đáp án (3 đề)
- Đề thi Hóa học 10 Giữa kì 1 có đáp án (3 đề)
- Đề thi Hóa học 10 Học kì 1 có đáp án (3 đề)
- Đề kiểm tra 15p Hóa học 10 Học kì 2 có đáp án (Bài số 1)(8 đề)
- Đề kiểm tra Hóa học 10 Giữa học kì 2 có đáp án (5 đề)
- Đề thi Hóa học 10 Giữa kì 2 có đáp án (5 đề)
- Đề thi Hóa học 10 Học kì 2 có đáp án (5 đề)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 10 (các môn học)
- Giáo án điện tử lớp 10 (các môn học)
- Giáo án Ngữ văn 10
- Giáo án Toán 10
- Giáo án Tiếng Anh 10
- Giáo án Vật Lí 10
- Giáo án Hóa học 10
- Giáo án Sinh học 10
- Giáo án Lịch Sử 10
- Giáo án Địa Lí 10
- Giáo án Kinh tế Pháp luật 10
- Giáo án Tin học 10
- Giáo án Công nghệ 10
- Giáo án Giáo dục quốc phòng 10
- Giáo án Hoạt động trải nghiệm 10
- Đề thi lớp 10 (các môn học)
- Đề thi Ngữ Văn 10 (có đáp án)
- Chuyên đề Tiếng Việt lớp 10
- Đề cương ôn tập Văn 10
- Đề thi Toán 10 (có đáp án)
- Đề thi cương ôn tập Toán 10
- Đề thi Toán 10 cấu trúc mới (có đáp án)
- Đề thi Tiếng Anh 10 (có đáp án)
- Đề thi Vật Lí 10 (có đáp án)
- Đề thi Hóa học 10 (có đáp án)
- Đề thi Sinh học 10 (có đáp án)
- Đề thi Lịch Sử 10 (có đáp án)
- Đề thi Địa Lí 10 (có đáp án)
- Đề thi Kinh tế & Pháp luật 10 (có đáp án)
- Đề thi Tin học 10 (có đáp án)
- Đề thi Công nghệ 10 (có đáp án)
- Đề thi Giáo dục quốc phòng 10 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

