Đề thi Hóa học 10 Giữa kì 2 năm 2026 có đáp án (30 đề)
Đề thi Hóa học 10 Giữa kì 2 năm 2026 có đáp án (30 đề)
Dưới đây là danh sách Đề thi Hóa học 10 Giữa kì 2 năm 2026 có đáp án (30 đề). Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện & đạt điểm cao trong các bài thi môn Hóa học 10.
Bài giảng: Đề kiểm tra 1 tiết Hóa học 10 Học kì 2 có đáp án (Lần 2 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)

Sở Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 1)
Bài giảng: Đề kiểm tra 1 tiết Hóa học 10 Học kì 2 có đáp án (Lần 2 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Với số mol lấy bằng nhau, phương trình hoá học nào dưới đây điều chế được nhiều oxi hơn?
A. 2KClO3 -xt, tº→ 2KCl +3O2.
B. 2KMnO4 -tº→ K2MnO4 + MnO2 + O2.
C. 2H2O2 -xt→ 2H2O + O2.
D. 2KNO3 -tº→ 2KNO2 + O2.
Câu 2: Cho 1,3 gam kẽm tác dụng với 0,32 gam lưu huỳnh sản phẩm thu được sau khi phản ứng xảy ra hoàn toàn là
A. ZnS. B. ZnS và S. C. ZnS và Zn. D. ZnS, Zn và S.
Câu 3: Nhận định nào sau đây là sai?
A. SO2 làm đỏ quỳ ẩm.
B. SO2 làm mất màu nước Br2.
C. SO2 là chất khí, màu vàng lục.
D. SO2 làm mất màu cánh hoa hồng.
Câu 4: Cho FeCO3 tác dụng với H2SO4 đặc, nóng, sản phẩm khí thu được là
A. CO2 và SO2. B. SO3 và CO2. C. SO2. D. CO2.
Câu 5: Để nhận ra sự có mặt của ion sunfat trong dung dịch, người ta thường dùng
A. quỳ tím.
B. dung dịch muối Mg2+
C. dung dịch chứa ion Ba2+
D. thuốc thử duy nhất là Ba(OH)2
Câu 6: Cho 11,2 gam Fe và 6,4 gam Cu tác dụng với dung dịch H2SO4 loãng, dư. Sau phản ứng thu được V lít khí H2 (đktc). Giá trị của V là
A. 2,24 lít. B. 3,36 lít. C. 4,48 lít. D. 6,72 lít.
Câu 7: Hoà tan hoàn toàn 0,8125g một kim loại hoá trị II và dung dịch H2SO4 đặc, nóng thu được 0,28 lít khí SO2 (đktc).Kim loại đã dùng là
A. Mg. B. Cu. C. Zn. D. Fe.
Câu 8: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm oxi - lưu huỳnh là
A. ns2np4. B. ns2np5.
C. ns2np3. D. (n-1)d10ns2np4.
Câu 9: Dãy chất gồm các chất vừa thể hiện tính oxi hóa, vừa thể hiện tính khử là
A. H2S, SO2. B. SO2, H2SO4. C. F2, SO2. D. S, SO2.
Câu 10: Khi cho Fe vào các axit sau, trường hợp nào không xảy ra phản ứng?
A. HCl. B. H2SO4 đặc, nóng C. H2SO4 loãng. D. H2SO4 đặc, nguội.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Viết các phương trình phản ứng xảy ra trong các trường hợp sau:
a/ Lưu huỳnh tác dụng với H2.
b/ Cho Fe2O3 vào H2SO4 đặc
c/ Đốt bột nhôm trong bình khí oxi
d/ Cho CaSO3 vào H2SO4 loãng
Câu 2 ( 2 điểm): Hòa tan m gam hỗn hợp X gồm: Fe và Al2O3 bằng một lượng vừa đủ 612,5 gam dung dịch H2SO4 8% thu được dung dịch Y. Cô cạn Y thu được 64,6 gam hỗn hợp muối khan.
1/ Xác định % khối lượng các chất trong X.
2/ Tính C% các chất tan trong Y.
Câu 3 ( 2 điểm): Sục từ từ 3,36 lít SO2 (ở đktc) vào dung dịch chứa 11,2gam KOH. Kết thúc phản ứng thu được dung dịch chứa m gam muối. Tính giá trị của m.
Câu 4 ( 1 điểm): Chia m gam hỗn hợp gồm Fe và Cu thành hai phần bằng nhau.
+ Cho phần 1 tác dụng vừa đủ với Cl2 thấy có 6,72 lít khí Cl2 ở đktc phản ứng.
+ Cho phần 2 tác dụng với H2SO4 đặc, nóng, dư thấy thu được dung dịch Y và V lít khí SO2 là sản phẩm khử duy nhất ở đktc. Cho dung dịch Y tác dụng với NaOH dư thu được kết tủa. Lọc kết tủa nung đến khối lượng không đổi thấy thu được 20 gam chất rắn.
Tính giá trị của m.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | A | C | C | A | C | C | C | A | D | D |
Câu 1: Đáp án A
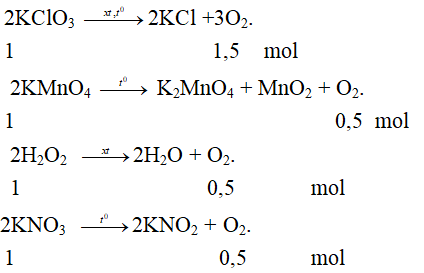
Câu 2:
Zn + S → ZnS
0,02 0,01 (mol)
Sau phản ứng thu được: ZnS: 0,01 mol và Zn dư 0,01 mol. Chọn đáp án C.
Câu 3: SO2 chất khí, không màu. Chọn đáp án C.
Câu 4:
2FeCO3 + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 2CO2 + 4H2O
Chọn đáp án A.
Câu 5: Để nhận ra sự có mặt của ion sunfat trong dung dịch, người ta thường dùng dung dịch chứa ion Ba2+. Chọn đáp án C.
Câu 6:
Fe + H2SO4 → FeSO4 + H2
0,2 0,2
V = 0,2. 22,4 = 4,48 lít. Chọn đáp án C.
Câu 7: Áp dụng định luật bảo toàn electron có nKL = nkhí = 0,0125 mol.
Mkl = 0,8125 : 0,0125 = 65. Vậy kim loại là Zn. Chọn đáp án C.
Câu 8: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm oxi - lưu huỳnh là ns2np4. Chọn đáp án A.
Câu 9: S, SO2 vừa thể hiện tính oxi hóa, vừa thể hiện tính khử. Chọn đáp án D
Câu 10: Fe bị thụ động hóa trong H2SO4 đặc, nguội. Chọn đáp án D
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
HS viết đúng mỗi PTHH được 0,5 điểm, không cân bằng trừ ½ số điểm mỗi PT
a/ H2 + S → H2S
b/ Fe2O3 + 3H2SO4 đặc → Fe2(SO4)3 + 3H2O
c/ 4Al + 3O2 → 2Al2O3
d/ CaSO3 + H2SO4 loãng → CaSO4 + SO2 + H2O
Câu 2 ( 2 điểm):
Theo bài ra có PTHH: (0,25 điểm)
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
x 3x x (mol)
Fe + H2SO4 → FeSO4 + H2 (0,25 điểm)
y y y (mol)
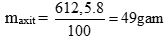
→ naxit = 0,5 mol. (0,25 điểm)
Gọi số mol Al2O3 và Fe lần lượt là x, y
Theo bài ra có hệ phương trình: (0,25 điểm)
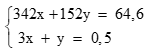
Giải hệ được x = 0,1 mol; y = 0,2 mol
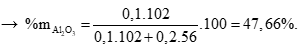
Tính số mol H2 = 0,2 mol
Áp dụng định luật bảo toàn khối lượng có:
mdd Y = mdd axit + mX - mkhí = 612,5 + 21,4 – 0,4 = 633,5 gam (0,25 điểm)
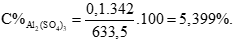
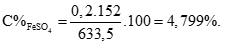
Câu 3 ( 2 điểm):
Tính được số mol SO2 = 0,15; số mol KOH = 0,2. (0,25 điểm)
Đặt (0,25 điểm)
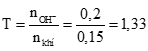
→ sau phản ứng thu được 2 muối.
PTHH:
SO2 + KOH → KHSO3 (0,25 điểm)
x x x (mol)
SO2 + 2KOH → K2SO3 + H2O (0,25 điểm)
y 2y y (mol)
Theo bài ra có HPT: (0,25 điểm)
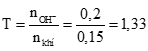
Giải hệ được x = 0,1, y = 0,05 (0,25 điểm)
→ m = 19,9 gam (0,25 điểm)
Câu 4 ( 1 điểm):
Gọi số mol Fe; Cu trong mỗi phần là a và b (mol) (0,25 điểm)
Phần 1: Áp dụng bảo toàn electron (hoặc viết PTHH) → 3a + 2b = 0,6
Phần 2: (0,25 điểm)
2Fe + 6H2SO4 đ → Fe2(SO4)3 + 3SO2 + 6H2O
a 0,5a (mol)
Cu + 2H2SO4 đ → CuSO4 + SO2 + 2H2O
b b (mol)
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 + 3Na2SO4
0,5a a (mol)
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
b b (mol)
2Fe(OH)3 →(tº) Fe2O3 + 3H2O
a 0,5a (mol)
Cu(OH)2 →(tº) CuO + H2O
b b
Chất rắn sau nung gồm Fe2O3: 0,5a mol và CuO: b mol (0,25 điểm)
→ 80a + 80b = 20
Giải hệ → a = 0,1; b = 0,15 → m = 2.(56.0,1 + 64.0,15) = 30.4 gam (0,25 điểm)
Sở Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 2)

Bài giảng: Đề kiểm tra 1 tiết Hóa học 10 Học kì 2 có đáp án (Lần 2 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Oxi không phản ứng trực tiếp với chất nào sau đây?
A. Crom. B. Flo. C. Cacbon. D. Lưu huỳnh.
Câu 2: Kim loại nào sau đây tác dụng với lưu huỳnh ở nhiệt độ thường?
A. Al. B. Fe. C. Hg. D. Cu.
Câu 3: Trong các oxit sau oxit nào không có tính khử?
A. CO. B. SO2. C. SO3. D. FeO.
Câu 4: Dẫn 2,24 lít khí H2S vào dung dịch chứa 0,2 mol NaOH thu được dung dịch chứa chất tan là
A. hai muối NaHS và Na2S. B. NaHS.
C. Na2S. D. Na2S và NaOH.
Câu 5: Hòa tan hoàn toàn 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lít hiđro (ở đktc) và dung dịch chứa m gam muối. Giá trị của m là?
A. 9,52. B. 10,27. C. 8,98. D. 7,25.
Câu 6: Các khí sinh ra khi cho saccarozơ vào dung dịch H2SO4 đặc, dư là
A. H2S và CO2. B. H2S và SO2.
C. SO3 và CO2. D. SO2 và CO2.
Câu 7: Cho các chất: Cu, CuO, NaCl, Mg, KOH, C, Na2CO3 số chất vừa tác dụng với dung dịch H2SO4 loãng, vừa tác dụng với dung dịch H2SO4 đặc, nóng là
A. 3. B. 4. C. 5. D. 6.
Câu 8: Cho 5,4 gam Al và 6,4 gam Cu tác dụng với dung dịch H2SO4 đặc, nóng, dư. Sau phản ứng thu được V lít SO2 duy nhất (đktc). Giá trị của V là
A. 6,72 lít. B. 3,36 lít. C. 11,2 lít. D. 8,96 lít.
Câu 9: Dãy chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A. Cl2, O3, S, SO2. B. SO2, S, Cl2, Br2.
C. Na, F2, S, H2S. D. Br2, O2, Ca, H2SO4.
Câu 10: Cấu hình electron lớp ngoài cùng của lưu huỳnh là
A. 2s22p4. B. 3s23p4. C. 3s23p3. D. 3s23p6.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Dẫn ra phương trình hóa học chứng minh SO2 vừa có tính oxi hóa, vừa có tính khử và giải thích ngắn gọn.
Câu 2 ( 2 điểm): Không dùng chất chỉ thị, hãy phân biệt các chất sau, chứa trong các lọ mất nhãn bằng phương pháp hóa học: BaCl2; HCl; Na2SO4.
Câu 3 ( 2 điểm): Dẫn từ từ 2,24 lít SO2 (ở đktc) vào 80 ml dung dịch Ba(OH)2 1M. Kết thúc phản ứng thu được m gam kết tủa. Tính m?
Câu 4 ( 1 điểm): Cho hỗn hợp X gồm 3 kim loại: Fe; Zn và Cu.
+ TN1: Cho 4,74 gam X phản ứng hoàn toàn trong H2SO4 loãng thấy thoát ra 1,568 lít khí ở đktc.
+ TN2: Cho 0,16 mol X phản ứng với H2SO4 đặc, nóng, dư thấy thoát ra 4,704 lít khí SO2 là sản phẩm khử duy nhất ở đktc.
Xác định % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | B | C | C | C | C | D | B | D | B | B |
Câu 1: Oxi không phản ứng trực tiếp với flo. Chọn đáp án B.
Câu 2: Thủy ngân tác dụng với lưu huỳnh ở nhiệt độ thường. Chọn đáp án C.
Câu 3: S trong SO3 có số oxi hóa cao nhất là +6 do đó SO3 không có tính khử. Chọn đáp án C.
Câu 4:
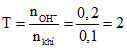
Sau phản ứng thu được Na2S, hai chất tham gia phản ứng hết. Chọn đáp án C.
Câu 5:
Áp dụng ĐL bảo toàn nguyên tố H có naxit = nkhí = 0,06 mol.
Áp dụng ĐL bảo toàn khối lượng có m = mX + maxit - mkhí = 3,22 + 0,06.98 – 0,06.2 = 8,98 gam. Chọn đáp án C.
Câu 6:
C12H22O11 -H2SO4 đặc→ 12C + 11H2O
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O.
Chọn đáp án D.
Câu 7: Chất vừa tác dụng với dung dịch H2SO4 loãng, vừa tác dụng với dung dịch H2SO4 đặc, nóng là CuO, Mg, KOH, Na2CO3. Chọn đáp án B.
Câu 8: Áp dụng định luật bảo toàn electron có
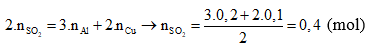
→ V = 0,4 . 22,4 = 8,96 lít. Chọn đáp án D.
Câu 9: Dãy gồm các chất vừa có tính oxi hóa, vừa có tính khử là SO2, S, Cl2, Br2. Chọn đáp án B.
Câu 10: Cấu hình electron lớp ngoài cùng của lưu huỳnh là 3s23p4. Chọn đáp án B.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
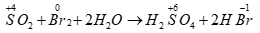
Số oxi hóa của S trong SO2 tăng từ +4 +6 nên SO2 thể hiện tính khử
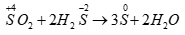
Số oxi hóa của S trong SO2 giảm từ +4 0 nên SO2 thể hiện tính oxi hóa.
Câu 2 ( 2 điểm):
Đánh STT các lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng. (0,5 điểm)
Dùng Ba(OH)2 phân biệt được Na2SO4 (hiện tượng: kết tủa trắng) Còn lại HCl; BaCl2 không hiện tượng. (0,5 điểm)
Còn lại HCl; BaCl2 dùng Na2SO4 vừa nhận ra ở trên, xuất hiện kết tủa trắng → BaCl2; không hiện tượng → HCl (0,5 điểm)
PTHH: (0,5 điểm)
Na2SO4 + Ba(OH)2 →2NaOH + BaSO4(↓)
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Câu 3 ( 2 điểm):
Tính được: nSO2=0,1mol, nBa(OH)2=0,08 mol (0,5 điểm)
Đặt
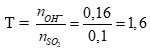
PTHH:
Ba(OH)2 + 2SO2 → Ba(HSO3)2 (0,25 điểm)
x 2x x (mol)
Ba(OH)2 + SO2 → BaSO3 + H2O (0,25 điểm)
y y y (mol)
Theo bài ra ta có hpt: (0,5 điểm)
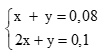
Giải hệ được x = 0,02mol, y = 0,06mol. (0,5 điểm)
→ m kết tủa = mBaSO3= 0,06. 217 = 13,02 gam
nên sau phản ứng tạo 2 muối Ba(HSO3)2 (x mol) và BaSO3 (y mol).
Câu 4 ( 1 điểm):
Gọi số mol Fe; Zn; Cu trong TN1 lần lượt là a,b,c (mol); (0,25 điểm)
Theo Kl: 56a + 65b + 64c = 4,74 (1)
Bảo toàn e hoặc viết PTHH → a + b = 0,07 (2)
Gọi số mol Fe; Zn; Cu trong TN2 lần lượt là ka; kb; kc (mol) (0,25 điểm)
→ k(a + b + c) = 0,16 (3)
lại có nSO2 = 0,21. Bảo toàn e hoặc viết PTHH → k(3a + 2b + 2c) = 0,42 (4)
Lấy (3)/(4)
→ 0,06a – 0,1b – 0,1c = 0 (5)
Từ (1), (2), (5) Giải hệ => a = 0,05; b = 0,02; c = 0,01 (0,25 điểm)
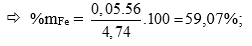
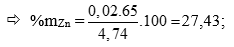
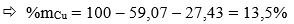
Sở Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 3)
Bài giảng: Đề kiểm tra 1 tiết Hóa học 10 Học kì 2 có đáp án (Lần 2 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Trong công nghiệp, người ta thường điều chế oxi bằng cách
A. nhiệt phân KClO3 có xúc tác MnO2.
B. nhiệt phân Cu(NO3)2.
C. điện phân nước.
D. nhiệt phân KMnO4.
Câu 2: Lưu huỳnh thể hiện tính khử khi tác dụng với chất nào dưới đây?
A. O2. B. Al. C. Hg. D. H2.
Câu 3: Trong các phản ứng sau đây, phản ứng nào sai?
A. H2S + 2NaCl → Na2S + 2HCl.
B. 2H2S + 3O2 dư → 2SO2 + 2H2O.
C. H2S + Pb(NO3)2 → PbS + 2HNO3.
D. H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl.
Câu 4: Hấp thụ 2,24 lít SO2 (đktc) vào 150 ml dung dịch NaOH 1M thu được dung dịch A. Chất tan có trong dung dịch A là
A. Na2SO3 và NaOH dư. B. Na2SO3.
C. NaHSO3. D. NaHSO3 và Na2SO3
Câu 5: Cho m gam FeO tác dụng hết với H2SO4 đặc nóng (dư), thoát ra 0,112 lít (ở đktc) khí SO2 (là sản phẩm khử duy nhất). Giá trị của m là
A. 7,2g. B. 3,6g. C. 0,72g. D. 0,36g.
Câu 6: Những kim loại nào sau đây bị thụ động hóa trong dd H2SO4 đặc, nguội?
A. Al và Zn. B. Al và Fe.
C. Fe và Cu. D. Fe và Mg.
Câu 7: Trường hợp nào tác dụng với H2SO4 đặc nóng và H2SO4 loãng đều cho sản phẩm giống nhau?
A. Fe. B. FeO. C. Fe2O3. D. Fe3O4.
Câu 8: Hoà tan hết hỗn hợp gồm Zn và Cu cần vừa đủ 200ml dung dịch H2SO4 loãng 0,1M thu được V lít khí (đktc). V có giá trị là
A. 0,224 lít. B. 2,24 lít. C. 4,48 lít. D. 0,448 lít.
Câu 9: Thuốc thử dùng để phân biệt 3 dung dịch H2SO4 loãng, Ba(OH)2, HCl đựng trong lọ mất nhãn là
A. Cu. B. dung dịch BaCl2.
C. dung dịch NaNO3. D. dung dịch NaOH.
Câu 10: Phát biểu nào sau đây là đúng?
A. Trong y học, oxi được dùng để chữa sâu răng.
B. H2S được dùng để tẩy trắng giấy, chất chống nấm mốc trong lương thực, thực phẩm.
C. Khí SO2 và khí CO2 đều không làm mất màu dung dịch brom.
D. Tính axit của H2CO3 > H2S.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Viết các phương trình hóa học xảy ra trong các trường hợp sau:
a/ Đốt hỗn hợp bột Fe với bột lưu huỳnh
b/ Cho H2S tác dụng với SO2
c/ Cho bạc tác dụng với ozon
d/ Cho cacbon tác dụng với H2SO4 đặc/ nóng
Câu 2 ( 2 điểm): Dẫn ra 2 phản ứng hóa học chứng minh S vừa có tính oxi hóa, vừa có tính khử và giải thích ngắn gọn.
Câu 3 ( 2 điểm): Dẫn từ từ 3,36 lít SO2 (ở đktc) vào 100 ml Ca(OH)2 1M. Kết thúc thí nghiệm thu được m gam kết tủa. Tính m?
Câu 4 ( 1 điểm): Nung m gam Fe trong không khí thu được a gam hỗn hợp X gồm: Fe và 3 oxit của Fe. Hòa tan a gam X trong Vml H2SO4 98% (đặc; vừa đủ; D = 1,84 gam/ml) thu được dung dịch Y và khí Z (sản phẩm khử duy nhất của S+6 là S+4). Y hòa tan tối đa 1,96 gam Fe. Cho Z lội từ từ qua 50 ml dung dịch NaOH 0,5M đến khi hấp thụ tối đa, lượng khí còn lại được cho lội qua dung dịch KMnO4 0,05M thấy làm mất màu vừa đủ 160 ml. Xác định a, V.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | C | A | A | D | C | B | C | D | B | D |
Câu 1: Trong công nghiệp, người ta thường điều chế oxi bằng cách điện phân nước. Chọn đáp án C.
Câu 2:
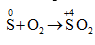
Số oxi hóa của S tăng từ 0 lên +4 vậy S thể hiện tính khử. Chọn đáp án A.
Câu 3: H2S + 2NaCl → không phản ứng. Chọn đáp án A.
Câu 4:
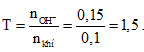
Chất tan có trong dung dịch A là NaHSO3 và Na2SO3. Chọn đáp án D.
Câu 5: Áp dụng ĐL bảo toàn e có nFeO = 2nkhí = 0,01 mol → m = 72.0,01 = 0,072 gam. Chọn đáp án C.
Câu 6: Al, Fe bị thụ động hóa trong dd H2SO4 đặc, nguội. Chọn đáp án B.
Câu 7:
Fe2O3 + 3H2SO4 loãng → Fe2(SO4)3 + 3H2O
Fe2O3 + 3H2SO4 đặc → Fe2(SO4)3 + 3H2O
Chọn đáp án C.
Câu 8:
Cu + H2SO4 loãng → không phản ứng
Zn + H2SO4 loãng → ZnSO4 + H2
0,02 0,02
V = 0,02.22,4 =0,448 lít. Chọn đáp án D.
Câu 9:
- Dùng BaCl2 nhận ra H2SO4 nhờ hiện tượng kết tủa trắng.
- Dùng H2SO4 vừa nhận ra cho vào hai ống nghiệm đựng hai chất còn lại.
+ Có kết tủa trắng → Ba(OH)2
+ Không hiện tượng → HCl.
Chọn đáp án B.
Câu 10: Tính axit của H2CO3 > H2S. Chọn đáp án D.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
HS viết đúng mỗi PTHH 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PT
a/ Fe + S → FeS
b/ 2H2S + SO2 → 3S + 2H2O
c/ 2Ag + O3 → Ag2O + O2
d/ C + 2H2SO4 đ/n → CO2 + 2SO2 + 2H2O
Câu 2 ( 2 điểm):
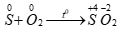
Số oxi hóa của S tăng từ 0 → +4 nên S thể hiện tính khử
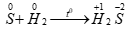
Số oxi hóa của S giảm từ 0 → -2 nên S thể hiện tính oxi hóa.
Câu 3 ( 2 điểm):
Tính được: nSO2 = 0,15mol, nCa(OH)2 = 0,1mol (0,5 điểm)
Đặt
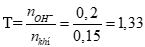
nên phản ứng tạo 2 muối Ca(HSO3)2 (x mol) và CaSO3 (y mol)
PTHH:
Ca(OH)2 + 2SO2 → Ca(HSO3)2 (0,25 điểm)
x 2x x (mol)
Ca(OH)2 + SO2 → CaSO3 + H2O (0,25 điểm)
y y y (mol)
Theo bài ra có HPT: (0,5 điểm)
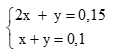
Giải hệ được x = y = 0,05 (0,25 điểm)
→ m = mCaSO3 = 120.0,05 = 6 gam. (0,25 điểm)
Câu 4 ( 1 điểm):
Quy đổi hỗn hợp X thành: Fe (x mol) và O2 (y mol) (0,25 điểm)
Tính được số mol: NaOH = 0,025; số mol KMnO4 = 0,008 mol; số mol Fe ht = 0,035 mol
Viết quá trình bảo toàn e:
Tính được số mol SO2 qua 2 pư ( hoặc 1 pư một bảo toàn e): (0,25 điểm)
SO2 + NaOH → NaHSO3
0,025 0,025 (mol)
5SO2 + 2KMnO4 + 2H2O → K2SO4 +2 MnSO4 + 2H2SO4
0,02 8.10-3 (mol)
Theo 2 phản ứng: số mol SO2 = 0,045 mol
Tính được số mol Fe2(SO4)3 trong Y: (0,25 điểm)
Pư: Fe + Fe2(SO4)3 → 3FeSO4
0,035 0,035 (mol)
Hệ pt:
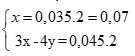
Giải hệ được: x = 0,07; y = 0,03
a = 56.0,07 + 32.0,03 = 4,88 gam; (0,25 điểm)
Số mol H2SO4 = 3.0,035 + 0,045= 0,15 mol
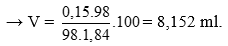
Sở Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 4)
Bài giảng: Đề kiểm tra 1 tiết Hóa học 10 Học kì 2 có đáp án (Lần 2 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Trong phòng thí nghiệm người ta có thể điều chế oxi bằng cách
A. nhiệt phân các hợp chất giàu oxi.
B. chưng phân đoạn không khí lỏng.
C. điện phân dung dịch CuSO4.
D. điện phân nước hoà tan H2SO4.
Câu 2: Lưu huỳnh tà phương (S α) và lưu huỳnh đơn tà (S β) là
A. hai đồng vị của lưu huỳnh.
B. hai hợp chất của lưu huỳnh.
C. hai dạng thù hình của lưu huỳnh.
D. hai đồng phân của lưu huỳnh.
Câu 3: Cho các phản ứng sau:
a) SO2 + Ca(OH)2 → CaSO3 + H2O
b) SO2 + 2H2S → 3S + 2H2O
c) SO2 + 2H2O + Br2 → 2HBr + H2SO4
d) SO2 + NaOH → NaHSO3
SO2 đóng vai trò là chất oxi hóa trong phản ứng
A. a, b, d. B. c, d. C. b. D. a, b, c, d.
Câu 4: Tính chất hóa học đặc trưng của dd H2S là
A. Tính axit yếu, tính khử mạnh.
B. Tính axit yếu, tính oxi hóa mạnh.
C. Tính axit mạnh, tính khử yếu.
D. Tính axit mạnh, tính oxi hóa yếu.
Câu 5: Hấp thụ hoàn toàn 6,72 lít khí H2S (đktc) vào dung dịch chứa 16g NaOH. Tiến hành cô cạn dung dịch sau phản ứng thu được lượng muối khan là
A. 19,0 gam. B. 20,8 gam. C. 21,2 gam. D. 12,1 gam.
Câu 6: Cho 3,22g hỗn hợp X (gồm Fe, Mg và Zn) phản ứng hoàn toàn với một lượng vừa đủ dd H2SO4 tạo ra 1,344 lít H2 (đktc) và dd Y chứa m (g) muối. Giá trị của m là
A. 8,98. B. 7,25. C. 3,55. D. 5,67.
Câu 7: Cho 20g oxit của kim loại hóa trị II tác dụng vừa hết với 500 ml dd H2SO4 1M. Công thức phân tử của oxit là
A. MgO. B. FeO. C. CuO. D. CaO.
Câu 8: Để đánh giá độ nhiễm bẩn không khí của một nhà máy, người ta lấy hai lít không khí rồi dẫn qua dung dịch Pb(NO3)2 dư thấy có kết tủa màu đen xuất hiện. Hiện tượng này chứng tỏ trong không khí có hiện diện khí nào sau?
A. CO2. B. H2S. C. NH3. D. SO2.
Câu 9: Thuốc thử dùng để nhận biết ion sunfat là
A. dd AgNO3. B. dd NaOH. C. dd BaCl2. D. dd Na2CO3.
Câu 10: Oxit nào sau đây tác dụng với axit H2SO4 đặc, nóng có thể giải phóng khí SO2?
A. Fe2O3. B. Al2O3. C. Fe3O4. D. ZnO.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Viết các phương trình phản ứng xảy ra trong các trường hợp sau:
a/ Cho O3 tác dụng với bạc
b/ Cho lưu huỳnh tác dụng với thủy ngân
c/ Cho SO2 tác dụng với lượng dư dd KOH
d/ Cho FeO tác dụng với H2SO4 đặc
Câu 2 ( 2 điểm): Bằng phương pháp hóa học (Không dùng chất chỉ thị) hãy phân biệt 3 lọ mất nhãn đựng các chất sau: H2SO4, HCl, NaCl.
Câu 3 ( 2 điểm): Hấp thụ hoàn toàn 6,272 lít SO2 (ở đktc) vào Vml dung dịch Ba(OH)2 2M, thu được dung dịch X và 17,36 gam chất rắn Y. Xác định V. Giả sử SO2 tan trong nước không đáng kể.
Câu 4 ( 1 điểm): Cho m gam hỗn hợp bột Fe và S có nFe=2nS rồi nung trong điều kiện không có oxi thu được hỗn hợp A. Hòa tan A bằng HCl dư thu được 1,6 gam chất rắn B, dung dịch C và hỗn hợp khí D. Sục D từ từ qua dung dịch CuCl2 thấy tạo ra 9,6 gam kết tủa đen. Tính m?
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | A | C | C | A | A | A | A | B | C | C |
Câu 1: Trong phòng thí nghiệm người ta có thể điều chế oxi bằng cách nhiệt phân các hợp chất giàu oxi kém bền với nhiệt. Chọn đáp án A.
Câu 2: Lưu huỳnh tà phương (S α) và lưu huỳnh đơn tà (S β) là hai dạng thù hình của lưu huỳnh. Chọn đáp án C.
Câu 3: SO2 đóng vai trò là chất oxi hóa trong phản ứng b) SO2 + 2H2S → 3S + 2H2O. Chọn đáp án C.
Câu 4: Tính chất hóa học đặc trưng của dd H2S là tính axit yếu, tính khử mạnh. Chọn đáp án A.
Câu 5:
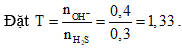
Sau phản ứng thu được 2 muối NaHS (x mol), Na2S (y mol)
Bảo toàn nguyên tố Na có x + 2y = 0,4.
Bảo toàn nguyên tố S có x + y = 0,3.
Giải hệ được x = 0,2 và y = 0,1 → m = 56.0,2 + 0,1.78 = 19 gam. Chọn đáp án A.
Câu 6:
Bảo toàn nguyên tố H có naxit = nH2 = 0,06 mol.
m = mKL + mion gốc axit = 3,22 + 0,06.96 = 8,98 gam. Chọn đáp án A.
Câu 7:
Đặt oxit là MO. PTHH:
MO + H2SO4 → MSO4 + H2O
0,5 0,5
→ MMO = 20 : 0,5 = 40 → MM = 24 vậy oxit là MgO. Chọn đáp án A.
Câu 8: Pb(NO3)2 + H2S → PbS↓đen + 2HNO3. Chọn đáp án B.
Câu 9: BaCl2 có thể dùng để nhận biết ion sunfat. Chọn đáp án C.
Câu 10: 2Fe3O4 + 10H2SO4 đ → 3Fe2(SO4)3 + SO2 + 10H2O. Chọn đáp án C.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
HS viết đúng mỗi PTHH 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PT
a/ O3 + 2Ag → Ag2O + O2
b/ S + Hg → HgS
c/ SO2 + 2KOH dư → K2SO3 + H2O
d/ 2FeO + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 4H2O
Câu 2 ( 2 điểm):
Đánh số thứ tự từng lọ, trích mẫu thử (0,5 điểm)
Dùng dd BaCl2 nhận ra H2SO4 do tạo kết tủa trắng (HCl, NaCl không hiện tượng) (0,5 điểm)
Phân biệt HCl và NaCl: (0,5 điểm)
Dùng dd Na2CO3 nhận ra HCl do có hiện tượng sủi bọt khí
Không hiện tượng là NaCl
PTHH: BaCl2 + H2SO4 → BaSO4 + 2HCl (0,5 điểm)
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Câu 3 ( 2 điểm):
Các phản ứng có thể xảy ra theo thứ tự: (0,5 điểm)
SO2 + Ba(OH)2 → BaSO3 + H2O (1)
SO2 + BaSO3 + H2O → Ba(HSO3)2 (2)
Số mol Y = số mol BaSO3 = 0,08 mol; số mol SO2 = 0,28 mol
TH1: Chỉ xảy ra phản ứng 1 (0,5 điểm)
Theo phản ứng 1: Số mol SO2 phản ứng = số mol Y = 0,08 < 0,28 → loại
TH2: Xảy ra cả 2 phản ứng (0,5 điểm)
Tính toán được số mol Ba(OH)2 = 0,18 mol → V = 0,09 lít = 90 ml
Vậy V = 90 ml (0,5 điểm)
Câu 4 ( 1 điểm):
Fe + S → FeS (0,25 điểm)
Do A + HCl thu được chất rắn B nên S dư
→ A có FeS, S dư và Fe dư
Cho A vào HCl loãng có phản ứng: (0,25 điểm)
FeS + 2HCl (loãng) → FeCl2 + H2S
0,1 0,1
Fe + 2HCl → FeCl2 + H2
Cho H2S vào CuCl2 có phản ứng:
H2S + CuCl2 → CuS + 2HCl
0,1 0,1
Tính được: (0,25 điểm)
nCuS = 0,1 mol = nFeS
nS dư = 0,05mol → nS = 0,15 mol, nFe = 0,3 mol
→ m = 32.0,15 + 0,3.56 = 21,6 gam (0,25 điểm)
Sở Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề 5)
Bài giảng: Đề kiểm tra 1 tiết Hóa học 10 Học kì 2 có đáp án (Lần 2 - Tự luận - Trắc nghiệm) - Cô Phạm Thu Huyền (Giáo viên VietJack)
Cho nguyên tử khối của các nguyên tố: Mn = 55, O = 16, Mg = 24, Fe=56, H = 1, Ag = 108, K = 39, Cl = 35,5, F = 19, Br = 80, I = 127, S = 32, Zn = 65, Cu = 64, Al = 27.
I. Trắc nghiệm ( 3 điểm)
Câu 1: Oxi là nguyên tố phi kim hoạt động, có tính oxi hóa mạnh là do
A. Oxi có nhiều trong tự nhiên.
B. Oxi có độ âm điện lớn.
C. Oxi là chất khí.
D. Oxi có 2 electron lớp ngoài cùng.
Câu 2: Số oxi hoá của lưu huỳnh trong các hợp chất: SO2, H2S, H2SO4, CuSO4 lần lượt là
A. 0, +4, +6, +6. B. +4, -2, +6, +6.
C. 0, +4, +6, -6. D . +4, +2, +6, +6.
Câu 3: Để phân biệt oxi và ozon có thể dùng chất nào sau đây?
A. Cu. B. Hồ tinh bột.
C. H2. D. Dung dịch KI và hồ tinh bột.
Câu 4: Chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A. O3. B. SO2. C. H2SO4. D. H2S.
Câu 5: Cho V lít SO2 (đktc) tác dụng hết với dung dịch Br2 dư. Thêm tiếp vào dung dịch sau phản ứng BaCl2 dư thu được 2,33 gam kết tủa. Thể tích V là
A. 0,11 lít. B. 1,12 lít. C. 0,224 lít. D. 2,24 lít.
Câu 6: H2SO4 đặc, nguội có thể tác dụng được với tất cả chất trong dãy nào sau đây?
A. Mg, Zn. B. Fe, Zn. C. Al, Zn. D. Fe, Al.
Câu 7: Hòa tan hoàn toàn 16 gam hỗn hợp Mg, Fe bằng dung dịch H2SO4 loãng vừa đủ. Sau phản ứng thấy khối lượng dung dịch tăng thêm 15,2 gam so với ban đầu. Khối lượng muối khan thu được sau khi cô cạn dung dịch là
A. 53,6 gam. B. 54,4 gam. C. 92 gam. D. 92,8 gam.
Câu 8: Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
A. Cu, Zn, Na. B. K, Mg, Al, Fe, Zn.
C. Ag, Ba, Fe, Sn. D. Au, Pt, Al.
Câu 9: Hấp thụ toàn bộ 4,48 lít SO2 (đktc) vào 300 ml dd NaOH 1M. Sản phẩm muối thu được là
A. Na2SO3. B. Na2SO4, NaHSO4.
C. NaHSO3. D. Na2SO3, NaHSO3.
Câu 10: Có các thí nghiệm sau:
(I) Nhúng thanh sắt vào dung dịch H2SO4 đặc, nguội.
(II) Sục khí H2S vào nước brom.
(III) Sục khí CO2 vào nước Gia-ven.
(IV) Nhúng lá nhôm vào dung dịch H2SO4 loãng, nguội.
Số thí nghiệm xảy ra phản ứng hoá học là
A. 2. B. 1. C. 3. D. 4.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm): Axit sunfuric là hóa chất hàng đầu được dùng trong nhiều ngành công nghiệp. Hàng năm, các nước trên thế giới sản xuất ra khoảng 160 triệu tấn. Viết PTHH sản xuất H2SO4 từ FeS2 theo sơ đồ: FeS2 → SO2 → SO3 → oleum → H2SO4.
Câu 2 ( 2 điểm): Bằng phương pháp hóa học (không dùng chất chỉ thị) hãy phân biệt 3 lọ mất nhãn đựng các chất sau: H2SO4; HCl; Na2SO4.
Câu 3 ( 2 điểm): Hấp thụ hoàn toàn V lít SO2 (ở đktc) vào 2,2 lít nước vôi trong 0,1M thu được dung dịch X và 14,4 gam chất rắn Y. Xác định V. Giả sử SO2 tan trong nước không đáng kể.
Câu 4 ( 1 điểm): Hòa tan hết 8,775 gam hỗn hợp B gồm Mg và Al trong 75 gam dung dịch H2SO4 98% thu được dung dịch X và hỗn hợp khí Y gồm SO2 và H2S.Cho Y từ từ qua bình đựng KMnO4 dư thấy có 2,4 gam kết tủa xuất hiện, lọc bỏ kết tủa, cho phần dung dịch còn lại tác dụng với dung dịch BaCl2 dư thấy thu được 26,2125 gam kết tủa nữa. Tính C% của H2SO4 trong X và %Al trong hỗn hợp B.
Đáp án và hướng dẫn giải
I. Trắc nghiệm ( 0,3 điểm/câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | B | B | D | B | C | A | B | B | D | C |
Câu 1: Oxi là nguyên tố phi kim hoạt động, có tính oxi hóa mạnh là do oxi có độ âm điện lớn. Chọn đáp án B.
Câu 2: Số oxi hoá của lưu huỳnh trong các hợp chất: SO2, H2S, H2SO4, CuSO4 lần lượt là: +4, -2, +6, +6. Chọn đáp án B.
Câu 3:
O2 + KI + H2O → không phản ứng.
O3 + 2KI + H2O → O2 + 2KOH + I2. I2 sinh ra làm xanh hồ tinh bột. Chọn đáp án D.
Câu 4: S trong SO2 có số oxi hóa +4, số oxi hóa trung gian của S do đó SO2 vừa có tính oxi hóa, vừa có tính khử. Chọn đáp án B.
Câu 5:
SO2 + Br2 + 2H2O → 2HBr + H2SO4
0,01 ← 0,01 (mol)
H2SO4 + BaCl2 → 2HCl + BaSO4
0,01 ← 0,01 (mol)
→ V = 0,01.22,4 = 0,224 lít. Chọn đáp án C.
Câu 6: Mg, Zn có thể tác dụng được với H2SO4 đặc, nguội. Chọn đáp án A.
Câu 7:
mdd ↑ = mKL – mH2 → mH2 = 16 – 15,2 = 0,8 gam → nH2 = 0,4 mol = ngốc axit.
mmuối = mKL + mgốc axit = 16 + 0,4.96 = 54,4 gam. Chọn đáp án B.
Câu 8: Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là K, Mg, Al, Fe, Zn. Chọn đáp án B.
Câu 9:
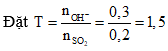
Sau phản ứng thu được hai muối là Na2SO3 và NaHSO3.
Chọn đáp án D.
Câu 10:
Thí nghiệm xảy ra phản ứng hoá học là:
(II) Sục khí H2S vào nước brom.
(III) Sục khí CO2 vào nước Gia-ven.
(IV) Nhúng lá nhôm vào dung dịch H2SO4 loãng, nguội. Chọn đáp án C.
II. Tự luận ( 7 điểm)
Câu 1 ( 2 điểm):
FeS2 → SO2 → SO3 → oleum → H2SO4.
HS viết đúng mỗi PTHH 0,5 điểm. Thiếu cân bằng trừ ½ số điểm mỗi PT.
1/ 4FeS2 + 11O2 →(tº) 2SO2 + 8Fe2O3
2/ 2SO2 + O2 ⇔(xt, tº) 2SO3
3/ H2SO4 + nSO3 → H2SO4.nSO3
4/ H2SO4.nSO3 + nH2O → (n + 1) H2SO4.
Câu 2 ( 2 điểm):
Đánh số thứ tự từng lọ, trích mẫu thử (0,5 điểm)
Dùng dung dịch BaCl2 vào các mẫu thử nếu: xuất hiện kết tủa trắng là Na2SO4; H2SO4 (nhóm I). (0,5 điểm)
Còn lại không hiện tượng là HCl.
PTHH: (0,5 điểm)
BaCl2 + H2SO4 → BaSO4+ 2HCl
BaCl2 + Na2SO4 → BaSO4+ 2NaCl
Nhỏ dd Na2SO3 vào nhóm I nếu: có khí bay ra là H2SO4 còn lại không hiện tượng là Na2SO4 (0,5 điểm)
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
Câu 3 ( 2 điểm):
Các phản ứng có thể xảy ra theo thứ tự: (0,5 điểm)
SO2 + Ca(OH)2 → CaSO3 + H2O (1)
SO2 + CaSO3 + H2O → Ca(HSO3)2 (2)
Số mol Y = số mol CaSO3 = 0,12 mol; số mol Ca(OH)2 = 0,22 mol
TH1: Chỉ xảy ra phản ứng 1 (0,5 điểm)
Theo pư 1: Số mol Ca(OH)2 pư = số mol Y = 0,12 < 0,22 → thỏa mãn.
→ số mol SO2 = 0,12 mol → V1 = 2,688 lít.
TH2: Xảy ra cả 2 phản ứng (0,5 điểm)
Tính toán được số mol SO2 = 0,32 mol → V2 = 7,168 lít.
Vậy có 2 nghiệm: V1 = 2,688 lít và V2 = 7,168 lít (0,5 điểm)
Câu 4 ( 1 điểm):
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2 MnSO4 + K2SO4 (0,25 điểm)
5H2S + 2KMnO4 + 3H2SO4 → 5S + 2MnSO4 + K2SO4 + 8H2O
Tính được nS = 2,4/32 = 0,075 → nH2S = 0,075.
Áp dụng đl bảo toàn nguyên tố → nSO2 = nBaSO4 = 0,1125 mol
Quá trình khử: 2H2SO4 + 2e → SO2 + 2H2O + SO2 2- (0,25 điểm)
5H2SO4 + 8e → H2S + 4H2O + 4SO4 2-
Tính theo quá trình → nH2SO4 = 0,6 mol → nH2SO4 dư = 0,15 mol
Theo định luật bảo toàn khối lượng → mx = 74,025 gam (0,25 điểm)
→ C% axit = 19,86%
Gọi nMg = a (mol); nAl = b (mol) (0,25 điểm)
Áp dụng đl bảo toàn e → 2a + 3b = 0,825
Theo khối lượng → 24a + 27b = 8,775
Giải hệ → a =0,225; b = 0,125 → %mAl = 38,46%.
Xem thêm bộ đề thi Hóa học 10 năm 2026 chọn lọc khác:
- Đề thi Giữa kì 1 Hóa học 10 có đáp án năm 2026 (3 đề)
- Bộ 20 Đề thi Hóa học 10 Giữa học kì 1 năm 2026 tải nhiều nhất
- Đề thi Hóa học 10 Giữa học kì 1 năm 2026 có ma trận (15 đề)
- Đề kiểm tra Hóa học 10 Giữa học kì 1 có đáp án (3 đề)
- Đề thi Hóa học 10 Giữa kì 1 có đáp án (3 đề)
- Đề thi Hóa học 10 Học kì 1 có đáp án (3 đề)
- Đề thi Hóa học 10 Học kì 2 có đáp án (5 đề)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 10 (các môn học)
- Giáo án điện tử lớp 10 (các môn học)
- Giáo án Ngữ văn 10
- Giáo án Toán 10
- Giáo án Tiếng Anh 10
- Giáo án Vật Lí 10
- Giáo án Hóa học 10
- Giáo án Sinh học 10
- Giáo án Lịch Sử 10
- Giáo án Địa Lí 10
- Giáo án Kinh tế Pháp luật 10
- Giáo án Tin học 10
- Giáo án Công nghệ 10
- Giáo án Giáo dục quốc phòng 10
- Giáo án Hoạt động trải nghiệm 10
- Đề thi lớp 10 (các môn học)
- Đề thi Ngữ Văn 10 (có đáp án)
- Chuyên đề Tiếng Việt lớp 10
- Đề cương ôn tập Văn 10
- Đề thi Toán 10 (có đáp án)
- Đề thi cương ôn tập Toán 10
- Đề thi Toán 10 cấu trúc mới (có đáp án)
- Đề thi Tiếng Anh 10 (có đáp án)
- Đề thi Vật Lí 10 (có đáp án)
- Đề thi Hóa học 10 (có đáp án)
- Đề thi Sinh học 10 (có đáp án)
- Đề thi Lịch Sử 10 (có đáp án)
- Đề thi Địa Lí 10 (có đáp án)
- Đề thi Kinh tế & Pháp luật 10 (có đáp án)
- Đề thi Tin học 10 (có đáp án)
- Đề thi Công nghệ 10 (có đáp án)
- Đề thi Giáo dục quốc phòng 10 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

