Đề thi Hóa học 10 Giữa kì 1 có đáp án năm 2025 (20 đề) | Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Để ôn luyện và làm tốt các bài thi Hóa học 10, dưới đây là Top 20 Đề thi Hóa học 10 Giữa kì 1 năm 2026 theo cấu trúc mới sách mới Kết nối tri thức, Cánh diều, Chân trời sáng tạo có đáp án, cực sát đề thi chính thức. Hi vọng bộ đề thi này sẽ giúp bạn ôn tập & đạt điểm cao trong các bài thi Hóa học 10.
Đề thi Hóa học 10 Giữa kì 1 có đáp án năm 2025 (20 đề) | Kết nối tri thức, Chân trời sáng tạo, Cánh diều
Đề thi Giữa kì 1 Hóa học 10 Kết nối tri thức có đáp án (3 đề)
Đề thi Giữa kì 1 Hóa học 10 Chân trời sáng tạo có đáp án (8 đề)
Sở Giáo dục và Đào tạo ...
Đề thi Giữa kì 1 - Kết nối tri thức
năm 2025
Môn: Hóa học 10
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Hóa học là ngành khoa học thuộc lĩnh vực nào sau đây?
A.Khoa học hình thức.
B.Khoa học xã hội.
C.Khoa học tự nhiên.
D.Khoa học ứng dụng.
Câu 2: Hầu hết hạt nhân các nguyên tử được cấu tạo bởi các loại hạt nào sau đây?
A. Proton và electron.
B. Proton, electron và neutron.
C. Proton và neutron.
D. Electron và neutron.
Câu 3: Trường hợp nào sau đây có sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng?
A. Electron, m ≈ 1 amu, q = -1.
B. Proton, m≈ 1 amu, q = -1.
C. Proton, m ≈ 0,00055 amu, q = +1.
D. Neutron, m ≈ 1 amu, q = 0.
Câu 4: Nguyên tử fluorine chứa 9 electron và có số khối là19. Tổng số hạt proton, electron và neutron trong nguyên tử fluorine là
A. 30. B. 32. C. 19. D. 28.
Câu 5: Số hiệu nguyên tử cho biết thông tin nào sau đây?
A. Số khối.
B. Nguyên tử khối trung bình.
C. Số proton.
D. Số neutron.
Câu 6: Cho kí hiệu nguyên tử sau: 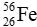
A. Số đơn vị điện tích hạt nhân là 26.
B. Tổng số proton và số neutron là 26.
C. Số neutron là 30.
D. Số khối là 56.
Câu 7: Nguyên tử magnesium có 12 electron. Điện tích hạt nhân của nguyên tử này là
A.12+. B.12. C.+12. D.-12.
Câu 8: Trong tự nhiên, nguyên tố bromine có 2 đồng vị. Trong đó 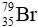
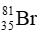
A.79,5.
B.79,1.
C.80,01.
D.35.
Câu 9: Số orbital trong các phân lớp s, p, d lần lượt là
A. 3, 5, 7.
B. 1, 2, 3.
C. 1, 3, 5.
D. 1, 2, 4.
Câu 10: Số electron tối đa trong lớp M là
A. 8. B. 18. C. 32. D. 2.
Câu 11: Ở trạng thái cơ bản, số electron độc thân trong nguyên tử O (Z = 8) là
A.0. B.1. C.3. D.2.
Câu 12: Nguyên tử X có 3 lớp electron, lớp thứ ba có 2 electron. Số hiệu nguyên tử X là
A.12. B.13. C.14. D.15.
Câu 13: Cấu hình electron nguyên tử chlorine (Z = 17) là
A. 1s22s22p63s23p2.
B. 1s22s22p63s23p5.
C. 1s22s22p63s23p3.
D. 1s22s22p63s23p4.
Câu 14: Cho biết nguyên tố A có 15 proton trong hạt nhân. A là
A.kim loại.
B.phi kim.
C.khí hiếm.
D.khí trơ.
Câu 15: Nguyên tử các nguyên tố thuộc cùng một chu kì có cùng đặc điểm nào sau đây?
A.Số electron.
B.Số lớp electron.
C.Số electron hóa trị.
D. Số electron ở lớp ngoài cùng.
Câu 16: Bảng tuần hoàn hiện nay gồm
A. 18 chu kì, trong đó 8 chu kì nhỏ và 10 chu kì lớn.
B. 7 chu kì, trong đó 3 chu kì nhỏ và 4 chu kì lớn.
C. 7 chu kì, trong đó 4 chu kì nhỏ và 3 chu kì lớn.
D. 8 chu kì, trong đó 4 chu kì nhỏ và 4 chu kì lớn.
Câu 17: Nguyên tố Cl (Z = 17) thuộc nhóm nào trong bảng tuần hoàn các nguyên tố hóa học?
A. IA. B. IIA. C. VA. D. VIIA.
Câu 18: Chu kì 2 trong bảng tuần hoàn gồm bao nhiêu nguyên tố?
A. 2 nguyên tố.
B. 8 nguyên tố.
C. 18 nguyên tố.
D. 32 nguyên tố.
Câu 19: Đại lượng nào sau đây trong nguyên tử của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
A. Số lớp electron.
B. Số electron ở lớp ngoài cùng.
C. Nguyên tử khối.
D. Số electron trong nguyên tử.
Câu 20: Cấu hình electron hóa trị của nguyên tử các nguyên tố nhóm IIIA trong bảng tuần hoàn các nguyên tố hóa học đều là
A. np3.
B. ns3.
C. ns2np1.
D. ns2np4.
Câu 21: Theo độ âm điện của Pauling, nguyên tố có độ âm điện lớn nhất trong bảng tuần hoàn là
A.Fluorine.
B.Hydrogen.
C.Helium.
D.Oxygen.
Câu 22: Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần độ âm điện?
A. Rb, K, Na, Li.
B. Na, Li, K, Rb.
C. Na, K, Rb, Li.
D. Li, Rb, Na, K.
Câu 23: X là nguyên tố thuộc nhóm VIA trong bảng tuần hoàn. Công thức oxide ứng với hóa trị cao nhất của X là
A. X2O3. B. X2O6. C. X3O. D. XO3.
Câu 24: Trong các chất dưới đây, chất nào có tính acid mạnh nhất?
A. H2SO4.
B. HClO4.
C. H3PO4.
D. H2SiO3.
Câu 25: Khi xếp theo chiều tăng dần của điện tích hạt nhân, đại lượng nào sau đây không biến đổi tuần hoàn?
A. Bán kính nguyên tử.
B. Số neutron.
C. Tính kim loại, tính phi kim.
D. Độ âm điện.
Câu 26: Nguyên tố X ở chu kì 3, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s22s22p6.
B. 1s22s22p63s23p1.
C. 1s22s22p63s3.
D. 1s22s22p63s2.
Câu 27: Nguyên tử nguyên tố G có cấu hình electron là [Ne]3s23p4. Vị trí của G trong bảng tuần hoàn là
A.ô thứ 16, chu kì 3, nhóm VIA.
B.ô thứ 26, chu kì 3, nhóm IVB.
C.ô thứ 16, chu kì 2, nhóm IVA.
D.ô thứ 26, chu kì 3, nhóm VIA.
Câu 28: Cho X (Z = 9), Y (Z = 17) và T (Z = 16). Các nguyên tố được sắp xếp theo thứ tự bán kính nguyên tử tăng dần là
A.X, Y, T.
B.T, Y, X.
C.X, T, Y.
D.Y, T, X.
Phần II. Tự luận (3 điểm)
Câu 1 (1 điểm): Chlorine có hai đồng vị bền là 35Cl và 37Cl. Nguyên tử khối trung bình của chlorine là 35,45. Tính tỉ lệ phần trăm số nguyên tử mỗi đồng vị của chlorine trong tự nhiên.
Câu 2 (1 điểm): Cation M+ và anion Y2- đều có cấu hình electron lớp ngoài cùng là 3s23p6. Hãy xác định vị trí của các nguyên tố M, Y trong bảng tuần hoàn, có giải thích ngắn gọn.
Câu 3 (1 điểm): Sắp xếp các nguyên tố sau: 3Li, 8O, 9F, 11Na theo chiều tăng dần bán kính nguyên tử, có giải thích ngắn gọn.
Sở Giáo dục và Đào tạo ...
Đề thi Giữa kì 1 - Cánh Diều
năm 2025
Môn: Hóa học 10
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nội dung nào dưới đây là đối tượng nghiên cứu của hóa học?
A. Sự lớn lên và sinh sản của tế bào.
B. Tốc độ của ánh sáng trong chân không.
C. Ứng dụng của chất.
D. Sự hình thành hệ Mặt Trời.
Câu 2: Phương pháp nghiên cứu lí thuyết là
A. sử dụng những định luật, nguyên lí, quy tắc, cơ chế, mô hình … để tiếp tục làm rõ những vấn đề của lí thuyết hóa học.
B. nghiên cứu những vấn đề dựa trên kết quả thí nghiệm, khảo sát, thu thập số liệu, phân tích, định lượng…
C. giải quyết các vấn đề hóa học được ứng dụng trong các lĩnh vực khác nhau.
D. nghiên cứu thành phần, cấu trúc, tính chất và sự biến đổi của chất.
Câu 3: Trong các chất: magnesium, nitrogen, oxygen, sodium chloride. Hợp chất là
A.magnesium.
B.nitrogen.
C.oxygen.
D.sodium chloride.
Câu 4: Thứ tự các bước trong phương pháp nghiên cứu hóa học là
A.xác định vấn đề nghiên cứu; nêu giả thuyết khoa học; thực hiện nghiên cứu; viết báo cáo: thảo luận kết quả và kết luận vấn đề.
B.nêu giả thuyết khoa học; xác định vấn đề nghiên cứu; thực hiện nghiên cứu; viết báo cáo: thảo luận kết quả và kết luận vấn đề.
C.xác định vấn đề nghiên cứu; nêu giả thuyết khoa học; viết báo cáo: thảo luận kết quả và kết luận vấn đề; thực hiện nghiên cứu.
D.nêu giả thuyết khoa học; xác định vấn đề nghiên cứu; viết báo cáo: thảo luận kết quả và kết luận vấn đề; thực hiện nghiên cứu.
Câu 5: Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron và neutron.
B. proton và neutron.
C. neutron và electron.
D. electron, proton và neutron.
Câu 6: Phát biểu nào sai khi nói về neutron?
A. Tồn tại trong hạt nhân nguyên tử.
B. Có khối lượng bằng khối lượng proton.
C. Có khối lượng lớn hơn khối lượng electron.
D. Không mang điện.
Câu 7: Nguyên tử aluminium có 13 proton và 14 neutron. Số hạt mang điện có trong nguyên tử này là
A. 13. B. 14. C. 27. D. 26.
Câu 8: Hạt electron có điện tích là
A. 1,602 × 10-19 C.
B. -1,602 × 10-19 C.
C. +1,602 × 10-19 C.
D. -1,602 × 1019 C.
Câu 9: Nguyên tử carbon có điện tích hạt nhân là +6. Số electron của nguyên tử này là
A. 6. B. 12. C. 18. D. 24.
Câu 10: Nếu xem nguyên tử như một quả cầu, có bán kính khoảng 10-10 m thì bán kính hạt nhân nguyên tử vào khoảng
A. 10-8 m.
B. 10-14 m.
C. 10-12 m.
D. 104 m.
Câu 11: Đơn vị khối lượng nguyên tử kí hiệu là
A. meV.
B. amu.
C. nanometre.
D. angstrom.
Câu 12: Số đơn vị điện tích hạt nhân nguyên tử (kí hiệu là Z) của một nguyên tố gọi là
A. số khối.
B. nguyên tử khối.
C. số hiệu nguyên tử.
D. số neutron.
Câu 13: Số hạt electron của nguyên tử có kí kiệu 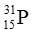
A. 31. B. 16. C. 15. D. 30.
Câu 14: Cho các nguyên tử sau:
A. A và B.
B. B và C
C. C và D.
D. A và D.
Câu 15: Từ hai đồng vị hydrogen (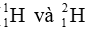
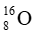
A. 1. B. 2. C. 3. D. 4.
Câu 16: Nguyên tử carbon có hai đồng vị bền: 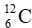
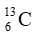
A. 12,50.
B. 12,02.
C. 12,01.
D. 12,06.
Câu 17: Orbital s có dạng
A. hình tròn.
B. hình số 8 nổi.
C. hình cầu.
D. hình bầu dục.
Câu 18: Lớp M có số electron tối đa bằng
A. 3. B. 4. C. 9. D. 18.
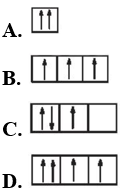
Câu 19: Sự phân bố electron theo ô orbital nào dưới đây là đúng?
Câu 20: Cấu hình electron của nguyên tử Cl (Z = 17) là
A. 1s22s22p63s23p6.
B. 1s22s22p63s23p5.
C. 1s22s22p63s23p3.
D. 1s22s22p63s23p4.
Câu 21: Nguyên tố X có số hiệu nguyên tử bằng 14. Electron cuối cùng của nguyên tử nguyên tố X điền vào lớp, phân lớp nào sau đây?
A. K, s.
B. L, p.
C. M, p.
D. N, d.
Câu 22: Phân lớp chứa đủ số electron tối đa được gọi là
A. phân lớp bão hòa.
B. phân lớp bán bão hòa.
C. phân lớp nửa bão hòa.
D. phân lớp chưa bão hòa.
Câu 23: Ô nguyên tố trong bảng tuần hoàn không cho biết thông tin nào sau đây?
A. Kí hiệu nguyên tố.
B. Tên nguyên tố.
C.Số hiệu nguyên tử.
D. Số khối của hạt nhân.
Câu 24: Chu kì 4 của bảng tuần hoàn có số nguyên tố là
A. 2 nguyên tố.
B. 18 nguyên tố.
C. 32 nguyên tố.
D. 8 nguyên tố.
Câu 25: Nguyên tử X có cấu hình electron [Ne]3s23p1. Vị trí của X trong bảng hệ thống tuần hoàn là
A. số thứ tự 3, chu kì 3, nhóm IIIA.
B. số thứ tự 11, chu kì 3, nhóm IIIA.
C. số thứ tự 13, chu kì 2, nhóm IA.
D. số thứ tự 13, chu kì 3, nhóm IIIA.
Câu 26: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố X là 3s2. Số thứ tự nguyên tố X trong bảng tuần hoàn là
A. 12. B. 13. C. 11. D. 14.
Câu 27: Cho cấu hình electron các nguyên tố sau đây: Na: [Ne]3s1; Cr: [Ar]3d54s1;Br: [Ar]3d104s24p5; F: 1s22s22p5; Cu: [Ar]3d104s1. Số nguyên tố thuộc khối s trong các nguyên tố trên là
A. 0. B. 1. C. 2. D. 3.
Câu 28: Bảng tuần hoàn hiện nay có số cột, số nhóm A và số nhóm B lần lượt là
A. 18, 8, 8.
B. 18, 8, 10.
C. 18, 10, 8.
D. 16, 8, 8.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt.
a) Xác định thành phần các hạt cấu tạo nên nguyên tử X.
b) Viết kí hiệu nguyên tử X.
Câu 2 (1 điểm): Nguyên tử của nguyên tố A có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố B có một electron ở lớp ngoài cùng 4s. Nguyên tử A và B có số electron hơn kém nhau là 3.
a) Viết cấu hình electron nguyên tử A, B.
b) Biểu diễn cấu hình electron A, B theo ô orbital và cho biết số electron độc thân có trong mỗi nguyên tử này.
Câu 3 (1 điểm): Hai nguyên tố X và Y đứng kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn, có tổng số điện tích hạt nhân bằng 25. Biết ZX < ZY, hãy xác định vị trí của X, Y trong bảng tuần hoàn (có giải thích ngắn gọn cách xác định).
Sở Giáo dục và Đào tạo ...
Đề thi Giữa kì 1 - Chân trời sáng tạo
năm 2025
Môn: Hóa học 10
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của hóa học?
A.Quỹ đạo chuyển động của Trái Đất.
B. Sự phân chia tế bào trong cơ thể.
C. Sự truyền âm trong chân không.
D. Cấu tạo và tính chất của glucose.
Câu 2: Loại liên kết trong phân tử muối ăn là
A. liên kết cộng hóa trị không phân cực.
B. liên kết cộng hóa trị phân cực.
C. liên kết ion.
D. liên kết kim loại.
Câu 3: Hiện tượng nào sau đây là hiện tượng hóa học?
A. Hòa tan muối ăn vào nước thu được dung dịch nước muối.
B. Dẫn khí carbon dioxide vào nước vôi trong, làm nước vôi trong vẩn đục.
C. Nước đá để ngoài không khí bị chảy thành nước lỏng.
D. Nhựa đường nấu ở nhiệt độ cao nóng chảy.
Câu 4: Nhiên liệu nào sau đây được coi là nhiên liệu của tương lai?
A. Than đá.
B. Hydrogen.
C. Dầu mỏ.
D. Oxygen.
Câu 5: Nhận định nào sai khi nói về neutron?
A. Có khối lượng lớn hơn khối lượng electron.
B. Không mang điện.
C. Tồn tại trong hạt nhân nguyên tử.
D. Có khối lượng bằng khối lượng proton.
Câu 6: Nguyên tử N có 7 proton, nguyên tử H có 1 proton. Số lượng hạt proton và electron có trong phân tử NH3 là
A. 8 proton và 8 electron.
B. 11 proton và 11 electron.
C. 10 proton và 11 electron.
D. 10 proton và 10 electron.
Câu 7: Hạt nhân nguyên tử gồm các loại hạt là
A.electron và proton.
B.proton và neutron.
C.electron và neutron.
D.electron, proton và neutron.
Câu 8: Nguyên tử calcium có điện tích hạt nhân là +20. Số hạt mang điện có trong nguyên tử calcium là
A. 20.B. 40.C. 60.D. 30.
Câu 9: Đồng vị là những nguyên tử của cùng một nguyên tố hóa học, nhưng khác nhau về
A. số proton.
B. số electron.
C. tính chất hóa học.
D. khối lượng nguyên tử.
Câu 10: Trong tự nhiên, lithium có hai đồng vị là 6Li và 7Li với tỉ lệ phần trăm số nguyên tử của mỗi đồng vị lần lượt là 7,42% và 92,58%. Nguyên tử khối trung bình của mẫu lithium này (kết quả tính đến hai chữ số thập phân) là
A. 6,07. B. 6,50. C. 6,90. D. 6,93.
Câu 11: Nguyên tử potassium (K) có 19 electron. Điện tích hạt nhân nguyên tử K là
A. 19. B. +19. C. -19. D. 19+.
Câu 12: Cho kí hiệu nguyên tử 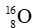
A.Kí hiệu hóa học của nguyên tố là O.
B.Số hiệu nguyên tử là 16.
C.Số proton trong một hạt nhân nguyên tử là 8.
D.Số neutron trong một hạt nhân nguyên tử là 8.
Câu 13: Lớp electron thứ 3 có bao nhiêu phân lớp?
A. 1. B. 2. C. 3. D. 4.
Câu 14: Phát biểu nào đúng khi nói về các orbital trong một phân lớp electron?
A. Khác nhau về mức năng lượng.
B. Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
C. Có cùng sự định hướng không gian.
D. Có cùng mức năng lượng.
Câu 15: Nếu 3 electron được điền vào 3 AO thì số lượng electron độc thân là
A. 0. B. 1. C. 2. D. 3.
Câu 16: Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron. Kí hiệu của các lớp thứ nhất, thứ hai, thứ ba, thứ tư lần lượt là
A.A, B, C, D.
B.V, X, Y, Z.
C.K, L, M, N.
D.M, N, O, P.
Câu 17: Số electron tối đa trong lớp L là
A. 2. B. 8. C. 18. D. 32.
Câu 18: Hình dạng của orbital s là
A. hình tròn.
B. hình cầu.
C. hình số tám nổi.
D. hình elip.
Câu 19: Một orbital chứa tối đa bao nhiêu electron?
A. 1. B. 2. C. 3. D. 4.
Câu 20: Phát biểu đúng khi nói về mô hình nguyên tử hiện đại là
A.Các electron chuyển động theo những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân.
B.Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân theo một quỹ đạo xác định, tạo thành đám mây electron.
C.Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
D.Các electron chuyển động theo những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân, tạo thành đám mây electron.
Câu 21: Lớp electron là
A. tập hợp các electron có mức năng lượng bằng nhau.
B. tập hợp các electron trong toàn bộ nguyên tử.
C. tập hợp các electron có mức năng lượng gần bằng nhau.
D. tập hợp các electron có mức năng lượng cao nhất trong nguyên tử.
Câu 22: Số electron tối đa trong phân lớp d là
A. 2. B. 10. C. 6. D. 14.
Câu 23: Phát biểu nào sau đây không đúng?
A. Lớp M có 9 phân lớp.
B. Lớp L có 4 orbital.
C. Phân lớp p có 3 orbital.
D. Năng lượng của electron trên lớp K là thấp nhất.
Câu 24: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y có một electron ở lớp ngoài cùng 4s. Nguyên tử X và Y có số electron hơn kém nhau là 3. Nguyên tử X, Y lần lượt là
A. khí hiếm và kim loại.
B. kim loại và khí hiếm.
C. kim loại và kim loại.
D. phi kim và kim loại.
Câu 25: Nguyên tử nguyên tố X có cấu hình electron là 1s22s22p63s23p3. Phát biểu nào sau đây là sai?
A. X là một phi kim.
B. X ở ô số 15 trong bảng tuần hoàn.
C. Nguyên tử của nguyên tố X có 9 electron p.
D. Nguyên tử của nguyên tố X có 3 phân lớp electron.
Câu 26: Số hiệu nguyên tử của nguyên tố hoá học bằng
A. số thứ tự của ô nguyên tố.
B. số thứ tự của chu kì.
C. số thứ tự của nhóm.
D. số electron lớp ngoài cùng của nguyên tử.
Câu 27: Nguyên tố Y ở chu kì 3, nhóm VA của bảng tuần hoàn. Cấu hình electron nguyên tử của Y là
A.1s22s22p63s23p5.
B.1s22s22p63s23p3.
C.1s22s22p63s23p63d54s2.
D.1s22s22p63s23p63d34s2.
Câu 28: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là
A.chu kì.
B.ô nguyên tố.
C.nhóm.
D.orbital.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Khối lượng riêng của calcium kim loại là 1,55 g/cm3. Giả thiết rằng, trong tinh thể calcium, các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Cho nguyên tử khối của calcium là 40 amu. Tính bán kính nguyên tử calcium.
Câu 2 (1 điểm): Cho các nguyên tử nguyên tố sau: Mg (Z = 12); S (Z = 16).
a) Viết cấu hình electron của Mg; S và biểu diễn cấu hình electron của chúng theo ô orbital. Xác định số electron độc thân của mỗi nguyên tử này.
b) Từ cấu hình electron, dự đoán tính chất hóa học của Mg; S (có giải thích ngắn gọn).
Câu 3 (1 điểm): Xác định vị trí các nguyên tố O (Z = 8) và P (Z = 15) trong bảng tuần hoàn (có giải thích ngắn gọn cách xác định).
Lưu trữ: Đề thi Hóa học 10 Giữa kì 1 (sách cũ)
Sở Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
năm 2025
Bài thi môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
(Cho C=12, O=16, H=1, Na=23,K=39,Mg =24, Ca=40, P=31, Cl =35,5, F=9, Si =27, N=14, S=32)
I- TRẮC NGHIỆM (7 Điểm)
Câu 1: Tính số p và n trong hạt nhân nguyên tử
A. 92p, 235n. B. 92p,143n. C. 92p, 143p. D. 92n, 235p.
Câu 2: Trong tự nhiên Gali có 2 đồng vị là 69Ga (60,1%) và 71Ga (39,9%). Nguyên tử khối trung bình của Gali là:
A. 70 B. 71,20 C. 69,80 D. 70,20
Câu 3: Nguyên tố hoá học là
A. tập hợp các nguyên tử có khối lượng giống nhau
B. tập hợp các nguyên tử có số nơtron giống nhau.
C. tập hợp các nguyên tử có cùng số khối.
D. tập hợp các nguyên tử có cùng điện tích hạt nhân.
Câu 4: Nguyên tố R có công thức hợp chất khí với hiđro cao nhất là RH2. Vậy công thức oxit cao nhất là
A. RO B. RO2 C. RO3 D. R2O3
Câu 5: Trong các hạt sau, hạt nào không mang điện tích?
A. nơtron B. electron C. Nơtron và electron D. proton
Câu 6: Các hạt cấu tạo nên hầu hết các nguyên tử là
A. electron, nơtron, proton. B. nơtron, electron.
C. electron, proton. D. proton, nơtron.
Câu 7: Chu kì là tập hợp các nguyên tố, mà nguyên tử của các nguyên tố này có cùng
A. số electron. B. số electron ở lớp ngoài cùng
C. số lớp electron. D. số electron hóa trị.
Câu 8: Biết rằng nguyên tố cacbon thuộc chu kỳ 2, nhóm VIA. Cấu hình electron của cacbon là :
A. 1s22s22p2. B. 1s22s22p3. C. 1s22s22p63s23p64s2 D. 1s22s22p4
Câu 9: Khối lượng nguyên tử hầu như tập trung ở
A. hạt nhân. B. hạt proton. C. hạt nơtron. D. vỏ nguyên tử.
Câu 10: Cấu hình electron của nguyên tử X: 1s22s22p63s23p5. Hợp chất khí với hiđro và oxi cao nhất có dạng
A. HX, X2O7. B. H2X, XO3. C. XH4, XO2. D. H3X, X2O5.
Câu 11: Cấu hình electron đầy đủ cho các nguyên tử có cấu hình electron lớp ngoài cùng 3s23p4 là:
A. 1s22s22p53s23p4 B. 1s22s22p63s23p6 C. 1s22s22p63s23p4 D. 1s22s23s23p4
Câu 12: Nguyên tử của nguyên tố nào sau đây có cấu hình electron 1s22s22p63s23p64s2 ?
A. Mg B. Ca C. Na D. K
Câu 13: Một nguyên tử A có tổng số electron là 10, nguyên tố Y thuộc loại:
A. Nguyên tố s. B. Nguyên tố p. C. Nguyên tố D. D. Nguyên tố f.
Câu 14: Trong bảng tuần hoàn các nguyên tố, số chu kỳ nhỏ và chu kỳ lớn là:
A. 4 và 4. B. 3 và 3. C. 4 và 3. D. 3 và 4.
Câu 15: Vỏ nguyên tử gồm các electron chuyển động như thế nào xung quanh hạt nhân?
A. Chuyển động rất nhanh theo những quỹ đạo xác định.
B. Chuyển động rất nhanh không theo những quỹ đạo xác định.
C. Chuyển động rất chậm và không theo những quỹ đạo xác định.
D. Chuyển động rất không nhanh và không theo những quỹ đạo xác định.
Câu 16: Nguyên tử Na (Z=11) bị mất đi 1e thì cấu hình e tương ứng của nó là:
A. 1s22s22p6 B. 1s22s22p63s1 C. 1s22s22p63s3 D. 1s22s22p63s23p64s1
Câu 17: Các nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn có tên gọi là
A. nhóm kim loại kiềm. B. nhóm halogen.
C. nhóm khí hiếm. D. nhóm kim loại kiềm thổ.
Câu 18: Cho các phát biểu sau
(a) Trong một chu kì, theo chiều tăng của điện tích hạt nhân thì tính kim loại giảm dần
(b) Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân thì tính phi kim tăng dần
(c) Các nguyên tố nhóm IA đều có tính kim loại mạnh
(d) Flo là phi kim mạnh nhất
(e) Chỉ có nguyên tử K mới chứa phân lớp electron 4s1.
Số phát biểu sai là:
A. 1. B. 2. C. 3. D. 4.
Câu 19: Trong một chu kì theo chiều tăng của điện tích hạt nhân nguyên tử
A. Bán kính nguyên tử tăng và độ âm điện giảm
B. Bán kính nguyên tử và độ âm điện tăng
C. Bán kính nguyên tử và độ âm điện giảm
D. Bán kính nguyên tử giảm và độ âm điện tăng
Câu 20: Nguyên tố canxi có số hiệu nguyên tử là 20, thuộc chu kỳ 4, nhóm IIA. Điều khẳng định nào sau đây về canxi là sai ?
A. Số electron ở vỏ nguyên tử của nguyên tố canxi là 20 .
B. Vỏ nguyên tử canxi có 4 lớp và lớp ngoài cùng có 2 electron.
C. Hạt nhân nguyên tử canxi có 20 proton.
D. Nguyên tố hóa học này là một phi kim.
Câu 21: Cho biết cấu hình electron của các nguyên tố X: 1s22s22p63s2; Y: 1s22s22p63s23p64s1; Z: 1s22s22p63s23p5. Nguyên tố nào là kim loại?
A. X. B. Z. C. X và Y. D. Y.
Câu 22: Tổng các hạt cơ bản trong một nguyên tử là 82 hạt. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số khối của nguyên tử đó là
A. 57 B. 65 C. 56 D. 55
Câu 23: Một nguyên tố R có Z =13. Công thức oxit cao nhất có dạng.
A. R2O3 B. RO2 C. R2O5 D. RO3
Câu 24: Nguyên tố M có số hiệu nguyên tử là 17, vị trí của M trong bảng tuần hoàn là
A. chu kì 3, nhóm VIIIA. B. chu kì 3, nhóm VA.
C. chu kì 3, nhóm VIA. D. chu kì 3, nhóm VIIA.
Câu 25: Ý nào sau đây không biến đổi tuần hoàn?
A. Số lớp electron B. Số electron lớp ngoài cùng
C. Tính kim loại, tính phi kim D. Hóa trị cao nhất với oxi
Câu 26: Nguyên tử của nguyên tố Y có số electron là 13. Điện tích hạt nhân của nguyên tử Y là:
A. 13 B. 13- C. 13+ D. +13
Câu 27: Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là:
A. 2, 8, 18, 32. B. 2, 4, 6, 8. C. 2, 6, 8, 18. D. 2, 6, 10, 14.
Câu 28: Nguyên tắc sắp xếp các nguyên tố vào bảng tuần hoàn:
(a) Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử;
(b) Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một hàng;
(c) Các nguyên tố có cùng số electron hóa trị được xếp vào một cột;
(d) Các nguyên tố có cùng số phân lớp electron trong nguyên tử được xếp vào cùng một hàng;
Số nguyên tắc đúng là
A. 2. B. 3. C. 1. D. 4.
--------------------
II- TỰ LUẬN (3 Điểm)
Câu 1 : (2 điểm) Xác định vị trí (STT, Chu kì, Nhóm) ; Tính chất hóa học ( Kim loại, Phi kim, Khí hiếm) của các nguyên tố sau ? (có giải thích cách xác định)
a) O (Z = 8)
b) Mg (Z = 12)
Câu 2: (1 điểm) Nguyên tố R có dạng R2O5. Trong hợp chất khí của R với hiđro chứa 91,18% R về khối lượng. Xác định tên nguyên tố R?
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I – TRẮC NGHIỆM
1 – B |
2 - C |
3 -D |
4 - C |
5 - A |
6 - A |
7 - C |
8 - D |
9 - A |
10 – A |
11 - C |
12 - B |
13 - B |
14 - D |
15 - B |
16 - A |
17 - B |
18 - B |
19 - D |
20 - D |
21 - C |
22 - C |
23 - A |
24 - D |
25 - A |
26 - C |
27 - D |
28 - B |
Câu 1:
Số proton = Z = 92;
Số nơtron = A – Z = 235 – 92 = 143.
Câu 2:
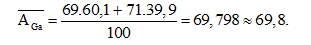
Câu 4:
Nguyên tố R có công thức hợp chất khí với hiđro cao nhất là RH2 → R thuộc nhóm VIA, công thức oxit cao nhất là RO3.
Câu 10:
X thuộc nhóm VIIA (do có 7 electron lớp ngoài cùng, nguyên tố p); vậy công thức oxit cao nhất là X2O7; công thức hợp chất khí với hiđro là HX.
Câu 13:
Cấu hình electron nguyên tử Y: 1s22s22p6. Vậy Y thuộc nguyên tố p.
Câu 16:
Na: 1s22s22p63s1
Vậy khi mất đi một electron thì cấu hình electron tương ứng là: 1s22s22p6.
Câu 18:
Phát biểu sai là: b và e.
Câu 20:
D sai vì Ca là kim loại.
Câu 21:
X có 2 electron lớp ngoài cùng; Y có 1 electron lớp ngoài cùng nên X và Y là kim loại.
Câu 22:
Theo bài ra có hệ phương trình:
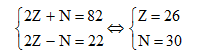
Số khối A = Z + N = 26 + 30 = 56.
Câu 23:
Cấu hình electron của R: [Ne]3s23p1
R thuộc nhóm IIIA, công thức oxit cao nhất có dạng R2O3.
Câu 24:
Cấu hình electron nguyên tử M: [Ne]3s23p5
Vậy M ở chu kỳ 3 (do có 3 lớp electron); nhóm VIIA (do có 7 electron hóa trị, nguyên tố p).
Câu 28:
Các nguyên tắc a, b, c đúng.
II – TỰ LUẬN
Câu 1:
a) O (Z = 8)
Cấu hình electron : 1s22s22p4
Oxi ở ô thứ 8 (Z = 8) ; chu kỳ 2 (do có 2 lớp electron) ; nhóm VIA (6 e hóa trị, nguyên tố p) ;
Oxi là phi kim do có 6 electron lớp ngoài cùng.
b) Mg (Z = 12)
Cấu hình electron : [Ne]3s2
Mg ở ô thứ 12 (Z = 12) ; chu kỳ 3 (do có 3 lớp electron) ; nhóm IIA (do có 2 e hóa trị, nguyên tố s)
Mg là kim loại do có 2 electron ở lớp ngoài cùng.
Câu 2 :
Công thức hợp chất khí với hiđro là RH3
%mR = 91,18%, ta có :
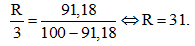
Vậy R là photpho (P).
Sở Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
năm 2025
Bài thi môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 2)

(Cho C=12, O=16, H=1, Na=23,K=39,Mg =24, Ca=40, P=31, Cl =35,5, F=9, Si =27, N=14, S=32)
A. PHẦN TRẮC NGHIỆM: (28 câu – 7 điểm)
Câu 1. Cấu hình electron của nguyên tử X: 1s22s22p63s23p5. Hợp chất khí với hiđro và oxi cao nhất của X có dạng
A. XH4, XO2. B. H3X, X2O5. C. H2X, XO3. D. HX, X2O7.
Câu 2. X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Phát biểu nào sau đây về X, Y là đúng?
A. Độ âm điện của X lớn hơn độ âm điện của Y.
B. Phân lớp ngoài cùng của nguyên tử X (ở trạng thái cơ bản) có 4 electron.
C. Lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 5 electron.
D. Đơn chất X là chất khí ở điều kiện thường.
Câu 3. Vỏ nguyên tử gồm các electron chuyển động như thế nào xung quanh hạt nhân?
A. Chuyển động rất không nhanh và không theo những quỹ đạo xác định.
B. Chuyển động rất chậm và không theo những quỹ đạo xác định.
C. Chuyển động rất nhanh không theo những quỹ đạo xác định.
D. Chuyển động rất nhanh theo những quỹ đạo xác định.
Câu 4. Cho các phát biểu sau:
(a) Các electron ở lớp L có mức năng lượng gần bằng nhau
(b) Các electron ở lớp M (n=3) liên kết chặt chẽ với hạt nhân hơn các electron ở lớp K (n=1)
(c) Các electron ở lớp L có mức năng lượng cao hơn các electron ở lớp K
(d) Các electron ở lớp K có mức năng lượng bằng nhau
(e) Các electron ở phân lớp 3s có mức năng lượng thấp hơn các electron ở phân lớp 2p
Số phát biểu đúng là
A. 5 . B. 3. C. 2. D. 4.
Câu 5. Các hạt cấu tạo nên hầu hết các nguyên tử là:
A. electron, proton. B. electron, nơtron, proton
C. nơtron, electron. D. proton, nơtron.
Câu 6. Cho 4,6 gam kim loại X (thuộc nhóm IA) tác dụng hết với 95,6 ml nước (d = 1g/ml), thu được 2,24 lit khí H2 (đktc). Kim loại X là :
A. K B. Li C. Na D. Rb
Câu 7. Nguyên tố X có phân lớp electron ngoài cùng là 3p4. Nhận định nào sai khi nói về X?
A. X là nguyên tố thuộc nhóm IVA
B. X là nguyên tố thuộc chu kì 3 .
C. Lớp ngoài cùng của nguyên tử nguyên tố X có 6 electron
D. Hạt nhân nguyên tử của X có 16 proton .
Câu 8. Cho ba nguyên tử có kí hiệu là 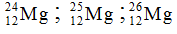 . Phát biểu nào sau đây là sai?
. Phát biểu nào sau đây là sai?
A. Hạt nhân của mỗi nguyên tử đều có 12 proton.
B. Ba nguyên tử trên đều thuộc nguyên tố Mg.
C. Đây là 3 đồng vị.
D. Số hạt electron của các nguyên tử lần lượt là: 12, 13, 14.
Câu 9. Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
A. 8. B. 16. C. 14. D. 6.
Câu 10. Nguyên tử của nguyên tố X có tổng số hạt mang điện trong hạt nhân là 13. Vị trí của X trong bảng tuần hoàn là
A. Chu kì 3, nhóm IIIA. B. Chu kì 2, nhóm IIIA.
C. Chu kì 3, nhóm VIIA. D. Chu kì 3, nhóm IIA.
Câu 11. Cấu hình electron của nguyên tử có số hiệu Z = 17 là
A. 1s22s22p63s23p44s1. B. 1s22s22p63s23p5.
C. 1s22s22p63s23d5. D. 1s22s22p63s23p34s2.
Câu 12. Oxit X có công thức R2O. Tổng số hạt cơ bản (p, n, e) trong X là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. X là chất nào dưới đây (biết rằng trong hạt nhân nguyên tử oxi có 8 proton và 8 nơtron) ?
A. N2O. B. Cl2O. C. K2O. D. Na2O.
Câu 13. Nguyên tố A có Z = 18, vị trí của A trong bảng tuần hoàn là
A. chu kì 3, phân nhóm VIIIB. B. chu kì 3, phân nhóm VIA.
C. chu kì 3, phân nhóm VIIIA. D. chu kì 3, phân nhóm VIB.
Câu 14. Nguyên tử của một nguyên tố R có lớp ngoài cùng là lớp M trên lớp M chứa 2 electron. Cấu hình electron của R và tính chất của R là
A. 1s22s22p63s23p2, phi kim. B. 1s22s22p63s2, phi kim.
C. 1s22s22p63s2, kim loại. D. 1s22s22p63s23p6, khí hiếm.
Câu 15. Ở trạng thái cơ bản, nguyên tử X có 3 lớp electron và có 3 electron ở phân lớp ngoài cùng. Vị trí của nguyên tố X trong bảng tuần hoàn là
A. chu kì 3, nhóm IIIA. B. chu kì 3, nhóm VIIA.
C. chu kì 3, nhóm VIA. D. chu kì 3, nhóm VA.
Câu 16. Phát biểu nào sau đây sai?
A. Một nguyên tử có số hạt proton bằng số hạt nơtron thì số khối là số lẻ.
B. Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số proton.
C. Dãy gồm các phân lớp e đã bão hòa: s2, p6, d10, f14.
D. Nguyên tố có cấu hình e ngoài cùng: 3s2 có số hạt mang điện tích dương là 12.
Câu 17. Nguyên tử của nguyên tố X có số proton là 13. Điện tích hạt nhân của nguyên tử X là
A. 13+. B. +13. C. 13. D. 13-.
Câu 18. Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì và có tổng số proton trong hai hạt nhân là 25. X và Y thuộc chu kì và nhóm nào trong bảng tuần hoàn ?
A. Chu kì 2, nhóm IIA B. Chu kì 3, các nhóm IIA và IIIA .
C. Chu kì 3, các nhóm IA và IIA . D. Chu kì 2, các nhóm IIIA và IVA .
Câu 19. Trong tự nhiên magie có 3 đồng vị bền 24Mg chiếm 78,99%, 25Mg chiếm 10,00% và 26Mg. Nguyên tử khối trung bình của Mg là
A. 24,89. B. 24,00. C. 24,32. D. 24,11.
Câu 20. Nguyên tử của nguyên tố X có tổng số electron ở phân lớp p là 5. Vị trí của nguyên tố X trong bảng tuần hoàn là
A. Nhóm VA,chu kì 3. B. VIIA, chu kì 2.
C. VIIB, chu kì 2. D. VIA, chu kì 3.
Câu 21. Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là
A. 28. B. 26. C. 27. D. 23.
Câu 22. Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4.Trong hợp chất khí của nguyên tố X với hiđro, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxit cao nhất là
A. 27,27%. B. 50,00%. C. 40,00%. D. 60,00%.
Câu 23. Số proton và số nơtron trong hạt nhân nguyên tử là
A. 24p, 28n. B. 52p, 24n. C. 28p, 24n. D. 24p, 52n.
Câu 24. Cho các phát biểu sau:
(a) Bảng tuần hoàn có 7 chu kì,trong đó có 3 chu kì nhỏ và 4 chu kì lớn;
(b) Bảng tuần hoàn có 8 nhóm, số thứ tự của nhóm bằng số electron lớp ngoài cùng;
(c) Các nhóm A có số electron lớp ngoài cùng bằng số thứ tự của nhóm;
(d) Các nguyên tố s và p thuộc về các nhóm A;
(e) Các chu kì nhỏ (1,2,3) bao gồm các nguyên tố s,p;
Số phát biểu đúng là :
A. 5. B. 2. C. 3. D. 4.
Câu 25. Số nguyên tố trong chu kì 3 và chu kì 5 lần lượt là
A. 8 và 18. B. 8 và 8. C. 18 và 18. D. 18 và 8.
Câu 26. Lớp thứ 3 (n = 3) có số phân lớp là
A. 4. B. 5. C. 7. D. 3.
Câu 27. Cho các nguyên tố M (Z = 11), X (Z = 17), Y (Z = 9) và R (Z = 19). Độ âm điện của các nguyên tố tăng dần theo thứ tự
A. R < M < X < Y. B. Y < M < X < R. C. M < X < Y < R. D. R < M < Z< Y.
Câu 28. Cho kí hiệu nguyên tử , phát biểu nào sau đây là sai?
A. Tổng số hạt mang điện trong nguyên tử P là 30.
B. Điện tích hạt nhân của nguyên tử P là 15+.
C. Hạt nhân nguyên tử P có 15 proton và 16 nơtron.
D. Lớp vỏ của nguyên tử P có 16 electron.
B. PHẦN TỰ LUẬN: (3 điểm)
Câu 1: (1,5 điểm) Cho nguyên tố X ở chu kỳ 3, nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học. Hỏi:
a) Viết cấu hình e của nguyên tử X? Xác định tên nguyên tố X?
b) Viết công thức oxit cao nhất, công thức hiđroxit tương ứng. Chúng có tính axit hay bazơ?
c) Viết công thức hợp chất khí với hiđro?
Câu 2: (1,5 điểm)
Trong tự nhiên, Cu có hai đồng vị bền là 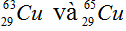 , nguyên tử khối trung bình của Cu là 63,54. Tính phần trăm khối lượng
, nguyên tử khối trung bình của Cu là 63,54. Tính phần trăm khối lượng 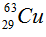 trong CuS (biết nguyên tử khối của S là 32).
trong CuS (biết nguyên tử khối của S là 32).
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
PHẦN TRẮC NGHIỆM
1 - D |
2 - B |
3 - C |
4 - B |
5 - B |
6 - C |
7 - A |
8 - D |
9 - B |
10 - A |
11 - B |
12 - D |
13 - C |
14 - C |
15 - D |
16 - A |
17 - A |
18 - B |
19 - C |
20 - B |
21- C |
22 - C |
23 - A |
24 - D |
25 - A |
26 - D |
27 - A |
28 - D |
Câu 1:
X thuộc nhóm VIIA (do có 7 electron lớp ngoài cùng, nguyên tố p), nên công thức hợp chất khí với hidro có dạng HX, công thức oxit cao nhất: X2O7.
Câu 2:
Theo bài ra có hệ phương trình:
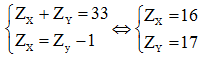
A sai do độ âm điện của Y lớn hơn độ âm điện của X.
B đúng vì cấu hình e của X là [Ne]3s23p4 hay phân lớp ngoài cùng có 4 electron.
C sai vì lớp ngoài cùng của Y có 7 electron.
D sai vì X là S, là chất rắn ở điều kiện thường.
Câu 4:
Các phát biểu đúng là: a, c và d.
Câu 6:
2X + 2H2O → 2X(OH)2 + H2
Có nX = 2.nkhí = 0,2 mol
MX = 4,6/0,2 = 23. Vậy X là Na.
Câu 7:
Cấu hình electron của X: [Ne]3s23p4
Vậy A sai vì X thuộc nhóm VIA.
Câu 8:
D sai vì các nguyên tử đều có 12 electron.
Câu 9:
Cấu hình electron nguyên tử X: [Ne]3s23p4
Vậy số đơn vị điện tích hạt nhân X là 16.
Câu 10:
Cấu hình electron nguyên tử X: [Ne]3s23p1
Vậy X ở chu kì 3, nhóm IIIA.
Câu 12:
Tổng số hạt cơ bản (p, n, e) trong X là 92
→ 2. (2pR + nR) + 2pO + nO = 92 → 2. (2pR + nR) = 68
Số hạt mang điện nhiều hơn số hạt không mang điện là 28
→ (2.2pR +2.nO )- (2nR + nO) = 28
→ 4pR - 2nR = 20
Giải hệ → pR= 11, nR = 12 → R là Na
Vậy công thức của X là Na2O.
Câu 13:
Cấu hình electron nguyên tử A: [Ne]3s23p6
Vậy A ở chu kì 3 (do có 3 lớp electron); nhóm VIIIA (do có 8e hóa trị, nguyên tố p).
Câu 14:
Lớp M – lớp thứ 3
Cấu hình electron của R: [Ne]3s2
Vậy R là kim loại do có 2 electron ở lớp ngoài cùng.
Câu 15:
Cấu hình electron của X là: [Ne]3s23p3
Vậy X ở chu kỳ 3, nhóm VA.
Câu 16:
A sai, vì tổng của 2 số lẻ là một số chẵn.
Câu 18:
Giả sử X đứng trước Y ta có hệ phương trình:
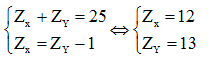
Cấu hình electron của X và Y lần lượt là: [Ne]3s2 và [Ne]3s23p1
Vậy X và Y đều thuộc chu kì 3, X thuộc nhóm IIA và Y thuộc nhóm IIIA.
Câu 19:
Nguyên tử khối trung bình của Mg là
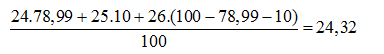
Câu 20:
Cấu hình electron của X: 1s22s22p5
Vậy X ở chu kỳ 2 (do có 2 lớp electron); nhóm VIIA (do có 7 e hóa trị, nguyên tố p).
Câu 21:
Theo bài ra ta có hệ phương trình:
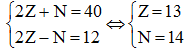
Số khối A = 13 + 14 = 27.
Câu 22:
Theo bài ra, X thuộc nhóm VIA, công thức hợp chất khí với hidro: H2S

Vậy X là lưu huỳnh, công thức oxit cao nhất là SO3.
%mS trong oxit cao nhất là 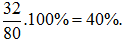
Câu 23:
Số proton = Z = 24;
Số nơtron = A – Z = 52 – 24 = 28.
Câu 24:
Các phát biểu đúng: a, c, d, e.
Câu 26:
Lớp thứ n có n phân lớp. Vậy lớp thứ 3 có 3 phân lớp.
Câu 27:
Y là Flo, có độ đâm điện lớn nhất → loại B và C.
Loại D do không có nguyên tố Z.
Câu 28:
D sai vì P có 15 electron.
Phần tự luận
Câu 1:
a) X ở chu kì 3 nên có 3 lớp electron, X thuộc nhóm VIIA nên có 7 electron lớp ngoài cùng.
Cấu hình electron của X là: [Ne]3s23p5. Vậy X là Clo.
b) Công thức oxit cao nhất là Cl2O7, là oxit axit.
Công thức hiđroxit tương ứng là HClO4 là axit.
c) Công thức hợp chất khí với hidro là HCl.
Câu 2:
Gọi % số nguyên tử của 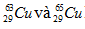 lần lượt là x và y. Theo bài ra ta có:
lần lượt là x và y. Theo bài ra ta có:
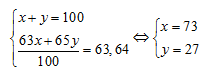
Giả sử có 1 mol CuS → Số mol Cu = 1 mol, số mol 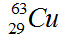 = 0,73 mol.
= 0,73 mol.
Phần trăm khối lượng  trong CuS là:
trong CuS là:

Sở Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
năm 2025
Bài thi môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 3)
Câu 1. Trong nguyên tử, loại hạt có mặt ở lớp vỏ nguyên tử là
A. proton. B. nơtron và electron.
C. nơtron. D. electron.
Câu 2. Hạt mang điện tích trong nguyên tử là
A. electron và nơtron. B. electron và proton.
C. nơtron và proton. D. electron, notron, proton.
Câu 3. Số proton và số nơtron trong hạt nhân nguyên tử 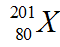 là
là
A. 201; 80. B. 121; 80. C. 80; 201. D. 80; 121.
Câu 4. Cấu hình electron nào sau đây là của nguyên tố phi kim ?
A. 1s22s1. B. 1s22s22p6.
C. 1s2. D. 1s22s22p63s23p5.
Câu 5. Cho các nguyên tử: 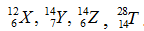 Các nguyên tử nào là đồng vị của cùng một nguyên tố hóa học?
Các nguyên tử nào là đồng vị của cùng một nguyên tố hóa học?
A. X và Z. B. Y và Z. C. T và Z. D. Y, Z,T.
Câu 6. Trong các cấu hình electron nào dưới đây sai?
A. 1s22s22p63s23p63d54s2 B. 1s22s22p63s23p6
C. 1s22s22p63s23p63d104s1. D. 1s22s22p63s23p64s24p4.
Câu 7. Số electron tối đa trong lớp M là
A. 32. B. 2. C. 18. D. 8.
Câu 8. Cho kí hiệu nguyên tử 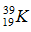 . Phát biểu đúng là
. Phát biểu đúng là
A. Trong hạt nhân có 38 hạt mang điện.
B. Số hiệu nguyên tử là 39.
C. Số nơtron trong hạt nhân hơn số proton là 2.
D. Có lớp electron ngoài cùng là N.
Câu 9. Số p, n, e của ion 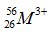 lần lượt là
lần lượt là
A. 26, 26, 23. B. 26, 30, 23. C. 26, 30, 26. D. 30, 26, 23.
Câu 10. Số p, n, e của ion 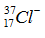 lần lượt là
lần lượt là
A. 17, 18, 20. B. 17, 17, 18. C. 17, 20, 18. D. 17, 20, 17.
Câu 11. Phát biểu nào dưới đây là đúng?
A. Electron ở phân lớp 4p có mức năng lượng thấp hơn phân lớp 4s.
B. Những electron ở lớp K có mức năng lượng thấp nhất.
C. Các electron trong cùng một lớp có năng lượng bằng nhau.
D. Những electron ở gần hạt nhân có mức năng lượng cao nhất.
Câu 12. Cho các nguyên tử có kí hiệu sau: 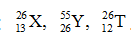 . Nhận định nào sau đây đúng khi nói về 3 nguyên tử trên?
. Nhận định nào sau đây đúng khi nói về 3 nguyên tử trên?
A. X, T là 2 đồng vị của cùng một nguyên tố hoá học.
B. X và T có cùng số khối.
C. X và Y có cùng số nơtron.
D. X, Y thuộc cùng một nguyên tố hoá học.
Câu 13. Ion X− có tổng số hạt proton, electron, nơtron là 53 trong X số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Cấu hình electron của nguyên tử X là
A. [Ne]3s23p5. B. [Ar]3d104s24p5.
C.[Ne]3s23p6. D. [Ar]3d54s2.
Câu 14. Nguyên tử khối trung bình của nguyên tố Br là 79,91; R có 2 đồng vị là 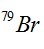 và
và 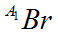 , Biết
, Biết 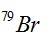 chiếm 54,5%. Số khối (A1) của đồng vị thứ 2 có giá trị là
chiếm 54,5%. Số khối (A1) của đồng vị thứ 2 có giá trị là
A. 80. B. 82. C. 81. D. 85.
Câu 15. Nguyên tử khối trung bình của Cl là 35,5. Cl có 2 đồng vị là 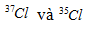 . Nếu có 50 nguyên tử
. Nếu có 50 nguyên tử 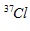 thì có bao nhiêu nguyên tử
thì có bao nhiêu nguyên tử 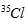 ?
?
A. 300 B. 150 C. 75 D. 100
Câu 16. Trong tự nhiên, nguyên tố đồng có hai đồng vị là  . Nguyên tử khối trung bình của đồng là 63,54. Thành phần phần trăm tổng số nguyên tử của đồng vị
. Nguyên tử khối trung bình của đồng là 63,54. Thành phần phần trăm tổng số nguyên tử của đồng vị 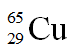 là
là
A. 27%. B. 50%. C. 54%. D. 73%.
Câu 17. Trong tự nhiên clo có hai đồng vị bền: 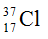 chiếm 24,23% tổng số nguyên tử, còn lại là
chiếm 24,23% tổng số nguyên tử, còn lại là 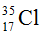 . Coi nguyên tử khối trung bình của oxy là 16, natri là 23. Thành phần % theo khối lượng của
. Coi nguyên tử khối trung bình của oxy là 16, natri là 23. Thành phần % theo khối lượng của 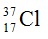 trong NaClOn là 8,42 %. (Cho Na = 23, O = 16). Giá trị của n là
trong NaClOn là 8,42 %. (Cho Na = 23, O = 16). Giá trị của n là
A. 4. B. 3. C. 1. D. 2.
Câu 18. Cho m gam kim loại Na tác dụng với dung dịch HCl dư. Sau phản ứng thu được 6,72 lít H2 (đktc). Giá trị m là
A. 4,5. B. 13,5. C. 2,7. D. 13,8.
Câu 19. Các đồng vị được phân biệt bởi yếu tố nào sau đây?
A. Số electron hoá trị. B. Số nơtron.
C. Số proton. D. Số lớp electron.
Câu 20: Nguyên tố X có số hiệu nguyên tử là 29. Cấu hình e của X là
A. 1s22s22p63s23p64s23d9. B. 1s22s22p63s23p63d104s1.
C. 1s22s22p63s23p63d94s2. D. 1s22s22p63s23p64s13d10.
Câu 21. Một nguyên tử của nguyên tố X có tổng số hạt cơ bản (p, n, e) là 34. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10. Phát biểu nào dưới đây sai về X?
A.X là nguyên tố s. B. X là nguyên tố phi kim.
C. X có 3 lớp electron. D. số khối của X bằng 23.
Câu 22. Nguyên tử X có Z = 17, Số electron ở trên lớp ngoài cùng là
A. 4. B. 3. C. 7. D. 5.
Câu 23. Các electron của nguyên tử nguyên tố X được phân bố trên ba lớp. Phân lớp ngoài cùng có 4e. Điện tích của hạt nhân nguyên tử nguyên tố là
A. 16+. B. 14+ C. 17+. D. 15+.
Câu 24. Nguyên tử M có electron ở phân mức năng lượng cao nhất là 3d4 . Cấu hình electron nguyên tử M là
A. [Ar]3d4. B. [Ar]3d44s2. C. [Ar]3d54s2. D. [Ar]3d54s1.
Câu 25. Các nguyên tố kim loại kiềm thổ là nhóm IIA trong bảng tuần hoàn, vậy nó thuộc họ
A. d. B. s. C. f. D. p.
Câu 26. Nguyên tố nào sau đây là phi kim?
A. 1s22s22p4. B. 1s22s22p63s2.
C.1s22s22p63s23p63d64s2. D. 1s22s22p6.
Câu 27. Cấu hình electron của nguyên tố X là 1s22s22p63s23p64s2. Phát biểu sai là
A. Lớp N có 2e. B. Lớp K có 2e.
C. Lớp L có 8e. D. Lớp M có 6e.
Câu 28. Cấu hình electron của nguyên tố X là [Ne] 3s2. Vậy X là
A. Á kim. B. Khí hiếm. C. Kim loại. D. Phi kim.
Câu 29. Nguyên tử X có Z = 9. Vị trí của X trong bảng tuần hoàn là
A. Chu kì 2, nhóm VIA. B. Chu kì 3, nhóm IVA.
C. Chu kì 2, nhóm VIIA. D. Chu kì 3, nhóm IIA.
Câu 30. Một nguyên tử kim loại M khi nhường 2e ở lớp ngoài nó trở thành cation mang điện M2+. Biết M2+ có phân mức năng lượng cao nhất là 3p6. Vậy M có cấu hình e là
A. [Ne]3s23p5. B. [Ar]3d104s2. C. [Ne]3s23p6. D. [Ar]4s2.
Đáp án và hướng dẫn giải
1 - D |
2 - B |
3 - D |
4 - D |
5 - A |
6 - D |
7 - C |
8 - D |
9 - B |
10 - C |
11 - B |
12 - B |
13 - A |
14 - C |
15 - B |
16 - A |
17 - B |
18 - D |
19 - C |
20 - B |
21 - B |
22 - C |
23 - A |
24 - D |
25 - B |
26 - A |
27 - C |
28 - C |
29 – C |
30 - A |
Câu 3. D
Số proton = z = 80
Số nơtron = A – z = 201 – 80 = 121.
Câu 4. D
Nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tử của nguyên tố phi kim.
1s22s22p63s23p5: có 7 electron ở lớp ngoài cùng là cấu hình electron nguyên tử nguyên tố phi kim.
Câu 5. A
X và Z có cùng số proton trong hạt nhân nên là đồng vị của cùng một nguyên tố hóa học.
Câu 6. D
D sai vì trât tự phân mức năng lượng là 1s 2s 2p 3s 3p 4s 3d …
Câu 7. C
Lớp M là lớp thứ 3, số electron tối đa trên lớp thứ 3 là 2.32 = 18.
Câu 8. D
A sai vì hạt mang điện trong hạt nhân là proton, số hạt proton = z = 19.
B sai vì số hiệu nguyên tử là 19.
C sai vì số nơtron 39 – 19 = 20 ; hơn số proton là 1.
D đúng vì cấu hình electron của K là [Ar]4s1 → lớp ngoài cùng là lớp thứ 4 hay lớp N.
Câu 9. B
Số proton = z = 26 = số electron trong nguyên tử.
Có M → M3+ + 3e
Vậy số electron của ion là 26 – 3 = 23.
Số nơtron = A – z = 56 – 26 = 30.
Câu 10. C
Số proton = z = 17 = số electron trong nguyên tử.
Có Cl + 1e → Cl-
Vậy số electron của ion là 17 + 1 = 18.
Số nơtron = A – z = 37 – 17 = 20.
Câu 11. B
A sai electron ở phân lớp 4p có mức năng lượng cao hơn phân lớp 4s.
B đúng.
C sai các electron trong cùng một lớp có năng lượng gần bằng nhau.
D sai vì những electron ở gần hạt nhân có mức năng lượng thấp nhất.
Câu 12. B
X và T có cùng số khối là 26.
Câu 13. A
X + 1e → X-
Tổng số hạt proton, electron, nơtron trong X là 53 – 1 = 52.
Gọi các hạt proton, electron, nơtron trong X lần lượt là p; e và n.
Theo bài ra, ta có hệ phương trình:
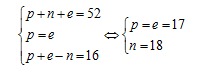
Vậy cấu hình electron của X là [Ne]3s23p5.
Câu 14. C
Ta có:
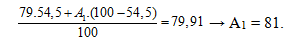 .
.
Bài 15. B
Gọi % số nguyên tử của hai đồng vị 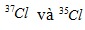 lần lượt là x và y. Theo bài ra ta có:
lần lượt là x và y. Theo bài ra ta có:
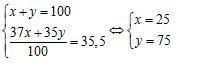
Nếu có 50 nguyên tử 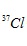 thì có tất cả số nguyên tử Cl là:
thì có tất cả số nguyên tử Cl là:
Vậy số nguyên tử 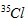 là 200 – 50 = 150.
là 200 – 50 = 150.
Câu 16. A
Gọi % số nguyên tử của hai đồng vị 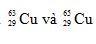 lần lượt là x và y. Ta có:
lần lượt là x và y. Ta có:
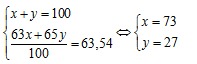
Câu 17. B
Nguyên tử khối trung bình của Cl là:
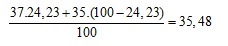
Giả sử có 1 mol Cl, vậy số mol 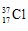 là 0,2423.
là 0,2423.
Thành phần % theo khối lượng của 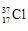 trong NaClOn là 8,42 % nên:
trong NaClOn là 8,42 % nên:
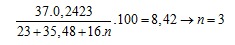
Câu 18. D
2Na + 2HCl → 2NaCl + H2
0,6 0,3 mol
→ m = 0,6.23 = 13,8 gam.
Câu 21. B
Theo bài ra ta có hệ phương trình:
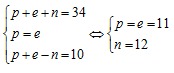
Cấu hình electron nguyên tử X là: [Ne]3s1
Vậy X có 3 lớp electron, là nguyên tố s, là nguyên tử của nguyên tố kim loại.
Số khối của X là 11 + 12 = 23.
Câu 22. C
Cấu hình electron của Z là [Ne]3s23p5. Vậy X có 7 electron ở lớp ngoài cùng.
Câu 23. A
Cấu hình electron nguyên tử X là 1s22s22p63s23p4.
Nguyên tử X có số p = số e = 16.
Điện tích hạt nhân nguyên tử là 16+.
Câu 25. B
Cấu hình electron tổng quát của các nguyên tố nhóm IIA là ns2 → thuộc họ s.
Câu 26. A
Các nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tử của nguyên tố phi kim.
1s22s22p4 → 6 electron lớp ngoài cùng, là cấu hình electron nguyên tử nguyên tố phi kim.
Câu 27. D
Lớp K, lớp thứ 1 có 2e
Lớp L, lớp thứ 2 có 8e
Lớp M, lớp thứ 3 có 8e
Lớp N, lớp thứ 4 có 2e.
Câu 28. C
X có 2e lớp ngoài cùng nên là nguyên tử của nguyên tố kim loại.
Câu 29. C
Cấu hình electron của X là 1s22s22p5
→ X thuộc chu kỳ 2 (do có 2 lớp e); nhóm VIIA (do 7e hóa trị, nguyên tố p).
Câu 30. D
Cấu hình electron của M2+ là 1s22s22p63s23p6
Có M → M2+ + 2e
Vậy cấu hình electron của M là 1s22s22p63s23p64s2 hay [Ar]4s2.
..........................
..........................
..........................
Tải xuống để xem tài liệu đề thi Hóa học 10 Giữa học kì 1 năm 2025 đầy đủ!
Xem thêm bộ đề thi Hóa học 10 năm 2025 chọn lọc khác:
- Đề thi Hóa học 10 Học kì 1 có đáp án (3 đề)
- Đề kiểm tra Hóa học 10 Giữa học kì 2 có đáp án (5 đề)
- Đề thi Hóa học 10 Giữa kì 2 có đáp án (5 đề)
- Đề thi Hóa học 10 Học kì 2 có đáp án (5 đề)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 10 (các môn học)
- Giáo án điện tử lớp 10 (các môn học)
- Giáo án Ngữ văn 10
- Giáo án Toán 10
- Giáo án Tiếng Anh 10
- Giáo án Vật Lí 10
- Giáo án Hóa học 10
- Giáo án Sinh học 10
- Giáo án Lịch Sử 10
- Giáo án Địa Lí 10
- Giáo án Kinh tế Pháp luật 10
- Giáo án Tin học 10
- Giáo án Công nghệ 10
- Giáo án Giáo dục quốc phòng 10
- Giáo án Hoạt động trải nghiệm 10
- Đề thi lớp 10 (các môn học)
- Đề thi Ngữ Văn 10 (có đáp án)
- Chuyên đề Tiếng Việt lớp 10
- Đề cương ôn tập Văn 10
- Đề thi Toán 10 (có đáp án)
- Đề thi cương ôn tập Toán 10
- Đề thi Toán 10 cấu trúc mới (có đáp án)
- Đề thi Tiếng Anh 10 (có đáp án)
- Đề thi Vật Lí 10 (có đáp án)
- Đề thi Hóa học 10 (có đáp án)
- Đề thi Sinh học 10 (có đáp án)
- Đề thi Lịch Sử 10 (có đáp án)
- Đề thi Địa Lí 10 (có đáp án)
- Đề thi Kinh tế & Pháp luật 10 (có đáp án)
- Đề thi Tin học 10 (có đáp án)
- Đề thi Công nghệ 10 (có đáp án)
- Đề thi Giáo dục quốc phòng 10 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

