Bộ 3 đề thi Hóa học 10 Học kì 1 năm 2026 tải nhiều nhất
Bộ 3 đề thi Hóa học 10 Học kì 1 năm 2026 tải nhiều nhất
Tuyển chọn Bộ 3 đề thi Hóa học 10 Học kì 1 năm 2026 tải nhiều nhất chọn lọc được các Giáo viên nhiều năm kinh nghiệm biên soạn và sưu tầm từ đề thi Hóa học 10 của các trường THPT. Hi vọng bộ đề thi này sẽ giúp học sinh ôn tập và đạt kết quả cao trong các bài thi Học kì 1 môn Hóa học 10.
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
Câu 1: Dãy các nguyên tố sắp xếp theo chiều tăng dần bán kính nguyên tử từ trái sang phải là (Cho: 7N, 8O, 9F, 15P)
A. N, O, F, P. B. P, N, F, O. C. F, O, N, P. D. P, N, O, F.
Câu 2: Phát biểu nào sau đây không đúng về liên kết hóa học?
A. Khi tạo liên kết hóa học, nguyên tử thường có xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
B. Liên kết cộng hóa trị là liên kết được hình thành bởi cặp electron chung giữa 2 nguyên tử.
C. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa 2 nguyên tử.
D. Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử gọi là liên kết cộng hóa trị có cực.
Câu 3: Phương trình biểu diễn sự hình thành ion nào sau đây không đúng?
A. Li → Li+ + 1e. B. S + 2e → S2-.
C. Al + 3e → Al3+. D. Mg → Mg2+ + 2e.
Câu 4: Cho các phát biểu sau:
1- Nguyên tử có cấu tạo rỗng gồm hạt nhân mang điện dương và vỏ electron mang điện âm.
2. Electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định.
3- Bảng tuần hoàn có 8 nhóm A và 10 nhóm B.
4- Nguyên tố nhóm VIA còn gọi là nhóm halogen là những phi kim điển hình.
5- Hóa trị của nguyên tố trong hợp chất cộng hóa trị gọi là cộng hóa trị.
6- Trong đơn chất N2 hai nguyên tử N liên kết với nhau bởi 2 cặp e chung.
Số phát biểu đúng là:
A. 3. B. 4. C. 5. D. 6.
Câu 5: Anion E2-có cấu hình electron là 1s22s22p6. Trong bảng tuần hoàn, E thuộc ô nguyên tố thứ
A. 8. B. 10. C. 12. D. 16.
Câu 6: Các nguyên tử X, Y, Z, T có cấu hình electron lần lượt là 1s2, 1s22s22p63s2, 1s22s22p63s23p1, 1s22s22p63s23p5. Dãy gồm các nguyên tử nguyên tố kim loại là
A. X, Y. B. X, Y, T. C. X, Y, Z. D. Y, Z.
Câu 7: Cấu hình electron của nguyên tử Na (Z = 11) ở trạng thái cơ bản là
A. 1s22s22p63s1. B. 1s22s22p63s2.
C. 1s22s22p53s1. D. 1s22s22p63s23p5.
Câu 8: Chọn nội dung đúng để hoàn thành câu sau: “Trong tất cả các hợp chất, …”
A. số oxi hóa của hiđro luôn bằng +1.
B. số oxi hóa của kali (Z = 19) luôn bằng +1.
C. số oxi hóa của oxi luôn bằng -2.
D. Cả A, B và C.
Câu 9: Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p4. Công thức hóa học và liên kết hóa học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết gì?
A. XY2, ion. B. X2Y, cộng hóa trị.
C. X2Y, ion. D. XY, cộng hóa trị.
Câu 10: Chọn phát biểu sai?
A. Trong một nguyên tử, số proton luôn bằng số electron và bằng số đơn vị điện tích hạt nhân.
B. Tổng số proton và số nơtron trong một hạt nhân được gọi là số khối.
C. Nguyên tố hoá học là những nguyên tử có cùng điện tích hạt nhân.
D. Đồng vị là các nguyên tử có cùng số proton và số nơtron.
Câu 11: Ở phân lớp 3d số electron tối đa là
A. 6. B. 10. C. 14. D. 18.
Câu 12: Nguyên tử M mất đi 3 electron ở lớp vỏ sẽ tạo ion dương M3+ theo sơ đồ: M → M3+ + 3e.
Biết ion M3+ có tổng số hạt proton, nơtron và electron là 37, trong đó có 14 hạt không mang điện. Vị trí của M trong bảng tuần hoàn là
A. ô 11, chu kì 3, nhóm IA.
B. ô 5, chu kì 2, nhóm IIIA.
C. ô 13, chu kì 3, nhóm IIIA.
D. ô 31, chu kì 4, nhóm IIIA.
Câu 13: Hai nguyên tử X và Y tạo thành phân tử XY có chứa 28 proton. Biết rằng:
+ X và Y đều có số hạt proton bằng số nơtron.
+ Số khối của X lớn hơn số khối của Y là 24 đơn vị.
Số hiệu nguyên tử của X và Y lần lượt là
A. 20 và 8. B. 24 và 4. C. 18 và 10. D. 17 và 9.
Câu 14: Nhóm gồm những nguyên tố phi kim điển hình là
A. IA. B. VA. C. VIIA. D. VIIIA.
Câu 15: Nguyên tố hóa học ở vị trí nào trong bảng tuần hoàn có các electron hóa trị là 3d34s2?
A. Chu kì 4, nhóm VA. B. Chu kì 4, nhóm VB.
C. Chu kì 4, nhóm IIA. D. Chu kì 4, nhóm IIIA.
Câu 16: Liên kết hóa học giữa các nguyên tử trong phân tử HCl thuộc loại liên kết
A. cộng hóa trị không cực. B. ion.
C. cộng hóa trị có cực. D. cho nhận.
Câu 17: Trong các nhóm chất sau đây, nhóm nào chỉ gồm những hợp chất cộng hóa trị:
A. MgCl2, H2O, HCl. B. K2O, HNO3, NaOH.
C. H2O, CO2, SO2. D. CO2, H2SO4, MgCl2.
Câu 18: Cho phản ứng hóa học sau:
aFeS + bHNO3 → cFe(NO3)3 + dH2SO4 + eNO + gH2O
Trong đó a, b, c, d, e, g là các số nguyên tối giản. Giá trị b là
A. 12. B. 6. C. 18. D. 10.
Câu 19: Số nơtron, electron trong ion lần lượt là
A. 64, 48. B. 64, 46. C. 64, 50. D. 46, 48.
Câu 20: Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ 3 có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
A. 6. B. 8. C. 14. D. 16.
Câu 21: Nguyên tử của nguyên tố A có tổng số electron trong các phân lớp p là 8. Nguyên tử của nguyên tố B có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của A là 6. A và B là các nguyên tố
A. Al và Br. B. Al và Cl. C. Si và Cl. D. Si và Ca.
Câu 22: Cấu hình electron nào sau đây là của nguyên tố thuộc nhóm VIIA?
A. 1s22s22p3. B. 1s22s22p5.
C. 1s22s22p63s1. D. 1s22s22p63s23p63d54s2.
Câu 23: Phát biểu nào sau đây là sai?
A. Nguyên tử kim loại thường có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
B. Các nhóm A bao gồm các nguyên tố s và nguyên tố p.
C. Trong một chu kì, bán kính nguyên tử kim loại nhỏ hơn bán kính nguyên tử phi kim.
D. Trong bảng tuần hoàn, hầu hết các nguyên tố hoá học là kim loại.
Câu 24: Nguyên tố Mg phổ biến thứ 8 trên vỏ trái đất, tồn tại với 3 đồng vị tự nhiên là 24Mg (80%), 25Mg (10%), 26Mg (10%). Nguyên tử khối trung bình của Mg là
A. 25,0. B. 24,3. C. 24,0. D. 25,7.
Câu 25: Nguyên tố Cl có 2 đồng vị tự nhiên là 35Cl và 37Cl. Nguyên tử khối trung bình của Cl là 35,5. Tính % khối lượng của đồng vị 37Cl trong hợp chất HClO4 (biết nguyên tử khối: H = 1, O = 16)
A. 25%. B. 36,8%. C. 9,2%. D. 36,3%.
Câu 26: Nguyên tử X có cấu hình e lớp ngoài cùng là ns2np2. Trong hợp chất khí của X với H thì H chiếm 25% về khối lượng. Nguyên tố R là
A. Cacbon (M = 12). B. Silic (M = 28).
C. Oxi (M = 16). D. Gemani (M = 73).
Câu 27: Cho 0,575 gam kim loại M (thuộc nhóm IA) tác dụng với nước dư thu được 280 ml khí H2 (đktc). Kim loại M là
A. Li (M = 7). B. Na (M = 23).
C. K (M = 39). D. Rb (M = 85).
Câu 28: Nguyên tố Y là phi kim thuộc chu kì 2 của BTH, Y tạo được hợp chất khí với hiđro và công thức oxit cao nhất là YO2. Hợp chất tạo bởi Y và kim loại M là MY2 trong đó Y chiếm 37,5% về khối lượng. M là
A. Mg. B. Cu. C. Al. D. Ca.
Câu 29: Nguyên tử nguyên tố R có tổng số các hạt cơ bản (p, n, e) là 82 hạt. Trong nguyên tử R, số hạt mang điện nhiều hơn số hạt không mang điện là 22. Số khối của hạt nhân nguyên tử R là
A. 52. B. 48. C. 56. D. 54.
Câu 30: Trong tự nhiên cacbon có 2 đồng vị bền là 126Cvà 136C. Nguyên tử khối trung bình của cacbon là 12,011. Phần trăm số nguyên tử của hai đồng vị trên là
A. 98,9% và 1,1%. B. 49,5% và 51,5%.
C. 99,8% và 0,2%. D.75% và 25%.
_______ Hết _______

Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 2)
Câu 1: Liên kết hóa học trong phân tử Br2 thuộc loại liên kết
A. hiđro. B. ion. C. CHT có cực. D. CHT không cực.
Câu 2: Cho sơ đồ phản ứng:
FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O
Sau khi cân bằng, tổng hệ số cân bằng (là các số nguyên, tối giản) của phản ứng là
A. 25. B. 21. C. 23. D. 19.
Câu 3: Nguyên tử của một nguyên tố có cấu hình electron là 1s22s22p63s2 thì nguyên tố đó thuộc
A. chu kì 2. B. chu kì 3. C. nhóm IIIA. D. nhóm IA.
Câu 4: Các đồng vị của cùng một nguyên tố hóa học được phân biệt bởi?
A. Số electron hóa trị. B. Số proton.
C. Số lớp electron. D. Số nơtron.
Câu 5: Anion X- có cấu hình electron ở phân lớp ngoài cùng là 3p6. Vị trí của X trong bảng tuần hoàn là
A. chu kì 3, nhóm VIIA. B. chu kì 3, nhóm IIA.
C. chu kì 2, nhóm IVA. D. chu kì 3, nhóm IVA.
Câu 6: Số oxi hoá của nguyên tố nitơ trong các hợp chất : NH4Cl, HNO3, NO, NO2, N2, N2O lần lượt là
A. –4, +6, +2, +4, 0, +1. B. –4, +5, –2, 0, +3, –1.
C. +3, –5, +2, –4, –3, –1. D. –3, +5, +2, +4, 0, +1.
Câu 7: Oxit cao nhất của một nguyên tố R ứng với công thức R2O7. R có thể là nguyên tố nào sau?
A. Nitơ (Z = 7). B. Cacbon (Z = 6).
C. Clo (Z = 17). D. Lưu huỳnh (Z = 16).
Câu 8: Vi hạt nào sau đây có số electron nhiều hơn số nơtron?

Câu 9: Cho phản ứng:
KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Hệ số cân bằng (là các số nguyên, tối giản) của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
A. 5 và 1. B. 2 và 10. C. 1 và 5. D. 5 và 2.
Câu 10: Trong phân tử N2, số cặp electron dùng chung là (cho 7N)
A. 2. B. 1. C. 3. D. 4.
Câu 11: Chỉ ra nội dung sai khi nói về ion?
A. Ion âm gọi là cation, ion dương gọi là anion.
B. Ion được hình thành khi nguyên tử nhường hay nhận electron.
C. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử.
D. Ion là phần tử mang điện.
Câu 12: Trong hạt nhân nguyên tử (trừ H), các hạt cấu tạo nên hạt nhân gồm:
A. proton, nơtron và electron. B. proton và nơtron.
C. nơtron. D. electron.
Câu 13: Cation R+ có cấu hình electron giống khí hiếm Ne. Vị trí của R trong bảng tuần hoàn là
A. chu kì 3, nhóm VIIA. B. chu kì 3, nhóm IA.
C. chu kì 4, nhóm IA. D. chu kì 3, nhóm VIA.
Câu 14: Trong số các phản ứng sau, phản ứng nào là phản ứng oxi hóa-khử ?
A. HNO3 + NaOH → NaNO3 + H2O.
B. N2O5 + H2O → 2HNO3.
C. 2HNO3 + 3H2S → 3S + 2NO + 4H2O.
D. 2Fe(OH)3 → Fe2O3 + 3H2O.
Câu 15: Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung
A. ở giữa hai nguyên tử. B. lệch về một phía của một nguyên tử.
C. chuyển hẳn về một nguyên tử. D. nhường hẳn về một nguyên tử.
Câu 16: Phản ứng nào dưới đây thuộc loại phản ứng thế?
A. NaOH + HBr → NaBr + H2O
B. 3NO2 + H2O → 2HNO3 + NO.
C. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4.
D. Fe + 2HCl → FeCl2 + H2
Câu 17: Cho dãy các chất sau: Na, SO2, FeO, N2, HCl. Số chất vừa có tính oxi hóa vừa có tính khử là
A. 3. B. 4. C. 5. D. 2.
Câu 18: Cho dãy các chất sau: NH3, HCl, O2, Cl2, H2O, CO2. Số chất trong dãy mà phân tử không bị phân cực là
A. 1. B. 4. C. 3. D. 2.
Câu 19: Vị trí của Al trong chu kì và nhóm thể hiện như sau:
B |
||
Mg |
Al |
Si |
Cho các nhận xét sau:
(a) Từ Mg đến Si, bán kính nguyên tử tăng.
(b) Al là kim loại lưỡng tính vì Mg là kim loại còn Si là phi kim.
(c) Tổng số electron hóa trị của Mg, Al, Si bằng 9.
(d) Tính axit của các hiđroxit giảm dần theo trật tự: H2SiO3, Al(OH)3, Mg(OH)2
(e) Nguyên tố Mg, Al, Si không tạo được hợp chất khí với hiđro.
(f) Độ âm điện giảm dần theo trật tự: Si, Al, Mg, B.
Trong các phát biểu trên, số phát biểu đúng là
A. 2. B. 3. C. 5. D. 4.
Câu 20: X và Y là hai kim loại thuộc cùng một nhóm A trong bảng tuần hoàn các nguyên tố hóa học. Biết ZX < ZY và ZX + ZY = 24. Phát biểu nào sau đây là không đúng?
A. X, Y đều có 2 electron ở phân lớp ngoài cùng.
B. Bán kính nguyên tử của Y lớn hơn bán kính nguyên tử của X.
C. Trong bảng tuần hoàn các nguyên tố hóa học thì X, Y đều thuộc nhóm IIA.
D. Hiđroxit tương ứng với oxit cao nhất của X, Y đều có tính bazơ mạnh.
Câu 21: Trong bảng tuần hoàn các nguyên tố, nguyên tố có tính phi kim mạnh nhất là
A. flo. B. oxi. C. clo. D. nitơ.
Câu 22: Phát biểu nào sau đây là không đúng?
A. Số thứ tự của chu kì bằng số lớp electron trong nguyên tử.
B. Khối các nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến VIIIA (trừ He).
C. Oxit cao nhất của một nguyên tố ở nhóm VIIA luôn có công thức R2O2.
D. Bảng tuần hoàn có 18 cột được chia thành 8 nhóm A và 8 nhóm B.
Câu 23: Trong hợp chất MgF2, điện hóa trị của F và Mg lần lượt là
A. -1 và +2. B. 2+ và 1-.
C. 1- và 2+. D. 1 và 2.
Câu 24: Nguyên tử X có tổng số hạt cơ bản là 77, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Cho các phát biểu sau:
(a) Nguyên tử X có số khối là 53.
(b) Nguyên tử X có 7 electron s.
(c) Lớp M của nguyên tử X có 13 electron.
(d) X là nguyên tố s.
(e) X là nguyên tố kim loại.
(f) X có 4 lớp electron.
Trong các phát biểu trên, số phát biểu đúng là
A. 5. B. 6. C. 3. D. 4.
Câu 25: Hòa tan hoàn toàn 7,30 gam hỗn hợp hai kim loại kiềm X, Y (MX < MY) thuộc hai chu kì liên tiếp vào 200 gam nước thu được dung dịch Z và 7,84 lít khí hiđro (đktc). Nồng độ phần trăm của YOH trong dung dịch Z là (cho nguyên tử khối Li = 7; Na = 23; K = 39; Rb = 85)
A. 2,904%. B. 6,389%. C. 2,894%. D. 1,670%.
Câu 26: Chia 22,0 g hỗn hợp X gồm Mg, Na và Ca thành 2 phần bằng nhau.
- Phần 1 cho tác dụng hết với O2 thu được 15,8g hỗn hợp 3 oxit.
- Phần 2 cho tác dụng với dung dịch HCl dư thu được V (lít) khí H2 (đktc).
Giá trị của V là
A. 6,72. B. 13,44. C. 8,96. D. 3,36.
Câu 27: Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH3. Trong oxit mà R có hóa trị cao nhất thì oxi chiếm 74,04% về khối lượng. Nguyên tố R là
A. As (M = 75). B. S (M = 32). C. N (M = 14). D. P (M = 31).
Câu 28: cho 7,8 gam hỗn hợp X gồm Mg và Al tác dụng vừa đủ với 5,6 lít hỗn hợp khí Y (đktc) gồm Cl2 và O2 thu được 19,7 gam hỗn hợp Z gồm 4 chất. Phần trăm khối lượng của Al trong X là
A. 65,38%. B. 34,62%. C. 69,23%. D. 30,77%.
Câu 29: Nguyên tử của một nguyên tố X có tổng số hạt cơ bản (proton, nơtron và electron) là 82, biết số hạt mang điện nhiều hơn số hạt không mang điện là 22. Kí hiệu hóa học của X là

Câu 30: Nguyên tử khối trung bình của đồng là 63,546. Đồng tồn tại trong tự nhiên với 2 loại đồng vị là 6529Cu, 6329Cu. Thành phần phần trăm về số nguyên tử của 6329Cu là
A. 27,3%. B. 72,7%. C. 25%. D. 75%.
_______ Hết _______
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 3)
Câu 1: Khi tham gia các phản ứng hoá học, nguyên tử kim loại có xu hướng
A. nhận proton. B. cho proton.
C. bị oxi hoá. D. bị khử.
Câu 2: Trong phản ứng: K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
Số phân tử HCl đóng vai trò chất khử là:
A. 6. B. 7.
C. 9. D. 8.
Câu 3: Cho 9 gam một kim loại M (hóa trị không đổi) vào dung dịch HNO3 dư, đến khi phản ứng xảy ra hoàn toàn thu được 2,8 lít (đktc) khí N2O duy nhất. Kim loại M là
A. Ag B. Al C. Zn D. Mg
Câu 4: Số oxi hóa của sắt trong Fe2+, Fe2O3, Fe, FeO lần lượt là:
A. +2, +4, 0, +2. B. 0, +3, 0, +3.
C. +2 , +3, 0, +2. D. +2, +3, 0, +3.
Câu 5: Cấu hình electron 1s22s22p6 không thể là của
A. F-. B. Ne. C. Na. D. Mg2+.
Câu 6. Các hạt cấu tạo nên hạt nhân hầu hết các nguyên tử là
A. proton và elctron. B. nơtron và electron.
C. nơtron và proton. D. nơtron, proton và electron.
Câu 7: Cho 2 kí hiệu: 3517Cl và 3717Cl. Tìm nhận định sai?
A. Đó là hai đồng vị của nhau .
B. Đó là hai nguyên tử có cùng số electron.
C. Đó là hai nguyên tử có cùng số nơtron.
D. Hai nguyên tử trên có cùng một số hiệu nguyên tử.
Câu 8: Các nguyên tố nhóm A trong bảng tuần hoàn là:
A. các nguyên tố s.
B. các nguyên tố p.
C. các nguyên tố s và các nguyên tố p.
D. các nguyên tố d.
Câu 9: X và Y là hai nguyên tố thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn, ở trạng thái đơn chất X và Y phản ứng được với nhau. Tổng số proton trong hạt nhân nguyên tử của X và Y là 23. Biết rằng X đứng sau Y trong bảng tuần hoàn. X là
A. P B. S C. Mg D. O
Câu 10: Trong các hiđroxit dưới đây chất nào có tính bazơ mạnh nhất?
A. NaOH. B. KOH. C. Mg(OH)2. D. Al(OH)3
Câu 11: Nguyên tố M có số hiệu nguyên tử là 26. M thuộc nhóm nào của bảng tuần hoàn?
A. VIIIB B. IIB C. IA D. IB
Câu 12: Bán kính của các nguyên tố của các nguyên tử halogen được sắp xếp theo thứ tự giảm dần từ trái qua phải là :
A. Br, I, Cl, F. B. F, Cl, Br, I.
C. I, Br, F, Cl. D. I, Br, Cl, F.
Câu 13: Cho các hợp chất sau: BaF2, MgO, KCl, H2O. Hợp chất nào là hợp chất ion?
A. BaF2 và KCl B. MgO và H2O
C. HCl và H2O D. BaF2 và H2O
Câu 14: X là nguyên tố thuộc nhóm A, ion Xn+ có cấu hình electron là 1s22s22p6. Số nguyên tố hóa học thỏa mãn với điều kiện trên là
A. 3. B. 4. C. 5. D. 2.
Câu 15: Hợp chất nào sau đây chứa ion đa nguyên tử?
A. HBr. B. K2O. C. NH4HCO3. D. Na2S.
Câu 16: Cho 3 ion: 11Na+, 12Mg2+, 9F-. Tìm câu khẳng định sai:
A. 3 ion trên có cùng số proton.
B. 3 ion trên có số electron lớp ngoài cùng bằng nhau.
C. 3 ion trên có cùng số electron.
D. 3 ion trên có cấu hình electron giống nhau.
Câu 17: Để đánh giá loại liên kết trong phân tử hợp chất, người ta có thể dựa vào hiệu độ âm điện (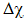 ). Nếu 0,4 ≤
). Nếu 0,4 ≤ 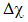 < 1,7 thì loại liên kết này là gì?
< 1,7 thì loại liên kết này là gì?
A. Liên kết cộng hóa trị có cực.
B. Liên kết cộng hóa trị không cực.
C. Liên kết ion.
D. Liên kết hiđro.
Câu 18: Loại phản ứng hóa học nào sau đây luôn là phản ứng oxi hóa khử?
A. Phản ứng hóa hợp.
B. Phản ứng phân hủy.
C. Phản ứng trao đổi.
D. Phản ứng thế trong hóa học vô cơ.
Câu 19: Phân tử không phân cực là
A. H2O B. HCl C. CO2 D. Na2O
Câu 20: Nguyên tử X có số hiệu nguyên tử 8, nguyên tử Y nằm cùng nhóm với X và ở chu kì kế tiếp với chu kì của nguyên tố X. Xác định liên kết hình thành giữa X và Y.
A. Liên kết kim loại. B. Liên kết ion.
C. Liên kết cộng hóa trị. D. Liên kết hiđro.
Câu 21: Chọn phát biểu đúng?
A. Số oxi hóa của oxi luôn bằng -2 trong hợp chất.
B. Trong các đơn chất, số oxi hóa của nguyên tố bằng hóa trị của nguyên tố.
C. Trong phân tử, tổng số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng 0.
D. Trong các hợp chất, số oxi hóa của H luôn bằng +1.
Câu 22: Điện hóa trị của nguyên tố Cl trong các hợp chất MgCl2 là:
A. 2+ B. 2- C. 1+ D. 1-
Câu 23: Số oxi hóa của Mn trong KMnO4 là?
A. +6 B. +7 C. -6 D.+5.
Câu 24: Chất khử là chất
A. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 25: Tổng số hạt proton, nơtron và electron trong nguyên tử của một nguyên tố là 52 hạt. Trong đó, số hạt không mang điện trong hạt nhân lớn gấp 1,059 lần số hạt mang điện dương. Kết luận nào sau đây không đúng với R?
A. R là phi kim.
B. R có số khối là 35.
C. Điện tích hạt nhân của R là 17+.
D. Ở trạng thái cơ bản R có 5 electron độc thân.
Câu 26: Oxit cao nhất của 1 nguyên tố R ứng với công thức RO2. Trong hợp chất của nguyên tố đó với H có 25 % H về khối lượng. Nguyên tố R là: (Cho nguyên tử khối của các chất như sau: Mg = 24, C = 12, N = 7, P = 31)
A. Mg. B. N. C. P. D. C.
Câu 27: Hòa tan hoàn toàn 3,9 gam hỗn hợp Al và Mg trong dung dịch HCl dư, thu được 4,48 lít (ở đktc) khí H2 và dung dịch chứa m gam muối. Giá trị của m là
A. 11,6. B. 17,7. C. 18,1. D. 18,5.
Câu 28: Khi cho Cu2S tác dụng với HNO3 thu được hỗn hợp sản phẩm gồm: Cu(NO3)2; H2SO4; NO và H2O. Số electron mà 1 phân tử Cu2S đã nhường là:
A. 6 electron. B. 9 electron.
C. 10 electron. D. 2 electron.
Câu 29: Cho 7,8 gam hỗn hợp X gồm Mg và Al tác dụng vừa đủ với 5,6 lít hỗn hợp khí Y (đktc) gồm Cl2 và O2 thu được 19,7 gam hỗn hợp Z gồm 4 chất. Phần trăm khối lượng của Al trong X là:
A. 34,62%. B. 65,38%.
C. 30,77%. D. 69,23%.
Câu 30: Cho m gam Cu phản ứng hết với dung dịch HNO3 thu được 8,96 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối đối với H2 là 19. Giá trị của m là:
A. 2,56 gam. B. 16 gam.
C. 25,6 gam. D. 8 gam.

Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 4)
Câu 1: Tổng hệ số cân bằng (là các số nguyên, tối giản) của phản ứng:
FeS2 + O2 → Fe2O3 + SO2 là
A. 25. B. 30. C. 32. D. 35.
Câu 2: Phản ứng nào sau đây luôn không là phản ứng oxi hóa – khử?
A. Phản ứng hóa hợp
B. Phản ứng phân hủy.
C. Phản ứng trao đổi.
D. Phản ứng thế trong hóa học vô cơ.
Câu 3: Chất khử là
A. Chất nhường electron. B. Chất nhận electron.
C. Chất nhường proton. D. Chất nhận proton.
Câu 4: Các đồng vị của cùng một nguyên tố hóa học được phân biệt bởi đại lượng nào sau đây?
A. Số nơtron B. Số electron hóa trị
C. Số proton D. Số lớp electron
Câu 5: Tổng số hạt cơ bản (proton, electron và nơtron) trong nguyên tử của nguyên tố X là 115 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Nguyên tố X là:
A. Brom B. Canxi C. Clo D. Sắt
Câu 6: Trong các hiđroxit sau, chất nào có tính axit mạnh nhất?
A. H2SeO4. B. H2SO4. C. HBrO4. D. HClO4
Câu 7: Xác định cấu hình electron nguyên tử của X ? Biết rằng, nguyên tố X thuộc chu kì 4, nhóm IIIA.
A. 1s22s22p63s23p1.
B. 1s22s22p63s23p64s2.
C. 1s22s22p63s23p63d34s2.
D. 1s22s22p63s23p63d104s24p1.
Câu 8: Oxit cao nhất của nguyên tố R là R2O5, trong hợp chất với hiđro R chiếm 82,35% về khối lượng. Nguyên tố R là:
A. N. B. As. C. P. D. S.
Câu 9. Các nguyên tố ở chu kì 4 có số lớp electron trong nguyên tử là
A. 7. B. 6. C. 5. D. 4.
Câu 10: Dãy các nguyên tố nhóm IIA gồm: Mg (Z = 12), Ca (Z = 20), Sr (Z = 38), Ba (Z = 56). Từ Mg đến Ba, theo chiều tăng của điện tích hạt nhân, tính kim loại thay đổi theo chiều
A. giảm dần. B. giảm rồi tăng.
C. tăng rồi giảm. D. tăng dần.
Câu 11: Nguyên tố có độ âm điện lớn nhất trong bảng tuần hoàn là
A. Na. B. Cl. C. F. D. Cs.
Câu 12: Nguyên tố R có công thức cao nhất trong hợp chất với oxi là R2O7. Công thức hợp chất khí với hiđro là
A. HR. B. RH4. C. H2R. D. RH3.
Câu 13: Theo định luật tuần hoàn, tính chất hóa học của các nguyên tố biến đổi tuần hoàn theo chiều tăng của
A. nguyên tử khối. B. điện tích ion.
C. số oxi hóa. D. điện tích hạt nhân nguyên tử.
Câu 14: Trong bảng tuần hoàn nguyên tố X có số thứ tự 11. X thuộc
A. chu kì 3, nhóm IIA. B. chu kì 2, nhóm IVA.
C. chu kì 2, nhóm IIIA. D. chu kì 3, nhóm IA.
Câu 15: Nguyên tố X thuộc nhóm VA. Công thức oxit cao nhất của X là
A. XO3. B. X2O5. C. XO2. D. X2O3.
Câu 16. R+ và X- đều có cấu hình electron là: 1s22s22p63s23p6. Vậy R, X là
A. 18Ar, 19K. B. 19K, 17Cl. C. 15P, 19K. D. 11Na, 9F.
Câu 17:Cấu hình electron của 1939K: 1s22s22p63s23p64s1. Vậy kết luận nào sau đây sai?
A. Có 20 proton trong hạt nhân.
B. Là nguyên tố mở đầu chu kỳ 4.
C. Nguyên tử có 1e ở lớp ngoài cùng.
D. Thuộc chu kỳ 4, nhóm IA.
Câu 18: Tổng số hạt proton (p), nơtron (n), electron (e) của nguyên tử nguyên tố X thuộc nhóm VIIA là 28. Nguyên tử khối của X là
A. 28. B. 19. C. 18. D. 9.
Câu 19: Trong phản ứng : 2Na + Cl2 → 2NaCl, nguyên tử Na
A. bị oxi hóa. B. bị khử.
C. vừa bị oxi hóa vừa bị khử. D. không bị bị oxi hóa, không bị khử.
Câu 20: Cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố X có dạng ns2np4. Trong hợp chất oxit cao nhất, X chiếm 40% khối lượng. Phần trăm khối lượng của X trong hợp chất khí với hiđro là
A. 27,27%. B. 94,12% . C. 60,00%. D. 5,88%.
Câu 21: Cho sơ đồ phản ứng: Fe + HNO3 → Fe(NO3)3 + NO + H2O.
Hòa tan 5,6 gam Fe vào dung dịch HNO3 loãng dư, thể tích khí NO thu được ở điều kiện tiêu chuẩn là
A. 4,48 lít. B. 11,2 lít. C. 3,36 lít. D. 2,24 lít.
Câu 22: Phát biểu nào sau đây đúng?
A. Iot có bán kính nguyên tử lớn hơn brom.
B. Brom có tính phi kim mạnh hơn flo.
C. Flo có có độ âm điện bé hơn clo.
D. Clo có bán kính nguyên tử lớn hơn iot.
Câu 23: Cho F (Z = 9), Cl (Z = 17), Br ( Z = 35 ), I ( Z = 53). Mức độ phân cực của liên kết hóa học trong hợp chất với hiđro của các nguyên tố nhóm VIIA được sắp xếp theo thứ tự giảm dần từ trái sang phải là
A. HI, HBr, HCl. B. HBr, HI, HCl.
C. HCl, HBr, HI. D. HI, HCl, HBr.
Câu 24: Cộng hóa trị của N trong HNO3 là:
A. 4 B. 2 C. 3 D. 5
Câu 25: Tổng số oxi hóa của N trong phân tử HNO3 và NH3 là
A. -3 B. +5 C. +2 D. +3
Câu 26: Cho một số hợp chất của lưu huỳnh: H2SO4, H2S, H2SO3, SO2, NaHS, Na2SO3, SO3, Na2S. Số chất trong đó lưu huỳnh có số oxi hóa là +4?
A. 2 B. 3 C. 4 D. 5
Câu 27: Nguyên tố X có hai đồng vị 13X và 11X. Mỗi đồng vị chiếm 50% số nguyên tử và nguyên tử khối có giá trị bằng số khối. 0,25 mol X có khối lượng là
A. 6 gam. B. 12 gam. C. 4 gam. D. 3 gam.
Câu 28: Cho 4 gam oxit của nguyên tố R thuộc nhóm IIA tác dụng vừa đủ với 200 ml dung dịch HCl 1M. Vậy nguyên tố R là
A. Ba. B. Mg. C. Be. D. Ca.
Câu 29: Cho m(g) Al tác dụng vừa đủ với dung dịch HNO3 tạo ra hỗn hợp khí A gồm 0,15 mol NO và 0,05 mol N2O (không có muối NH4NO3). Giá trị của m là:
A. 7,76g B. 7,65g C. 7,85g D. 8,85
Câu 30: Hòa tan hoàn toàn 19,2g kim loại M trong dung dịch HNO3 dư thu được 8,96 lít (đktc) hỗn hợp khí gồm NO2 và NO có tỉ lệ thể tích 3:1(không còn sản phẩm khử khác). Xác định kim loại M.
A. Fe (M = 56) B. Cu (M = 64)
C. Al (M = 27) D. Zn (M = 65)
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 5)
Câu 1: Liên kết cộng hóa trị là liên kết
A. giữa các phi kim với nhau.
B. được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
C trong đó cặp electron dùng chung bị lệch về một nguyên tử.
D. được hình thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Câu 2: Cho các phát biểu sau:
(a) Liên kết trong phân tử HCl, NH3 là liên kết cộng hóa trị có cực.
(b) Trong phân tử CH4, nguyên tố C có cộng hóa trị là 4.
(c) Dãy sắp xếp thứ tự tăng dần độ phân cực liên kết trong phân tử: H2O, H2S, Na2O, K2O (biết ZO = 8, ZS = 16).
(d) Trong phân tử C2H2 có một liên kết ba.
Phát biểu không đúng là
A. (d). B. (c). C. (b). D. (a).
Câu 3: Cho dãy các chất sau: Cl2, SO2, FeO, N2, HCl. Số chất vừa có tính oxi hóa vừa có tính khử là
A. 3. B. 4. C. 5. D. 2.
Câu 4: Cho dãy các chất sau: NH3, HCl, O2, Cl2, H2O, CO2. Số chất trong dãy mà phân tử không bị phân cực là
A. 1. B. 4. C. 3. D. 2.
Câu 5: Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là
A. tạo ra chất khí
B. tạo ra chất kết tủa
C. có sự thay đổi màu sắc của các chất
D. có sự thay đổi số oxi hóa của một số nguyên tố
Câu 6: Số electron tối đa trong phân lớp d là
A. 2. B. 8. C. 10. D. 14.
Câu 7: Cho các dãy nguyên tố mà mỗi nguyên tố được biểu diễn bằng số hiệu nguyên tử tương ứng. Dãy nào sau đây chỉ gồm các nguyên tố phi kim?
A. 8, 9, 15. B. 2, 5, 11. C. 3, 9, 16. D. 3, 12, 13.
Câu 8: Trong tự nhiên, oxi có 3 đồng vị là 168O; 178O, 188O. Có bao nhiêu loại phân tử O2?
A. 3. B. 6. C. 9. D. 12.
Câu 9: Nguyên tử nguyên tố X có tổng số các hạt proton, electron và nơtron bằng 58. Trong hạt nhân nguyên tử, số hạt proton và số hạt nơtron hơn kém nhau 1 đơn vị. Số hiệu nguyên tử của X là:
A. 17 B. 16 C. 19 D. 20
Câu 10. A, B là 2 nguyên tố thuộc cùng nhóm A và ở 2 chu kì 2 và 3 trong bảng tuần hoàn. Số đơn vị điện tích hạt nhân của A và B chênh lệch nhau là
A. 12. B. 6. C. 8. D. 10.
Câu 11. Oxit cao nhất của nguyên tố R là R2O5, trong hợp chất với hiđro R chiếm 82,35% về khối lượng. Nguyên tố R là
A. S. B. As. C. P. D. N.
Câu 12. Các nguyên tố từ Li đến F, theo chiều tăng của điện tích hạt nhân thì
A. bán kính nguyên tử tăng, độ âm điện giảm.
B. bán kính nguyên tử và độ âm điện đều tăng.
C. bán kính nguyên tử giảm, độ âm điện tăng.
D. bán kính nguyên tử và độ âm điện đều giảm.
Câu 13. Nguyên tố có Z = 19 thuộc chu kì
A. 3. B. 5. C. 2. D. 4.
Câu 14: Cho 15,2 gam hỗn hợp X gồm Mg và Ca phản ứng vừa đủ với 8,96 lít (đktc) hỗn hợp khí Y gồm Cl2 và O2 thu được 39,7 gam chất rắn Z chỉ gồm các muối clorua và các oxit kim loại. Khối lượng của Mg trong 15,2 gam X là
A. 4,8 gam. B. 7,2 gam. C. 9,2 gam. D. 3,6 gam.
Câu 15: Cho phương trình hóa học sau:
FeS2 + KNO3 + KHSO4 → Fe2(SO4)3 + K2SO4 + NO + H2O
Tổng hệ số (số nguyên, tối giản) của tất cả các chất phản ứng trong phương trình trên là
A. 20. B. 24. C. 52. D. 44.
Câu 16: Phản ứng nào dưới đây thuộc loại phản ứng oxi hóa khử?
A. KOH + HBr → KBr + H2O
B. 2KMnO4 → K2MnO4 + MnO2 + O2
C. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4.
D. CaO + CO2 → CaCO3
Câu 17: Hòa tan hoàn toàn 7,30 gam hỗn hợp hai kim loại kiềm X, Y (MX < MY) thuộc hai chu kì liên tiếp vào 200 gam nước thu được dung dịch Z và 7,84 lít khí hiđro (đktc). Nồng độ phần trăm của YOH trong dung dịch Z là (cho nguyên tử khối Li = 7; Na = 23; K = 39; Rb = 85)
A. 2,904%. B. 6,389%. C. 2,894%. D. 1,670%.
Câu 18: Trong hợp chất BaO, điện hóa trị của O và Ba lần lượt là
A. -2 và +2. B. 2+ và 1-.
C. 2- và 2+. D. 2 và 2.
Câu 19: Sắp xếp các chất sau theo chiều tăng dần số oxi hóa của nitơ:
NH4Cl, NO, NO2, HNO3, N2, N2O.
A. N2, NO, N2O, NO2, NH4Cl, HNO3.
B. NH4Cl, N2, N2O, NO, NO2, HNO3.
C. NH4Cl, N2, NO2, NO, N2O, HNO3.
D. NH4Cl, N2, NO, N2O, NO2, HNO3.
Câu 20: Chọn phát biểu sai?
A. Các nguyên tố phi kim thuộc nhóm VIA, VIIA có thể nhận thêm 2 hay 1 electron, nên trong hợp chất ion có thể có điện hóa trị 2-, 1-.
B. Khi viết điện hóa trị của nguyên tố, ghi giá trị điện tích trước, dấu của điện tích ghi sau.
C. Số oxi hóa được viết bằng chữ số thường, dấu đặt phía sau và được đặt trên kí hiệu nguyên tố.
D. Số oxi hóa của các nguyên tố ở các ion Fe3+, S2-, K+, Cl- lần lượt là +3, -2, +1, -1.
Câu 21: Để khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe3O4 và Fe2O3 đến Fe cần vừa đủ 2,24 lít khí CO ở điều kiện tiêu chuẩn. Khối lượng sắt thu được là
A. 15 gam. B. 16 gam. C. 17 gam. D. 18 gam.
Câu 22: Cho phương trình hóa học của phản ứng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu.
Nhận xét nào sau đây về phản ứng trên là đúng?
A. Al2(SO4)3 là chất khử, CuSO4 là chất oxi hóa.
B. CuSO4 là khử, Al2(SO4)3 là chất oxi hóa.
C. Al là chất oxi hóa, CuSO4 là chất khử.
D. CuSO4 là chất oxi hóa, Allà chất khử.
Câu 23: Trong số các chất sau: HF, CaO, CH4, N2.Số lượng các chất có liên kết cộng hóa trị và liên kết ion lần lượt là
A. 2 và 2. B. 3 và 1. C. 2 và 1. D. 1 và 3.
Câu 24: Hòa tan 12,6 gam Fe bằng dung dịch H2SO4 loãng dư, thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,05M. Giá trị của V là
A. 108. B. 90. C. 45. D. 135.
Câu 25: Cần tối thiểu m gam kẽm để khử hoàn toàn lượng bạc có trong 300 ml dung dịch AgNO3 0,1M. Giá trị của m là
A. 0,975. B. 1,950. C. 3,900. D. 3,240.
Câu 26: Nguyên tố X là một phi kim nhóm A. Hợp chất của X với hiđro là XH3. Hóa trị và số oxi hóa của X trong oxit tương ứng với hóa trị cao nhất lần lượt là:
A. 5 và -5. B. 5 và +5.
C. 3 và +3. D. 3 và -3.
Câu 27: X là nguyên tố thuộc nhóm IVA, chu kì 5 của bảng tuần hoàn. Cho các phát biểu sau:
(1) X có 4 lớp electron và có 20 electron p.
(2) X có 5 electron hóa trị và 8 electron s.
(3) X có thể tạo được hợp chất bền với oxi có công thức hóa học XO2 và XO3.
(4) X có tính kim loại mạnh hơn so với nguyên tố có số thứ tự 33.
(5) X ở cùng nhóm với nguyên tố có số thứ tự 14.
Trong các phát biểu trên, số phát biểu sai là
A. 2 B. 3 C. 4 D. 5
Câu 28: Nung m gam Fe trong không khí, sau phản ứng thu được 11,2 gam chất rắn X gồm Fe, Fe2O3, Fe3O4 và FeO. Hòa tan hoàn toàn hỗn hợp X vào dung dịch HNO3 dư thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là bao nhiêu?
A. 8,4 gam B. 5,6 gam C. 11,2 gam D. 7 gam

Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 6)
Câu 1. Nguyên tử nguyên tố R có cấu hình electron: 1s22s22p63s23p63d54s2, vị trí của R trong bảng tuần hoàn là
A. Chu kì 4, nhóm IIA. B. Chu kì 4, nhóm VIIIA.
C. Chu kì 4, nhóm VIIB. D. Chu kì 4, nhóm IIB.
Câu 2. Nguyên tử X có 20 proton trong hạt nhân, chọn phát biểu không đúng về X?
A. X tạo được hợp chất khí với hiđro. B. X thuộc chu kì 4.
C. Công thức oxit cao nhất của X là XO. D. X là một kim loại thuộc nhóm IIA.
Câu 3. Phản ứng nào sau đây không là phản ứng oxi hóa – khử?
A. Fe + 2HCl → FeCl2 + H2
B. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
C. NaOH + HCl → NaCl + H2O
D. Cl2 + 2NaOH → NaCl + NaClO + H2O
Câu 4. Chất nào sau đây là hợp chất ion?
A. H2. B. CO2. C. NaCl. D. NH3.
Câu 5. Các chất được sắp xếp theo chiều tăng dần tính phân cực là
A. NaCl, Cl2, HCl. B. HCl, Cl2, NaCl.
C. Cl2, HCl, NaCl. D. NaCl, HCl, Cl2.
Câu 6. Phát biểu nào dưới đây không đúng ?
A. Sự oxi hóa là sự nhường electron.
B. Sự khử là sự nhận electron.
C. Chất oxi hóa là chất nhận electron.
D. Chất khử là chất nhận electron.
Câu 7. Lớp vỏ nguyên tử X có điện tích -32.10-19 (C). Nguyên tố X thuộc
A. chu kì 3, nhóm IIB. B. chu kì 2, nhóm IIA.
C. chu kì 4, nhóm IIB. D. chu kì 4, nhóm IIA.
Câu 8. Trong một chu kì theo chiều tăng dần của điện tích hạt nhân, điều nhận xét nào sau đây không đúng quy luật?
A. Độ âm điện giảm dần .
B. Tính axit của các hiđroxit tăng dần.
C. Số electron lớp ngoài cùng tăng từ 1 đến 8.
D. Tính kim loại giảm dần.
Câu 9. Cấu hình e lớp ngoài cùng của 2 nguyên tử A, B lần lượt là 3sx và 3p5. Biết rằng phân lớp 3s của 2 nguyên tử A, B hơn kém nhau chỉ 1 electron. Tổng số hiệu nguyên tử của 2 nguyên tử A, B là
A. 29. B. 27. C. 26. D. 28.
Câu 10. Tổng số hạt (p, n, e) trong nguyên tử nguyên tố R là 28, số khối của R là (biết R thuộc nhóm VIIA)
A. 17. B. 18. C. 19. D. 35.
Câu 11. Nguyên tử 7935X có số hiệu nguyên tử là
A. 35. B. 79. C. 44. D. 114.
Câu 12. Nguyên tử nguyên tố X có số thứ tự là 15 trong bảng tuần hoàn. Công thức oxit bậc cao và hợp chất khí với hiđro của nguyên tử X là
A. XO và H2X. B. XO3 và H2X.
C. XO2 và H2X. D. X2O5 và XH3.
Câu 13. Nguyên tố hóa học là tập hợp các nguyên tử có cùng
A. số electron và số nơtron. B. số khối.
C. số nơtron. D. điện tích hạt nhân.
Câu 14. Sắp xếp theo chiều tăng dần tính kim loại của các nguyên tố: X (Z = 5), Y (Z = 8), Q (Z = 13) là
A. Y < X < Q. B. Q < X < Y.
C. Y < Q < X. D. X < Y < Q.
Câu 15. Nguyên tử nguyên tố X có 4 lớp, lớp thứ 3 có 12 electron, điện tích hạt nhân của nguyên tử X là
A. 23+. B. 24+. C. 26+. D. 25+.
Câu 16. Cation X2+ có cấu hình electron kết thúc ở 2p6, cấu hình electron của nguyên tử X là
A. 1s22s22p5 . B. 1s22s22p4.
C. 1s22s22p63s2. D. 1s22s22p63s1.
Câu 17. Clo có 2 đồng vị 35Cl và 37Cl, khối lượng nguyên tử trung bình của Clo là 35,5 (đvC). Hỏi trong 500 nguyên tử Clo có bao nhiêu nguyên tử 37Cl.
A. 75. B. 225. C. 375. D. 125.
Câu 18. Trong phản ứng Cl2 + 2NaOH → NaCl + NaClO + H2O. Vai trò của Cl2 là
A. chất oxi hóa. B. chất khử.
C. vừa là chất khử, vừa là chất oxi hóa. D. môi trường phản ứng.
Câu 19. Ion O2- được tạo thành từ nguyên tử 168O. Ion này có:
A. 8p, 8n, 10e. B. 8p, 10n, 10e.
C. 8p, 10n, 8e. D. 10p, 8n, 8e.
Câu 20. Cho các nguyên tố với cấu hình phân lớp ngoài cùng R (3s1), X (3s2), T (4s1). Dãy nguyên tố được sắp xếp theo chiều tính kim loại giảm dần là
A. R > X > T. B. X > R > T.
C. T > X > R. D. T > R > X.
Câu 21. Nhận xét nào sau đây không đúng ?
A. Cấu hình e của 29X là [Ar]3d104s1.
B. Lớp ngoài cùng của nguyên tử X có cấu hình là 3s23p4 thì X là kim loại.
C. Nguyên tử và ion của nó có số khối bằng nhau.
D. Các đồng vị của một nguyên tố hóa học thì có cùng cấu hình electron.
Câu 22. Hòa tan 4,59 gam Al bằng dung dịch HNO3 thu được hỗn hợp khí NO và N2O có tỉ khối so với H2 bằng 16,75. Thể tích NO và N2O thu được ở đktc là:
A. 2,24 lít và 6,72 lít B. 2,016 lít và 0,672 lít
C. 0,672 lít và 2,016 lít D. 1,972 lít và 0,448 lít
Câu 23. Cặp chất nào sau đây chỉ chứa liên kết cộng hóa trị phân cực ?
A. H2O và HCl. B. N2 và CO2 .
C. H2O và NaCl. D. Cl2 và O2.
Câu 24. Số oxi hóa của S trong H2S, SO2, SO32-, SO42- lần lượt là
A. +2, +4, +6, +6. B. –2, +4, +6, +8.
C. -2, +4, +4, +6. D. +2, +4, +4, +6.
Câu 25. Tổng số hạt (p, n, e) trong nguyên tử R là 26. Trong đó số hạt mang điện nhiều gấp 1,6 lần số hạt không mang điện. Cấu hình của nguyên tử R là
A. 1s22s22p4. B. 1s22s22p5 .
C. 1s22s22p6 . D. 1s22s22p63s1.
Câu 26. Nguyên tố X có công thức hợp chất khí với hiđro là XH3. Trong hợp chất oxit bậc cao của X có chứa 74,07% O về khối lượng. Nguyên tố X là
A. P (31). B. N (14). C. As (75). D. Si (28).
Câu 27. Nguyên tử X có tổng các hạt proton, nơtron và electron là 82, trong đó số hạt mang điện nhiều hơn hạt không mang điện là 22. Số electron trong ion X2+ là
A. 26. B. 24. C. 28. D. 30.
Câu 28. Hòa tan hoàn toàn 0,84g hỗn hợp 2 kim loại A, B nhóm IIA ở 2 chu kì liên tiếp vào dung dịch HCl dư thu được 1,344 lít khí H2 (đktc). Cho Be (M = 9), Mg (M = 24), Ca (M = 40), Sr (M = 88), Ba (M = 137). Hai kim loại A, B là
A. Be, Mg. B. Mg, Ca. C. Ca, Sr. D. Sr, Ba.
Câu 29: Hòa tan 5,6 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V (ml) dung dịch KMnO4 0,5M. Giá trị của V là:
A. 20 B. 40 C. 60 D. 80
Câu 30: Hòa tan hoàn toàn m gam FexOy bằng dung dịch H2SO4 đặc nóng dư thu được khí A và dung dịch B. Cho khi A hấp thụ hoàn toàn vào dung dịch NaOH dư tạo ra 12,6 gam muối. Mặt khác, cô cạn dung dịch B thì thu được 120 gam muối khan. Công thức oxit là:
A. FeO B. Fe3O4 C. Fe2O3 D. Tất cả đều sai.
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 7)
Câu 1: Liên kết ion là loại liên kết hóa học được hình thành bởi lực hút tĩnh điện giữa
A. cation và anion. B. cation và electron tự do.
C. các ion mang điện tích cùng dấu. D. electron chung và hạt nhân nguyên tử.
Câu 2. Phân lớp electron nào chứa tối đa 14 electron?
A. 2p B. 3d C. 4f D. 1s
Câu 3. Nguyên tử nào sau đây cần nhường đi 2electron để đạt cấu trúc bền?
A. A (Z = 8). B. B (Z = 9). C. C (Z = 10). D. D (Z = 12)
Câu 4. Trong phản ứng AgNO3 + HCl → AgCl + HNO3. Vai trò của HNO3 là
A. chất khử. B. chất oxi hóa.
C. môi trường phản ứng D. không là chất khử, không là chất oxi hóa.
Câu 5: Số oxi hóa dương cao nhất của N trong hợp chất là
A. +1. B. +3. C. +5. D. +7.
Câu 6: Tổng số hạt proton, nơtron và electron trong nguyên tử R là 52. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16. Số nơtron của nguyên tử R là
A. 35. B. 17. C. 18. D. 16.
Câu 7. Trong nguyên tử, loại hạt nào mang điện tích âm?
A. Proton B. Nơtron. C. Electron. D. Hạt nhân.
Câu 8. Một nguyên tử Na có kí hiệu: 2311Na. Hỏi Na có mấy nơtron?
A. 11 B. 34 C. 12 D. 23
Câu 9. Trong các loại phản ứng hóa học trong hóa vô cơ: phản ứng hóa hợp, phản ứng phân hủy, phản ứng thế, phản ứng trao đổi. Loại phản ứng nào luôn là phản ứng oxi hóa khử?
A. Phản ứng thế. B. Phản ứng hóa hợp.
C. Phản ứng trao đổi. D. Phản ứng phân hủy.
Câu 10. Cấu hình electron của nguyên tử nào sau đây là kim loại?
A. 1s2 . B. 1s2 2s2 2p6. C. 1s2 2s1. D. 1s2 2s2 2p3.
Câu 11. Nguyên tố Clo có cấu hình electron là 1s2 2s2 2p6 3s23p5. Hỏi clo nằm ở vị trí nào trong bảng tuần hoàn.
A. Ô 17, chu kỳ 7, nhóm IIIA. B. Ô 17, chu kỳ 3, nhóm VIIA.
C. Ô 17, chu kỳ 3, nhóm VA. D. Ô 17, chu kỳ 3, nhóm IIA.
Câu 12. Hợp chất nào sau đây chứa liên kết ion?
A. H2O B. NH3 C. CH4 D. Na2O
Câu 13: Tổng số hạt mang điện âm trong anion NO3- là (cho 8O, 7N)
A. 30. B. 33. C. 31. D. 32.
Câu 14. Bảng tuần hoàn được sắp xếp theo nguyên tắc nào?
A. Tăng dần điện tích hạt nhân nguyên tử.
B. Giảm dần điện tích hạt nhân nguyên tử.
C. Tăng dần số lớp electron trong nguyên tử.
D. Tăng dần giá trị độ âm điện của nguyên tử.
Câu 15. Chu kỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số …….
A. điện tích hạt nhân. B. bán kính nguyên tử.
C. lớp electron. D. phân lớp electron.
Câu 16. Nguyên tử Mg (Z=12) có cấu hình electron là: 1s2 2s22p6 3s2. Khi Magie cháy trong khí oxi, thì magie có sự tạo thành ion nào sau đây?
A. Mg → Mg2- + 2e. B. Mg → Mg2+ + 2e.
C. Mg → Mg3+ + 3e. D. Mg → Mg+ + 1e.
Câu 17. Số oxi hóa của oxi bằng 0 trong chất nào sau đây?
A. CuO. B. H2O. C. O2. D. CO2.
Câu 18. Ion nào là ion đơn nguyên tử?
A. SO42-. B. OH-. C. Na+. D. NH4+.
Câu 19. Nitơ là chất khử trong phản ứng nào sau đây:
A. N2 + 3H2 2NH3. B. N2 + 6Li
2NH3. B. N2 + 6Li  2Li3N.
2Li3N.
C. N2 + O2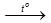 2NO. D. N2 + 3Mg
2NO. D. N2 + 3Mg  Mg3N2.
Mg3N2.
Câu 20. Nguyên tố đồng có hai đồng vị là 63Cu, 65Cu. Nguyên tử khối trung bình của đồng là 63,54. Hỏi % số nguyên tử 63Cu là mấy?
A. 25. B. 73. C. 75. D. 27.
Câu 21. Một nguyên tố R tạo hợp chất khí với hidro có công thức RH2. Nguyên tố R chiếm 40% về khối lượng trong oxit bậc cao nhất. Xác định tên nguyên tố R.
A. Photpho (M = 31). B. Silic (M = 28). C. Nitơ (M = 14). D. Lưu huỳnh (M = 32).
Câu 22. Số oxi hóa của N trong dãy chất: N2, NH3, HNO3, ion NH4+, ion NO3- lần lượt là:
A. 0, +3, +5, -4, +6. B. 0, -3, +5, +3, +5.
C. 0, +3, -5, +3, -5. D. 0, -3, +5, -3, +5.
Câu 23: Cacbon có 2 đồng vị 12C và 13C, oxi có 3 đồng vị là 16O, 17O và 18O. Từ các đồng vị trên có thể tạo thành bao nhiêu công thức phân tử cacbon monooxit (CO) khác nhau?
A. 6. B. 2.
C. 3. D. 8.
Câu 24: Trong phản ứng 6KI + 2KMnO4 +4H2O → 3I2 + 2MnO2 + 8KOH, chất bị oxi hóa là
A. KI. B. MnO2. C. H2O. D. KMnO4.
Câu 25. Xét phản ứng: a Fe(OH)2 + b HNO3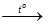 c Fe(NO3)3 + d NO + e H2O. Với a, b, c, d, e là các hệ số cân bằng, có giá trị nguyên, tối giản. Tổng giá trị của a, d, e là:
c Fe(NO3)3 + d NO + e H2O. Với a, b, c, d, e là các hệ số cân bằng, có giá trị nguyên, tối giản. Tổng giá trị của a, d, e là:
A. 25. B. 22. C. 12. D. 13.
Câu 26. Nguyên tố R có tổng số hạt p, n, e trong nguyên tử là 52. Trong R, tổng số hạt mang điện nhiều hơn số hạt không mang điện là 16. Hãy tìm % khối lượng của R trong oxit cao nhất của nó. (Cho O=16)
A. 38,80%. B. 58,04%. C. 38,46%. D. 76,42%.
Câu 27. Cho 7,22 gam hỗn hợp X gồm Fe và kim loại M hóa trị không đổi. Chia hỗn hợp thành 2 phần bằng nhau, hòa tan hết phần 1 trong dung dịch HCI dư thu được 2,128 lít H2. Hòa tan hết phần 2 trong HNO3 thu được 1,792 lít NO. Tìm M?
A. Cu B. Mg C.Zn D. Al
Câu 28: Nguyên tử của nguyên tố X có cấu hình 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p4 . Công thức hóa học và liên kết hóa học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết gì?
A. XY2, ion. B. X2Y, cộng hóa trị.
C. X2Y, ion. D. XY, cộng hóa trị.
Câu 29:Cho 1,35 gam hỗn hợp gồm Cu, Mg, Al tác dụng với dung dịch HNO3 dư, thu được 1,12 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối so với hiđro bằng 20. Tổng khối lượng muối nitrat sinh ra là
A. 66,75 gam. B. 33,35 gam.
C. 6,775 gam. D. 3,335 gam.
Câu 30: Hỗn hợp X gồm hai muối cacbonat của hai kim loại (thuộc hai chu kì kế tiếp trong nhóm IIA). Hòa tan 4,8g X bằng dung dịch HCl dư thấy khối lượng dung dịch sau phản ứng tăng 2,6 gam so với dung dịch trước phản ứng. Khối lượng của muối có phân tử khối bé hơn trong hỗn hợp là (Cho nguyên tử khối: Be = 9, Mg = 24, Ca = 40, Ba = 137, C = 12, O = 16)
A. 3,45 gam. B. 1,05 gam. C. 3,75 gam. D. 1,97 gam.
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 8)
Câu 1: Phản ứng nào sau đây là phản ứng oxi hóa – khử?
A. CaO + CO2 → CaCO3
B. FeO + 2HCl → FeCl2 + H2O
C. CaO + CO2 → CaCO3
D. Mg + 2HCl → MgCl2 + H2
Câu 2. Điện hóa trị của Mg trong hợp chất MgO là
A. +2. B. 2+. C. 2 - . D. -2.
Câu 3: Cấu hình electron nào sau đây là của khí hiếm?
A. 1s2. B. 1s22s22p63s2.
C. 1s22s22p63s23p63d104s2. D. 1s22s22p63s23p5.
Câu 4: Hòa tan hoàn toàn 19,2 gam kim loại M trong dung dịch HNO3 dư thu được 8,96 lít (đktc) hỗn hợp khí gồm NO2 và NO có tỉ lệ thể tích 31. Kim loại M là
A. Cu (64) B. Zn (65) C. Al (27) D. Fe (56)
Câu 5: Chất oxi hoá là chất
A. cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 6: Nguyên tố X có cấu hình electron 1s22s22p63s23p64s2, vị trí của X trong bảng tuần hoàn là
A. ở ô thứ 20, chu kì 4, nhóm IIB. B. ở ô thứ 20, chu kì 4, nhóm VIIIA.
C. ở ô thứ 4, chu kì 20, nhóm IIA. D. ở ô thứ 20, chu kì 4, nhóm IIA.
Câu 7: Xét trong một nhóm A theo chiều tăng điện tích hạt nhân thì tính kim loại biến đổi như thế nào?
A. tăng và giảm. B. giảm dần.
C. giảm và tăng. D. tăng dần.
Câu 8: Hầu hết nguyên tử được cấu tạo bởi bao nhiêu loại hạt cơ bản?
A. 1 B.2 C. 3 D. 4
Câu 9: Cho 6,4 gam hỗn hợp hai kiêm loại A và B (nhóm IIA, thuộc hai chu kì liên tiếp) tác dụng với dung dịch HCl dư, thu được 4,48 lít khí H2 (đktc). Hai kim loạ A, B là (Be=9, Mg=24, Ca=40, Sr=88, Ba=137)
A. Be, Mg B. Ca, Sr C. Sr, Ra D. Mg, Ca
Câu 10: Nguyên tố hoá học là những nguyên tử có cùng
A. số proton B. số khối. C. số nơtron. D. số nơtron và số proton.
Câu 11: Các nguyên tố xếp ở chu kì 3 có số lớp electron trong nguyên tử là
A. 3 B. 5 C. 6 D. 7
Câu 12: Nhóm I A gồm các nguyên tố Li-Na-K-Rb-Cs có tên gọi khác là gì?
A. kim loại kiềm. B. halogen.
C. khí hiếm. D. kim loại kiềm thổ.
Câu 13: Phát biểu nào sau đây sai
A. Điện hóa trị có trong hợp chất ion.
B. Điện hóa trị bằng số cặp electron dùng chung.
C. Cộng hóa trị có trong hợp chất cộng hóa trị.
D. Cộng hóa trị bằng số cặp electron dùng chung.
Câu 14: Chất khử là chất
A. nhận electron và có số oxi hoá giảm sau phản ứng.
B. nhận electron và có số oxi hoá tăng sau phản ứng.
C. nhường electron và có số oxi hoá giảm sau phản ứng.
D. nhường electron và có số oxi hoá tăng sau phản ứng.
Câu 15: Số proton và số nơtron có trong một nguyên tử nhôm (2713Al) lần lượt là
A. 13 và 14. B. 13 và 15. C. 12 và 14. D. 13 và 13.
Câu 16: Phân lớp p chứa tối đa
A. 2 electron. B. 6 electron. C. 10 electron. D. 14 electron.
Câu 17: Dãy các nguyên tố nào sau đây được xếp theo chiều tăng dần tính kim loại?
A. K, Na, Mg, Al B. Mg, Na, K, Na
C. Al, Mg, Na, K D. Na, K, Mg, Al
Câu 18: Hai nguyên tố X, Y đứng kế nhau trong cùng một chu kì của bảng tuần hoàn có tổng số đơn vị điện tích hạt nhân là 25. Hai nguyên tố A, B là?
A. Na, Mg B. Mg, Al C. N, O D. P, S
Câu 19: Đồng có 2 đồng vị 63Cu (69,1%) và 65Cu. Nguyên tử khối trung bình của đồng là
A. 64, 000 B. 63,542
C. 64,382 D. 63,618
Câu 20: Dãy gồm các chất trong phân tử chỉ có liên kết cộng hoá trị phân cực là
A. HCl, O3, H2S. B. O2, H2O, NH3.
C. HF, Cl2, H2O. D. H2O, HF, H2S.
Câu 21: Trong phản ứng MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O, vai trò của MnO2 là chất
A. oxi hóa. B. khử.
C. tạo môi trường. D. khử và môi trường.
Câu 22: Cho phương trình phản ứng: HCl + KMnO4 → KCl + MnCl2 + Cl2 + H2O
Sau khi cân bằng tổng hệ số của các chất tham gia phản ứng là là
A. 17 B. 35 C. 16 D. 18
Câu 23: Cho các phát biểu sau:
(a) Điện hóa trị của một nguyên tố là hóa trị của nguyên tử nguyên tố đó trong hợp chất ion.
(b) Cộng hóa trị của một nguyên tố là hóa trị của nguyên tử nguyên tố đó trong hợp chất cộng hóa trị.
(c) Điện hóa trị của một nguyên tố bằng điện tích ion của nguyên tử nguyên tố đó trong phân tử.
(d) Cộng hóa trị của một nguyên tố bằng số liên kết của nguyên tử nguyên tố đó với các nguyên tử khác trong phân tử.
(e) Số oxi hóa của đơn chất luôn bằng không trừ chất rắn.
(f) Số oxi hóa của oxi trong hợp chất luôn là -2.
Số pháp biểu đúng là
A. 3 B. 4 C. 5 D. 6
Câu 24: Cho 9,6 gam một kim loại hòa tan hoàn toàn trong 200 gam dung dịch HCl thu được 1 muối có khối lượng 208,8 gam. Kim loại đó là
A. Be. B. Mg. C. Zn. D. Fe
Câu 25: Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH3. Trong oxit mà R có hoá trị cao nhất thì oxi chiếm 74,07% về khối lượng. Nguyên tố R là
A. S. B. As. C. N. D. P.
Câu 26: Đốt cháy X mol Fe bởi oxi thu được 5,04 gam hỗn hợp A gồm các oxit sắt. Hòa tan hoàn toàn A trong dung dịch HNO3 thu được 0,035 mol hỗn họp Y gồm NO và NO2. Tỷ khối hơi của Y đối với H2 là 19. Tính X
A. 0,06 mol. B. 0,065 mol. C. 0,07 mol. D. 0,075 mol.
Câu 27: Cho 0,85 gam hai kim loại thuộc hai chu kỳ kế tiếp trong nhóm IA vào cốc chứa 49,18 gam H2O thu được dung dịch A và khí B. Để trung hòa dung dịch A cần 30 ml dung dịch HCl 1M. Nồng độ % của các chất chất tan có khối lượng phân tử lớn nhất trong dung dịch A là
A. 20% B. 11,2% C. 1,12% D. 1,6%
Câu 28: Hòa tan 4,59 gam Al bằng dung dịch HNO3 thu được hỗn hợp khí NO và N2O (sản phẩm khử duy nhất) có tỉ khối hơi đối với hiđro bằng 16,75. Thể tích NO và N2O thu được ờ đktc là:
A. 2,24 lít và 6,72 lít. B. 2,016 lít và 0,672 lít.
C. 0,672 lít và 2,016 lít. D. 1,972 lít và 0,448 lít.
Câu 29: Trong tinh thể, nguyên tử crom chiếm 68% về thể tích. Khối lượng riêng của kim loại crom là 7,19 g/cm3. Bán kính nguyên tử tương đối của nguyên tử Cr là (biết khối lượng mol của Cr = 52)
A. 1,17. 10-8 cm. B. 1,25.10-8 cm.
C. 1,12. 10-8 cm. D. 1,54. 10-8 cm.
Câu 30: Nung m gam bột Fe trong oxi thu được 3 gam hỗn hợp chất rắn X. Hòa tan hết hỗn hợp X trong dung dịch (dư) thoát ra 0,56 lít (đktc) NO (là sản phẩm khử duy nhất). Giá trị của m là
A. 2,22 B. 2,62 C. 2,32 D. 2,52
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 9)
Phần trắc nghiệm (6 điểm)
Câu 1. Nguyên tử 8035X có số hạt mang điện nhiều hơn số hạt không mang điện là
A. 35. B. 25. C. 10. D. 45.
Câu 2. Nguyên tử nguyên tố X có 4 lớp, lớp thứ 3 có 11 electron, số proton của nguyên tử X là
A. 23. B. 24. C. 26. D. 25.
Câu 3. Cation R2+ có cấu hình electron kết thúc ở 2p6, cấu hình electron của nguyên tử R là
A. 1s22s22p5 . B. 1s22s22p4.
C. 1s22s22p63s2. D. 1s22s22p63s1.
Câu 4: Hai nguyên tố X và Y cùng một chu kì trong bảng tuần hoàn các nguyên tố hóa học, X thuộc nhóm IIA, Y thuộc nhóm IIIA (ZX + ZY = 51). Phát biểu nào sau đây đúng?
A. Kim loại X không khử được ion Cu2+ trong dung dịch.
B. Ở nhiệt đọ thường X không khử được H2O.
C. Hợp chất với oxi của X có dạng X2O7.
D. Trong nguyên tử nguyên tố X có 25 proton.
Câu 5: Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hidro (R có số oxi hóa thấp nhất) và trong oxit cao nhất tương ứng là a% và b%. với a : b = 11 : 4. Phát biểu nào sau đây đúng?
A. Phân tử oxit cao nhất của R không phân cực
B. Oxit cao nhất của R ở điều kiện thường là chất rắn
C. Trong bảng tuần hoàn R thuộc chu kì 3
D. Nguyên tử R (ở trạng thái cơ bản) có 6 electron s
Câu 6: Oxit cao nhất của nguyên tố R có phân tử khối là 60. Phát biểu nào sau đây đúng?
A. R tác dụng trực tiếp với Oxi ngay ở nhiệt độ thường
B. R phản ứng được với dung dịch kiềm giải phóng khí hidro
C. Oxit cao nhất của R tan nhiều trong nước
D. Ở trạng thái cơ bản R có 4 electron ở phân lớp ngoài cùng
Câu 7: Khi cho 13,8g một kim loại nhóm IA tác dụng với nước thu được 6,72 lít khí (đktc). Tên kim loại là
A. kali B. natri C. liti D. xesi
Câu 8: Cation X2+ có tổng số hạt cơ bản (p, n, e) bằng 80, trong đó tỉ số hạt electron so với hạt nơtron là 4/5. Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố X thuộc
A. chu kì 4, nhóm VIIIB. B. chu kì 4, nhóm VIA.
C. chu kì 4, nhóm IIA. D. chu kì 4, nhóm IIB.
Câu 9: Tổng số hạt cơ bản trong nguyên tử của 2 nguyên tố M và X lần lượt là 58 và 52. Hợp chất MX có tổng số hạt proton trong phân tử là 36. Liên kết trong MX thuộc loại liên kết nào
A. Ion B. Liên kết cộng hóa trị phân cực
C. Liên kết cộng hóa trị phân cực D. Liên kết cho – nhận
Câu 10. Dãy chất nào chỉ có các liên kết ion
A. N2, HCl, NaCl. B. HCl, MgO, CaCl2.
C. NaCl, CaO, CO2. D. NaCl, K2O, CaO.
Câu 11. Các chất được sắp xếp theo chiều tăng dần tính phân cực là
A. NaCl, Cl2, HCl. B. HCl, Cl2, NaCl.
C. Cl2, HCl, NaCl. D. NaCl, HCl, Cl2.
Câu 12. Cho các nguyên tố 12M, 17X. Công thức hợp chất và loại liên kết tạo thành giữa các nguyên tử của 2 nguyên tố này là
A. MX và liên kết cộng hóa trị . B. MX2 và liên kết ion.
C. MX2 và liên kết cộng hóa trị . D. M2X và liên kết ion.
Câu 13. Khi Mg kết hợp với nguyên tố X ở nhóm VA thành một hợp chất ion mà X chiếm 28% về khối lượng. Công thức hợp chất của X với Mg là
A. Mg3P2. B. Mg3As2. C. Mg5P2. D. Mg3N2.
Câu 14. Cặp chất chỉ chứa liên kết cộng hóa trị phân cực là
A. H2O và HCl. B. N2 và Cl2 .
C. H2O và NaCl. D. Cl2 và HCl.
Câu 15. Hạt nhân nguyên tử R có điện tích +32.10-19 (C). Nguyên tố R thuộc
A. chu kì 3, nhóm IIB. B. chu kì 2, nhóm IIA.
C. chu kì 4, nhóm IIB. D. chu kì 4, nhóm IIA.
Câu 16. Ion O2- được tạo thành từ nguyên tử 188O. Ion này có:
A. 8p, 8n, 10e. B. 8p, 10n, 10e.
C. 8p, 10n, 8e. D. 10p, 8n, 8e.
Câu 17. Cho các nguyên tố với cấu hình phân lớp ngoài cùng R (3s1), X (3s2), T (4s1). Dãy hiđroxit được sắp xếp theo chiều tính bazơ giảm dần là
A. ROH > X(OH)2 > TOH. B. X(OH)2 > ROH > TOH
C. TOH > X(OH)2 > ROH. D. TOH > ROH >X(OH)2.
Câu 18. Số oxi hóa của S trong H2S, SO2, SO32-, SO42- lần lượt là
A. +2, +4, +6, +6. B. –2, +4, +6, +8.
C. -2, +4, +4, +6. D. +2, +4, +4, +6.
Câu 19. Clo có 2 đồng vị 35Cl và 37Cl, khối lượng nguyên tử trung bình của Clo là 35,5 (đvc). Hỏi trong 300 nguyên tử Clo có bao nhiêu nguyên tử 35Cl.
A. 75. B. 225. C. 125. D. 120.
Câu 20. Nguyên tử X có tổng hạt cơ bản (n, p, e) là 82. Hạt mang điện nhiều hơn hạt không mang điện là 22. Số electron trong ion X2+ là
A. 26. B. 24. C. 28. D. 30.
Câu 21. Tổng số hạt (p, n, e) trong nguyên tử R là 26. Trong đó số hạt mang điện nhiều gấp 1,6 lần số hạt không mang điện. Cấu hình của nguyên tử R là
A. 1s22s22p4. B. 1s22s22p5 .
C. 1s22s22p6 . D. 1s22s22p63s1.
Câu 22. Hòa tan hết m (g) kim loại A hóa trị II vào bình dung dịch axit HCl dư tạo ra 3,36 lít khí H2 (đktc). Sau phản ứng khối lượng bình phản ứng tăng lên 9,45g. Kim loại A là
A. Mg (M = 24). B. Cu (M = 64).
C. Zn (M = 65). D. Ca (M = 40).
Câu 23. Nguyên tố X có công thức hợp chất khí với hiđro là XH3. Trong hợp chất oxit bậc cao của X có chứa 74,07% O về khối lượng. Nguyên tố X là
A. P (31). B. N (14). C. As (75). D. Si (28).
Câu 24. Hòa tan hoàn toàn 0,84g hỗn hợp 2 kim loại A, B nhóm IIA ở 2 chu kì liên tiếp vào dung dịch HCl dư thu được 1,344 lít khí H2 (đktc). Cho Be (M = 9), Mg (M = 24), Ca (M = 40), Sr (M = 88), Ba (M = 137). Hai kim loại A, B là
A. Be, Mg. B. Mg, Ca. C. Ca, Sr. D. Sr, Ba.
Phần Tự luận:
Câu 1: (2 điểm) Cho các phân tử sau: NaCl, HCl và N2
a/ Dự đoán loại liên kết hóa học trong mỗi phân tử trên.
b/ Viết công thức electron, công thức cấu tạo của phân tử HCl và phân tử N2.
c/ Xác định hóa trị (điện hóa trị hoặc cộng hóa trị) của các nguyên tố trong mỗi phân tử trên.
Câu 2: (2 điểm) Hòa tan 5,6 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V (ml) dung dịch KMnO4 0,5M. Viết các phản ứng xảy ra và tính V.
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 10)
Phần trắc nghiệm: (6 điểm)
Câu 1: Nguyên tố X thuộc chu kì 3, nhóm VA trong bảng tuần hoàn. Cấu hình electron trong nguyên tử X là
A. 1s22s22p63s23p4. B. 1s22s22p63s23p3.
C. 1s22s22p63s23p5. D. 1s22s22p63s23p2.
Câu 2: Dãy các nguyên tố nhóm IIA gồm: Mg (Z = 12), Ca (Z = 20), Sr (Z = 38), Ba (Z = 56). Từ Mg đến Ba, theo chiều tăng của điện tích hạt nhân, tính kim loại thay đổi theo chiều
A. giảm dần. B. giảm rồi tăng.
C. tăng rồi giảm. D. tăng dần.
Câu 3: Cacbon trong tự nhiên là hỗn hợp của hai đồng vị 12C và 13C, trong đó đồng vị 12C chiếm 98,89%. Biết rằng đồng vị cacbon 13C có nguyên tử khối bằng 12,991. Nguyên tử khối trung bình của cacbon là
A. 12,512. B. 12,111. C. 12,011. D. 12,150.
Câu 4: Phản ứng nào dưới đây thuộc loại phản ứng oxi hóa khử?
A. NaOH + HBr → NaBr + H2O
B. 3NO2 + H2O → 2HNO3 + NO.
C. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4.
D. CuO + 2HCl → CuCl2 + H2O
Câu 5: Trong hợp chất MgCl2, điện hóa trị của Cl và Mg lần lượt là
A. -1 và +2. B. 2+ và 1-.
C. 1- và 2+. D. 1 và 2.
Câu 6: Liên kết cộng hóa trị là liên kết
A. giữa các phi kim với nhau.
B. được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
C trong đó cặp electron dùng chung bị lệch về một nguyên tử.
D. được hình thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Câu 7: Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là
A. tạo ra chất khí
B. tạo ra chất kết tủa
C. có sự thay đổi màu sắc của các chất
D. có sự thay đổi số oxi hóa của một số nguyên tố
Câu 8: Nguyên tố có độ âm điện lớn nhất trong bảng tuần hoàn là
A. Na. B. Cl. C. F. D. Cs.
Câu 9: Nguyên tố R có công thức cao nhất trong hợp chất với oxi là R2O7. Công thức hợp chất khí với hiđro là
A. HR. B. RH4. C. H2R. D. RH3.
Câu 10: Liên kết hóa học trong phân tử Br2 thuộc loại liên kết
A. hiđro. B. ion. C. CHT có cực. D. CHT không cực.
Câu 11: Cho sơ đồ phản ứng:
FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O
Sau khi cân bằng, tổng hệ số cân bằng (là các số nguyên, tối giản) của phản ứng là
A. 25. B. 21. C. 23. D. 19.
Câu 12: Cho phản ứng:
KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Hệ số cân bằng của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
A. 5 và 1. B. 2 và 10. C. 1 và 5. D. 5 và 2.
Câu 13: Trong phân tử N2, số cặp electron dùng chung là (cho 7N)
A. 2. B. 1. C. 3. D. 4.
Câu 14: Chỉ ra nội dung sai khi nói về ion?
A. Ion âm gọi là cation, ion dương gọi là anion.
B. Ion được hình thành khi nguyên tử nhường hay nhận electron.
C. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử.
D. Ion là phần tử mang điện.
Câu 15: Nguyên tử khối trung bình của đồng là 63,546. Đồng tồn tại trong tự nhiên với 2 loại đồng vị là 6529Cu, 6329Cu. Thành phần phần trăm về số nguyên tử của 6329Cu là
A. 27,3%. B. 72,7%. C. 25%. D. 75%.
Câu 16: Trong phản ứng nào dưới đây HCl thể hiện tính oxi hóa?
A. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
B. 2HC1 + Mg → MgCl2 + H2.
C. HC1 + AgNO3 → AgCl + HNO3.
D. 8HC1 + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O.
Câu 17: Cho quá trình Fe2+ → Fe3+ + 1e, đây là quá trình:
A. tự oxi hóa – khử. B. nhận proton.
C. oxi hóa. D. nhường electron.
Câu 18: Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro (R có số oxi hóa thấp nhất) và trong oxi cao nhất tương ứng là a% và b% với a : b = 11 : 4. Phát biểu nào sau đây là đúng?
A. Nguyên tử R (ở trạng thái cơ bản) có 6 electron s.
B. Oxit cao nhất của R ở điều kiện thường là chất rắn.
C. Trong bảng tuần hoàn, R thuộc chu kì 3.
D. Phân tử oxi cao nhất của R không phân cực.
Câu 19: Ion nào là ion đơn nguyên tử?
A. NH4+. B. NO3-. C. Cl-. D. OH-.
Câu 20: Số oxi hóa của S trong các H2SO4, S, SO3, H2S lần lượt là
A. +6; +8; +6; -2. B. +4; 0; +4; -2.
C. +6; 0; +6; -2. D. +4; -8; +6; -2.
Câu 21: Phương trình biểu diễn sự hình thành ion nào sau đây không đúng?
A. Na → Na+ + 1e. B. S + 2e → S2-.
C. Al + 3e → Al3+. D. Mg → Mg2+ + 2e.
Câu 22: Chọn nội dung đúng để hoàn thành câu sau: “Trong tất cả các hợp chất, …”
A. số oxi hóa của hiđro luôn bằng +1.
B. số oxi hóa của flo luôn bằng +1.
C. số oxi hóa của oxi luôn bằng -2.
D. số oxi hóa của flo luôn bằng -1.
Câu 23: Cho biết độ âm điện của Ca = 1,00; Al = 1,61; Cl = 3,16; S = 2,58. Trong các hợp chất CaS, CaCl2, Al2S3, AlCl3, số hợp chất có liên kết cộng hóa trị có cực là
A. 1. B. 2. C. 3. D. 4.
Câu 24: Hỗn hợp X gồm hai muối cacbonat của hai kim loại (thuộc hai chu kì kế tiếp trong nhóm IIA). Hòa tan 4,8g X bằng dung dịch HCl dư thấy khối lượng dung dịch sau phản ứng tăng 2,6 gam so với dung dịch trước phản ứng. Khối lượng của muối có phân tử khối bé hơn trong hỗn hợp là (Cho nguyên tử khối: Be = 9, Mg = 24, Ca = 40, Ba = 137, C = 12, O = 16)
A. 3,45 gam. B. 1,05 gam. C. 3,75 gam. D. 1,97 gam
Phần tự luận (4 điểm):
Câu 1 (2 điểm). Xác định chất khử, chất oxi hóa, quá trình khử, quá trình oxi hóa và cân bằng các phản ứng oxi hóa khử sau theo phương pháp thăng bằng electron:
a. Al + Fe3O4 → Al2O3 + Fe
b. FeS2 + H2SO4 đặc 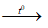 Fe2(SO4)3 + SO2 + H2O.
Fe2(SO4)3 + SO2 + H2O.
Câu 2 (2 điểm). Nung m gam Fe trong không khí, sau phản ứng thu được 11,2 gam chất rắn X gồm Fe, Fe2O3, Fe3O4 và FeO. Hòa tan hoàn toàn hỗn hợp X vào dung dịch HNO3 dư thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là bao nhiêu?
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Bộ đề thi năm 2025 các lớp các môn học được Giáo viên nhiều năm kinh nghiệm tổng hợp và biên soạn theo Thông tư mới nhất của Bộ Giáo dục và Đào tạo, được chọn lọc từ đề thi của các trường trên cả nước.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

