Công thức tính nồng độ OH- lớp 11 (hay, chi tiết)
Bài viết Công thức tính nồng độ OH- lớp 11 trình bày đầy đủ công thức, ví dụ minh họa có lời giải chi tiết và các bài tập tự luyện giúp học sinh nắm vững kiến thức trọng tâm về Công thức tính nồng độ OH- từ đó học tốt môn Hóa học.
Công thức tính nồng độ OH- lớp 11 (hay, chi tiết)
I. Lý thuyết và phương pháp giải
Một số công thức tính nồng độ OH-.
- Tính nồng độ OH- do base mạnh phân li ra:
Giả sử base mạnh có dạng: M(OH)a ⇒ [OH-] = a.[M(OH)a]
- Tính nồng độ OH- dựa vào pOH, pH:
+ Giả sử dung dịch có pOH = b ⇒ [OH-] = 10-b.
+ Giả sử dung dịch có pH = a ⇒ [H+] = 10-a ⇒ [OH-] =
- Tính nồng độ OH- của dung dịch sau pha trộn acid mạnh với base mạnh:
Bước 1: Bản chất của phản ứng giữa acid mạnh với base mạnh là: H+ + OH- → H2O
Bước 2: Nếu base dư: Tính nồng độ ion OH- ⇒
Lưu ý: Vdd sau trộn = Vacid + Vbase = V1 + V2.
Tính nồng độ OH- thường là bước trung gian để tính pH của dung dịch base.
II. Ví dụ minh họa
Ví dụ 1: Nồng độ OH- có trong dung dịch NaOH 0,01M là
A. 0,01M.
B. 0,1M.
C. 1M.
D. 0,02M.
Hướng dẫn giải
Đáp án đúng là: A
Ví dụ 2: Khi trộn những thể tích bằng nhau của dung dịch HNO3 0,01M và dung dịch NaOH 0,03M thì thu được dung dịch Y. Nồng độ OH- có trong dung dịch Y là
A. 0,01M.
B. 0,1M.
C. 1M.
D. 0,02M.
Hướng dẫn giải
Đáp án đúng là: A
Theo bài ra OH- dư;
[OH-] dư =
III. Bài tập vận dụng
Câu 1: Nồng độ OH- có trong dung dịch Ba(OH)2 0,05M là
A. 0,05M.
B. 0,1M.
C. 1M.
D. 0,02M.
Hướng dẫn giải
Đáp án đúng là: B
Câu 2: Nồng độ OH- có trong dung dịch KOH 0,01M là
A. 0,01M.
B. 0,1M.
C. 1M.
D. 0,02M.
Hướng dẫn giải
Đáp án đúng là: A
Câu 3: pH của dung dịch KOH 0,06M và NaOH 0,04M là
A. 1.
B. 2.
C. 13.
D. 12,8.
Hướng dẫn giải
Đáp án đúng là: C
∑[OH-] = 0,06 + 0,04 = 0,1M.
pOH = - log (0,1) = 1.
Vậy pH của dung dịch là: 14 – 1 = 13.
Câu 4: Trộn 200 ml Ba(OH)2 0,01M với 200 ml KOH 0,03M thu được dung dịch X. Nồng độ OH- có trong dung dịch Y là
A. 0,01M.
B. 0,04M.
C. 0,025M.
D. 0,02M.
Hướng dẫn giải
Đáp án đúng là: C
Ta có:
Câu 5: Cho m gam Na vào lượng nước dư thu được 1,5 lít dung dịch X có pH = 12. Nồng độ OH- có trong dung dịch X là
A. 0,01M.
B. 0,04M.
C. 0,03M.
D. 0,02M.
Hướng dẫn giải
Đáp án đúng là: A
2Na + 2H2O → 2NaOH + H2
pH = 12 ⇒ pOH = 14 – 12 = 2 ⇒ [OH−] = 10-2M = 0,01M.
Câu 6: Dung dịch X có pH = 12, thì [OH−] của dung dịch là
A. 0,01M.
B. 1,2M.
C. 0,12M.
D. 0,20M.
Hướng dẫn giải
Đáp án đúng là: A
pH = 12 ⇒ pOH = 14 – 12 = 2 ⇒ [OH-] = 10-2 = 0,01M.
Câu 7:Khi trộn những thể tích bằng nhau của dung dịch HNO3 0,01M và dung dịch NaOH 0,03M thì thu được dung dịch có giá trị pH bằng
A. 9.
B. 12,30.
C. 13.
D. 12.
Hướng dẫn giải
Đáp án đúng là: D
Theo bài ra OH- dư;
[OH-] dư =
pH = 14 – pOH = 14 + log(10-2) = 12.
Câu 8: Cho m gam K vào lượng nước dư thu được 1,5 lít dung dịch có pH = 12. Giá trị của m là
A. 0,23 gam.
B. 0,585 gam.
C. 0,115 gam.
D. 0,345 gam.
Hướng dẫn giải
Đáp án đúng là: B
2K + 2H2O → 2KOH + H2
pH = 12 ⇒ pOH = 14 – 12 = 2 ⇒ [OH−] = 10-2M.
⇒ nK = nKOH = nOH- = 0,01.1,5 = 0,015 mol ⇒ m = 0,585 gam.
Câu 9: Trộn 100 ml dung dịch có pH = 1 gồm HCl và HNO3 với 100 ml dung dịch NaOH nồng độ a (mol/l), thu được 200 ml dung dịch có pH = 12. Giá trị của a là
A. 0,15.
B. 0,30.
C. 0,03.
D. 0,12.
Hướng dẫn giải
Đáp án đúng là: D
Dung dịch thu được có pH = 12 → [OH-] dư = 10-2M
Câu 10: Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M, thu được dung dịch X. Dung dịch X có pH bằng
A. 1,2.
B. 1,0.
C. 12,8.
D. 13,0.
Hướng dẫn giải
Đáp án đúng là: D
nH+ = 2.0,1.0,05 + 0,1.0,1 = 0,02 mol
nOH- = 0,1.0,2 + 2.0,1.0,1 = 0,04 mol
H+ + OH- → H2O
Vậy OH- dư; [OH-] dư = 0,1M
pH = 14 + log 0,1 = 13.
Xem thêm các bài viết về công thức Hóa học 11 hay, chi tiết khác:
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài 500 Công thức, Định Lí, Định nghĩa Toán, Vật Lí, Hóa học, Sinh học được biên soạn bám sát nội dung chương trình học các cấp.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

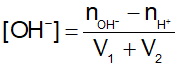
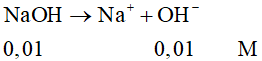
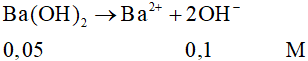
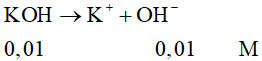






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

