Tóm tắt công thức Hóa học lớp 12 cả năm chi tiết
Tóm tắt công thức Hóa học lớp 12 cả năm chi tiết
Với mục đích giúp học sinh dễ dàng hơn trong việc nhớ kiến thức & công thức môn Hóa học lớp 12 để có thể giải nhanh các bài tập trắc nghiệm Hóa học và chuẩn bị ôn thi THPT Quốc gia đạt kết quả cao, VietJack biên soạn bản Tóm tắt công thức Hóa học lớp 12 cả năm chi tiết. Hi vọng loạt bài này sẽ như là cuốn sổ tay kiến thức và công thức giúp bạn học tốt môn Hóa học lớp 12.
Tài liệu tóm tắt công thức Hóa học lớp 12 gồm 9 chương, liệt kê các công thức quan trọng nhất:
- Chương 1: Este - Lipit
- Chương 2: Cacbohiđrat
- Chương 3: Amin, amino axit và protein
- Chương 4: Polime và vật liệu polime
- Chương 5: Đại cương về kim loại
- Chương 6: Kim loại kiềm, kim loại kiềm thổ, nhôm
- Chương 7: Sắt và một số kim loại quan trọng
- Chương 8: Phân biệt một số chất vô cơ
- Chương 9: Hóa học và vấn đề môi trường
Hi vọng với bài tóm tắt công thức Hóa học 12 này, học sinh sẽ dễ dàng nhớ được công thức và biết cách làm các dạng bài tập Hóa học lớp 12. Mời các bạn đón xem:

Tóm tắt công thức Hóa học lớp 12 Chương 1, 2, 3, 4
CHƯƠNG I: ESTE – LIPIT
1. Công thức tổng quát của este no, đơn chức, hở: CnH2nO2 (n ≥ 2)
2. Tính số đồng phân este đơn chức no:
Số đồng phân este CnH2nO2 = 2n-2 (điều kiện: 1 < n < 5)
3. Tính số triglixerit tạo bởi gilxerol với các axit cacboxylic béo:
Số trieste = 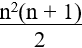
CHƯƠNG II: CACBOHIĐRAT
1. Công thức chung của cacbohiđrat: Cn(H2O)m
2. Công thức cụ thể của một số cacbohiđrat:
+ Tinh bột (hoặc xenlulozơ): (C6H10O5)n hay C6n(H2O)5n.
+ Glucozơ (hoặc fructozơ): C6H12O6 hay C6(H2O)6.
+ Saccarozơ (hoặc mantozơ): C12H22O11 hay C12(H2O)11.
CHƯƠNG III: AMIN, AMINO AXIT VÀ PROTEIN
1. Công thức tổng quát amin no, đơn chức, hở: CnH2n+1NH2 hay CnH2n +3N (n ≥ 1)
2. Tính số đồng phân amin đơn chức no:
Số đồng phân amin CnH2n +3N =2n -1 (điều kiện: n < 5).
3. Tính số đi, tri, tetra …, n peptit tối đa tạo bởi hỗn hợp gồm x amino axit khác nhau:
Số n peptitmax = xn
4. Tính khối luợng amino axit A (chứa n nhóm NH2 và m nhóm COOH ) khi cho amino axit này vào dung dịch chứa a mol HCl, sau đó cho dung dịch sau phản ứng tác dụng vừa đủ với b mol NaOH:
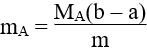
Lưu ý: (A): Amino axit (NH2)nR(COOH)m.
5. Tính khối luợng amino axit A (chứa n nhóm NH2 và m nhóm COOH ) khi cho amino axit này vào dung dịch chứa a mol NaOH, sau đó cho dung dịch sau phản ứng tác dụng vứa đủ với b mol HCl:
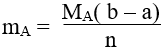
CHƯƠNG IV: POLIME VÀ VẬT LIỆU POLIME
Công thức tính hệ số trùng hợp polime
Giả sử polime có dạng (-A-)n
Ta có: 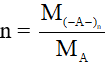
Tóm tắt công thức Hóa học lớp 12 Chương 5
1. Dãy hoạt động hóa học của kim loại
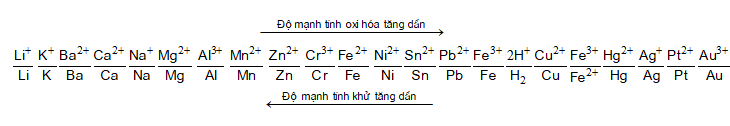
2. Quy tắc anpha ( )
)
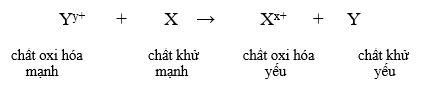
- Giả sử có hai cặp oxi hóa khử: Xx+/ X và Yy+/Y (trong đó cặp Xx+/ X đứng trước cặp Yy+/Y trong dãy điện hóa).
- Áp dụng quy tắc alpha ( )
)
Phản ứng xảy ra theo chiều mũi tên như sau:
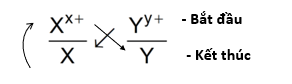
3. Công thức biểu diễn định luật Faraday
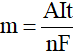
Trong đó:
m: Khối lượng chất thu được ở điện cực, tính bằng gam.
A: Khối lượng mol nguyên tử của chất thu được ở điện cực.
n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
I: Cường độ dòng điện, tính bằng ampe (A).
t: Thời gian điện phân, tính bằng giây (s).
F: Hằng số Faraday (F = 96 500 Culong/mol)
Tóm tắt công thức Hóa học lớp 12 Chương 6
1. Tính lượng kết tủa xuất hiện khi hấp thụ hết lượng CO2 vào dd Ca(OH)2 hoặc Ba(OH)2:
nkết tủa = nOH-– nCO2 |
Lưu ý: Điều kiện áp dụng công thức: nkết tủa < nCO2.
2. Tính lượng kết tủa xuất hiện khi hấp thụ hết lượng CO2 vào dd chứa hỗn hợp NaOH và Ca(OH)2 hoặc Ba(OH)2:
|
Trước hết tính nCO32- = nOH- – nCO2 Sau đó so sánh với nBa2+ hoặc nCa2+ để xem chất nào phản ứng hết |
Lưu ý:
Điều kiện áp dụng công thức: nCO32- < nCO2
3. Tính VCO2 cần hấp thụ hết vào dd Ca(OH)2 hoặc Ba(OH)2 thu được lượng kết tủa theo yêu cầu:
|
Trường hợp 1: nCO2 = n↓ Trường hợp 2: nCO2 = nOH- – n↓ |
4. Tính Vdd NaOH cần cho vào dd Al3+ để xuất hiện lượng kết tủa theo yêu cầu:
|
Trường hợp 1: nOH- = 3n↓ Trường hợp 2: nOH- = 4n Al3+– n↓ |
Lưu ý: Hai kết quả trên tương ứng với hai trường hợp NaOH dùng thiếu và NaOH dùng dư.
Trường hợp 1 ứng với kết tủa chưa đạt cực đại;
Trường hợp 2 ứng với kết tủa đã đạt cực đại sau đó tan bớt một phần.
5. Tính Vdd HCl cần cho vào dd Na[Al(OH)]4 (hoặc NaAlO2) để xuất hiện lượng kết tủa theo yêu cầu:
|
Trường hợp 1: nH+ = n↓ Trường hợp 2: nH+ = 4nNa[Al(OH)]4-– 3n↓ |
Tóm tắt công thức Hóa học lớp 12 Chương 7
1. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp kim loại bằng H2SO4 loãng giải phóng H2:
m muốisunfat = m hỗn hợp KL + 96.nH2 |
2. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp kim loại bằng dd HCl giải phóng H2:
m muối clorua = mhỗn hợp KL +71.nH2 |
3. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp oxit kim loại bằng H2SO4 loãng:
m muối sunfat = mhỗn hợp KL + 80.nH2SO4 |
4. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp oxit kim loại bằng dd HCl:
m muối clorua = mhỗn hợp KL + 27, 5.nHCl |
5. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp kim loại bằng dd HCl vừa đủ:
m muối clorua = mhỗn hợp KL + 35,5.nHCl |
6. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2:
mmuối= mKL +96.nSO2 |
7. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2, S, H2S:
mmuối= mKL + 96.(nSO2 + 3nS + 4nH2S) |
8. Tính số mol HNO3 cần dùng để hòa tan hỗn hợp các kim loại:
nHNO3 = 4nNO + 2nNO2 + 10nN2O +12nN2 +10nNH4NO3 |
Lưu ý:
+) Không tạo ra khí nào thì số mol khí đó bằng 0.
+) Giá trị nHNO3 không phụ thuộc vào số kim loại trong hỗn hợp.
+) Công thức này chỉ dùng khi cho hỗn hợp kim loại tác dụng với HNO3.
+) Chú ý khi tác dụng với Fe3+ vì Fe khử Fe3+ về Fe2+ nên số mol HNO3 đã dùng để hoà tan hỗn hợp kim loại nhỏ hơn so với tính theo công thức trên. Vì thế phải nói rõ HNO3 dư bao nhiêu %.
9. Tính số mol H2 SO4 đặc, nóng cần dùng để hoà tan 1 hỗn hợp kim loại dựa theo sản phẩm khử SO2 duy nhất:
nH2SO4 = 2nSO2 |
10. Tính khối lượng muối nitrat kim loại thu được khi cho hỗn hợp các kim loại tác dụng HNO3 (không có sự tạo thành NH4NO3):
mmuối = mKL + 62.(3nNO + nNO2 + 8nN2O +10nN2) |
Lưu ý:
+) Không tạo ra khí nào thì số mol khí đó bằng 0.
+) Nếu có sự tạo thành NH4NO3 thì cộng thêm vào mNH4NO3 có trong dd sau phản ứng.
11. Tính khối lượng muối thu được khi cho hỗn hợp sắt và các oxit sắt tác dụng với HNO3 dư giải phóng khí NO:
mmuối= |
12. Tính khối lượng muối thu được khi hoà tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 bằng HNO3 đặc, nóng, dư giải phóng khí NO2:
mmuối= |
Lưu ý:
+ Hỗn hợp không nhất thiết phải đủ bốn chất vẫn có thể áp dụng được công thức.
+ Dạng toán này, HNO3 phải dư để muối thu được là Fe (III). Không được nói HNO3 vừa đủ vì có thể phát sinh Fe dư khử Fe3+ về Fe2+ :
+ Nếu giải phóng hỗn hợp NO và NO2 thì công thức là:
mmuối = |
13. Tính khối lượng muối thu được khi hoà tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 bằng H2SO4 đặc, nóng, dư giải phóng khí SO2:
mmuối = |
Lưu ý: Hỗn hợp không nhất thiết phải đủ 4 chất vẫn có thể áp dụng được công thức.
14. Tính khối lượng sắt đã dùng ban đầu, biết oxi hoá lượng sắt này bằng oxi được hỗn hợp rắn X. Hoà tan hết rắn X trong HNO3 loãng dư được NO:
mFe = |
15. Tính khối lượng sắt đã dùng ban đầu, biết oxi hoá lượng sắt này bằng oxi được hỗn hợp rắn X. Hoà tan hết rắn X trong HNO3 loãng dư được NO2:
mFe= |
16. Tính VNO (hoặc NO2) thu được khi cho hỗn hợp sản phẩm sau phản ứng nhiệt nhôm (hoàn toàn hoặc không hoàn toàn) tác dụng với HNO3:
|
nNO = hoặc nNO2 = 3nAl + (3x -2y)nFexOy |
17. Tính m gam Fe3O4 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng HNO3 loãng dư được khí NO là duy nhất:
m = |
Lưu ý:
Khối lượng Fe2O3 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng HNO3 loãng dư được khí NO là duy nhất:
m = |
18. Tính m gam Fe3O4 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng H2SO4 đặc, nóng, dư được khí SO2 là duy nhất:
m = |
Lưu ý:
Khối lượng Fe2O3 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng H2SO4 đặc, nóng, dư được khí SO2 là duy nhất:
m = |
Xem thêm các bài tóm tắt công thức Hóa học của các lớp hay, chi tiết khác:
- Tóm tắt công thức Hóa học lớp 8
- Tóm tắt công thức Hóa học lớp 9
- Tóm tắt công thức Hóa học lớp 10
- Tóm tắt công thức Hóa học lớp 11
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài 500 Công thức, Định Lí, Định nghĩa Toán, Vật Lí, Hóa học, Sinh học được biên soạn bám sát nội dung chương trình học các cấp.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

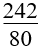 (mhỗn hợp + 24.nNO)
(mhỗn hợp + 24.nNO)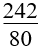 (mhỗn hợp + 8nNO2)
(mhỗn hợp + 8nNO2)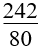 (mhỗn hợp + 8nNO2 +24nNO)
(mhỗn hợp + 8nNO2 +24nNO)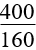 (mhỗn hợp + 16nSO2)
(mhỗn hợp + 16nSO2)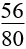 (mhỗn hợp + 24nNO)
(mhỗn hợp + 24nNO)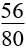 (mhh + 8nNO2)
(mhh + 8nNO2)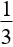 [3nAl + (3x -2y)nFexOy]
[3nAl + (3x -2y)nFexOy]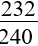 (mx + 24nNO)
(mx + 24nNO)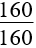 (mx + 24nNO)
(mx + 24nNO)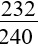 (mx + 16nSO2)
(mx + 16nSO2)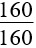 (mx + 16nSO2)
(mx + 16nSO2)





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

