Tóm tắt công thức Hóa học 8 (chương trình mới)
Với mục đích giúp học sinh dễ dàng hơn trong việc nhớ kiến thức & công thức môn Hóa học 8, VietJack biên soạn bản Tóm tắt công thức Hóa 8 trong chương trình sách mới Khoa học tự nhiên 8. Hi vọng loạt bài này sẽ như là cuốn sổ tay kiến thức và công thức giúp bạn học tốt môn Hóa học 8.
Tóm tắt công thức Hóa học 8 (chương trình mới)
(199k) Xem khóa học KHTN 8 KNTTXem khóa học KHTN 8 CDXem khóa học KHTN 8 CTST
Lý thuyết trọng tâm Hóa học 8 (sách mới)
- Lý thuyết Hóa học 8 Kết nối tri thức
- Lý thuyết Hóa học 8 Chân trời sáng tạo
- Lý thuyết Hóa học 8 Cánh diều
Lưu trữ: Công thức Hóa học 8 (sách cũ)
Tài liệu tóm tắt công thức Hóa học lớp 8 gồm 6 chương, liệt kê các công thức quan trọng nhất:
- Chương 1: Chất - Nguyên tử - Phân tử
- Chương 2: Phản ứng hóa học
- Chương 3: Mol và tính toán hóa học
- Chương 4: Oxi - Không khí
- Chương 5: Hiđro - Nước
- Chương 6: Dung dịch
Hi vọng với bài tóm tắt công thức Hóa học 8 này, học sinh sẽ dễ dàng nhớ được công thức và biết cách làm các dạng bài tập Hóa học lớp 8. Mời các bạn đón xem:

Tóm tắt công thức Hóa học lớp 8 Chương 1
1. Số hiệu nguyên tử (Z) = số proton (P) = số electron (E);
Z = P = E
2. Tổng các hạt trong nguyên tử = số proton (P) + số electron (E) + số nơtron (N)
= P + E + N
3. Tổng các hạt trong hạt nhân nguyên tử = số proton (P) + số nơtron (N)
= P + N
4. Tính nguyên tử khối (NTK)
NTK của A = 
Trong đó:
+) mA là khối lượng nguyên tử A (đơn vị gam)
+) 1đvC = 1u = 1,6605.10-27 kg = 1,6605.10-24 gam.
Ví dụ: NTK của oxi =  đvC.
đvC.
5. Tính khối lượng nguyên tử (mnguyên tử)
mnguyên tử = ∑mp + ∑me + ∑mn
6. Tính phân tử khối (PTK)
Hợp chất có dạng: AxByCz
PTK = (NTK của A).x + (NTK của B).y + (NTK của C).z
Ví dụ: Tính phân tử khối của CaCO3
PTK = NTK của Ca + NTK của C + 3.(NTK của O) = 40 + 12 + 16.3 = 100 đvC.
7. Quy tắc hóa trị
Xét hợp chất có dạng: 
Với:
A, B là nguyên tố hoặc nhóm nguyên tử.
a, b lần lượt là hóa trị của A, B.
x, y chỉ số nguyên tử hoặc nhóm nguyên tử.
Theo quy tắc hóa trị: x.a = y.b
⇒ biết x, y và a thì tính được b = 
⇒ biết x, y và b thì tính được a = 
Chú ý: Quy tắc này được vận dụng chủ yếu cho các hợp chất vô cơ.
Tóm tắt công thức Hóa học lớp 8 Chương 2
1. Định luật bảo toàn khối lượng
Giả sử có phản ứng: A + B → C + D
Áp dụng định luật bảo toàn khối lượng: mA + mB = mC + mD
Trong đó mA, mB, mC, mD là khối lượng mỗi chất.
Ví dụ: Nung đá vôi (CaCO3), sau phản ứng thu được 4,4 gam khí cacbon đioxit (CO2) và 5,6 gam canxi oxit. Khối lượng đá vôi đem nung là bao nhiêu?
Giải:
Phương trình hóa học: đá vôi → cacbon đioxit + canxi oxit
Theo định luật bảo toàn khối lượng: mđá vôi = mcacbon đioxit + mcanxi oxit
ó mđá vôi = 4,4 + 5,6 = 10 gam.
Vậy khối lượng đá vôi đem nung là 10g.
Tóm tắt công thức Hóa học lớp 8 Chương 3
1. Công thức tính số mol (n; đơn vị: mol)
- n =
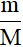
Lưu ý:
+ m: khối lượng (đơn vị: gam).
+ M: khối lượng mol (đơn vị: g/mol).
- n =
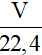
Lưu ý:
+ V: thể tích khí ở đktc (đơn vị: lít).
+ Công thức này áp dụng cho tính số mol khí ở đktc.
- n = CM.Vdd
Lưu ý:
CM: nồng độ dung dịch (đơn vị: mol/ lít)
Vdd: thể tích dung dịch (đơn vị: lít)
- n =
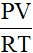
Lưu ý:
Công thức này áp dụng cho chất khí.
P: áp suất (đơn vị: atm)
V: thể tích (đơn vị: lít)
R: hằng số (R = 0,082)
T: Nhiệt độ kenvin (T = oC + 273)
- n =
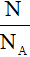
Lưu ý:
N: số nguyên tử hoặc phân tử.
NA: số avogađro (NA = 6,02.1023)
2. Công thức tính tỉ khối của chất khí
- Tỉ khối của chất A so với chất B
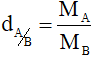
- Tỉ khối của chất A so với không khí
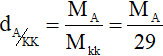
- Từ các công thức trên ta rút ra các hệ quả sau:
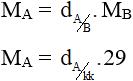
Lưu ý: MA; MB lần lượt là khối lượng mol khí A và khí B (đơn vị: g/mol).
3. Công thức tính khối lượng chất tan (m hoặc mct; đơn vị: gam)
- m = n.M
Lưu ý:
n: số mol (đơn vị: mol)
M: khối lượng mol (đơn vị: g/ mol)
- mct = mdd - mdm
Lưu ý:
mdd: khối lượng dung dịch (đơn vị: gam);
mdm: khối lượng dung môi (đơn vị: gam);
- mct =
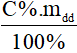
Lưu ý:
C%: nồng độ phần trăm (đơn vị: %)
mdd: khối lượng dung dịch (đơn vị: gam).
4. Công thức tính thể tích chất khí (Vkhí hoặc V; đơn vị: lít)
- Thể tích khí ở điều kiện tiêu chuẩn (đktc): Vkhí = nkhí.22,4
- Thể tích khí ở điều kiện nhiệt độ phòng: Vkhí = nkhí.24
- Thể tích khí ở điều kiện nhiệt độ, áp suất bất kì:
Vkhí =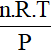
Lưu ý:
n hay nkhí là số mol khí (đơn vị: mol)
P: áp suất chất khí (đơn vị: atm)
R: hằng số (R = 0,082)
T: Nhiệt độ kenvin (T = oC + 273)
5. Công thức tính thành phần phần trăm về khối lượng các chất trong hỗn hợp
Giả sử hỗn hợp gồm hai chất A và B:
mhh = mA + mB
%mA =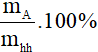
%mB =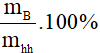 hay %mB = 100% - %mA
hay %mB = 100% - %mA
Lưu ý:
mhh; mA; mB lần lượt là khối lượng hỗn hợp, khối lượng chất A, khối lượng chất B (đơn vị: gam)
6. Công thức tính thành phần phần trăm về thể tích các chất trong hỗn hợp
Giả sử hỗn hợp gồm hai chất A và B
Vhh = VA + VB
%VA =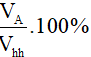
%VB =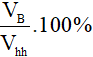 hay %VB = 100% - %VA
hay %VB = 100% - %VA
Lưu ý:
- Vhh; VA; VB lần lượt là thể tích hỗn hợp, thể tích chất A, thể tích chất B.
- Với các chất khí ở cùng điều kiện, thì điều kiện về thể tích cũng chính là tỉ lệ về số mol, nên có thể tính như sau:
nhh = nA + nB
%VA =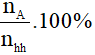
%VB = 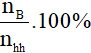 hay %VB = 100% - %VA
hay %VB = 100% - %VA
-Với nhh; nA; nB lần lượt là số mol hỗn hợp, số mol chất A, số mol chất B.
7. Công thức tính hiệu suất phản ứng (H; đơn vị: %)
- Tính theo khối lượng chất sản phẩm:
H = 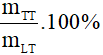
Lưu ý:
mTT: khối lượng sản phẩm thực tế;
mLT: khối lượng sản phẩm theo lý thuyết;
mTT và mLT trong công thức phải có cùng đơn vị.
- Tính theo số mol chất tham gia:
H = 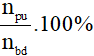
Lưu ý:
npư: số mol chất tham gia đã phản ứng.
nbđ: số mol chất tham gia ban đầu.
8: Công thức tính khối lượng chất tham gia khi có hiệu suất
Do hiệu suất phản ứng nhỏ hơn 100%, nên lượng chất tham gia thực tế đem vào phản ứng phải hơn nhiều so với lý thuyết để bù vào sự hao hụt. Sau khi tính khối lượng chất tham gia theo phương trình phản ứng, ta có khối lượng chất tham gia khi có hiệu suất như sau:
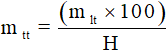
9. Công thức tính khối lượng sản phẩm khi có hiệu suất
Do hiệu suất phản ứng nhỏ hơn 100%, nên lượng sản phẩm thực tế thu được phải nhỏ hơn so với lý thuyết. Sau khi khối lượng sản phẩm theo phương trình phản ứng, ta tính khối lượng sản phẩm khi có hiệu suất như sau:
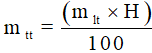
10. Tính thành phần phần trăm về khối lượng của nguyên tố trong hợp chất
Giả sử có công thức hóa học đã biết AxBy, ta tính được %A; %B
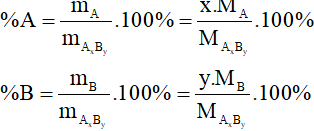
Tóm tắt công thức Hóa học lớp 8 Chương 6
1. Công thức tính độ tan (S; đơn vị: gam)
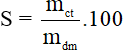
Lưu ý:
mct: là khối lượng chất tan (đơn vị: gam)
mdd: là khối lượng dung dịch (đơn vị: gam)
2. Công thức tính nồng độ phần trăm (C%; đơn vị: %)
- C% =
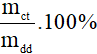
Lưu ý:
mct: khối lượng chất tan (đơn vị: gam)
mdd: khối lượng dung dịch (đơn vị: gam)
- C% =
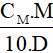
Lưu ý:
CM: nồng độ mol (đơn vị: mol/ lít)
M: khối lượng mol (đơn vị: g/mol)
D: khối lượng riêng (đơn vị: g/ml)
3. Công thức tính nồng độ mol (CM; đơn vị: mol/l)
- CM =
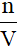
Lưu ý:
n: số mol chất tan (đơn vị: mol)
V: thể tích dung dịch (đơn vị: lít)
- CM =
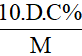
Lưu ý:
D: khối lượng riêng (đơn vị: g/ml)
C%: nồng độ phần trăm (đơn vị: C%)
M: khối lượng mol (đơn vị: g/mol)
4. Công thức tính khối lượng chất tan (m hoặc mct; đơn vị: gam)
- m = n.M
Lưu ý:
n: số mol (đơn vị: mol)
M: khối lượng mol (đơn vị: g/ mol)
- mct = mdd - mdm
Lưu ý:
mdd: khối lượng dung dịch (đơn vị: gam);
mdm: khối lượng dung môi (đơn vị: gam);
- mct =
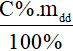
Lưu ý:
C%: nồng độ phần trăm (đơn vị: %)
mdd: khối lượng dung dịch (đơn vị: gam).
- mct =
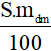
Lưu ý:
S: độ tan của một chất trong dung môi (thường là nước) (đơn vị: gam);
mdm: khối lượng dung môi (đơn vị: gam);
5. Công thức tính khối lượng dung dịch (mdd; đơn vị: gam)
- mdd = mct + mdm
Lưu ý:
mct: khối lượng chất tan (đơn vị: gam)
mdm: khối lượng dung môi (đơn vị: gam)
- mdd =
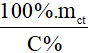
Lưu ý:
mct: khối lượng chất tan (đơn vị: gam)
C%: nồng độ phần trăm (đơn vị: C%)
- mdd = Vdd. D
Lưu ý:
Vdd: thể tích dung dịch (đơn vị: ml)
D: khối lượng riêng của dung dịch (đơn vị: g/ml)
6. Công thức tính thể tích dung dịch (Vdd hoặc V)
- Vdd =
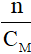
Lưu ý:
n: số mol (đơn vị: mol)
CM: nồng độ mol (đơn vị: mol/ lít)
Vdd: đơn vị lít
- Vdd =
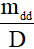
Lưu ý:
mdd: khối lượng dung dịch (đơn vị: gam)
D: khối lượng riêng dung dịch (đơn vị: g/ml)
Vdd: đơn vị ml
Xem thêm các bài tóm tắt công thức Hóa học hay, chi tiết của các lớp khác:
- Tóm tắt công thức Hóa học lớp 9
- Tóm tắt công thức Hóa học lớp 10
- Tóm tắt công thức Hóa học lớp 11
- Tóm tắt công thức Hóa học lớp 12
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài 500 Công thức, Định Lí, Định nghĩa Toán, Vật Lí, Hóa học, Sinh học được biên soạn bám sát nội dung chương trình học các cấp.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

