Một số hợp chất của nitrogen với oxygen lớp 11 (Chuyên đề dạy thêm Hóa 11)
Tài liệu Một số hợp chất của nitrogen với oxygen Hóa học lớp 11 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa học 11.
Một số hợp chất của nitrogen với oxygen lớp 11 (Chuyên đề dạy thêm Hóa 11)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa học 11 (cả 3 sách) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
I. CÁC OXIDE CỦA NITROGEN
1.Công thức, tên gọi
- Oxide của nitrogen kí hiệu: NOx (là hợp chất gây ô nhiễm không khí điển hình)
- Gồm N2O, NO, NO2, N2O4
|
Oxide |
N2O |
NO |
NO2 |
N2O4 |
|
Tên gọi |
Dinitrogen oxide |
Nitrogen monoxide |
Nitrogen dioxide |
Dinitrogen tetroxide |
2.Ngồn gốc phát sinh NOx trong không khí
- Trong tự nhiên: NOx sinh ra do sự phun trào núi lửa, cháy rừng, mưa dông có sấm sét, phân hủy hợp chất hữu cơ.
- Các hoạt động của con người như: giao thông vận tải, sản xuất công nghiệp, nông nghiệp, nhà máy điện và trong đời sống.
Các khí NOx là khí độc, có thể gây ảnh hưởng sức khỏe con người một trong các nguyên nhân gây mưa acid, sương mù quang hóa, hiệu ứng nhà kính, thủng tầng ozone và hiện tượng phú dưỡng, làm ô nhiễm môi trường.
3. Mưa acid
- Nước mưa thường có pH= 5,6 (chủ yếu do CO2 tan tạo môi trường acid yếu. Khi nước mưa có pH< 5,6 gọi là hiện tượng mưa acid.
+ Tác nhân: do SO2 và NOx phát thải chủ yếu do các hoạt động công nghiệp, nhiệt điện, giao thông, khai thác và chế biến dầu mỏ.
+ Quá trình tạo acid: với sự xúc tác của ion kim loại trong khói bụi, khí SO2 và NOx bị oxi hóa bởi oxygen, ozone, hydrogen peroxide, gốc tự do… rồi hòa tan vào nước tạo thành sulfuric acid và nitric acid
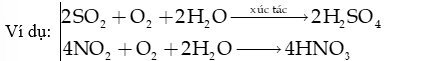
+ Acid trong nước mưa (H2SO4, HNO3) sẽ làm giảm pH của đất và nước, từ đó ảnh hưởng tiêu cực đến cây trồng, thủy sản,…Mưa acid cũng ăn mòn kim loại, biến đổi thành phần vật liệu của các công trình xây dựng.
II. Nitric acid
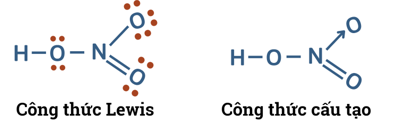
1. Cấu tạo
|
- Nitric acid (HNO3) có công thức: - Đặc điểm cấu tạo của HNO3: + Số oxi hóa của N là +5 + Liên kết O-H phân cực mạnh về phía O. + Liên kết N → O là liên kết cho nhận. |
|
2. Tính chất vật lí
- Nitric acid tinh khiết là chất lỏng, không màu, có khối lượng riêng D =1,53 g/mL
- Nitric acid nóng chảy ở -42oC và sôi ở 83oC.
- Nitric acid bốc khối mạnh trong không khí ẩm và tan vô hạn trong nước.
- Nitric acid thương mại thường có nồng độ 68%, khối lượng riêng là 1,4 g/cm3.
3. Tính chất hóa học
Nitric acid là một acid rất mạnh và có tính oxi hóa rất mạnh.
a) Tính acid
- Nitric acid có khả năng cho proton, thể hiện tính chất của một acid Bronsted-Lowry
+ Làm quỳ tím chuyển sang màu đỏ
+ Tác dụng oxide base, base, muối (xảy ra phản ứng trao đổi)
Fe2O3 + 6HNO3 2Fe(NO3)3 + 3H2O
NaOH + HNO3 NaNO3 + H2O;
- Trong công nghiệp, nitric acid được sử dụng để sản xuất phân bón giàu dinh dưỡng: ammonium nitrate (NH4NO3), calcium nitrate Ca(NO3)2.
NH3 + HNO3 NH4NO3; CaCO3 + 2HNO3 Ca(NO3)2 + CO2 + H2O
b) Tính oxi hóa
- Nitric acid có tính oxi hóa rất mạnh do chứa nguyên tử N có số oxi hóa cao nhất (+5) → HNO3 có khả năng nhận electron.
+ Khi HNO3 đặc, nóng thì luôn giải phóng NO2.
+ Phản ứng với kim loại: 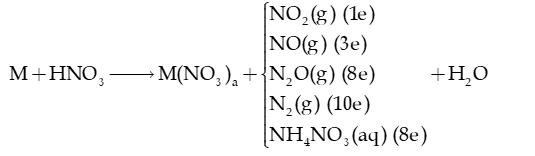
với a là hóa trị cao nhất của kim loại M.
+ Al, Fe, Cr thụ động (không phản ứng) trong HNO3 đặc nguội.
+ Mg, Al, Zn tác dụng với HNO3 loãng có thể tạo các sản phẩm khử là N2, N2O, NH4NO3.
+ Kim loại từ Fe đến Ag tác dụng với HNO3 loãng tạo sản phẩm khử là NO
+ Với Phi kim.
6HNO3 (đặc) + S H2SO4 + 6NO2 (g) + 2H2O
4HNO3 + 3C 4NO (g) + 3CO2 (g) + 2H2O
5HNO3 (đặc) + P H3PO4 + 5NO2 (g) + H2O
+ Với hợp chất:
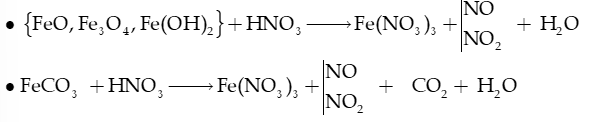
+ Nitric acid đặc tạo với hydrochloric acid đặc hỗn hợp có tính oxi hóa mạnh gọi là nước cường toan –aqua regia, có khả năng hòa tan Au, Pt.
Au + HNO3 + 3HCl AuCl3 + NO + 2H2O
- Do có tính oxi hóa mạnh, nitric acid thường được sử dụng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng trong quặng.
III. HIỆN TƯỢNG PHÚ DƯỠNG
|
- Phú dưỡng: là hiện tượng ao, hồ dư thừa quá nhiều các nguyên tố dinh dưỡng (nitrogen, phosphurus) trong nguồn nước, do tác động từ con người. - Nguyên nhân: + Khi làm lượng nitrogen trong nước đạt 300 μg/L và hàm lượng phosphorus đạt 20 μg/L sẽ gây hiện tượng phú dưỡng. + Nước thải, hay các đầm nuôi trồng thủy sản, sự dư thừa thức ăn chăn nuôi cũng gây ra sự dư thừa dinh dưỡng |
|
- Tác hại: Cản trở sự hấp thụ ánh sáng mặt trời vào nước, giảm sự quang hợp của thực vật thủy sinh. Rong, rêu, tảo phát triển mạnh gây thiếu oxygen, gây mất cân bằng sinh thái. Ngoài ra, xác rong tảo phân hủy gây ô nhiễm môi trường nước, không khí và tạp chất bùn lắng xuống lòng ao.
- Để hạn chế hiện tượng phú dưỡng cần:
+ Tạo điều kiển để nước trong kênh, rạch, ao, hồ được lưu thông.
+ Xử lí nước thải trước khi cho chảy vào ao, hồ,…
+ Sư dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm trong năm để hạn chế rửa trôi ion từ nguồn phân bón dư thừa vào kênh, rạch, ao, hồ.
Phần I. Đề bài
PHẦN A. BÀI TẬP TỰ LUẬN
Câu 1: Hoàn thành các PTHH sau:
a) Tính acid của HNO3
1) HNO3 + NaOH .......................................................................................
2) HNO3 + Cu(OH)2 .......................................................................................
3) HNO3 + Fe(OH)3 .......................................................................................
4) HNO3 + Fe2O3 .......................................................................................
5) HNO3 + CuO > .......................................................................................
6) HNO3 + NaHCO3 .......................................................................................
7) HNO3 + CaCO3 .......................................................................................
8) HNO3 + Na2CO3 .......................................................................................
b) Tính oxi hóa mạnh của HNO3
- Tác dụng với kim loại:
+ Kim loại…….……………… thụ động trong HNO3…………..
+ Với HNO3 đặc, nóng, sản phẩm khử là……………..
+ Mg, Al, Zn tác dụng với HNO3 loãng có thể tạo các sản phẩm khử là………….
+ Kim loại từ Fe đến Ag tác dụng với HNO3 loãng tạo sản phẩm khử là…………
9) HNO3 (đặc) + Cu NO2(g) +
10) HNO3 (loãng) + Cu NO(g)
11) HNO3 (đặc) + Fe
12) HNO3 (loãng) + Fe
13) HNO3 (đặc) + Al NO2(g) +
14) HNO3 (loãng) + Al N2O(g) +
15) HNO3 (loãng) + Al N2(g) +
16) HNO3 (loãng) + Al NH4NO3 +
17) HNO3 (đặc) + Mg NO2(g) +
18) HNO3 + Mg N2(g) +
19) HNO3 + Mg N2O(g) +
20) HNO3 + Mg NH4NO3 +
- Tác dụng với phi kim:
21) HNO3 (loãng) + C
22) HNO3 đặc + C
23) HNO3 (loãng) + S
24) HNO3 (đặc) + S
25) HNO3 (loãng) + P
26) HNO3 (đặc) + P
- Tác dụng với hợp chất:
27) HNO3 (đặc) + FeO
28) HNO3 (loãng) + FeO
29) HNO3 (đặc) + Fe(OH)2
30) HNO3 (loãng) + Fe(OH)2
31) HNO3 (đặc) + Fe3O4
32) HNO3 (loãng) + Fe3O4
33) HNO3 (đặc) + FeCO3
34) HNO3 (loãng) + FeCO3
Câu 2: Viết phương trình phân li và các phương trình hóa học minh họa cho tính chất acid mạnh của nitric acid.
Câu 3: Từ đặc điểm cấu tạo, dự đoán tính tan và tính chất hóa học của nitric acid.
Câu 4: Tính nồng độ mol/L của dung dịch HNO3 60%, biết khối lượng riêng của dung dịch là 1,41 g/mL.
Câu 5: Trong công nghiệp, người ta sản xuất nitric acid (HNO3) từ ammonia theo sơ đồ chuyển hóa sau:
a) Viết các phương trình hóa học xảy ra.
b) Để điều chế 200 000 tấn nitric acid có nồng độ 60% cần dùng bao nhiêu tấn ammonia? Biết rằng hiệu suất của quá trình sản xuất nitric acid theo sơ đồ trên là 96,2%.
Câu 6: Sơ đồ phản ứng sau đây cho thấy rõ vai trò của thiên nhiên và con người trong việc vận chuyển nitrogen từ khí quyển vào trong lòng đất, cung cấp nguồn phân đạm cho cây cối:
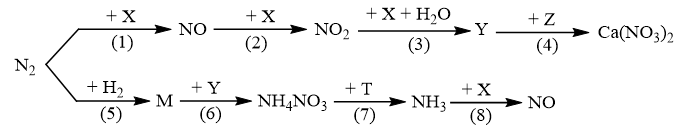
Hãy viết phương trình hóa học của các phản ứng trong sơ đồ chuyển hóa trên.
Câu 7: Cho phương trình hóa học của phản ứng:
Biết enthalpy tạo thành chuẩn của các chất được trình bày trong bảng sau:

a) Tính nhiệt đốt cháy 1 kg hỗn hợp lỏng gồm N2O4 và N2H4.
b) Tại sao hỗn hợp lỏng (N2O4 và N2H4) được dùng làm nhiên liệu tên lửa?
Câu 8: Nêu các biện pháp nhằm hạn chế hiện tượng phú dưỡng xảy ra ở các ao, hồ.
Câu 9: Giải thích nguyên nhân phát thải NOx từ hoạt động giao thông vận tải, nhà máy nhiệt điện, luyện kim, đốt nhiên liệu. Đề xuất các biện pháp nhằm cắt giảm các nguồn phát thải đó.
Câu 10: Hãy mô tả đặc điểm của ao, hồ có hiện tượng phú dưỡng và đề xuất cách cải tạo.
Câu 11: Mưa được hình thành do hơi nước bay lên gặp lạnh ngưng tụ thành những giọt nước lớn dần, rơi xuống bề mặt trái đất gây mưa acid. Vậy tại sao trong nước mưa lại có acid?
Câu 12: Mưa acid gây phá hủy rộng lớn cho rừng cây khắp nơi trên thế giới, đặc biệt là những vùng công nghiệp hóa như châu Âu và Bắc Mỹ. Mưa acid xảy ra chủ yếu do sự phóng thích SO2 từ sự nung quặng sunfua và sự đốt cháy các nhiên liệu. Trong không khí, một phần SO2 chuyển thành SO3 được hấp thụ trong nước mưa chuyển thành sunfuric acid. Giả sử rằng cứ phân tử nước (chứa trong lít nước của một trận mưa) hấp thụ một phân tử SO3 và toàn bộ sunfuric acid đều tan trong lượng mưa nêu trên.
Cho H = 1,008; O = 16,00; S = 32,06; NA = 6,022x1023
Giả sử khối lượng riêng của nước (lỏng) là 1,00 g/mL.
PHẦN B. BÀI TẬP TRẮC NGHIỆM
Câu 13: Nitrogen tác dụng với O2 ( 30000C) tạo ra
A. N2O5.
B. N2O3.
C. NO.
D. NO2.
Câu 14: Phân tử HNO3 có cấu tạo như sau:
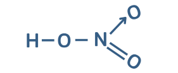
Các loại liên kết có trong phân tử HNO3 là
A. cộng hoá trị và ion.
B. ion và phối trí.
C. phối trí (cho - nhận) và cộng hoá trị.
D. cộng hoá trị và hiđro.
Câu 15: Trong phân tử HNO3, nguyên tử N có
A. hoá trị V, số oxi hoá +5.
B. hoá trị IV, số oxi hoá +5.
C. hoá trị V, số oxi hoá +4.
D. hoá trị IV, số oxi hoá +3.
Câu 16: Phú dưỡng là hiện tượng xảy ra do sự gia tăng hàm lượng của nguyên tố
A. Fe, Mn.
B. N, P.
C. Ca, Mg.
D. Cl, F.
Câu 17: Oxide của nitrogen được tạo thành ở nhiệt độ rất cao, khi nitrogen có trong không khí bị oxi hoá được gọi là
A. tức thời.
B. nhiệt.
C. nhiên liệu.
D. NOx tự nhiên.
Câu 18: Oxide của nitrogen được tạo thành khi nguyên tố nitrogen trong nhiên liệu hoặc sinh khối kết hợp với oxygen dư thừa trong không khí được gọi là
A. nhiên liệu.
B. tư nhiên.
C. tức thời.
D. nhiệt.
Câu 19: Số oxi hoá thấp nhất của nitrogen là
A. -3.
B. 0.
C. +1.
D. +4.
Câu 20: Phân tử nào sau đây có chứa một liên kết cho - nhận?

Câu 21: Acid nào sau đây thể hiện tính oxi hoá mạnh khi tác dụng với chất khử?

Câu 22: Kim loại nào sau đây không tác đụng với nitric acid?
A. Zn.
B. Cu.
C. Ag.
D. Au.
Câu 23: Oxide của nitrogen được tạo thành khi nitrogen trong không khí tác dụng với các gốc tự do được gọi là
A. NOx nhiệt.
B. NOx tức thời.
C. NOx tự nhiên.
D. NOx nhiên liệu.
Câu 24: Nhóm các kim loại đều không phản ứng được với HNO3?
A. Al, Fe.
B. Au, Pt.
C. Al, Au.
D. Fe, Pt.
Câu 25: Kim loại không tan trong dung dịch HNO3 đặc, nguội là
A. Mg.
B. Al.
C. Zn.
D. Cu.
Câu 26: Kim loại Fe không phản ứng được với dung dịch nào sau đây?
A. HNO3 đặc, nguội.
B. H2SO4 đặc, nóng.
C. HNO3 loãng.
D. H2SO4 loãng.
Câu 27: Kim loại Fe bị thụ động bởi dung dịch
A. H2SO4 loãng.
B. HCl đặc, nguội.
C. HNO3 đặc, nguội.
D. HCl loãng.
Câu 28: Kim loại bị thụ động trong HNO3 đặc, nguội là
A. Al, Fe,Cr.
B. Ag, Fe,Cu.
C. Pb, Ag,Fe.
D. Pt, Au,Ag.
Câu 29: Các kim loại đều tác dụng được với dung dịch HCl nhưng không tác dụng với dung dịch HNO3 đặc, nguội
A. Fe, Al, Cr.
B. Cu, Fe, Al.
C. Fe, Mg, Al.
D. Cu, Pb, Ag.
Câu 30: Nitrogen monoxide được tạo thành khi mưa dông kèm theo sấm sét do phản ứng giữa nitrogen và oxygen trong không khí được gọi là
A. NOx nhiên liệu.
B. NOx tức thời.
C. NOx tự nhiên.
D. NOx nhiệt.
Câu 31: Mưa acid là hiện tượng nước mưa có pH thấp hơn 5,6 (giá trị pH của khí carbon dioxide bão hoà trong nước). Hai tác nhân chính gây mưa acid là

Câu 32: Hiện tượng mưa acid
A. là hiện tượng sẵn có trong tự nhiên.
B. xảy ra do sự bốc hơi của nước rồi ngưng tụ.
C. xảy ra khi nước mưa có pH < 7.
D. xảy ra khi nước mưa có pH < 5,6.
Câu 33: Hiện tượng mưa acid là do không khí bị ô nhiễm bởi các khí nào sau đây?
A. SO2, NO, NO2.
B. NO, CO, CO2.
C. CH4, HCl, CO.
D. Cl2, CH4, SO2.
Câu 34: Để điều chế được silver nitrate từ một mẫu silver (bạc) tinh khiết, cần hoà tan mẫu silver vào dung dịch nào sau đây?

Câu 35: Cho phản ứng:
Hệ số tỉ lượng của HNO3 trong phương trình hoá học trên là
A. 4.
B. 1.
C. 28.
D. 10.
Câu 36: Cho phản ứng:
Hệ số tỉ lượng a, b, c, d, e là những số nguyên dương có tỉ lệ tối giản. Tổng (a + b) bằng
A. 3.
B. Câu.
C. 4.
D. 6.
Câu 37: Hiện tượng phú dưỡng là một biểu hiện của môi trường ao, hồ bị ô nhiễm do dư thừa các chất dinh dưỡng. Sự dư thừa dinh dưỡng chủ yếu do hàm lượng các ion nào sau đây vượt quá mức cho phép?
A. Sodium, potassium.
B. Calcium, magnesium.
C. nitrate, phosphate.
D. Chloride, sulfate.
Câu 38: Cho các nhận định sau về tính chất hoá học của nitric acid: (1) có tính acid mạnh; (2) có tính acid yếu; (3) có tính oxi hoá mạnh; (4) có tính khử mạnh. Số nhận định đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 39: Phát biểu nào sau đây không đúng?
A. và HCl đều dễ tan trong nước.
B. và HCl đều là acid mạnh trong nước.
C. và đều có tính oxi hoá mạnh ở điều kiện thường.
D. và đều bị phân huỷ bởi nhiệt.
................................
................................
................................
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm Chuyên đề dạy thêm Hóa học lớp 11 các chủ đề hay khác:
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

