Sulfur và Sulfur dioxide lớp 11 (Chuyên đề dạy thêm Hóa 11)
Tài liệu Sulfur và Sulfur dioxide Hóa học lớp 11 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa học 11.
Sulfur và Sulfur dioxide lớp 11 (Chuyên đề dạy thêm Hóa 11)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa học 11 (cả 3 sách) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
I. SULFUR
1. Trạng thái tự nhiên
- Sulfur (lưu huỳnh) là nguyên tố phổ biến thứ 17 trên vỏ Trái Đất, có 4 đồng vị bền là .
- Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và hợp chất.
+ Đơn chất sulfur được phân bố ở vùng lân cận núi lửa và suối nước nóng,…
+ Hợp chất sulfur gồm các khoáng vật sulfide (), sulfate (), protein,… như pyrite (FeS2), chalcopyrite (CuFeS2), chu sa, thần sa (HgS), thạch cao (CaSO4.2H2O),…

- Sulfur chiếm khoảng 0,2% khối lượng cơ thể người, có trong thành phần nhiều protein và enzyme.
2. Cấu tạo nguyên tử, phân tử
|
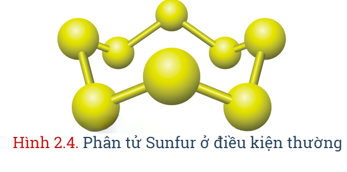
- Nguyên tố sulfur nằm ở ô số 16, nhóm VIA, chu kì 3 trong bảng tuần hoàn.- Nguyên tử sulfur có độ âm điện 2,58; có tính phi kim, tạo ra nhiều hợp chất với các số oxi hóa khác nhau từ -2 đến +6.- Ở dạng phân tử, sulfur gồm 8 nguyên tử liên kết cộng hóa trị với nhau tạo thành mạch vòng (S8). Để đơn giản, người ta dùng kí hiệu S trong các phản ứng hóa học. |
|
3. Tính chất vật lí
- Đơn chất sulfur có 2 dạng thù hình: dạng tà phương (bền ở nhiệt độ thường) và dạng đơn tà.
- Sulfur không tan trong nước, ít tan trong alcohol, tan nhiều trong carbon disulfide (CS2), benzene, dầu hỏa,…
- Nóng chảy ở 1130C và sôi ở 4450C.
4. Tính chất hoá học
a. Tác dụng với hydrogen và kim loại
- Ở nhiệt độ cao, sulfur tác dụng với hydrogen tạo hydrogen sulfide, tác dụng với nhiều kim loại tạo muối sulfide
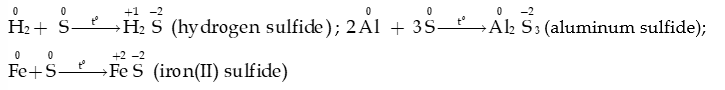
- Sulfur tác dụng với thủy ngân (mercury) ở ngay nhiệt độ thường: phản ứng này được dùng để xử lí mercury rơi vãi.
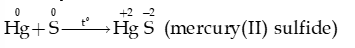
- Trong phản ứng với hydrogen và với kim loại, sulfur thể hiện tính oxi hóa: bị khử từ số oxi hóa 0 về -2.
b. Tác dụng với phi kim
- Ở nhiệt độ thích hợp, sulfur tác dụng với một số phi kim như fluorine, oxygen,…
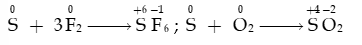
- Trong phản ứng fluorine, oxygen ở trên, sulfur thể hiện tính khử: bị oxi hóa từ số oxi hóa 0 đến +4 hoặc +6.
5. Ứng dụng

- Sản xuất diêm, thuốc nổ, sulfuric acid, thuốc trừ sâu, thuốc diệt nấm, lưu hóa cao su.
II. Sulfur dioxide
1. Tính chất vật lí
- Là chất khí, không màu, mùi hắc, nặng hơn không khí, tan nhiều trong nước.
- Là khí độc.
2. Tính chất hóa học
a. Tính oxi hóa ()
- Sulfur dioxide tác dụng với hydrogen sulfide tạo sulfur và nước: phản ứng được dùng để chuyển hóa hydrogen sulfide trong khí thiên nhiên thành sulfur.
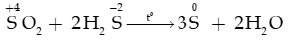
- Khí thải có liên quan đến mưa acid: .
b. Tính khử ()
- Sunlfur dioxide là chất khử khi tác dụng với các chất oxi hóa halogen (F2, Cl2,.), potassium permanganate (KMnO4), nitrogen dioxide (NO2),…
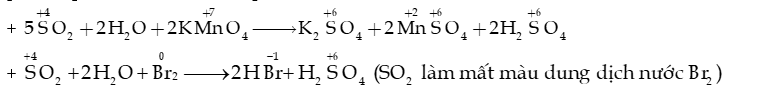
+ Quá trình tạo mưa acid khi không khí bị ô nhiễm bởi sulfur dioxide: SO2 + NO2 SO3 + NO.
3. Ứng dụng
- Dùng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc cho sản phẩm mây tre đan,.
- Là chất trung gian trong quá trình sản xuất sulfuric acid.
4. Sulfur dioxide và ô nhiễm môi trường
a) Nguồn phát sinh sulfur dioxide
|
|
- Nguồn tự nhiên: khí thải núi lửa. - Nguồn nhân tạo: đốt cháy nhiên liệu có chứa tạp chất sulfur (than đá, dầu mỏ), đốt quặng sulfide, đốt sulfur và quặng pyrite. |
b) Tác hại
- Sulfur dioxide là một trong các tác nhân gây ô nhiễm khí quyển, gây mưa acid,…
- Sulfur dioxide gây viêm đường hô hấp ở người.
c) Biện pháp cắt giảm phát thải sulfur dioxide vào khí quyển
- Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo; sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên.
- Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
Phần I. Đề bài
Câu 1: Hoàn thành các phương trình hóa học sau:
|
1 |
H2 + S |
6 |
SO2 + O2 |
|
2 |
Fe + S |
7 |
SO2 + H2S |
|
3 |
Zn + S |
8 |
SO2 + H2O + Br2 |
|
4 |
S + O2 |
9 |
SO2 + H2O + KMnO4 |
|
5
|
S + F2 |
10 |
SO2 + NO2 |
Câu 2: Hãy nêu một số ví dụ về phản ứng thuận nghịch mà em biết.
Câu 3: Phản ứng của sulfur với hydrogen, nhôm (aluminium), thủy ngân (mercury) và fluorine, hãy xác định sự thay đổi số oxi hóa của nguyên tử các nguyên tố. Sulfur là chất oxi hóa hay chất khử?
Câu 4: Hãy xác định sự thay đổi số oxi hóa của nguyên tử các nguyên tố và vai trò của sulfur dioxide trong phản ứng của sulfur dioxide với hydrogen sulfide và nitrogen dioxide.
Câu 5: a) Trình bày ứng dụng của sulfur dioxide. Giải thích.
b) Kể tên một số nguồn phát thải sulfur dioxide vào khí quyển. Em hãy đề xuất một số biện pháp nhằm cắt giảm sự phát thải đó.
Câu 6: Phản ứng oxi hoá là giai đoạn then chốt trong quá trình sản xuất :
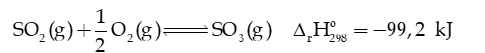
a) Viết biểu thức tính hằng số cân bằng của phản ứng.
b) Hãy cho biết phản ứng trên là toả nhiệt hay thu nhiệt.
c) Trong thực tế, phản ứng được thực hiện ở khoảng 4500C. Tại sao không thực hiện phản ứng ở 250C hoặc 6000C?
Câu 7: Xét phản ứng giữa và trong không khí ô nhiễm sulfur dioxide:
Tính biến thiên enthalpy của phản ứng và cho biết phản ứng trên là toả nhiệt hay thu nhiệt. (Biết nhiệt tạo thành của lần lượt là 33,2 kJ/mol; -296,8 kJ/mol;91,3 kJ/mol và -395,7 kJ/mol.
Câu 8: Cho giá trị enthalpy tạo thành chuẩn của khí SO2 và khí SO3 lần lượt là -296,8 kJ/mol và -395,7 kJ/mol.
Tính giá trị biến thiên enthalpy chuẩn của phản ứng: .
Từ đó, hãy cho biết phản ứng trên có thuận lợi về mặt năng lượng không
Câu 9: Một số quá trình tự nhiên và hoạt động của con người thải hydrogen sulfide vào không khí. Chất này có thể bị oxi hóa bởi oxygen có trong không khí theo hai phản ứng sau:
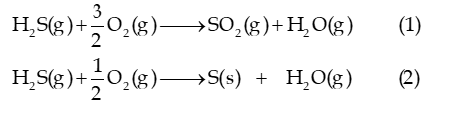
Cho biết giá trị enthalpy tạo thành chuẩn của H2S (g), SO2 (g) và H2O (g) lần lượt là -20,7 kJ/mol; -296,8 kJ/mol và -241,8 kJ/mol.
a) Tính giá trị biến thiên enthalpy chuẩn của mỗi phản ứng trên. Ở 298K, mỗi phản ứng có thuận lợi về mặt năng lượng không?
b) Trong môi trường không khí mà nồng độ oxygen bị suy giảm, hãy dự đoán hydrogen sulfide sẽ chuyển hóa thành sulfur dioxide (SO2) hay sulfur (S). Giải thích
Câu 10: Bột đá vôi cỏ thể được sử dụng để xử lí khí thải chứa sulfur dioxide từ các nhà máy điện đốt than và dầu mỏ. Phương trình hoá học của phản ứng là
a) Tính giá trị biến thiên enthalpy chuẩn của phản ứng trên theo số liệu giá trị enthalpy tạo thành chuẩn của các họp chất trong bảng sau đây. Cho biết phản ứng có thuận lợi về mặt năng lượng không.
|
Hợp chất |
CaSO3 (s) |
CaCO3 (s) |
SO2 (g) |
CO2 (g) |
|
(kJ/mol) |
-1 634,9 |
-1 207,6 |
-296,8 |
-393,5 |
b) Trong phản ứng trên, vì sao đá vôi phải được dùng ở dạng bột?
c) Calcium sulfite (CaSO3) thường được chuyển hoá thành thạch cao có công thức CaSO4.2H2O. Phản ứng hoá học chuyển CaSO3 thành CaSO4.2H2O có thuộc loại phản ứng oxi hoá - khử không? Giải thích.
Câu 11: Hỗn hợp X gồm SO2 và O2 có tỉ khối so với H2 bằng 24. Nung nóng X trong bình kín chứa xúc tác , thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 30. Viết phương trình hoá học và tính hiệu suất của phản ứng oxi hoá SO2 thành SO3.
Câu 12: Tại nhiều làng nghề thủ công mĩ nghệ, sulfur dioxide được dùng là chất chống mốc cho các sản phẩm mây tre đan.
Trong một ngày, một làng nghề đốt cháy 20 kg sulfur để tạo thành sulfur dioxide.
a) Viết phương trình hoá học và tính thể tích khí SO2 (đkc) tối đa tạo ra?
b) Giả thiết có 20% lượng khí SO2 trên bay vào khí quyền và chuyển hoá hết thành H2SO4 trong nước mưa theo sơ đồ: SO2
a) Viết các phương trình hoá học theo sơ đồ trên.
b) Tính thể tích nước mưa bị nhiễm acid nếu nồng độ H2SO4 trong nước mưa là .
B. CÁC DẠNG CÂU HỎI TRẮC NGHIỆM
Câu 13: Sulfur là chất rắn có màu
A. đỏ.
B. vàng.
C. không màu.
D. xanh.
Câu 14: Nguyên tố sulfur có số hiệu nguyên tử là 16, trong bảng tuần hoàn, sulfur thuộc nhóm nào?
A. nhóm IIA.
B. nhóm IVA.
C. nhóm VIA.
D. nhóm VIIA.
Câu 15: Nguyên tố sulfur ở ô số 16, nhóm VIA, chu kì 3 trong bảng tuần hoàn. Ở trạng thái cơ bản, nguyên tử sulfur có số electron độc thân là
A. 1.
B. 2.
C. 3.
D. 6.
Câu 16: Chất phản ứng ngay với bột sulfur ở điều kiện thường là
A. H2.
B. O2.
C. Hg.
D. Fe.
Câu 17: Số electron lớp ngoài cùng của nguyên tử sulfur (S) là
A. 1.
B. 6.
C. 5.
D. 7.
Câu 18: Số oxi hóa thấp nhất của nguyên tử sulfur (S) trong hợp chất là
A. -1.
B. +4.
C. +6.
D. -2.
Câu 19: Số oxi hóa cao nhất của nguyên tử sulfur (S) trong hợp chất là
A. -1.
B. +4.
C. +6.
D. -2.
Câu 20: Hợp chất SO2 có tên gọi là
A. sulfur oxide.
B. sulfur dioxide.
C. disulfur oxide.
D. sulfur trioxide.
Câu 21: Sulfur dioxide thuộc loại oxide nào sau đây?
A. Oxide acid.
B. Oxide base.
C. Oxide trung tính.
D. Oxide lưỡng tính.
Câu 22: Trong phản ứng: . Sulfur đóng vai trò là
A. chất khử.
B. chất oxi hóa.
C. chất bị khử.
D. kim loại.
Câu 23: Sulfur là chất oxi hóa trong phản ứng nào sau đây?
A. S + O2 SO2.
B. S + 2H2SO4 3SO2 + 2H2O.
C. S + Fe FeS.
D. S + 3F2 SF6.
Câu 24: Phản ứng nào sau đây sulfur đóng vai trò là chất khử?

Câu 25: Phản ứng nào sau đây sulfur đóng vai trò là chất oxi hóa?
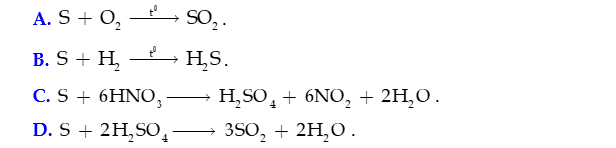
Câu 26: Cho phản ứng: SO2 + Cl2 + 2H2O H2SO4 + 2HCl. Trong phản ứng SO2 đóng vai trò là
A. Chất oxi hoá.
B. Chất khử.
C. Môi trường.
D. Vừa là chất khử vừa là chất oxi hoá.
Câu 27: Cho phản ứng: SO2 + NO2 SO3 + NO. Trong phản ứng SO2 đóng vai trò là
A. Chất bị khử.
B. Chất bị oxi hóa.
C. Môi trường.
D. Vừa là chất khử vừa là chất oxi hoá.
Câu 28: Phương trình hóa học xảy ra khi cho aluminium tác dụng với sulfur là
A. S + Al AlS.
B. 3S2 + 4Al 2Al2S3.
C. 3S + 2Al Al2S3.
D. S + 2Al Al2S.
Câu 29: Cách xử lý thủy ngân khi nhiệt kế thủy ngân không may bị vỡ là
A. rắc bột sulfur lên thủy ngân rồi gom lại.
B. rắc muối ăn lên thủy ngân rồi gom lại.
C. rắc đường lên thủy ngân rồi gom lại.
D. rắc bột sắt lên thủy ngân rồi gom lại.
Câu 30: Ứng dụng nào sau đây của sulfur không đúng?
A. Sản xuất sulfuric acid.
B. Sản xuất thuốc trừ sâu.
C. Dùng làm gia vị thức ăn cho người.
D. Dùng để lưu hóa cao su.
Câu 31: Trong khí thải do đốt nhiên liệu hóa thạch có chất khí X không màu, mùi hắc, gây viêm đường hô hấp ở người. Khi khuếch tán vào bầu khí quyển, X là nguyên nhân chủ yếu gây hiện tượng “mưa acid’. X là
A. SO2.
B. CO2.
C. H2S.
D. CO.
Câu 32: Khí Y làm đục nước vôi trong và được dùng làm chất tẩy trắng bột gỗ trong công nghiệp giấy, khử màu trong sản xuất đường, chống nấm mốc cho sản phẩm mây tre đan,. Chất Y là
A. CO2.
B. O3.
C. NH3.
D. SO2.
Câu 33: Sulfur dioxide là oxide acid trong phản ứng nào sau đây?
A. 2SO2 + O2 2SO3.
B. SO2 + 2NaOH Na2SO3 + H2O.
C. SO2 + 2H2S 3S + 2H2O.
D. SO2 + Br2 + 2H2O 2HBr + H2SO4.
................................
................................
................................
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm Chuyên đề dạy thêm Hóa học lớp 11 các chủ đề hay khác:
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

