Chuyên đề Nitrogen – sulfur lớp 11
Tài liệu chuyên đề Nitrogen – sulfur Hóa học lớp 11 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa học 11.
Chuyên đề Nitrogen – sulfur lớp 11
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa học 11 (cả 3 sách) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
Nitrogen
I. TRẠNG THÁI TỰ NHIÊN CỦA NITROGEN
- Dạng đơn chất: Nitrogen chiếm khoảng 78% thể tích không khí. Nitrogen trong tự nhiên có 2 đồng vị bền: .
- Dạng hợp chất: Có nhiều trong sodium nitrate (NaNO3), diêm tiêu natri. Trong cơ thể người và động vật, là thành phần cấu tạo nên nucleic acid, protein,…
II. CẤU TẠO NGUYÊN TỬ, PHÂN TỬ
1) Cấu tạo nguyên tử
- Nguyên tố N thuộc ô số 7, nhóm VA, chu kì 2 trong bảng tuần hoàn.
- Độ âm điện lớn (3,04); là phi kim điển hình.
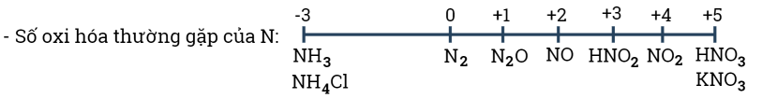
- Nitrogen tạo ra nhiều hợp chất với các số oxi hóa khác nhau từ - 3 đến +5.
2) Cấu tạo phân tử
- Công thức cấu tạo:
- Phân tử nitrogen (N2) có năng lượng liên kết lớn (945 kJ/mol) và không có cực.
→ Liên kết ba trong phân tử N2 có năng lượng liên kết rất lớn (khó bị phá vỡ) nên ở nhiệt độ và áp suất thường, nitrogen rất khó tham gia phản ứng (tính trơ của đơn chất nitrogen).
III. TÍNH CHẤT VẬT LÍ
|
- Ở điều kiện thường, nitrogen (N2) là chất khí, không màu, không mùi, không vị - Khó hóa lỏng (hóa lỏng ở -196oC); hóa rắn -210oC. - Tan rất ít trong nước. - Không duy trì sự cháy và sự hô hấp. |
|
|
- Ở dạng đơn chất, tương tác van der Waals giữa các phân tử nitrogen rất yếu nên nhiệt độ sôi thấp. - Tương tác van der Waals giữa các phân tử nitrogen nước phân tử nước rất yếu nên nitrogen rất ít tan trong nước. |
|
IV. TÍNH CHẤT HÓA HỌC
- Nitrogen khá trơ ở nhiệt độ thường, ở nhiệt độ cao, nitrogen trở nên hoạt động hơn. Nitrogen thể hiện được cả tính oxi hóa và tính khử.
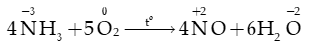
1) Tác dụng với hydrogen
Ở nhiệt độ cao (380oC – 450oC), áp suất cao khoảng 200 bar, xúc tác Fe.
2) Tác dụng với oxygen
- Ở nhiệt độ khoảng 3000oC hoặc có tia lửa điện, nitrogen tác dụng với oxygen tạo thành nitrogen monoxide
|
- Khi có sấm sét:
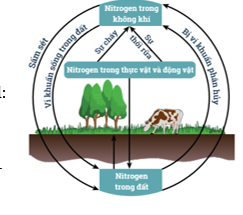
- Trong nước mưa, nitrogen dioxide (NO2) chuyển thành acid: → Quá trình tạo và cung cấp đạm nitrate cho đất từ nước mưa:
|
|
V. ỨNG DỤNG
- Nitrogen hóa lỏng ở nhiệt độ thấp (-196oC) nên ứng dụng làm lạnh nhanh.
- Trong lĩnh vực sinh học và y học, các mẫu sinh vật học (máu, mô, tế bào, bộ phận cơ thể,…) được bảo quản trong bình nitrogen lỏng.
- Tổng hợp ammonia (NH3), từ đó sản xuất phân đạm, nitric acid.
- Bảo quản thực phẩm.
PHẦN A. CÁC DẠNG BÀI TẬP TỰ LUẬN
Câu 1: Dựa vào tương tác van der Waals, hãy giải thích tại sao đơn chất N2 khó hóa lỏng và ít tan trong nước.
Câu 2: Trong phương trình hóa học của phản ứng tổng hợp ammonia, hãy xác định các nguyên tử có sự thay đổi số oxi hóa và vai trò của nitrogen.
Câu 3: Trong phương trình hóa học của phản ứng giữa nitrogen và oxygen:
a) Hãy các định các nguyên tử có sự thay đối số oxi hóa.
b) Tại sao thực tế không sử dụng phản ứng để tạo ra NO, một hợp chất trung gian quan trọng trong công nghiệp sản xuất nitric acid?
Câu 4: Viết các phương trình hóa học minh họa quá trình hình thành đạm nitrate trong tự nhiên xuất phát từ nitrogen.
Câu 5: Dựa vào giá trị năng lượng liên kết (Eb), hãy dự đoán ở điều kiện thường, chất nào (nitrogen, hydrogen, oxygen, chlorine) khó và dễ tham gia phản ứng hóa học nhất. Vì sao?
a) N2 (g) 2N (g) Eb = 945 kJ/mol; b) H2 (g) 2H (g) Eb = 432 kJ/mol
c) O2 (g) 2O (g) Eb = 498 kJ/mol; d) Cl2 (g) 2Cl (g) Eb = 243 kJ/mol.
Câu 6: a) Tại sao nitrogen lỏng được dùng để bảo quản mẫu vật phẩm trong y học?
b) Tại sao dùng khí nitrogen để làm căng vỏ bao bì thực phẩm mà không dùng không khí?
Câu 7: Dựa vào các giá trị năng lượng liên kết, hãy dự đoán ở nhiệt độ thường thì đơn chất nitrogen hay chlorine dễ phản ứng với hydrogen hơn. Cho biết năng lượng liên kết Cl−Cl trong phân tử chlorine là 243 kJ/mol; năng lượng liên kết N ≡ N trong phân tử nitrogen là 946 kJ/mol.
Câu 8: Viết phương trình hoá học của phản ứng giữa nitrogen với hydrogen và với oxygen. Nêu ứng dụng của mỗi phản ứng này trong thực tế.
Câu 9: Trong công nghiệp, ammonia được sản xuất dựa vào phản ứng thuận nghịch giữa nitrogen và hydrogen trong thiết bị kín.
a) Khi phản ứng đạt trạng thái cân bằng thì trong thiết bị sẽ có các khí nào?
b) Hãy tìm hiểu về nhiệt độ hoá lỏng của mỗi khí có trong thiết bị. Từ đó cho biết, nếu giữ nguyên áp suất và làm lạnh thiết bị thì khí nào sẽ hoá lỏng đầu tiên.
Câu 10: Tính phân tử khối trung bình của không khí, giả thiết thành phần không khí: 78% nitrogen, 21% oxygen và 1% argon.
Câu 11: Một bình kín có dung tích là 0,5 L chứa 1,5 mol H2 và 0,5 mol N2 ở nhiệt độ xác định. Ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Tính hằng số cân bằng KC của phản ứng xảy ra trong bình.
DẠNG 1: BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG
Cho phản ứng: aA + bB mM + nN
Biến thiên enthalpy chuẩn của phản ứng, tính theo nhiệt tạo thành :
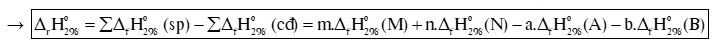
Biến thiên enthalpy chuẩn của phản ứng, tính theo năng lượng liên kết:
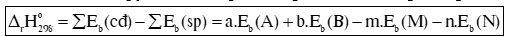
Trong đó: Eb (A), Eb (B), Eb (M), Eb (N) lần lượt là tổng năng lượng liên kết của tất cả các liên kết trong phân tử A, B, M, N.
Câu 12: Cho phản ứng: 3H2 (g) + N2 (g)⇌ 2NH3. Tính biến thiên enthalpy của phản ứng tạo thành ammonia (NH3), biết năng lượng liên kết Eb (H – H) = 432 kJ/mol; Eb (N≡N) = 945 kJ/mol; Eb (N – H) = 391 kJ/mol. Cho biết phản ứng thu nhiệt hay tỏa nhiệt.
Câu 13: Tính biến thiên enthapy theo các phương trình phản ứng sau, biết nhiệt sinh của NH3 bằng -46 kJ/mol.
N2(g) + 3H2(g) 2NH3(g) (1)
(2)
So sánh (1) và (2). Khi tổng hợp được 1 tấn NH3 thì nhiệt lượng toả ra hay thu vào là bao nhiêu? Tính theo hai phương trình phản ứng trên thì kết quả thu được giống nhau hay khác nhau.
Câu 14: Dựa vào năng lượng liên kết ở bảng:
|
Liên kết |
N≡N |
O = O |
N = O |
|
Eb (kJ/mol) |
945 |
498 |
607 |
Tính biến thiên enthalpy của phản ứng và giải thích vì sao nitrogen (N≡N) chỉ phản ứng với oxygen (O=O) ở nhiệt độ cao hoặc có tia lửa điện để tạo thành nitrogen monoxide (N=O).
N2(g) + O2(g) 2NO(g)
Câu 15: Cho hai phương trình hoá học sau:
N2(g) + O2(g) 2NO(g) (1)
2NO(g) + O2(g) 2NO2(g) (2)
Những phát biểu nào sau đây về hai phương trình hoá học trên là đúng?
a) Xác định phản ứng nào là phản ứng tỏa nhiệt, phản ứng thu nhiệt?
b) Trong 2 phản ứng trên, phản ứng nào thuận lợi về mặt năng lượng, phản ứng nào không thuận lợi về mặt năng lượng?
c) Xác định enthalpy tạo thành chuẩn của NO2.
d) Từ giá trị biến thiên enthalpy chuẩn của phản ứng (1) và năng lượng liên kết trong phân tử O2, N2 lần lượt là 498 kJ/mol và 946 kJ/mol, tính được năng lượng liên kết trong phân tử NO ở cùng điều kiện.
Câu 16: Cho bảng giá trị năng lượng của một số liên kết ở điều kiện chuẩn sau:
|
Liên kết |
H – H |
N – H |
N ≡ N |
|
Năng lượng liên kết (kJ/mol) |
436 |
389 |
946 |
a) Tính giá trị biến thiên enthalpy chuẩn của phản ứng sau theo năng lượng liên kết: N2(g) + 3H2(g) 2NH3(g)
b) Từ kết quả tính ở a) thì có thể suy ra giá trị enthalpy tạo thành chuẩn của khí ammonia là bao nhiêu kJ/mol?
c) Kết quả thực nghiệm xác nhận giá trị enthalpy tạo thành chuẩn của khí ammonia là -45,9 kJ/mol. Hãy cho biết vì sao có sự khác biệt về giá trị enthalpy tạo thành chuẩn của khí ammonia theo kết quả tính ở b) và kết quả thực nghiệm.
Ammonia muối ammonium
I. AMMONIA
1) Cấu tạo phân tử
- Phân tử ammonia (NH3) có dạng hình chóp tam giác

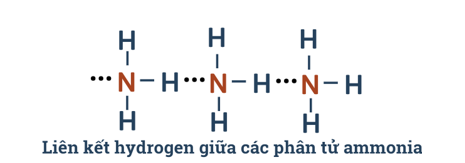
- Nguyên tử N còn một cặp electron không liên kết, tạo ra vùng có mật độ điện tích âm trên nguyên tử N.
- Liên kết N – H tương đối bền với mặt năng lượng liên kết là 386 kJ/mol.
2) Tính chất vật lí
- Ở điều kiện thường, ammonia tồn tại ở thể khí, không màu, nhẹ hơn không khí, mùi khai và xốc và độc.
- Ammonia tan nhiều trong nước (ở điều kiện thường, 1 lít nước hòa tan được 700 lít khí ammonia.
3) Tính chất hóa học
a) Tính base
- Cặp electron hóa trị riêng trên nguyên tử nitrogen (N) gây nên tính base của ammonia (NH3).
- Khi tan trong nước NH3 nhận H+ của nước tạo uon ammonium (NH3)
→ Theo brønted – Lowry, NH3 là một base (nhận H+):
- Dung dịch NH3 có tính base yếu, làm quỳ tím hóa xanh.
- Ammonia (dạng khí cũng như dung dịch) tác dụng với acid tạo thành muối ammonium.
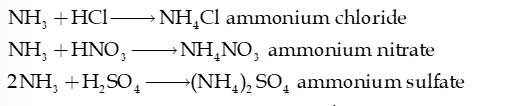
- Ammonia tác dụng với dung dịch muối
Ví dụ: 2NH3 (aq) + 2H2O (l) + MgCl2 (aq) Mg(OH)2 (s) + 2NH4Cl (aq)
b) Tính khử
Trong phân tử ammonia (NH3), nguyên tử nitrogen (N) có số oxi hóa -3 (số oxi hóa thấp nhất của N) nên NH3 thể hiện tính khử
- Ammonia cháy với ngọn lửa màu vàng:
- Trong công nghiệp, khi có xúc tác Pt, ở nhiệt độ 800 – 900oC:
4) Ứng dụng

5) Tổng hợp ammonia
- Tổng hợp NH3 thường thực hiện ở nhiệt độ 380 – 450oC
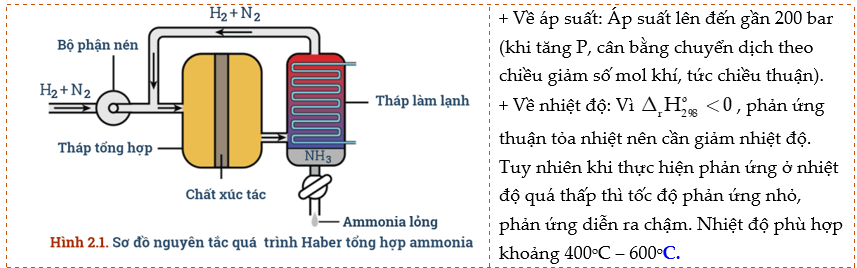
II. MUỐI AMMONIUM
1) Tính tan, sự điện li
- Các muối ammonium: NH4Cl, NH4NO3, NH4ClO4, (NH4)2SO4, NH4H2PO4, (NH4)2HPO4, NH4HCO3, (NH4)2CO3,…
- Hầu hết các muối ammonium đều dễ tan trong nước và phân li hoàn toàn.
Ví dụ: ;
2) Tác dụng với dung dịch kiềm – nhận biết ion ammonium ()
- Muối ammonium tác dụng với dung dịch kiềm (khi đun nóng), tạo khí ammonia (NH3) có mùi khai.
- Ví dụ:
3) Tính chất kém bền nhiệt
Các muối ammonium dễ bị nhiệt phân hủy khi đun nóng tạo khí ammonia (NH3)
Nhận xét: 2 khí khi bay lên gặp nhiệt độ thấp hơn, chúng lại kết hợp với nhau tạo lại tinh thể NH4Cl dạng khói trắng.
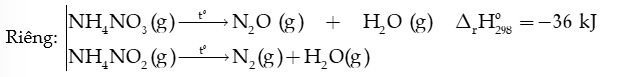
4) Ứng dụng của muối ammonium

- Làm phân bón hóa học, chất phụ gia thực phẩm, thuốc long đờm, thuốc bổ sung chất điện giải, chất đánh sạch bề mặt kim loại,…
PHẦN A. CÁC DẠNG BÀI TẬP TỰ LUẬN
Câu 1: Hoàn thành các phương trình hóa học sau:
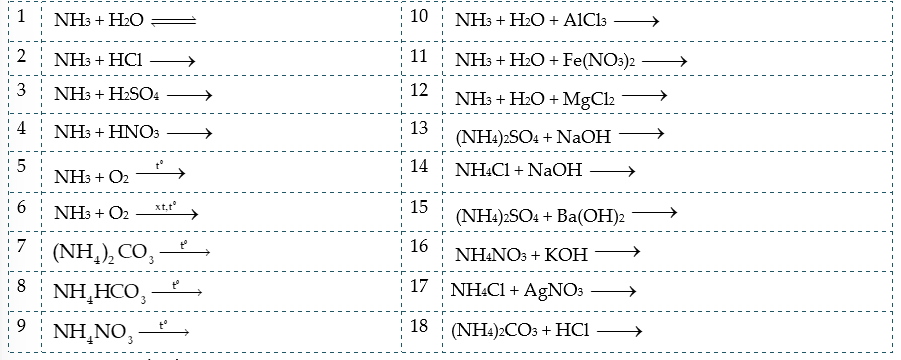
Câu 2: a) Viết cấu hình electron của các nguyên tử H (Z = 1) và N (Z = 7).
b) Trình bày các bước lập công thức Lewis của phân tử ammonia.
Câu 3: Trong công nghiệp, phản ứng giữa ammonia với acid được dùng để sản xuất phân bón:
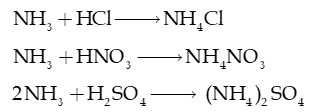
Xác định chất cho, chất nhận proton trong mỗi phản ứng trên. Dùng mũi tên để biểu diễn sự cho, nhận đó.
Câu 4: Hãy giải thích tại sao ammonia tan tốt trong nước.
Câu 5: Trong hai phản ứng oxi hóa ammonia bằng oxygen:
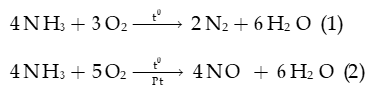
a) Xác định các nguyên tử có sự thay đổi số oxi hóa.
b) Viết quá trình oxi hóa, quá trình khử.
Câu 6: Vận dụng kiến thức về cân bằng hóa học, tốc độ phản ứng, biến thiên enthalpy để giải thích các điều kiện của phản ứng sản xuất ammonia:
a) Nếu tăng hoặc giảm nhiệt độ sẽ ảnh hưởng đến sự chuyển dịch cân bằng và tốc độ phản ứng như thế nào?
b) Nếu giảm áp suất, cân bằng chuyển dịch theo chiều nào? Tại sao không thực hiện ở áp suất cao hơn?
c) Vai trò của chất xúc tác trong phản ứng là gì?
Câu 7: Từ đặc điểm cấu tạo của phân tử ammonia, hãy giải thích tại sao các phân tử ammonia có khả năng tạo liên kết hydrogen mạnh với nhau.
Một số hợp chất của nitrogen với oxygen
I. CÁC OXIDE CỦA NITROGEN
1.Công thức, tên gọi
- Oxide của nitrogen kí hiệu: NOx (là hợp chất gây ô nhiễm không khí điển hình)
- Gồm N2O, NO, NO2, N2O4
|
Oxide |
N2O |
NO |
NO2 |
N2O4 |
|
Tên gọi |
Dinitrogen oxide |
Nitrogen monoxide |
Nitrogen dioxide |
Dinitrogen tetroxide |
2.Ngồn gốc phát sinh NOx trong không khí
- Trong tự nhiên: NOx sinh ra do sự phun trào núi lửa, cháy rừng, mưa dông có sấm sét, phân hủy hợp chất hữu cơ.
- Các hoạt động của con người như: giao thông vận tải, sản xuất công nghiệp, nông nghiệp, nhà máy điện và trong đời sống.
Các khí NOx là khí độc, có thể gây ảnh hưởng sức khỏe con người một trong các nguyên nhân gây mưa acid, sương mù quang hóa, hiệu ứng nhà kính, thủng tầng ozone và hiện tượng phú dưỡng, làm ô nhiễm môi trường.
3. Mưa acid
- Nước mưa thường có pH= 5,6 (chủ yếu do CO2 tan tạo môi trường acid yếu. Khi nước mưa có pH< 5,6 gọi là hiện tượng mưa acid.
+ Tác nhân: do SO2 và NOx phát thải chủ yếu do các hoạt động công nghiệp, nhiệt điện, giao thông, khai thác và chế biến dầu mỏ.
+ Quá trình tạo acid: với sự xúc tác của ion kim loại trong khói bụi, khí SO2 và NOx bị oxi hóa bởi oxygen, ozone, hydrogen peroxide, gốc tự do… rồi hòa tan vào nước tạo thành sulfuric acid và nitric acid
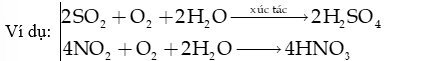
+ Acid trong nước mưa (H2SO4, HNO3) sẽ làm giảm pH của đất và nước, từ đó ảnh hưởng tiêu cực đến cây trồng, thủy sản,…Mưa acid cũng ăn mòn kim loại, biến đổi thành phần vật liệu của các công trình xây dựng.
II. Nitric acid
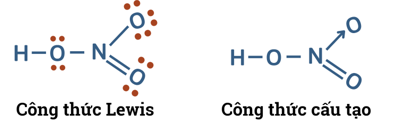
1. Cấu tạo
|
- Nitric acid (HNO3) có công thức: - Đặc điểm cấu tạo của HNO3: + Số oxi hóa của N là +5 + Liên kết O-H phân cực mạnh về phía O. + Liên kết N → O là liên kết cho nhận. |
|
2. Tính chất vật lí
- Nitric acid tinh khiết là chất lỏng, không màu, có khối lượng riêng D =1,53 g/mL
- Nitric acid nóng chảy ở -42oC và sôi ở 83oC.
- Nitric acid bốc khối mạnh trong không khí ẩm và tan vô hạn trong nước.
- Nitric acid thương mại thường có nồng độ 68%, khối lượng riêng là 1,4 g/cm3.
3. Tính chất hóa học
Nitric acid là một acid rất mạnh và có tính oxi hóa rất mạnh.
a) Tính acid
- Nitric acid có khả năng cho proton, thể hiện tính chất của một acid Bronsted-Lowry
+ Làm quỳ tím chuyển sang màu đỏ
+ Tác dụng oxide base, base, muối (xảy ra phản ứng trao đổi)
Fe2O3 + 6HNO3 2Fe(NO3)3 + 3H2O
NaOH + HNO3 NaNO3 + H2O;
- Trong công nghiệp, nitric acid được sử dụng để sản xuất phân bón giàu dinh dưỡng: ammonium nitrate (NH4NO3), calcium nitrate Ca(NO3)2.
NH3 + HNO3 NH4NO3; CaCO3 + 2HNO3 Ca(NO3)2 + CO2 + H2O
b) Tính oxi hóa
- Nitric acid có tính oxi hóa rất mạnh do chứa nguyên tử N có số oxi hóa cao nhất (+5) → HNO3 có khả năng nhận electron.
+ Khi HNO3 đặc, nóng thì luôn giải phóng NO2.
+ Phản ứng với kim loại: 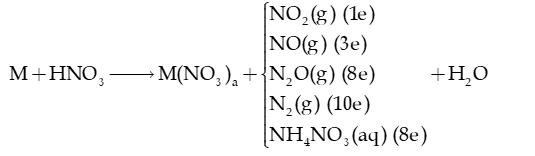
với a là hóa trị cao nhất của kim loại M.
+ Al, Fe, Cr thụ động (không phản ứng) trong HNO3 đặc nguội.
+ Mg, Al, Zn tác dụng với HNO3 loãng có thể tạo các sản phẩm khử là N2, N2O, NH4NO3.
+ Kim loại từ Fe đến Ag tác dụng với HNO3 loãng tạo sản phẩm khử là NO
+ Với Phi kim.
6HNO3 (đặc) + S H2SO4 + 6NO2 (g) + 2H2O
4HNO3 + 3C 4NO (g) + 3CO2 (g) + 2H2O
5HNO3 (đặc) + P H3PO4 + 5NO2 (g) + H2O
+ Với hợp chất:
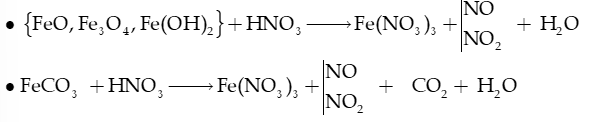
+ Nitric acid đặc tạo với hydrochloric acid đặc hỗn hợp có tính oxi hóa mạnh gọi là nước cường toan –aqua regia, có khả năng hòa tan Au, Pt.
Au + HNO3 + 3HCl AuCl3 + NO + 2H2O
- Do có tính oxi hóa mạnh, nitric acid thường được sử dụng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng trong quặng.
III. HIỆN TƯỢNG PHÚ DƯỠNG
|
- Phú dưỡng: là hiện tượng ao, hồ dư thừa quá nhiều các nguyên tố dinh dưỡng (nitrogen, phosphurus) trong nguồn nước, do tác động từ con người. - Nguyên nhân: + Khi làm lượng nitrogen trong nước đạt 300 μg/L và hàm lượng phosphorus đạt 20 μg/L sẽ gây hiện tượng phú dưỡng. + Nước thải, hay các đầm nuôi trồng thủy sản, sự dư thừa thức ăn chăn nuôi cũng gây ra sự dư thừa dinh dưỡng |
|
- Tác hại: Cản trở sự hấp thụ ánh sáng mặt trời vào nước, giảm sự quang hợp của thực vật thủy sinh. Rong, rêu, tảo phát triển mạnh gây thiếu oxygen, gây mất cân bằng sinh thái. Ngoài ra, xác rong tảo phân hủy gây ô nhiễm môi trường nước, không khí và tạp chất bùn lắng xuống lòng ao.
- Để hạn chế hiện tượng phú dưỡng cần:
+ Tạo điều kiển để nước trong kênh, rạch, ao, hồ được lưu thông.
+ Xử lí nước thải trước khi cho chảy vào ao, hồ,…
+ Sư dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm trong năm để hạn chế rửa trôi ion từ nguồn phân bón dư thừa vào kênh, rạch, ao, hồ.
Phần I. Đề bài
PHẦN A. BÀI TẬP TỰ LUẬN
Câu 1: Hoàn thành các PTHH sau:
a) Tính acid của HNO3
1) HNO3 + NaOH .......................................................................................
2) HNO3 + Cu(OH)2 .......................................................................................
3) HNO3 + Fe(OH)3 .......................................................................................
4) HNO3 + Fe2O3 .......................................................................................
5) HNO3 + CuO > .......................................................................................
6) HNO3 + NaHCO3 .......................................................................................
7) HNO3 + CaCO3 .......................................................................................
8) HNO3 + Na2CO3 .......................................................................................
b) Tính oxi hóa mạnh của HNO3
- Tác dụng với kim loại:
+ Kim loại…….……………… thụ động trong HNO3…………..
+ Với HNO3 đặc, nóng, sản phẩm khử là……………..
+ Mg, Al, Zn tác dụng với HNO3 loãng có thể tạo các sản phẩm khử là………….
+ Kim loại từ Fe đến Ag tác dụng với HNO3 loãng tạo sản phẩm khử là…………
9) HNO3 (đặc) + Cu NO2(g) +
10) HNO3 (loãng) + Cu NO(g)
11) HNO3 (đặc) + Fe
12) HNO3 (loãng) + Fe
13) HNO3 (đặc) + Al NO2(g) +
14) HNO3 (loãng) + Al N2O(g) +
15) HNO3 (loãng) + Al N2(g) +
16) HNO3 (loãng) + Al NH4NO3 +
17) HNO3 (đặc) + Mg NO2(g) +
18) HNO3 + Mg N2(g) +
19) HNO3 + Mg N2O(g) +
20) HNO3 + Mg NH4NO3 +
- Tác dụng với phi kim:
21) HNO3 (loãng) + C
22) HNO3 đặc + C
23) HNO3 (loãng) + S
24) HNO3 (đặc) + S
25) HNO3 (loãng) + P
26) HNO3 (đặc) + P
- Tác dụng với hợp chất:
27) HNO3 (đặc) + FeO
28) HNO3 (loãng) + FeO
29) HNO3 (đặc) + Fe(OH)2
30) HNO3 (loãng) + Fe(OH)2
31) HNO3 (đặc) + Fe3O4
32) HNO3 (loãng) + Fe3O4
33) HNO3 (đặc) + FeCO3
34) HNO3 (loãng) + FeCO3
Câu 2: Viết phương trình phân li và các phương trình hóa học minh họa cho tính chất acid mạnh của nitric acid.
Câu 3: Từ đặc điểm cấu tạo, dự đoán tính tan và tính chất hóa học của nitric acid.
Bài tập về HNO3
1) BẢO TOÀN NGUYÊN TỐ
- Bảo toàn nguyên tố trong 1 chất ta có:
Ví dụ: Trong
- Bảo toàn nguyên tố cho 1 phản ứng
Tổng số mol nguyên tử của một nguyên tố trước và sau phản ứng luôn bằng nhau.
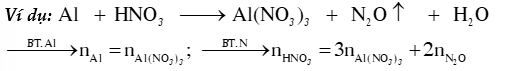
2) BẢO TOÀN ELECTRON (BTE)

- Các dấu hiệu có muối NH4NO3 tạo ra:
+ Hỗn hợp X chứa Mg, Al, Zn khi tác dụng với HNO3 thu được khí và dung dịch Y, cô cạn dung dịch Y thu được m gam muối khan → Thường có tạo ra.
+ Kim loại tác dụng với HNO3 không có khí tạo ra → Sản phẩm khử là NH4NO3.
- Các dấu hiệu không có NH4NO3 tạo ra:
+ Kim loại bài cho không chứa kim loại từ K đến Al.
+ Sản phẩm khử chỉ có khí.
+ Dung dịch sản phẩm tác dụng với dung dịch base không có khí bay ra.
- Dung dịch sản phẩm chứa Fe2+, không chứa Fe3+ khi:
+ Bài cho HNO3 tối thiểu cần dùng; + Dung dịch thu được hoà tan tối đa kim loại.
+ Bài cho sản phẩm thu được chứa kim loại dư.
Ví dụ 1: Hòa tan hết một lượng bột sắt vào dung dịch HNO3 loãng,dư thu được hỗn hợp khí gồm 0,03 mol N2O và 0,02 mol NO. Khối lượng sắt đã bị hòa tan là bao nhiêu (trong các giá trị sau).
A. 5,6g. B. 1,5g. C. 2,8g. D. 4,6g.
Hướng dẫn giải:
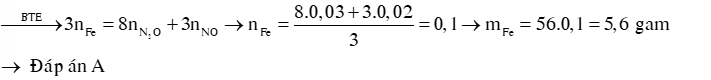
Ví dụ 2: Cho 11,52 gam Mg vào dung dịch HNO3 loãng dư,kết thúc phản ứng thu được dung dịch X và 0,08 mol khí N2O duy nhất. Cô cạn dung dịch X,thu được lượng muối khan là.
A. 73,44 gam. B. 71,04 gam. C. 72,64 gam. D. 74,24 gam
Hướng dẫn giải:
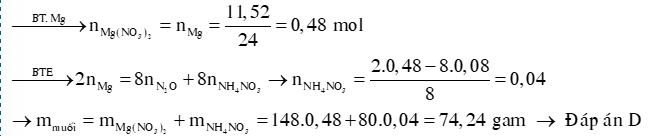
Dạng 1: MỘT KIM LOẠI TÁC DỤNG VỚI HNO3
Câu 1: Hòa tan 16,8 gam Fe bằng dung dịch HNO3 loãng dư, sinh ra V lít khí NO (sản phẩm khử duy nhất,ở đkc). Giá trị của V là
A. 3,7185.
B. 2,479.
C. 7,41.
D. 4,958.
Câu 2: Hòa tan hoàn toàn 2,4 gam kim loại Mg vào dung dịch HNO3 loãng,chỉ thu được V lít khí N2 sản phẩm khử duy nhất (đkc). Giá trị của V là
A. 0,7437 lít.
B. 7,437 lít.
C. 0,4958 lít.
D. 4,958 lít.
Câu 3: Hoàn tan hoàn toàn 1,92 gam Cu bằng dung dịch HNO3, thu được x mol NO2 (là sản phẩm khử duy nhất của N+5). Giá tri của x là
A. 0,06.
B. 0,18.
C. 0,30.
D. 0,12.
Câu 4: Hòa tan hoàn toàn m gam Al bằng dung dịch HNO3 loãng,thu được 0,015 mol khí N2O (sản phẩm khử duy nhất) và dung dịch X. Số mol acid HNO3 đã tham gia phản ứng là
A. 0,17.
B. 0,15.
C. 0,19.
D. 0,12.
Câu 5: Cho m gam Al phản ứng hoàn toàn với dung dịch HNO3 loãng (dư),thu được 4,958 lít khí NO (đkc, sản phẩm khử duy nhất). Giá trị của m là
A. 4,05.
B. 8,10.
C. 2,70.
D. 5,40.
Câu 6: Hoà tan hoàn toàn m gam sắt bằng dung dịch HNO3, sau phản ứng thu được 3,7185 lít NO2 (đkc) là sản phẩm khử duy nhất,dung dịch X và 2,8 gam chất rắn không tan. Giá trị của m là
A. 2,8 gam.
B. 5,6 gam.
C. 7,0 gam.
D. 8,4 gam.
Câu 7: Hoà tan hoàn toàn 4,8 gam Mg bằng dung dịch HNO3 loãng, dư, sau phản ứng chỉ thu được dung dịch X và không thấy xuất hiện khí. Khối lượng muối có trong X là
A. 29,6 gam.
B. 33,6 gam.
C. 44,4 gam.
D. 59,2 gam.
Câu 8: Hòa tan hoàn toàn 14,58 gam Al trong dung dịch HNO3 loãng,đun nóng thì có 2,0 mol HNO3,đã phản ứng,đồng thời có V lít khí N2 thoát ra (đkc). Giá trị của V là
A. 2,479.
B. 3,09875.
C. 0,12395.
D. 1,85925.
Câu 9: Cho 1,68 gam bột Mg tác dụng vừa đủ với 500 mL dung dịch HNO3 nồng độ x mol/L thu được dung dịch Y và 0,4958 lít khí NO (đkc). Giá trị của X là
A. 0,373.
B. 0,36.
C. 0,32.
D. 0,16.
Câu 10: Cho 2,16 gam Al tan hoàn toàn trong dung dịch chứa HNO3 vừa đủ (không thấy khí thoát ra)thu được dung dịch X có chứa m gam muối. Giá trị của m là
A. 17,04.
B. 19,44.
C. 11,19.
D. 13,64.
XÁC ĐỊNH KIM LOẠI, XÁC ĐỊNH SẢN PHẨM KHỬ
Câu 11: Cho 19,2 gam kim loại M tan hết trong dung dịch HNO3 dư thu được 4,958 lít khí NO duy nhất (đkc). Kim loại M là
A. Fe.
B. Mg.
C. Al.
D. Cu.
Câu 12: Hoà tan hết 16,2gam kim loại M bằng dung dịch HNO3 được 6,1975 lít khí X gồm NO và N2 có khối lượng là 7,2g.Biết rằng N+2 và N0 là sản phẩm khử của N+5.Kim loại M là
A. Fe.
B. Al.
C. Zn.
D. Mg.
Câu 13: Hoà tan hết 2,4g kim loại M bằng dung dịch HNO3 dư được 0,4958 lít khí N2 là sản phẩm khử duy nhất đkc. Kim loại M là
A. Zn.
B. Mg.
C. Al.
D. Ca.
Câu 14: Cho 0,04 mol Mg tan hết trong dung dịch HNO3 thấy thoát ra 0,01 mol khí X là sản phẩm khử duy nhất (đkc). Khí X là
A. N2.
B. NH3.
C. NO.
D. N2O.
Câu 15: Cho 13,92 gam Fe3O4 tác dụng hết trong dung dịch HNO3 thấy thoát ra 0,4958 lít khí NxOy (đkc). Khí NxOy là
A. NO.
B. N2O.
C. NO2.
D. N2.
Sulfur và Sulfur dioxide
I. SULFUR
1. Trạng thái tự nhiên
- Sulfur (lưu huỳnh) là nguyên tố phổ biến thứ 17 trên vỏ Trái Đất, có 4 đồng vị bền là .
- Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và hợp chất.
+ Đơn chất sulfur được phân bố ở vùng lân cận núi lửa và suối nước nóng,…
+ Hợp chất sulfur gồm các khoáng vật sulfide (), sulfate (), protein,… như pyrite (FeS2), chalcopyrite (CuFeS2), chu sa, thần sa (HgS), thạch cao (CaSO4.2H2O),…

- Sulfur chiếm khoảng 0,2% khối lượng cơ thể người, có trong thành phần nhiều protein và enzyme.
2. Cấu tạo nguyên tử, phân tử
|
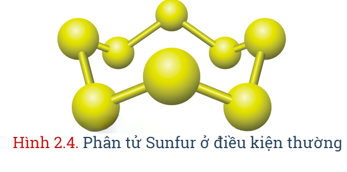
- Nguyên tố sulfur nằm ở ô số 16, nhóm VIA, chu kì 3 trong bảng tuần hoàn.- Nguyên tử sulfur có độ âm điện 2,58; có tính phi kim, tạo ra nhiều hợp chất với các số oxi hóa khác nhau từ -2 đến +6.- Ở dạng phân tử, sulfur gồm 8 nguyên tử liên kết cộng hóa trị với nhau tạo thành mạch vòng (S8). Để đơn giản, người ta dùng kí hiệu S trong các phản ứng hóa học. |
|
3. Tính chất vật lí
- Đơn chất sulfur có 2 dạng thù hình: dạng tà phương (bền ở nhiệt độ thường) và dạng đơn tà.
- Sulfur không tan trong nước, ít tan trong alcohol, tan nhiều trong carbon disulfide (CS2), benzene, dầu hỏa,…
- Nóng chảy ở 1130C và sôi ở 4450C.
4. Tính chất hoá học
a. Tác dụng với hydrogen và kim loại
- Ở nhiệt độ cao, sulfur tác dụng với hydrogen tạo hydrogen sulfide, tác dụng với nhiều kim loại tạo muối sulfide
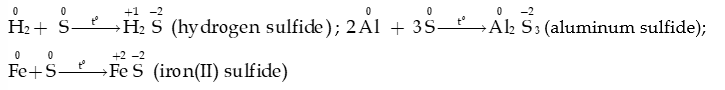
- Sulfur tác dụng với thủy ngân (mercury) ở ngay nhiệt độ thường: phản ứng này được dùng để xử lí mercury rơi vãi.
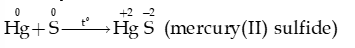
- Trong phản ứng với hydrogen và với kim loại, sulfur thể hiện tính oxi hóa: bị khử từ số oxi hóa 0 về -2.
b. Tác dụng với phi kim
- Ở nhiệt độ thích hợp, sulfur tác dụng với một số phi kim như fluorine, oxygen,…
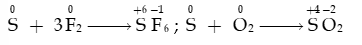
- Trong phản ứng fluorine, oxygen ở trên, sulfur thể hiện tính khử: bị oxi hóa từ số oxi hóa 0 đến +4 hoặc +6.
5. Ứng dụng

- Sản xuất diêm, thuốc nổ, sulfuric acid, thuốc trừ sâu, thuốc diệt nấm, lưu hóa cao su.
II. Sulfur dioxide
1. Tính chất vật lí
- Là chất khí, không màu, mùi hắc, nặng hơn không khí, tan nhiều trong nước.
- Là khí độc.
2. Tính chất hóa học
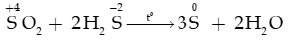
a. Tính oxi hóa ()
- Sulfur dioxide tác dụng với hydrogen sulfide tạo sulfur và nước: phản ứng được dùng để chuyển hóa hydrogen sulfide trong khí thiên nhiên thành sulfur.
- Khí thải có liên quan đến mưa acid: .
b. Tính khử ()
- Sunlfur dioxide là chất khử khi tác dụng với các chất oxi hóa halogen (F2, Cl2,.), potassium permanganate (KMnO4), nitrogen dioxide (NO2),…
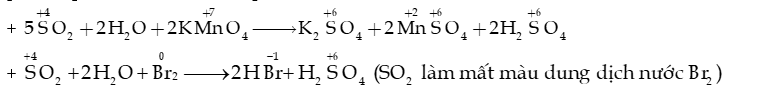
+ Quá trình tạo mưa acid khi không khí bị ô nhiễm bởi sulfur dioxide: SO2 + NO2 SO3 + NO.
3. Ứng dụng
- Dùng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc cho sản phẩm mây tre đan,.
- Là chất trung gian trong quá trình sản xuất sulfuric acid.
4. Sulfur dioxide và ô nhiễm môi trường
a) Nguồn phát sinh sulfur dioxide
|
|
- Nguồn tự nhiên: khí thải núi lửa. - Nguồn nhân tạo: đốt cháy nhiên liệu có chứa tạp chất sulfur (than đá, dầu mỏ), đốt quặng sulfide, đốt sulfur và quặng pyrite. |
b) Tác hại
- Sulfur dioxide là một trong các tác nhân gây ô nhiễm khí quyển, gây mưa acid,…
- Sulfur dioxide gây viêm đường hô hấp ở người.
c) Biện pháp cắt giảm phát thải sulfur dioxide vào khí quyển
- Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo; sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên.
- Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
Phần I. Đề bài
Câu 1: Hoàn thành các phương trình hóa học sau:
|
1 |
H2 + S |
6 |
SO2 + O2 |
|
2 |
Fe + S |
7 |
SO2 + H2S |
|
3 |
Zn + S |
8 |
SO2 + H2O + Br2 |
|
4 |
S + O2 |
9 |
SO2 + H2O + KMnO4 |
|
5
|
S + F2 |
10 |
SO2 + NO2 |
Câu 2: Hãy nêu một số ví dụ về phản ứng thuận nghịch mà em biết.
Câu 3: Phản ứng của sulfur với hydrogen, nhôm (aluminium), thủy ngân (mercury) và fluorine, hãy xác định sự thay đổi số oxi hóa của nguyên tử các nguyên tố. Sulfur là chất oxi hóa hay chất khử?
Câu 4: Hãy xác định sự thay đổi số oxi hóa của nguyên tử các nguyên tố và vai trò của sulfur dioxide trong phản ứng của sulfur dioxide với hydrogen sulfide và nitrogen dioxide.
Câu 5: a) Trình bày ứng dụng của sulfur dioxide. Giải thích.
b) Kể tên một số nguồn phát thải sulfur dioxide vào khí quyển. Em hãy đề xuất một số biện pháp nhằm cắt giảm sự phát thải đó.
Câu 6: Phản ứng oxi hoá là giai đoạn then chốt trong quá trình sản xuất :
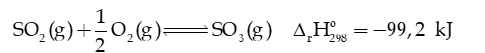
a) Viết biểu thức tính hằng số cân bằng của phản ứng.
b) Hãy cho biết phản ứng trên là toả nhiệt hay thu nhiệt.
c) Trong thực tế, phản ứng được thực hiện ở khoảng 4500C. Tại sao không thực hiện phản ứng ở 250C hoặc 6000C?
Câu 7: Xét phản ứng giữa và trong không khí ô nhiễm sulfur dioxide:
Tính biến thiên enthalpy của phản ứng và cho biết phản ứng trên là toả nhiệt hay thu nhiệt. (Biết nhiệt tạo thành của lần lượt là 33,2 kJ/mol; -296,8 kJ/mol;91,3 kJ/mol và -395,7 kJ/mol.
Câu 8: Cho giá trị enthalpy tạo thành chuẩn của khí SO2 và khí SO3 lần lượt là -296,8 kJ/mol và -395,7 kJ/mol.
Tính giá trị biến thiên enthalpy chuẩn của phản ứng: .
Từ đó, hãy cho biết phản ứng trên có thuận lợi về mặt năng lượng không
Câu 9: Một số quá trình tự nhiên và hoạt động của con người thải hydrogen sulfide vào không khí. Chất này có thể bị oxi hóa bởi oxygen có trong không khí theo hai phản ứng sau:
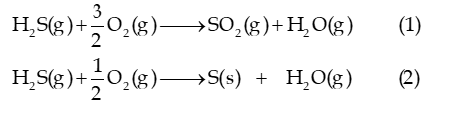
Cho biết giá trị enthalpy tạo thành chuẩn của H2S (g), SO2 (g) và H2O (g) lần lượt là -20,7 kJ/mol; -296,8 kJ/mol và -241,8 kJ/mol.
a) Tính giá trị biến thiên enthalpy chuẩn của mỗi phản ứng trên. Ở 298K, mỗi phản ứng có thuận lợi về mặt năng lượng không?
b) Trong môi trường không khí mà nồng độ oxygen bị suy giảm, hãy dự đoán hydrogen sulfide sẽ chuyển hóa thành sulfur dioxide (SO2) hay sulfur (S). Giải thích
Sulfuric acid và muối Sulfate
I. SULFURIC ACID
1) Cấu tạo phân tử
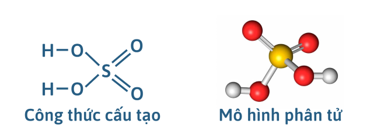
2) Tính chất vật lí
- Ở điều kiện thường, sulfuric acid là chất lỏng sánh như dầu, không màu, không bay hơi.
- Dung dịch H2SO4 98% có khối lượng riêng là 1,84g/cm3, nặng gần gấp hai lần nước.
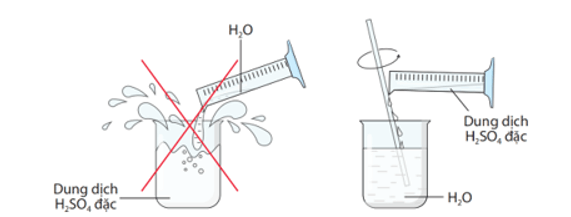
- Tan vô hạn trong nước và tỏa rất nhiều nhiệt.
- Khi pha loãng sulfuric acid đặc, ta cho từ từ acid vào nước, vừa rót vừa khuấy đều (không làm ngược lại).
3) TÍNH CHẤT HÓA HỌC
a) Dung dịch sulfuric acid loãng
- Dung dịch H2SO4 loãng có tính acid mạnh.
+ Làm quỳ tím chuyển sang màu đỏ
+ Tác dụng với base, basic oxide tạo muối sulfate và nước
VD: 2NaOH + H2SO4 Na2SO4 + H2O; CuO + H2SO4 CuSO4 + H2O
+ Tác dụng với muối
Điều kiện: Muối sunfat kết tủa hoặc axit mới dễ bay hơi)
Ví dụ: BaCl2 + H2SO4 (loãng) BaSO4 (s) + 2HCl
Na2CO3 + H2SO4 Na2SO4 + CO2 (g) + H2O
+ Tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học Muối sulfate + H2 (g)
VD: Fe + H2SO4 FeSO4 + H2 (g)
b) Tính oxi hóa mạnh của H2SO4 đặc
- Kim loại (K đến Ag) + H2SO4 đặc Muối sulfate + sản phẩm khử + H2O
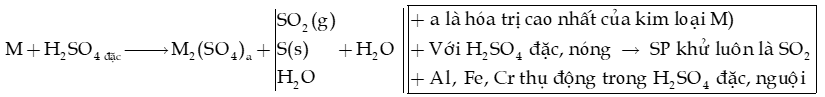
Ví dụ:
- Phi kim (C, S, P,…) + H2SO4 đặc SO2
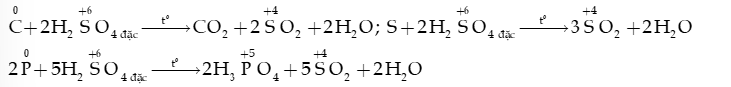
- Hợp chất + H2SO4 đặc: Ví dụ: 2KBr +
c) Tính háo nước của H2SO4 đặc
- Sulfuric acid đặc hấp thụ mạnh nước, nó cũng hấp thụ mạnh các hợp chất carbohydrate Cn(H2O)m, như đường saccharose, glucose và tinh bột…
+ H2SO4 đặc hấp thụ nước của đường saccharose: .
+ Một phần C bị H2SO4 đặc oxi hóa thành CO2:
- Acid H2SO4 đặc có thể dùng làm khô các chất khi không xảy ra phản ứng.
- Khi bị dính dung dịch sulfuric acid đặc, cơ thể người sẽ bị tổn thương nặng do tế bào bị mất nước, bị đốt nóng từ lượng nhiệt phát ra và bị oxi hóa mạnh. Cần thận trọng khi sử dụng dung dịch H2SO4 đặc.
4) Ứng dụng
- Sản xuất phân bón, thuốc nhuộm, giấy, chất dẻo, tơ sợi, chất tẩy rửa, thuốc nổ, chế biến dầu mỏ,.…
5) Cách bảo quản, sử dụng và nguyên tắc xử lí sơ bộ khi bỏng acid.
- Cách bảo quản: đựng trong bình kín, đặt nơi khô ráo, thoáng mát, không đặt gần chất khử, kim loại nhẹ.
- Sử dụng đồ bảo hộ như: áo bảo hộ, găng tay bảo hộ, kính chống thấm,…
- Nguyên tắc xử lí sơ bộ khi bỏng acid: Nhanh chóng bỏ quần áo bị dính acid, sau đó rửa ngay nước sạch khoảng 20 phút. Sau đó nhanh chóng chuyển người bị bỏng đến cơ sở ý tế gần nhất để theo dõi và điều trị.
6) Quy trình sản xuất sulfuric acid trong công nghiệp theo phương pháp tiếp xúc
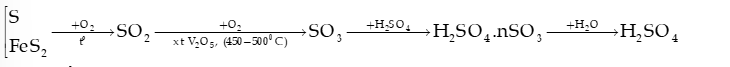
II. MUỐI SULFATE
1) Ứng dụng của một số muối sulfate
- Calcium sulfate (CaSO4) dùng trong vật liệu xây dưng, chất phụ gia,…
- Barium sulfate (BaSO4) dùng làm phụ gia pha màu cho công nghiệp sơn, thủy tinh, gốm sứ,…
- Magnesium sulfate (MgSO4) sản xuất muối tắm, bổ sung magnesium cho tôm, cá, động vật thủy sinh,…
- Ammonium sulfate (NH4)2SO4 là thành phần của thuốc trừ sâu hòa tan, thuốc diệt nấm, phân bón,…
2) Nhận biết sulfate ion
Thuốc thử là ion Ba2+ (trong dung dịch muối barium hoặc dung dịch Ba(OH)2).
Hiện tượng: xuất hiện kết tủa trắng barium sulfate (BaSO4), không tan trong các dung dịch acid và các dung dịch base.
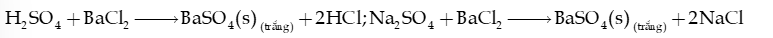
Phần A. BÀI TẬP TỰ LUẬN
Câu 1: Hoàn thành các PTHH sau:
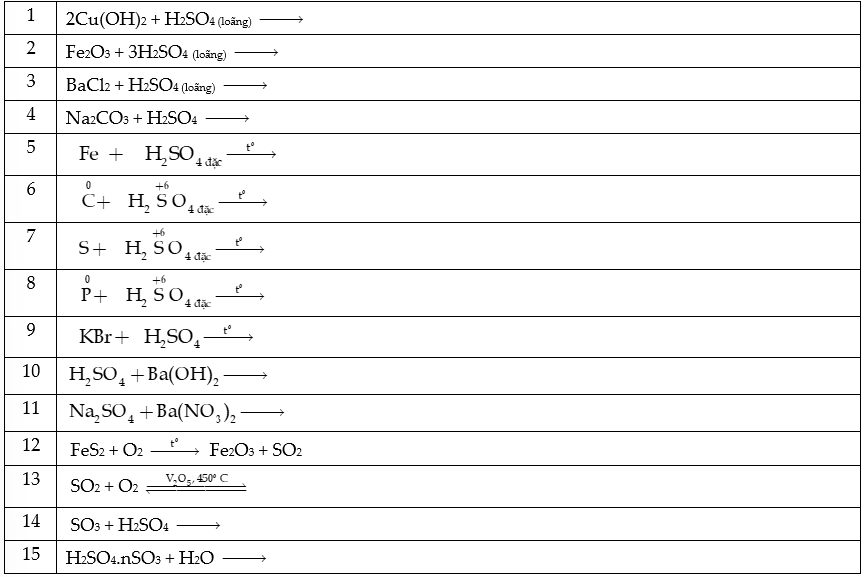
Câu 2: Dung dịch sulfuric acid đặc được dùng làm khô khí ẩm nào trong số các khí sau: CO, H2, CO2, SO2, O2 và NH3? Giải thích?
Câu 3: Trong công nghiệp, copper(II) sulfate được sản xuất bằng cách ngâm đồng phế liệu trong sulfuric acid loãng và sục không khí: (1)
a) Lập phương trình hoá học của phản ứng (1).
b) Tại sao thực tế không sản xuất từ đồng phế liệu theo sơ đồ phản ứng:
Câu 4: Trình bày phương pháp hóa học để phân biệt các cặp dung dịch sau:
a) và NaCl
b) loãng và HCl
Câu 5: Cho các dung dịch không màu của mỗi chất sau: K2CO3, Na2SO4, Ba(NO3)2. Hãy trình bày cách phân biệt các dung dịch đã cho bằng phương pháp hóa học. Viết các phương trình hóa học xảy ra.
Câu 6: Cho các dung dịch không màu của mỗi chất sau đây chứa trong các lọ mất nhãn riêng biệt: Na2CO3, MgSO4, KNO3, NaOH, HCl. Hãy trình bày cách phân biệt các dung dịch đã cho bằng phương pháp hoá học. Viết phương trình hoá học của các phản ứng xảy ra.
Câu 7: Hãy mô tả hiện tượng xảy ra và hoàn thành phương trình hóa học của phản ứng xảy ra khi sulfuric acid loãng:
a) Tiếp xúc với lá kim loại hoạt động bị phủ bởi lớp oxide kim loại (chẳng hạn lá kẽm (zinc) bị phủ bởi lớp zinc oxide).
b) Tiếp xúc với mẩu đá vôi hay mẩu phấn viết bảng.
c) Tiếp xúc với bột baking soda (sodium hydrogencarbonate).
d) Được cho vào nước vôi trong, Ca(OH)2.
Một số dạng bài tập về Sulfuric acid loãng
DẠNG 1: KIM LOẠI TÁC DỤNG VỚI H2SO4 LOÃNG
1) Kim loại tác dụng với dung dịch H2SO4 loãng
- Cu, Ag không tác dụng với dung dịch H2SO4 loãng
- Kim loại đứng trước H + H2SO4 loãng muối sunfat (hóa trị thấp của KL) + (g)
Ví dụ :
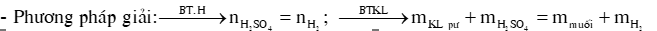
2) Kim loại tác dụng với hỗn hợp acid HCl, H2SO4 loãng
Ví dụ 1: Hòa tan hoàn toàn 5,85 gam bột kim loại M vào dung dịch HCl,thu được 8,05675 lít khí H2 (đkc). Kim loại M là
A. Mg. B. Al. C. Zn. D. Fe.
Hướng dẫn giải:
Cách 1:
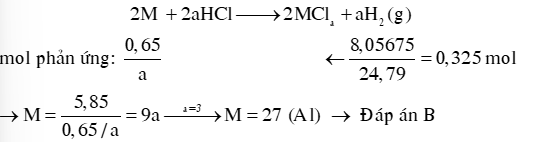
Cách 2:
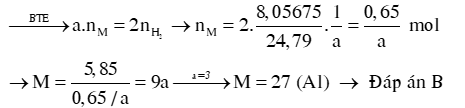
Ví dụ 2: Hòa tan hoàn toàn 2,43 gam hỗn hợp gồm Mg và Zn vào một lượng vừa đủ dung dịch H2SO4 loãng, sau phản ứng thu được 1,2395 lít H2 (đkc) và dung dịch X. Khối lượng muối trong dung dịch X là
A. 4,83 gam. B. 5,83 gam. C. 7,33 gam. D. 7,23 gam.
Hướng dẫn giải:
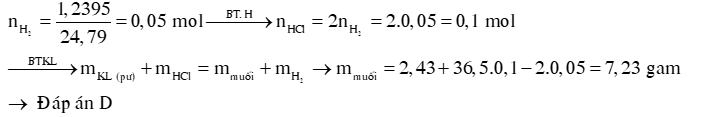
Câu 1: Cho 12,15 gam kim loại M tác dụng hết với H2SO4 loãng dư thoát ra 16,73325 lít khí H2 (đkc). Kim loại M là
A. Fe.
B. Mg.
C. Al.
D. Na.
Câu 2: Cho 13,0 gam một kim loại hóa trị II phản ứng hết với dung dịch H2SO4 dư,thu được 4,958 lít khí H2 (đkc). Kim loại đó là
A. Ca.
B. Zn.
C. Fe.
D. Mg.
Câu 3: Hòa tan hoàn toàn 5,6 gam Fe và 2,4 gam bột kim loại M vào dung dịch H2SO4 loãng, dư,thu được 3,9664 lít khí H2 (đkc). Kim loại M là
A. Al.
B. Mg.
C. Zn.
D. Ca.
Câu 4: Cho m gam hỗn hợp X gồm Cu và Fe vào dung dịch H2SO4 loãng (dư), kết thúc phản ứng thu được 2,479 lít khí H2 (đkc). Khối lượng của Fe trong 2m gam X là
A. 4,48 gam.
B. 11,2 gam.
C. 16,8 gam.
D. 5,6 gam.
Câu 5: Hoà tan hoàn toàn 0,78 gam hỗn hợp kim loại Al, Mg bằng dung dịch H2SO4 loãng, thấy thoát ra 896 mL khí H2 (đkc). Cô cạn dung dịch sau phản ứng thu được bao nhiêu gam muối sulfate khan?
A. 3,84 gam.
B. 4,62 gam.
C. 46,2 gam.
D. 36,5 gam.
Câu 6: Hòa tan hết 8 gam hỗn hợp X gồm Fe và Mg bằng dung dịch H2SO4 loãng, dư thu được 4,958 lít khí H2 ở đkc. Phần trăm khối lượng của Fe trong hỗn hợp X là
A. 30%.
B. 70%.
C. 56%.
D. 44%.
Câu 7: Hoà tan hoàn toàn 6,48 gam hỗn hợp X gồm Mg và kim loại M, có khối lượng bằng nhau, trong dung dịch H2SO4 loãng dư thu được dung dịch Y và 7,80885 lít H2 (đkc). Kim loại M là
A. Ca.
B. Al.
C. Fe.
D. Cu.
Câu 8: Hoà tan 13,44 gam một kim loại M có hóa trị không đổi bằng dung dịch H2SO4 loãng dư, thu được dung dịch Y và V lít khí H2 (đkc). Cô cạn dung dịch Y thu được 36,48 gam muối sulfate khan. Kim loại M là
A. Mg.
B. Al.
C. Fe.
D. Zn.
Câu 9: Cho 10 gam hỗn hợp gồm Fe và Cu tác dụng với dung dịch H2SO4 loãng dư. Sau phản ứng thu được 2,479 lít khí hydrogen (ở đkc), dung dịch X và m gam kim loại không tan. Giá trị của m là
A. 6,4.
B. 3,4.
C. 4,4.
D. 5,6.
Câu 10: Hỗn hợp X gồm 3 kim loại Al, Mg, Fe. Cho 6,7 gam hỗn hợp X tác dụng hết với dung dịch H2SO4 loãng được 6,1975 lít H2 (đkc) và dung dịch Y. Cô cạn dung dịch Y thu được m gam muối khan. Giá trị của m là
A. 6,2.
B. 7,2.
C. 30,7.
D. 31,7.
Câu 11: Cho 12,3 gam hỗn hợp gồm Al, Mg, Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 8,575%, thu được 8,6765 lít khí H2 (đkc). Khối lượng dung dịch thu được sau phản ứng là
A. 412,3 gam.
B. 400 gam.
C. 411,6 gam.
D. 97,80 gam.
Câu 12: Hoà tan hoàn toàn 11,9 gam hỗn hợp kim loại Al, Zn, Fe bằng dung dịch H2SO4 loãng, thấy thoát ra V lít khí H2 (đkc). Cô cạn dung sau phản ứng thu được 50,3 muối sulfate khan. Giá trị của V là
A. 3,7185.
B. 6,1975.
C. 7,437.
D. 9,916.
Câu 13: Hòa tan hoàn toàn 16 gam hỗn hợp Mg, Al, Fe bằng dung dịch H2SO4 loãng vừa đủ, sau phản ứng thấy khối lượng dung dịch tăng thêm 15,2 gam so với ban đầu. Khối lượng muối khan thu được sau khi cô cạn dung dịch là
A. 53,6 gam.
B. 54,4 gam.
C. 92,0 gam.
D. 92,8 gam.
Câu 14: Hoà tan hoàn toàn 15,6 gam kim loại M có hóa trị không đổi vào H2SO4 loãng, dư thu được dung dịch Y và 5,9496 lít H2 (đkc). Kim loại M là
A. Fe.
B. Cu.
C. Zn.
D. Mg.
Câu 15: Cho m gam kim loại M tác dụng hết vơi H2SO4 loãng thu được 5m gam muối. Kim loại M là
A. Mg.
B. Fe.
C. Zn.
D. Al.
Câu 16: Hoà tan hết 7,74 gam hỗn hợp bột Mg,Al bằng 500 mL dung dịch hỗn hợp HCl 1M và H2SO4 0,28M thu được dd X và 9,6681 lít khí H2 (ở đkc). Cô cạn dung dịch X thu được lượng muối khan là
A. 38,93 gam.
B. 103,85 gam.
C. 25,95 gam.
D. 77,86 gam.
Câu 17: Hoà tan hết 14,3g X gồm Mg, Al, Zn, Fe trong 500 mL dung dịch Y gồm HCl 1M và H2SO4 0,5M được dung dịch Z và 12,395 lít H2 (đkc). Khối lượng muối tạo ra sau phản ứng trong dung dịch Z là
A. 55,06g.
B. 58,93g.
C. 48,82g.
D. 56,05g.
Câu 18: Hòa tan hết 14,58 gam hỗn hợp Zn và Mg vào 500 mL dung dịch HCl 0,8M và H2SO4 0,4M thu được dung dịch Y và 9,916 lít H2 (đkc). Cô cạn dung dịch Y thu được m gam muối khan. Giá trị của m là
A. 47,98.
B. 39,38.
C. 48,88.
D. 41,88
DẠNG 2: OXIDE BAZƠ TÁC DỤNG VỚI H2SO4 LOÃNG
1) Oxide base tác dụng với H2SO4 loãng
Oxit ba zơ + H2SO4 loãng muối sunfat +
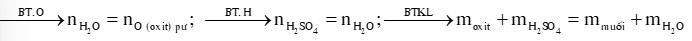
2) Hỗn hợp kim loại, oxide kim loại tác dụng với H2SO4 loãng
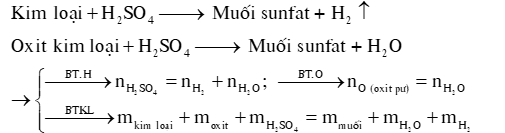
Ví dụ 1: Hoà tan hết 2,81g X gồm Fe2O3; MgO; ZnO và Fe3O4 bằng 500 mL dung dịch H2SO4 0,1M loãng vừa đủ. Sau phản ứng thì khối lượng muối thu được khi cô cạn dung dịch là
A. 4,81g.
B. 6,81g.
C. 3,81g.
D. 5,81g
Hướng dẫn giải:
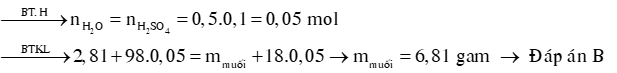
Ví dụ 2: Cho hỗn hợp gồm X gồm 0,3 mol Fe; 0,15 mol Fe2O3 và 0,1 mol Fe3O4 tác dụng vừa đủ với dung dịch H2SO4 loãng thu được dung dịch Y. Cho dung dịch Y tác dụng với dung dịch NaOH dư, lọc kết tủa đem nung trong không khí đến khối lượng không đổi thu được m gam chất rắn Z. Giá trị của m là
A. 70.
B. 65.
C. 72.
D. 75.
Hướng dẫn giải:
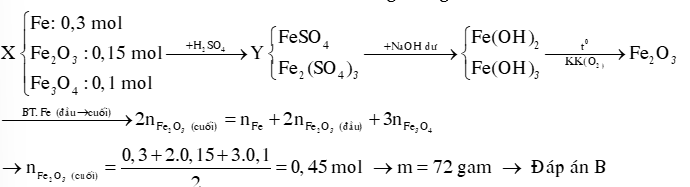
Nhận xét: Với những câu hỏi đơn giản như trên, khi thành thạo ta không cần viết sơ đồ phản ứng và nhìn nhận Bảo toàn nguyên tố (đầu → cuối).
Một số dạng bài tập về Sulfuric acid đặc
DẠNG 1: KIM LOẠI TÁC DỤNG VỚI H2SO4 ĐẶC
- Kim loại (K đến Ag) + H2SO4 đặc Muối sulfate + sản phẩm khử + H2O

|
Ví dụ 1: Cho 2,8 gam Fe kim loại tác dụng hoàn toàn với dung dịch H2SO4 đặc nóng dư, thu được dung dịch X và V lít SO2 ở đkc (sản phẩm khử duy nhất của S+6). Giá trị của V là A. 2,479. B. 1,11555. C. 1,2395. D. 1,85925. Hướng dẫn giải: |
Câu 1: Khi cho 9,6 gam Cu tác dụng với H2SO4 đặc, nóng, lấy dư. Thể tích khí SO2 thu được sau khi phản ứng xảy ra hoàn toàn ở (đkc) là
A. 2,479 lít.
B. 3,7185 lít.
C. 4,958 lít.
D. 7,437 lít.
Câu 2: Cho 5,4 gam Al và 6,4 gam Cu tác dụng với dung dịch H2SO4 đặc nóng, dư, sau phản ứng thu được dung dịch X và V lít (đkc) khí SO2, sản phẩm khử duy nhất. Giá trị của V là
A. 7,437.
B. 3,7185.
C. 12,395.
D. 9,916.
|
Ví dụ 2: Hòa tan hết 10,2 gam hỗn hợp X gồm Al và Mg trong dung dịch H2SO4 đặc, nóng, dư. Kết thúc phản ứng thu được dung dịch Y và 4,958 lít khí Z gồm H2S và SO2 có tỉ lệ mol là 1:1. Cô cạn dung dịch Y thu được m gam muối khan. Giá trị của m là A. 96,6 g. B. 58,2 g. C. 98,6 g. D. 76,6 g Hướng dẫn giải: |
Câu 3: Cho 15,82 gam hỗn hợp Al, Fe, Cu tác dụng hết với dung dịch H2SO4 đặc nóng thu được dung dịch A và 10,6595 lít SO2 (đkc). Cô cạn dung dịch A sẽ thu được số gam muối khan là
A. 57,1.
B. 60,3.
C. 58,81.
D. 54,81.
Câu 4: Hòa tan hỗn hợp A gồm 16,8 gam Fe; 2,7 gam Al và 5,4 gam Ag tác dụng với H2SO4 đặc nóng, dư chỉ thoát ra khí SO2. Số mol H2SO4 tham gia phản ứng là
A. 1,25 mol.
B. 1,20 mol.
C. 1,45 mol.
D. 1,85 mol.
Câu 5: Hòa tan hết 4,20 gam hỗn hợp 3 kim loại X, Y, Z bằng dung dịch H2SO4 đặc, nóng thu được 0,025 mol S (sản phẩm khử duy nhất). Cô cạn dung dịch thu được sau phản ứng thu được m gam muối khan. Giá trị của m là
A. 14,10 gam.
B. 11,40 gam.
C. 6,60 gam.
D. 1,410 gam.
Câu 6: Hòa tan hoàn toàn 11,9 gam Al, Zn vào dung dịch H2SO4 đặc nóng, thu được dung dịch X; 8,4286 lít khí SO2 (đkc) và 0,64 gam S. Tổng khối lượng muối trong X là
A. 50,3 gam.
B. 49,8 gam.
C. 47,15 gam.
D. 45,26 gam.
Câu 7: Cho 7,40 gam hỗn hợp kim loại Ag, Al, Mg tan hết trong dung dịch H2SO4 đặc nóng dư thu được hỗn hợp sản phẩm khử gồm 0,015 mol S và 0,0125 mol H2S và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
A. 12,65 gam.
B. 15,62 gam.
C. 16,52 gam.
D. 15,26 gam.
Câu 8: Cho m gam Cu phản ứng với dung dịch H2SO4 đặc nóng, dư. Lượng khí SO2 bay ra làm mất màu vừa hết 200 mL dung dịch KMnO4 0,2M. Biết S+4 là sản phẩm khử duy nhất của S+6. Giá trị của m là
A. 9,6 g.
B. 6,4 g.
C. 3,2 g.
D. 7,68 g
|
Ví dụ 3: Cho 9 gam hỗn hợp Al và Mg có tỉ lệ số mol Al: Mg = 4: 3 tác dụng với tác dụng với H2SO4 đặc nóng vừa đủ (chứa 0,5625 mol H2SO4) thu được 1 sản phẩm khử duy nhất X. X là A. SO2. B. S. C. H2S. D. H2 Hướng dẫn giải:
|
Câu 9: Hoà tan hoàn toàn 26 gam một kim loại M vào dung dịch H2SO4 đặc nóng thu được 9,916 lít khí SO2 (đkc). Kim loại đã dùng là
A. Mg.
B. Cu.
C. Zn.
D. Fe.
Câu 10: Khi cho 7,2 gam Al tác dụng hết với dung dịch H2SO4 đặc, nóng, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối Al2(SO4 )3, H2O và sản phẩm khử X. Vậy X là
A. SO2.
B. S.
C. H2S.
D. SO2, H2S.
Câu 11: Cho 5,6 gam Fe tác dụng với dung dịch H2SO4 đặc nóng thu được 0,929625 lít khí (đkc) gồm một sản phẩm khử duy nhất. Sản phẩm khử duy nhất đó là
A. SO2.
B. S.
C. H2S.
D. H2.
Câu 12: Cho 9,6g Mg phản ứng hết với dung dịch H2SO4 đặc nóng thấy có 49g H2SO4 tham gia phản ứng tạo ra MgSO4; H2O và SP khử X. Tìm X:
A. SO2.
B. S.
C. H2.
D. H2S.
Câu 13: Cho hỗn hợp X gồm 0,08 mol mỗi kim loại Mg, Al, Zn vào dung dịch H2SO4 đặc, nóng, dư thu được 0,07 mol một sản phẩm khử duy nhất chứa sulfur. Xác định sản phẩm khử?
A. SO2.
B. S.
C. H2S.
D. SO3.
Câu 14: Cho hỗn hợp X gồm 5,4 gam Al, 4,8 gam Mg và 13 gam Zn tác dụng với dung dịch H2SO4 đặc, nóng dư thu được 0,175 mol một sản phẩm khử duy nhất là X. X là
A. SO2.
B. S.
C. H2S.
D. H2.
Câu 15: Cho 1,26 gam hỗn hợp Mg và Al có tỉ lệ mol tương ứng là 3:2 tác dụng với H2SO4 đặc, nóng vừa đủ thu được 0,015 mol một sản phẩm khử có chứa sulfur. Sản phẩm khử đó là
A. SO2.
B. S.
C. H2S.
D. H2.
Câu 16: Hòa tan hoàn toàn 19,2 gam kim loại M trong dung dịch H2SO4 đặc nóng dư thu được khí mùi xốc. Cho khí này hấp thụ hoàn toàn trong 1 lít dung dịch NaOH 0,6 M, sau phản ứng đem cô cạn dung dịch thu được 37,8 gam chất rắn. Kim loại M là
A. Cu.
B. Ca.
C. Fe.
D. Mg.
Câu 17: Hoà tan hoàn toàn 12,1 gam hỗn hợp X gồm Fe và kim loại M hoá trị II trong dung dịch H2SO4 loãng thì thu được 4,958 lít H2 đkc. Cũng cho lượng hỗn hợp trên hoà tan hoàn toàn vào H2SO4 đặc, nóng, dư thì thu được 6,1975 lít khí SO2 đkc. Kim loại M là
A. Fe.
B. Zn.
C. Ca.
D. Al
|
Ví dụ 4: Hòa tan 18,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch H2SO4 đặc, nóng dư thu được 8,6765 lít SO2 (đkc) và dung dịch Y. Phần trăm khối lượng của Fe trong hỗn hợp X là A. 60,87%. B. 45,65%. C. 53,26%. D. 30,43%. Hướng dẫn giải:
|
Nitrogen và hợp chất của nitrogen
A. CÁC DẠNG CÂU HỎI TỰ LUẬN
DẠNG 1: BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG
Cho phản ứng: aA + bB mM + nN
Biến thiên enthalpy chuẩn của phản ứng, tính theo nhiệt tạo thành :
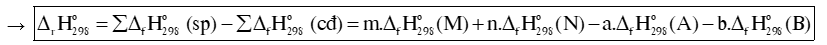
Biến thiên enthalpy chuẩn của phản ứng, tính theo năng lượng liên kết:
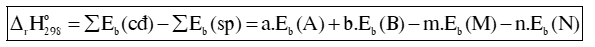
Trong đó: Eb (A), Eb (B), Eb (M), Eb (N) lần lượt là tổng năng lượng liên kết của tất cả các liên kết trong phân tử A, B, M, N.
Câu 1: Cho phản ứng: 3H2 (g) + N2 (g)⇌ 2NH3. Biến thiên enthalpy của phản ứng tạo thành ammonia (NH3) ở 298K là -105 kJ, cho biết năng lượng liên kết Eb (N≡N) = 945 kJ/mol; Eb (N – H) = 391 kJ/mol, biến thiên enthalpy của phản ứn ở 298K là -105 kJ.
a) Cho biết phản ứng trên là phản ứng tỏa nhiệt hay thu nhiệt.
b) Tính năng lượng liên kết Eb (H – H).
Hướng dẫn giải:
a) Ta thấy = -105kJ < 0 → Phản ứng tỏa nhiệt.
b) Biến thiên enthalpy của phản ứng tạo thành ammonia (NH3):
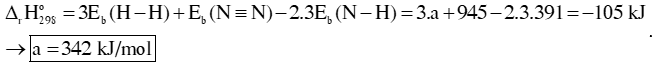
Câu 2: Cho cân bằng hoá học sau:
a) Hãy tính của phản ứng, cho nhiệt tạo thành của NO2 (g) và N2O4 (g) lần lượt là 33,2 kJ/mol và 11,1 kJ/mol.
b) Cân bằng sẽ chuyển dịch theo chiều nào khi giảm nhiệt độ của hệ?
Hướng dẫn giải:
a) =11,1-2.33,2 = -55,3 kJ/mol
b) Phản ứng trên là phản ứng tỏa nhiệt, khi giảm nhiệt độ cân bằng chuyển dịch theo chiều thuận.
Câu 3: Dựa vào năng lượng liên kết ở bảng:
|
Liên kết |
N≡N |
O = O |
N = O |
|
Eb (kJ/mol) |
945 |
498 |
a |
Biến thiên enthalpy của phản ứng là 229 kJ.
N2(g) + O2(g) 2NO(g)
Hướng dẫn giải:
N2 (g) + O2 (g) 2NO (g)
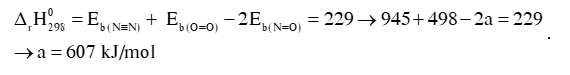
Câu 4: Cho phản ứng sau:
Hãy xác định:
a) Biến thiên enthalpy của phản ứng, cho nhiệt tạo thành chuẩn của S8 (g) và H2S (g) lần lượt là 101,3 kJ/mol -20,6 kJ/mol.
b) Năng lượng liên kết trong phân tử S8 (g), biết và .
Hướng dẫn giải:
a) =-20,6 - 101,3 = -33,2625 kJ
b)
Câu 5: Cho bảng giá trị năng lượng của một số liên kết ở điều kiện chuẩn sau:
|
Liên kết |
H – H |
N – H |
N ≡ N |
|
Năng lượng liên kết (kJ/mol) |
a |
389 |
946 |
Biến thiên enthalpy chuẩn của phản ứng sau theo năng lượng liên kết là -80 kJ.
Tính a.
Hướng dẫn giải:
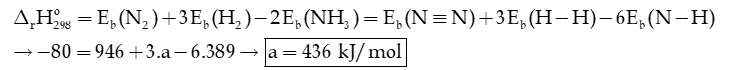
Câu 6: Cho phương trình hóa học của phản ứng:
Biết enthalpy tạo thành chuẩn của các chất được trình bày trong bảng sau:

a) Tính nhiệt đốt cháy 312 gam hỗn hợp lỏng gồm N2O4 và N2H4.
b) Tại sao hỗn hợp lỏng (N2O4 và N2H4) được dùng làm nhiên liệu tên lửa?
Hướng dẫn giải:
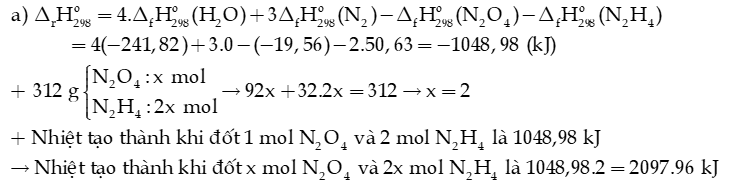
b) Hỗn hợp lỏng (N2O4 và N2H4) được dùng làm nhiên liệu tên lửa vì khi xảy ra phản ứng nó tỏa ra lượng nhiệt rất lớn.
DẠNG 2: HẰNG SỐ CÂN BẰNG, HIỆU SUẤT PHẢN ỨNG.
1) Hằng số cân bằng của phản ứng: aA + bB ⇌ cC + dD
2) Hiệu suất của phản ứng tổng hợp NH3.
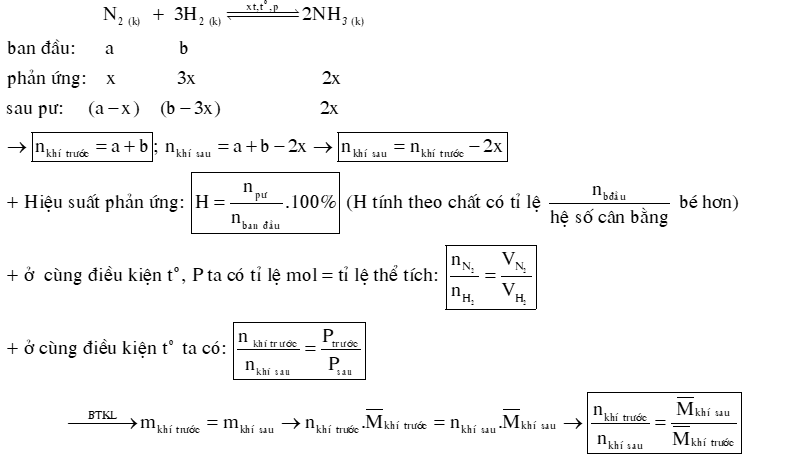
Câu 7: Một bình kín có dung tích là 2 L chứa 3 mol H2 và 1 mol N2 ở nhiệt độ xác định. Ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Tính hằng số cân bằng KC của phản ứng xảy ra trong bình.
Hướng dẫn giải:
Sulfur và hợp chất của Sulfur
A. CÁC DẠNG CÂU HỎI TỰ LUẬN.
Câu 1: Hoàn thành các phương trình hóa học sau:
|
1 |
H2 + S |
|
CuO + H2SO4 |
|
2 |
H2S + SO2 |
|
Fe + H2SO4 đặc |
|
3 |
Fe + S |
|
FeS2 + O2 |
|
4 |
S + O2 |
|
H2SO4 đặc + C |
|
5 |
S + F2 |
|
H2SO4 đặc + KBr |
|
6 |
SO2 + O2 |
|
H2SO4 + K2CO3 |
|
7 |
SO2 + H2S |
|
H2SO4 (đặc) + Fe2O3 |
|
8 |
SO2 + H2O + Br2 |
|
H2SO4 + Mg(OH)2 |
|
9 |
SO2 + H2O + KMnO4 |
|
H2SO4 + SO3 |
|
10 |
Fe + H2SO4 loãng |
|
H2SO4.nSO3 + H2O |
Câu 2: Mưa acid gây phá hủy rộng lớn cho rừng cây khắp nơi trên thế giới. Mưa acid xảy ra chủ yếu do sự phóng thích SO2 từ sự nung quặng sunfua và sự đốt cháy các nhiên liệu. Trong không khí, một phần SO2 chuyển thành SO3 được hấp thụ trong nước mưa chuyển thành sunfuric acid. Giả sử rằng cứ 8.104 phân tử nước (chứa trong 5,4.104 lít nước của một trận mưa) hấp thụ một phân tử SO3 và toàn bộ sunfuric acid đều tan trong lượng mưa nêu trên.
Cho H = 1,008; O = 16,00; S = 32,06; NA = 6,022x1023
Giả sử khối lượng riêng của nước (lỏng) là 1,00 g/mL
Hướng dẫn giải
Khối lượng nước là 5,4.104.1000 = 5,4.107 gam

Câu 3: Hiện nay, mưa acid, hiệu ứng nhà kính và thủng tầng ozone là ba thảm hoạ môi trường toàn cầu. Mưa acid tàn phá nhiều rừng cây, các công trình kiến trúc bằng đá và kim loại. Tác nhân chủ yếu gây ra mưa acid là sulfur dioxide.
a) Trong khí quyển, SO2 chuyển hoá thành H2SO4 trong nước mưa theo sơ đồ sau:
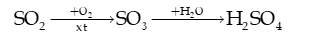
Viết các phương trình hoá học.
b) Một cơn mưa acid xuất hiện tại một khu công nghiệp diện tích 10 km2 với lượng mưa trung bình 80 mm (lượng nước mưa trên 1 m2). Hãy tính:
- Thể tích nước mưa đã rơi xuống khu công nghiệp.
- Khối lượng H2SO4 trong lượng nước mưa, biết nồng độ H2SO4 trong nước mưa là .
c) Lượng acid trong nước mưa có thể ăn mòn các công trình bằng đá vôi.
- Viết 1 phương trình hoá học minh hoạ.
- Khối lượng tối đa bị ăn mòn bởi lượng acid trên.
d) Em hãy tìm hiểu về nguyên nhân phát sinh các khí gây mưa acid và đề xuất giải pháp hạn chế.
Hướng dẫn giải:
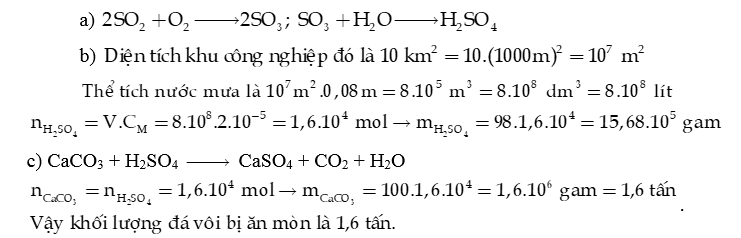
B. CÁC DẠNG CÂU HỎI TRẮC NGHIỆM.
Câu 4: Kim loại nào sau đây tác dụng với sulfur ở nhiệt độ thường?
A. Al.
B. Fe.
C. Hg.
D. Cu.
Câu 5: Dung dịch sulfuric acid loãng tác dụng với Fe tạo thành khí H2 và:
A. FeSO4.
B. Fe2(SO4)3.
C. Fe(OH)2.
D. Fe(OH)3.
Câu 6: Số oxi hóa có thể có của sulfur trong hợp chất là
A. 0, 2, 4, 6.
B. -2, 0, +4, +6.
C. 1, 3, 5, 7.
D. -2, +4, +6.
Câu 7: Thuốc thử để nhận biết sulfuric acid và dung dịch muối sulfate là
A. AgNO3.
B. NaCl.
C. BaCl2.
D. KNO3.
Câu 8: Cho vài giọt dung dịch BaCl2 vào dung dịch nào sau đây sẽ tạo kết tủa trắng?
A. NaCl.
B. Na2SO4.
C. NaNO3.
D. NaOH.
Câu 9: Dung dịch H2SO4 loãng phản ứng được với tất cả các kim loại thuộc dãy nào sau đây?
A. Cu, Na.
B. Ag, Zn.
C. Mg, Al.
D. Au, Pt.
Câu 10: Acid H2SO4 loãng tác dụng với Fe tạo thành sản phẩm là
A. Fe2(SO4)3 và H2.
B. FeSO4 và H2.
C. FeSO4 và SO2.
D. Fe2(SO4)3 và SO2.
Câu 11: Chất X tan trong nước và tác dụng được với dung dịch H2SO4 loãng. Chất X là chất nào sau đây?
A. FeS.
B. PbS.
C. Na2S.
D. CuS.
Câu 12: Kim loại nào sau đây tác dụng với dung dịch H2SO4 loãng và dung dịch H2SO4 đặc nóng cho 2 loại muối khác nhau?
A. Fe.
B. Mg.
C. Cu.
D. Ag.
Câu 13: Phản ứng nào sau đây sulfur đóng vai trò là chất oxi hóa?
A. S + O2 SO2
B. S + 2Na Na2S
C. S + 2H2SO4 (đ) 3SO2 + 2H2O
D. S + 6HNO3 (đ) H2SO4 + 6NO2 + 2H2O
Câu 14: Oleum có công thức tổng quát là
A. H2SO4.nSO2.
B. H2SO4.nH2O.
C. H2SO4.nSO3.
D. H2SO4 đặc.
Câu 15: Người ta nung nóng Cu với dung dịch H2SO4 đặc, nóng. Khí sinh ra có tên gọi là
A. Khí oxygen.
B. Khí hydrogen.
C. Khí carbonic.
D. Khí sunfurơ.
Câu 16: Trường hợp nào sau đây có phản ứng?
A. H2SO4 loãng + Cu.
B. H2SO4 loãng + S.
C. H2SO4 đặc, nguội + Al.
D. H2SO4 đặc + Na2CO3.
Câu 17: Nhóm gồm tất cả các kim loại tan trong dung dịch H2SO4 đặc nóng nhưng không tan trong dung dịch H2SO4 loãng là
A. Hg, Ag, Cu.
B. Al, Fe, Cr.
C. Ag, Fe, Pt.
D. Al, Cu, Au.
Câu 18: Cho chất rắn nào sau đây vào dung dịch H2SO4 đặc thì xảy ra phản ứng oxi hoá khử?
A. KBr.
B. NaCl.
C. CaF2.
D. CaCO3.
Câu 19: Khi pha loãng dung dịch sulfuric acid đặc cần tuân thủ thao tác nào sau đậy để đảm bảo an toàn?
A. Rót từ từ acid vào nước.
B. Rót nhanh acid vào nước.
C. Rót từ từ nước vào acid.
D. Rót nhanh nước vào acid.
Câu 20: Phản ứng điều chế xảy ra ở điều kiện nào sau đây?
A. Nhiệt độ phòng.
B. Đun nóng đến .
C. Đun nóng đến và có mặt chất xúc tác V2O5.
D. Nhiệt độ phòng và có mặt chất xúc tác V2O5.
Câu 21: Dãy gồm tất cả các chất đều tác dụng với dung dịch H2SO4 loãng là
A. Fe3O4, BaCl2, NaCl, Al, Cu(OH)2.
B. Fe(OH)2, Na2CO3, Fe, CuO, NH3.
C. CaCO3, Cu, Al(OH)3, MgO, Zn.
D. Zn(OH)2, CaCO3, CuS, Al, Fe2O3.
Câu 22: H2SO4 đặc, nguội không tác dụng được với tất cả các kim loại thuộc nhóm nào?
A. Al, Mg, Fe.
B. Fe, Al, Cr.
C. Ag, Cu, Au.
D. Ag, Cu, Fe.
Câu 23: H2SO4 đặc nóng không tác dụng với chất nào sau đây?
A. Fe.
B. NaCl rắn.
C. Ag.
D. Au.
Câu 24: Dãy chất nào sau đây phản ứng được với dung dịch sulfuric acid đặc nguội?
A. Au,.
B. Mg, Fe.
C. Zn, NaOH.
D. Al, S.
Câu 25: Cho phản ứng Al + H2SO4 đặc Al2(SO4)3 + SO2↑ + H2O. Hệ số cân bằng của H2SO4 là
A. 4.
B. 8.
C. 6.
D. 3.
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm Chuyên đề dạy thêm Hóa học lớp 11 các chương hay khác:
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều

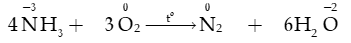


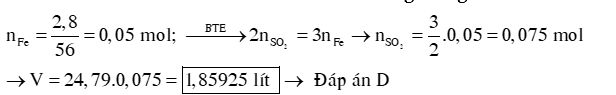
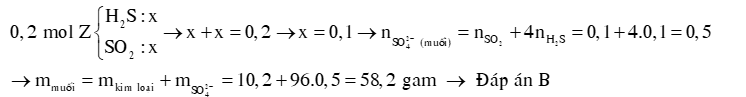
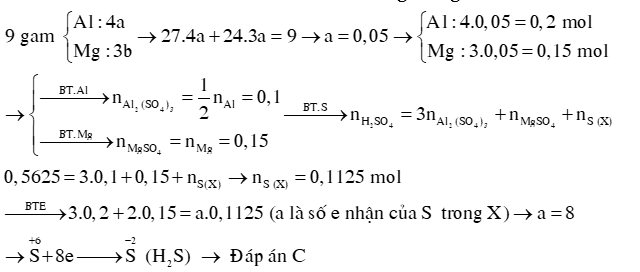
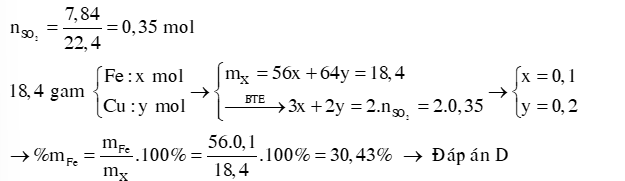
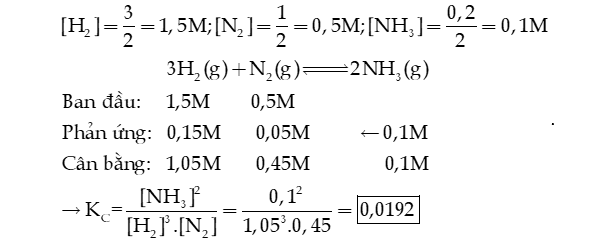



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

