Chuyên đề Dẫn xuất halogen - alcohol - phenol lớp 11
Tài liệu chuyên đề Dẫn xuất halogen - alcohol - phenol Hóa học lớp 11 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa học 11.
Chuyên đề Dẫn xuất halogen - alcohol - phenol lớp 11
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thử chuyên đề Hóa học 11 KNTT
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa học 11 (cả 3 sách) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
Dẫn xuất halogen
1) Khái niệm: Khi thay thế nguyên tử hydrogen của phân tử hydrocarbon bằng nguyên tử halogen ta được dẫn xuất halogen của hydrocarbon (gọi tắt là dẫn xuất halogen).
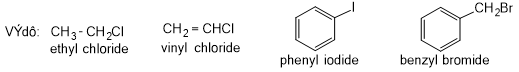
Ví dụ: CH3Cl, CH2Cl2, CH2 = CHCl; C6H5Cl,…
2) Phân loại
- Theo mạch C:
+ Dẫn xuất halogen no: Ví dụ: CH3Cl; CH3Br; CH3F; CH3Br; CH2-Cl-CH2Cl; CCl4,…
+ Dẫn xuất halogen không no: Ví dụ: CF2=CF2, CH2=CH-Cl, CH≡C-CH2Cl, …
- Theo bậc của carbon: bậc của dẫn xuất halogen là bậc của nguyên tử C liên kết trực tiếp với nguyên tử halogen.
+ Dẫn xuất halogen bậc I: Ví dụ: CH3CH2Cl; CH3-CH2-CH2-Br
+ Dẫn xuất halogen bậc II: Ví dụ: CH3CHClCH3.
+ Dẫn xuất halogen bậc III: Ví dụ: (CH3)C-Br.
3) Đồng phân, danh pháp
a) Đồng phân: Dẫn xuất halogen có đồng phân mạch carbon và đồng phân vị trí nhóm chức.
b) Danh pháp
- Tên thông thường:
CHCl3 (chloroform); CHBr3(bromoform); CHI3 (iodoform); CCl4 (carbon tetrachloride).
- Tên gốc-chức = Tên gốc hydrocarbon + halide
+ Tên gốc hydrocarbon:
|
CH3 methyl |
CH3-CH2- ethyl |
CH3-CH2-CH2- propyl |
CH2=CH- vinyl |
CH≡C- acetylene |
phenyl |
benzyl |
|
-CH2-: methylene |
-CH2-CH2-: ethylene |
CH2=CH-CH2 allyl |
|||||
+ Tên halide:
-F: fluoride |
-Cl: chloride |
-Br: bromide |
I: Idodide |
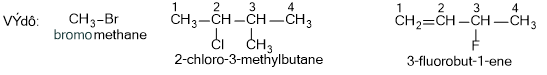
- Tên thay thế:
4) Tính chất vật lí
- Ở điều kiện thường các dẫn xuất monohalogen có phân tử khối nhỏ như CH3Cl, CH3Br, C2H5Cl là chất khí. Các dẫn xuất halogen có phân tử khối lớn hơn thương ở thể lỏng (như CH3I, CH2Cl2, CHCl3, CCl4, C6H5Br (phenyl bromide, C6H5CH2Cl (benzen chloride),…
5) Tính chất hóa học
a) Phản ứng thế nguyên tử halogen bằng nhóm OH
RX + NaOH ROH + NaX (thủy phân dẫn xuất halogen)
(X là F, Cl, Br, I liên kết với nguyên tử C no)
Ví dụ: CH3CH2Br + NaOH CH3CH2OH + NaBr
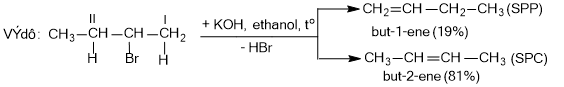
b) Phản ứng tách hidro halogenua (HX)
Ví dụ: H-CH2-CH2-Cl CH2=CH2 + HCl
(HCl tạo ra có phản ứng với dung dịch NaOH: HCl + NaOH NaCl + H2O)
- PTTQ: (đối với dẫn xuất halogen no, đơn chức, mạch hở)
CnH2n+1X + KOH CnH2n + KX + H2O
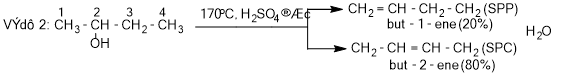
- Quy tắc tách Zaitsev (Zai-xep): Khi tách HX khỏi dẫn xuất halogen, nguyên tử halogen X ưu tiên tách cùng nguyên tử hydrogen ở carbon bên cạnh bậc cao hơn (là sản phẩm chính).
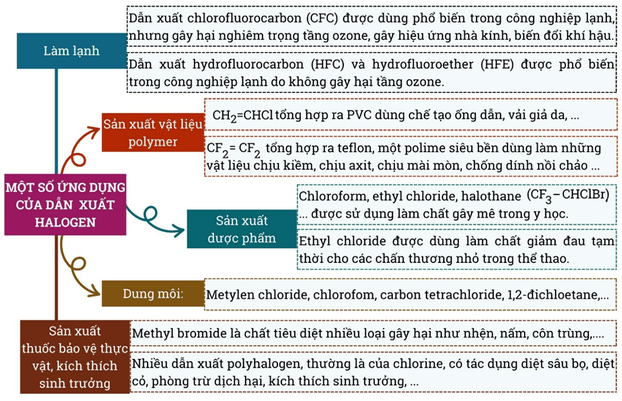
6) Ứng dụng
A. CÁC DẠNG CÂU HỎI TỰ LUẬN
Câu 1: Gọi tên theo danh pháp thay thế các dẫn xuất halogen sau đây
Câu 2: R-45B là một chất làm lạnh thế hệ mới sẽ thay thế các chất làm lạnh không thân thiện với môi trường, ảnh hương đến tầng ozone. R-45B chứa hỗn hợp gồm difluoromethane và 2,3,3,3-tetrafluoropropene. Hãy viết công thức cấu tạo các dẫn xuất halogen có trong R-45B.
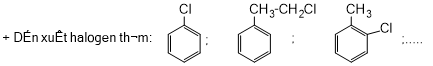
Câu 3: Gọi tên gốc chức các dẫn xuất halogen sau:
a) CH3-CH2-Br; |
b) CH2 = CH-Cl; |
c) CH3I; |
d) CH2Cl-CH2Cl |
e) CH2=CH-CH2Br |
f) |
g) |
h) CH2F2 |
Câu 4: Viết công thức cấu tạo các dẫn xuất halogen có tên gọi sau đây:
a) 2-bromopropan; b) chloroethane;
c) 2-bromo-3-methylpentane; d) 2-chloro-2-methylbutane.
Câu 5: Viết công thức cấu tạo các dẫn xuất halogen có tên gọi sau đây:
a) iodoethane: b) trichloromethane;
c) 2-bromopentane; d) 2-chloro-3-methylbutane.
Câu 6: a)Các nhà hoá học đã tìm ra một số dẫn xuất halogen không chứa chlorine như: CF3CH2F, CF3CH2CF2CH3,. đang được sử dụng trong công nghiệp nhiệt lạnh, vì sự phân huỷ các hợp chất này nhanh chóng sau khi phát tán vào không khí nên ảnh hưởng rất ít đến tầng ozone hay sự ấm lên toàn cầu thấp. Gọi tên theo danh pháp thay thế 2 hợp chất đó.
b) Vẽ công thức cấu tạo của hợp chất có tên: 4-chloro-3,4-dimethylpent-2-ene.
c) Viết đồng phân và gọi tên các dẫn xuất halogen bậc I của hợp chất có công thức C4H9Br.
Câu 7: Viết các đồng phân cấu tạo của dẫn xuất halogen có công thức phân tử C4H9Cl và gọi tên theo danh pháp thay thế.
Câu 8: Viết công thức cấu tạo và gọi tên thay thế của các hợp chất có cùng công thức phân tử là C5H11Cl.
Câu 9: Viết công thức cấu tạo và gọi tên thay thế của các dẫn xuất halogen có cùng công thức phân tử C3H6Cl2.
Câu 10: Cho các chất có công thức: CH3F, CH3Cl, CH3Br, CH3I và nhiệt độ sôi của chúng (không theo thứ tự) là 42 °C, 4 °C, -24 °C, -78°C. Hãy dự đoán nhiệt độ sôi tương ứng với mỗi chất trên. Giải thích.
Câu 11: Viết phương trình hoá học của phản ứng xảy ra khi đun các hợp chất sau với dung dịch sodium hydroxide: CH3Cl, CH3CHClCH3, C6H5CH2Br và CH₂=CHCH₂Cl.
Câu 12: Viết phương trình hóa học xảy ra khi đun nóng 2-chloropropane (CH3CHClCH3) với sodium hydroxide trong ethanol.
Câu 13: Đun nóng hợp chất A có công thức phân tử C5H11Br trong môi trường kiềm và ethanol, thu được sản phẩm chính là 2-methylbut-2-ene. Hãy xác định các công thức cấu tạo có thể có của A.
Câu 14: Thực hiện phản ứng tách hydrogen bromide của hợp chất 2-bromo-2-methylbutane thu được những alkene nào? Xác định sản phẩm chính của phản ứng.
Câu 15: Viết phương trình hoá học của phản ứng xảy ra khi đun các dẫn xuất halogen, sau với dung dich potassium hydroxide trong ethanol.
a)2-chloropropane
b) 2-bromo-2-methylbutane. Gọi tên các sản phẩm sinh ra.
Alcohol
I. KHÁI NIỆM, DANH PHÁP
1) Khái niệm
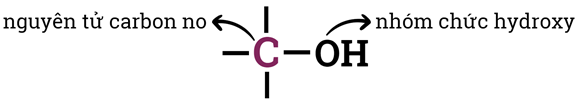
- Alcohol là những hợp chất hữu cơ trong phân tử chứa nhóm hydroxy (-OH) liên kết với nguyên tử carbon no.
2) Phân loại
a)Alcohol no, đơn chức, mạch hở: CnH2n+1OH (n≥1).
Trong phân tử có một nhóm -OH liên kết với gốc alkyl.
Ví dụ: CH3-OH (methanol); CH3-CH2-OH (ethanol)
b) Alcohol không no, có 1 liên kết đôi, đơn chức, mạch hở: CnH2n-1OH (n ≥ 2).
Ví dụ: CH2=CH-CH2OH: allyl alcohol
c) Alcohol thơm, đơn chức:
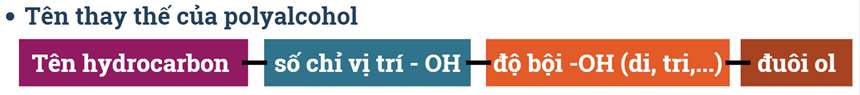
d) Alcohol đa chức (polyalcohol): chứa 2 hay nhiều nhóm -OH.
Ví dụ: HO-CH2-CH2-OH: ethylene alcohol; HO-CH2-CH(OH)-CH2OH: glycerol
3) Bậc của alcohol
Là bậc của nguyên tử carbon (C) liên kết với nhóm hydroxy (-OH).
Ví dụ: CH3–CH2–CH2–CH2OH: alcohol bậc I;
CH3–CH2–CH(CH3) –OH: alcohol bậc II; CH3–C(CH3)2–OH: alcohol bậc III
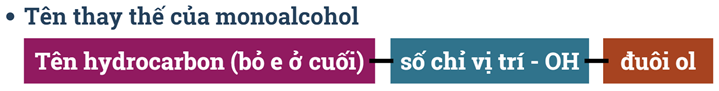
4) Danh pháp
a) Danh pháp thay thế
- Chọn mạch chính và đánh số C
+ Chọn mạch C dài nhất, nhiều nhánh nhất, chứa liên kết bội (nếu có).
+ Đánh số ưu tiên từ phía gần: -OH > liên kết bội > nhánh.
+ Nếu nhóm -OH chỉ có một vị trí duy nhất thì không cần số chỉ vị trí nhóm -OH.
Ví dụ: CH3-CH2-CH2-CH2-OH: butan-1-ol; CH3-CH2-CH(OH)-CH3: butan-2-ol
CH3-CH(CH3)-CH2-CH2-OH: 3-methylbutan-1-ol
Ví dụ: HO-CH2-CH2-OH: ethane-1,2-diol; HO-CH2-CH(OH)-CH2OH: propane-1,2,3-triol
b) Tên thường
CH3-OH: methyl alcohol |
CH3-CH(CH3)-OH: isopropyl alcohol |
C2H5-OH: ethyl alcohol |
HO-CH2-CH2-OH: ethylene glycol |
CH3CH2CH2OH: propyl alcohol |
HO-CH2-CH(OH)-CH2OH: glycerol |
II. ĐẶC ĐIỂM CẤU TẠO
Trong phân tử alcohol, các liên kết O-H và C-O đều phân cực về phía nguyên tử oxygene (do O có độ âm điện lớn → Trong các phản ứng hóa học, alcohol thường bị phân cắt ở liên kết O-H hoặc C-O. |
III. TÍNH CHẤT VẬT LÍ
- Ở điều kiện thường, các alcohol no, đơn chức từ C1 đến C12 ở trạng thái lỏng, các alcohol từ C13 trở lên ở trạng thái rắn
- Ethylene glycol, glycerol là chất lỏng sánh, nặng hơn nước và có vị ngọt.
- Alcohol có nhiệt độ sôi cao hơn các hydrocarbon, dẫn xuất halogene có phân tử khối tương đương (do có liên kết hydrogen liên phân tử)
- Alcohol có khối lượng phân tử nhỏ, tan tốt trong nước, độ tan giảm khi khối lượng phân tử tăng (do có liên kết hydrogen với nước).
IV. TÍNH CHẤT HÓA HỌC
1) Phản ứng thế nguyên tử H của nhóm -OH
Alcohol phản ứng với các kim loại mạnh như sodium, potassium giải phóng khí hydrogen:
2R-OH + 2Na 2RONa + H2; R(OH)a + aNa R(ONa)a + 0,5aH2.
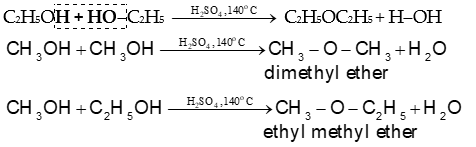
2) Phản ứng tạo ether
- Phản ứng giữa hai phân tử alcohol tạo ether:
Ví dụ: Tách nước ở 140oC hỗn hợp hai alcohol CH3OH và C2H5OH
→ Tách nước hỗn hợp 2 alcohol CH3OH và C2H5OH thu được hỗn hợp 3 ether.
3) Phản ứng tạo alkene
- Xúc tác: bột Al2O3 nung nóng hoặc đun alcohol với H2SO4 đặc, H3PO4 đặc
Ví dụ 1: C2H5OH C2H4 + H2O
- Phản ứng tách nước của alcohol tạo alkene ưu tiên theo quy tắc Zaitsev:
- Trong phản ứng tách nước của alcohol, nhóm -OH bị tách ưu tiên cùng với nguyên tử hydrogene ở carbon bên cạnh có bậc cao hơn.
4) Phản ứng oxi hóa
a) Oxi hóa không hoàn toàn (phản ứng với CuO, to).
- Alcohol bậc 1 bị oxi hóa tạo aldehyde: RCH2OH + CuO RCHO + Cu↓ + H2O
- Alcohol bậc hai bị oxi hóa tạo ketone: R–CH(OH)–R’ + CuO R–COR’ + Cu↓ + H2O
- Alcohol bậc III khó bị oxi hóa.
b)Phản ứng cháy của alcohol: CnH2n+1OH + O2 nCO2 + (n+1)H2O
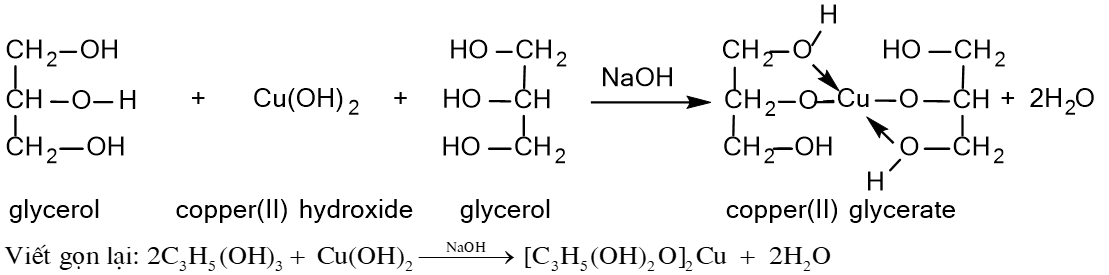
5) Phản ứng riêng của polyalcohol với Cu(OH)2
Các polyalcohol có các nhóm -OH liền kề nhau như ethylene glycol, glycerol có thể tác dụng với copper (II) hydroxide tạo thành dung dịch màu xanh lam đậm.
→ Phản ứng này dùng để nhận biết các polyalcohol có các nhóm -OH liền kề.
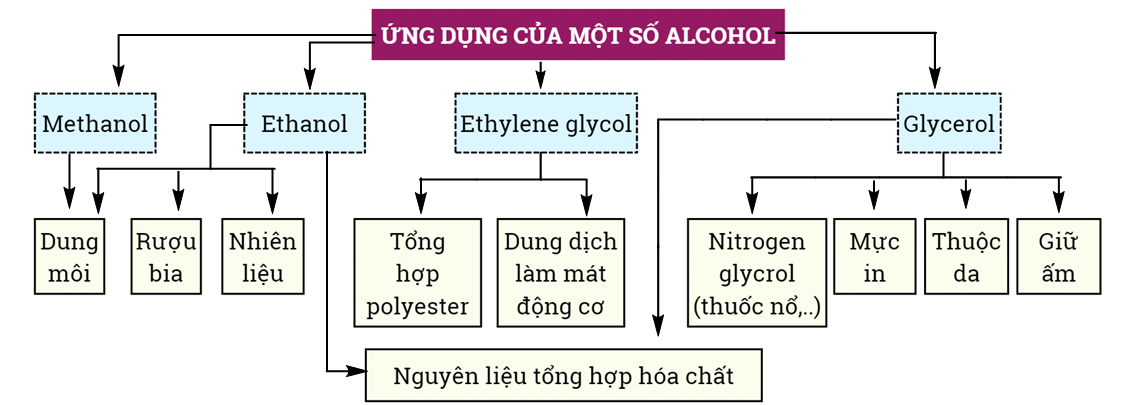
V. ỨNG DỤNG
VI. ĐIỀU CHẾ
1) Hydrate hóa alkene (alkene cộng nước):
Phương pháp này được sử dụng phổ biến trong công nghiệp để điều chế ethanol:
2) Điều chế ethanol bằng phương pháp sinh hóa
Khi lên mên tinh bột, enezyme sẽ phân giải tinh bột thành glucose, sau đó glucose sẽ chuyển hóa thành ethanol:
Phenol
I. KHÁI NIỆM: Phenol là những hợp chất hữu cơ trong phân tử có nhóm -OH liên kết trực tiếp với nguyên tử carbon của vòng benzene.
II. ĐẶC ĐIỂM CẤU TẠO
- Trong phân tử phenol, liên kết O-H của phenol phân cực mạnh, nên phenol thể hiện tính acid yếu.
- Phenol có thể tham gia phản ứng thế nguyên tử hydrogen của vòng benzene.
III. TÍNH CHẤT VẬT LÍ
- Ở điều kiện thường, phenol là chất rắn không màu, nóng chảy ở 43 oC, sôi ở 181,8 oC.
- Phenol dễ bị chảy rữa khi để ngoài không khí ẩm
- Phenol tạo được liên kết H với nước, nhưng ít tan trong nước ở điều kiện thường, tan nhiều khi đun nóng (tan vô hạn ở 66oC), tan tốt trong các dung môi hữu cơ như ethanol, ether và acetone.
- Phenol rất độc, gây bỏng khi tiếp xúc với da.
IV. TÍNH CHẤT HÓA HỌC
1) Phản ứng thế nguyên tử H của nhóm -OH (tính acid của phenol)
- Trong dung dịch nước, phenol phân li theo cân bằng:
- Phenol là acid yếu, không làm đổi mày quỳ tím.
+ Tính acid: C6H5OH > H2CO3 (nấc 2): C6H5OH + Na2CO3 C6H5ONa + NaHCO3.
+ Tính acid: H2CO3 (nấc 1) > C6H5OH: C6H5ONa + CO2 + H2O C6H5OH + NaHCO3.
- Phenol có thể phản ứng được với kim loại kiềm, dung dịch base.
Ví dụ:
|
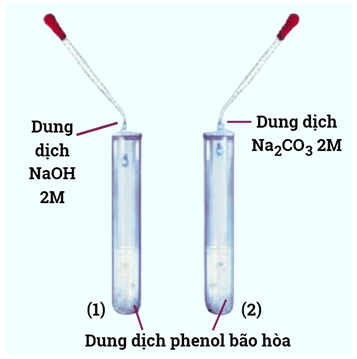
Thí nghiệm 1: Phenol phản ứng với dung dịch NaOH và với dung dịch Na2CO3. Dụng cụ: Ống nghiệm, ống hút nhỏ giọt, giá đỡ, găng tay, kính bảo hộ. Hóa chất: phenol, dung dịch NaOH 2 M, dung dịch Na2CO3 2M, nước cất. Tiến hành: Bước 1: Lắc đều hỗn hợp phenol lỏng với nước để tạo huyền phù. Lấy lần lượt 1 mL phenol dạng huyền phù cho vào ống nghiệm, đánh số thứ tự (1) và (2). |
|
|
Bước 2: Thêm tiếp 1 mL dung dịch NaOH vào ống nghiệm (1), 1 mL dung dịch Na2CO3 vào ống nghiệm (2). Lắc đều và để ổn định 2 ống nghiệm. Bước 3: Sục khí CO2 vào ống nghiệm (1) và ống nghiệm (2). Hiện tượng và các phương trình hóa học | |
Bước 1: Phenol ít tan trong nước ở điều kiện thường do đó ban đầu dung dịch có màu trắng đục.
Bước 2: Phenol phản ứng với các dung dịch NaOH, Na2CO3 tạo thành các muối tan nên sau phản ứng thu được dung dịch trong suốt.
Bước 3: Dung dịch trong hai ống nghiệm vẩn đục trở lại.
C6H5ONa + CO2 + H2O C6H5OH + NaHCO3.
5. Phản ứng thế ở vòng thơm
Phản ứng thế ưu tiên vào vị trí 2, 4 và 6 (ortho và para)
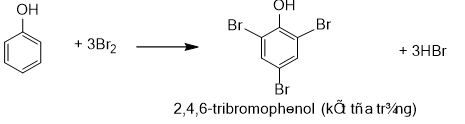
a)Phản ứng bromine hóa
Do ảnh hưởng của nhóm -OH, phản ứng thế nguyên tử của hydrogen ở vòng benzene của phenol xảy ra dễ dàng hơn so với benzene.
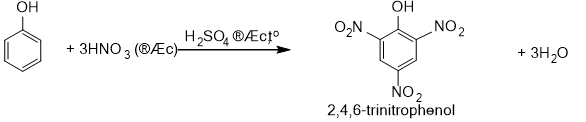
b)Phản ứng nitro hóa
6. Ứng dụng của phenol
- Dung dịch phenol ở nồng độ thấp được sử dụng như thuốc sát trùng, diệt nấm, vi khuẩn, vius, thuốc tăng trưởng thực vật.
- Sản xuất phẩm nhuộm, thuốc nổ (2,4,6-trinitrophenol), chất diệt cỏ, diệt nấm mốc.
- Sản xuất mĩ phẩm, tơ sợi, chất dẻo, tổng hợp dược phẩm (aspirin, paracetamol),…
7. Điều chế
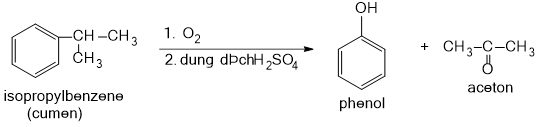
Phenol được tổng hợp từ cumene (isopropylbenzene) bằng phản ứng oxi hóa khử bởi oxygen rồi thủy phân trong môi trường acid thu được phenol và acetone
- Ngoài ra, phenol còn được điều chế từ nhựa than đá.
A. CÁC DẠNG CÂU HỎI TỰ LUẬN
Câu 1: Hãy giải thích tại sao phenol có thể phản ứng được với dung dịch NaOH còn alcohol thì không phản ứng với dung dịch NaOH
Câu 2: So sánh điều kiện phản ứng bromine hoá vào vòng benzene của phenol và benzene. Từ đó, rút ra nhận xét khả năng thế nguyên tử hydrogen của vòng benzene của phenol so với benzene.
Câu 3: Hãy xác định công thức cấu tạo của hợp chất hữu cơ X, biết X có công thức phân tử C7H8O, có chức vòng benzene và phản ứng được với dung dịch NaOH.
Câu 4: Hợp chất hữu cơ X thuộc loại phenol, có công thức phân tử là C8H10O. Số đồng phân cấu tạo của X là bao nhiêu
Câu 5: Viết phương trình hoá học của phản ứng xảy ra khi cho 4 – methylphenol tác dụng với nước bromine.
Câu 6: Cho các chất có công thức sau: C6H5OH, C6H5CH3, C6H5Cl và các giá trị nhiệt độ sôi (không theo thứ tự) là 110 oC, 132 oC, 182 oC. Hãy dự đoán nhiệt độ sôi tương ứng với mỗi chất trên. Giải thích.
Câu 7: a)Viết công thức phân tử và công thức cấu tạo của phenol đơn giản nhất.
b) Phenol phản ứng với dung dịch potassium hydroxide. Viết phương trình hóa học của phản ứng.
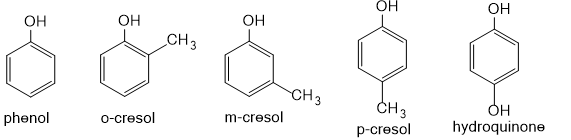
Câu 8: Viết công thức cấu tạo của các đồng phân phenol có công thức C7H8O. Gọi tên các đồng phân đó
Câu 9: Hãy dẫn ra các phương trình hóa học với bromine; dung dịch HNO3 (đặc) để chứng minh phản ứng thế nguyên tử H ở vòng benzene trong phenol dễ hơn benzene.
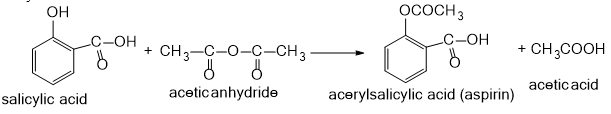
Câu 10: Aspirin được dùng trong dùng để hạ sốt và giảm đau nhẹ đến trung bình do tình trạng đau nhức cơ, răng, cảm lạnh đau đầu và sưng tấy do viêm khớp phương trình hóa học điều chế Aspirin từ salicylic acid
a) Salicylic acid chứa những nhóm chức nào?
b) Nhóm chức nào của salicylic acid đã tham gia phản ứng trên?
Câu 11: Thực hiện các thí nghiệm sau:
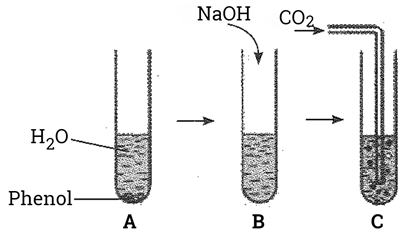
- Cho phenol vào ống nghiệm, thêm nước và lắc đều ống nghiệm thấy dung dịch có màu trắng đục (Hình A) .
- Cho dung dịch NaOH vào ống nghiệm thấy dung dịch chuyển sang trong suốt (Hình B) .
- Sục khí CO2 vào ống nghiệm thấy dung dịch chuyển màu trắng đục như ban đầu (Hình C) .
Giải thích hiện tượng trong các thí nghiệm trên và viết các phương trình hóa học.
Câu 12: Trình bày cách phân biệt các dung dịch sau: dung dịch phenol, dung dịch ethanol, dung dịch glycerol.
Câu 13: Picric acid có nhiều ứng dụng trong y học (định lượng creatinine để chấn đoản và theo dõi tình trạng suy thận, khử trùng và làm khô da khi điều trị bỏng,…), trong quân sự (sản xuất đạn, thuốc nổ,…), trong phòng thí nghiệm (nhuộm mẫu, làm thuốc thử,…).
a) Viết phương trình hóa học của phản ứng điều chế picric acid từ phenol.
b) Giải thích vì sao trong phòng thí nghiệm thường bảo quản picric acid trong lọ dưới một lớp nước và trong quá trình làm việc với picric acid, tránh để acid tiếp xúc với kim loại?
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm Chuyên đề dạy thêm Hóa học lớp 11 các chương hay khác:
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều

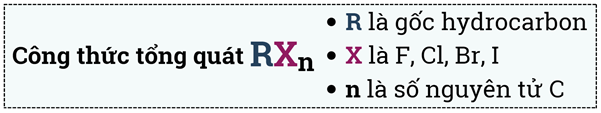
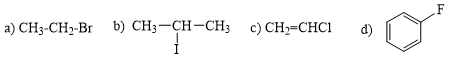

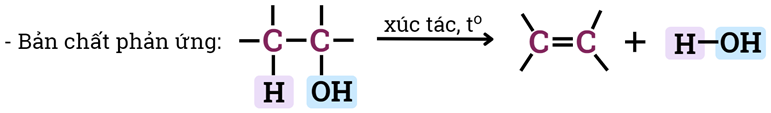
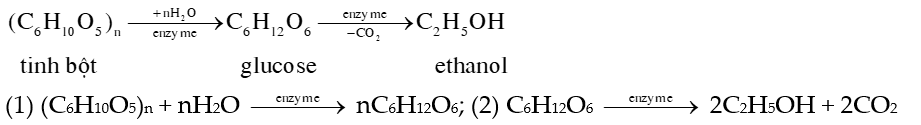

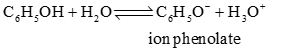



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

