Chuyên đề Hydrocarbon lớp 11
Tài liệu chuyên đề Hydrocarbon Hóa học lớp 11 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa học 11.
Chuyên đề Hydrocarbon lớp 11
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa học 11 (cả 3 sách) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
Alkane
PHẦN LÝ THUYẾT
I. KHÁI NIỆM & ĐỒNG ĐẲNG VỀ ALKANE
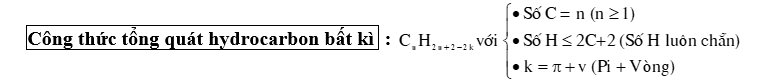
⦁ Alkane (Paraffin) là các hydrocarbon no, mạch hở, có công thức chung là : CnH2n+2 (n 1).
⦁ Trong phân tử alkane chỉ có các liên kết đơn () C – C và C – H.
|
Số nguyên tử carbon |
Tên tiền tố |
Công thức phân tử Alkane |
Công thức cấu tạo Alkane |
Tên Alkane |
|
C1 |
Meth– |
CH4 |
CH4 |
Methane |
|
C2 |
Eth– |
C2H6 |
CH3CH3 |
Ethane |
|
C3 |
Prop– |
C3H8 |
CH3CH2CH3 |
Propane |
|
C4 |
But– |
C4H10 |
CH3[CH2]2CH3 |
Butane |
|
C5 |
Pent– |
C5H12 |
CH3[CH2]3CH3 |
Pentane |
|
C6 |
Hex– |
C6H14 |
CH3[CH2]4CH3 |
Hexane |
|
C7 |
Hept– |
C7H16 |
CH3[CH2]5CH3 |
Heptane |
|
C8 |
Oct– |
C8H18 |
CH3[CH2]6CH3 |
Octane |
|
C9 |
Non– |
C9H20 |
CH3[CH2]7CH3 |
Nonane |
|
C10 |
Dec– |
C10H22 |
CH3[CH2]8CH3 |
Decane |
II. ĐỒNG PHÂN – DANH PHÁP
2.1. Đồng phân: Cùng công thức phân tử nhưng khác công thức cấu tạo.
⦁ Các alkane từ C1 ⟶ C3 không có đồng phân. Từ C4 trở đi có đồng phân mạch C ⟶ Công thức nhanh : 2n–4 + 1 (3 < n < 7)
⦁ Số lượng các đồng phân : C4 : 2 đồng phân C5 : 3 đồng phân C6 : 5 đồng phân C7 : 9 đồng phân
2.2. Cách viết đồng phân
+ Bước 1 : Viết đồng phân mạch C thẳng (không nhánh).
+ Bước 2 : Viết đồng phân mạch C phân nhánh :
⦁ Bẻ 1C trên mạch chính làm mạch nhánh, gắn nhánh vào các vị trí khác nhau trên mạch chính. Lưu ý không gắn nhánh vào vị trí C đầu mạch.
⦁ Khi bẻ 1C không còn đồng phân thì bẻ 2C. 2C đó có thể cùng liên kết với 1C hoặc 2C khác nhau trên mạch chính.
⦁ Lần lượt bẻ tiếp các C khác cho đến khi không bẻ được nữa thì dừng lại.
2.3. Bậc của carbon trong alkane ⦁ Bậc của 1 nguyên tử carbon bằng số nguyên tử C liên kết trực tiếp với nó.

2.4 "Tên IUPAC” = “Tên thay thế” = “Tên quốc tế” = “Tên hệ thống” của alkane
⦁ Bước 1 : Chọn mạch carbon chính phải dài nhất (nhiều C nhất).
⦁ Bước 2 : Đánh số thứ tự carbon gần nhánh nhất sao cho tổng số vị trí nhánh là nhỏ nhất.
⦁ Bước 3 : Phải nêu đầy đủ số chỉ vị trí của các nhánh và thêm tiền tố đi (2), tri (3), tetra (4) trước tên các nhánh giống nhau.
⦁ Bước 4 : Giữa số và số phải có dấu phẩy “,”. Giữa số và chữ phải có dấu gạch ngang “–“
⦁ Bước 5 : Nhóm thế cùng loại : Thứ tự đọc theo α, 𝛽,…. Ví dụ trong phân tử có nhóm -CH3- và -C2H5 thì đọc ethyl trước và methyl sau.
⦁ Bước 6 : Gọi tên theo công thức : Tên Alkane = số chỉ vị trí nhánh + tên nhánh + tên mạch chính + ane
Từ tên gọi suy ra công thức cấu tạo :
⦁ Bước 1 : Viết mạch chính, ví dụ : Propane (mạch chính có 3C), Butane (mạch chính có 4C), Pentane (5C),….
⦁ Bước 2 : Viết nhánh dựa vào số chỉ vị trí và tên nhánh, ví dụ : 2-methyl (có 1 nhóm CH3 ở vị trí C số 2),
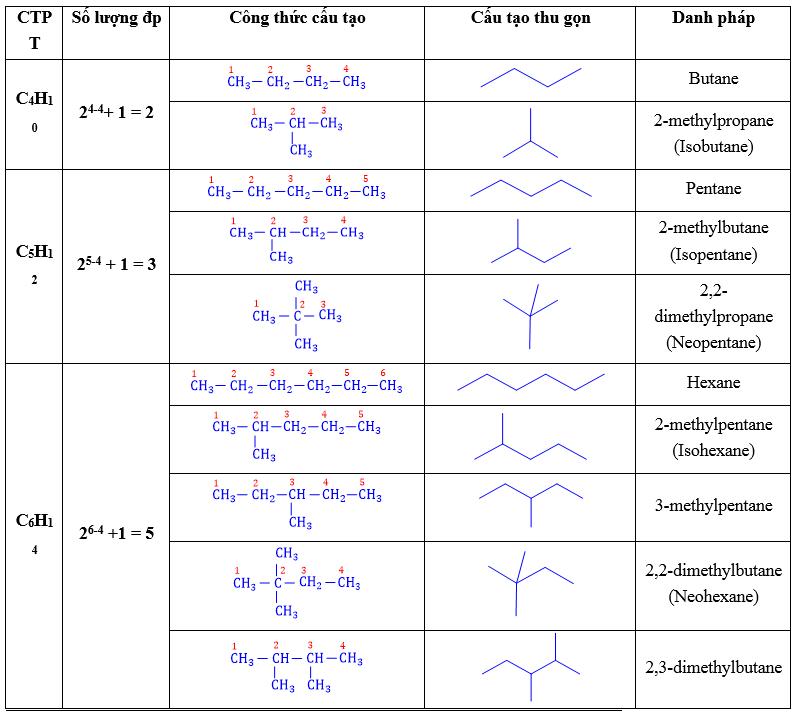
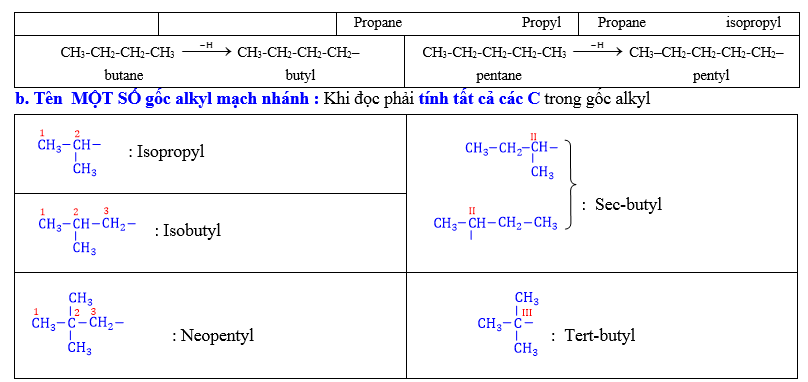
2.5. Tên các nhóm alkyl: Alkane (CnH2n+2) Alkyl (CnH2n+1–)
a. Tên gốc alkyl mạch thẳng

III. TÍNH CHẤT VẬT LÝ
+ Ở điều kiện thường, alkane :
⦁ Trạng thái khí : C1 ⟶ C4 và neopentane.
⦁ Trạng thái lỏng : C5 ⟶ C17 (trừ neopentane).
⦁ Trạng thái rắn : C18 ⟶ ....
+ Alkane không tan hoặc ít tan trong nước và nhẹ hơn nước, tan tốt trong dung môi hữu cơ.
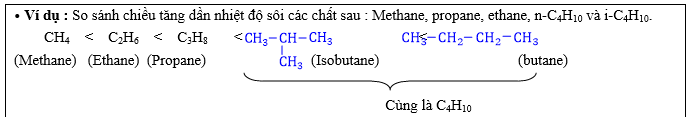
+ So sánh nhiệt độ sôi các alkane :
⦁ Khác số C : Số C càng cao ⟶ tos càng cao.
⦁ Cùng số C : Càng gọn (ít nhánh) thì tos càng cao và ngược lại càng cồng kềnh (nhiều nhánh) thì tos càng thấp.
+ Khi số nguyên tử carbon tăng, phân tử khối và tương tác Van der Waals giữa các phân tử alkane tăng, dẫn đến nhiệt độ sôi của các alkane cũng tăng.
+ Alkane có cùng công thức phân tử, các chất có nhánh sẽ gọn & tròn hơn, các chất không nhánh sẽ dài & cồng kềnh hơn vì vậy diện tích bề mặt chất có nhánh sẽ hơn chất không nhánh dẫn đến lực liên kết giữa các phân tử có nhánh yếu hơn không nhánh ⟶ Chất có nhánh có tos thấp hơn chất không nhánh.
Hydrocarbon không no
A. PHẦN LÝ THUYẾT
I. KHÁI NIỆM

II. ĐỒNG PHÂN – DANH PHÁP
2.1. Đồng phân cấu tạo
- Các alkene và alkyne C2, C3 không có đồng phân. Từ C4 trở đi có đồng phân mạch C & đồng phân vị trí liên kết bội.
- Cách viết đồng phân của alkene và alkyne :
+ Bước 1 : Viết mạch carbon không phân nhánh. Sau đó, đặt liên kết bội vào các vị trí khác nhau trên mạch chính.
+ Bước 2 : Viết mạch carbon phân nhánh :
⦁ Bẻ 1 carbon làm nhánh, đặt nhánh vào các vị trí khác nhau trong mạch. Sau đó ứng với mỗi mạch carbon lại đặt liên
kết bội vào các vị trí khác nhau.
⦁ Khi bẻ 1 carbon không còn đồng phân thì bẻ đến 2 carbon. 2 carbon có thể cùng liên kết với 1C hoặc 2C khác nhau. Lại đặt liên kết bội vào các vị trí khác nhau.
⦁ Lần lượt bẻ tiếp các nguyên tử carbon khác cho đến khi không bẻ được nữa thì dừng lại.
2.2. Đồng phân hình học : Là đồng phân về vị trí không gian của hợp chất có liên kết đôi C=C.

2.3. Tên IUPAC = Tên thay thế = Tên quốc tế = Tên hệ thống của alkene – alkyne
Bước Nhiệm vụ thực hiện
|
Bước |
Nhiệm vụ thực hiện |
|
1 |
Chọn mạch carbon chính phải dài nhất (nhiều C nhất). |
|
2 |
Đánh số thứ tự carbon gần vị trí liên kết bội nhất sao cho tổng số vị trí nhánh là nhỏ nhất. |
|
3 |
Phải nêu đầy đủ số chỉ vị trí của các nhánh và thêm tiền tố di (2), tri (3), tetra (4) trước tên các nhánh giống nhau. |
|
4 |
Giữa số và số phải có dấu phẩy. Giữa số và chữ phải có dấu gạch ngang “–“ |
|
5 |
Nhóm thế cùng loại : Thứ tự đọc theo α, b, …. Ví dụ trong phân tử có nhóm -CH3- và -C2H5 thì đọc ethyl trước và methyl sau. |
|
Nhóm thế khác loại : –Halogen ⟶ Nitro (–NO2) ⟶ –Alkyl |
|
|
6 |
Tên Alkene = số chỉ vị trí nhánh + tên nhánh + tên mạch chính + vị trí liên kết đôi + ene |
|
Tên Alkyne = số chỉ vị trí nhánh + tên nhánh + tên mạch chính + vị trí liên kết ba + yne |
2.4. Tên các nhóm alkenyl : Alkene (CnH2n) Alkenyl (–CnH2n-1)

2.5. Tên thông thường : Một số ít alkene và alkyne có tên thông thường :
⦁ Ví dụ 1: C2H4 : CH2=CH2 : Ethene hay Ethylene
C3H6 : CH2=CH-CH2 : Propene hay Propylene
C2H2 : CH≡CH : Ethyne hay Acetylene
C4H6 : CH2=CH-CH=CH2 : Divinyl
C4H4 : CH2=CH-C≡CH : Vinyl acetylene
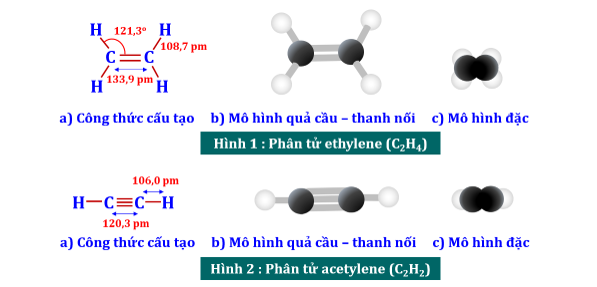
III. CẤU TẠO CỦA ETHYLENE & ACETYLENE
+ Phân tử ethylene (C2H4) có :
⦁ 2C và 4H đều nằm trên một mặt phẳng.
⦁ Các góc liên kết . Liên kết đôi C=C gồm 1 liên kết + 1 liên kết π.
+ Phân tử acetylene (C2H2) có :
⦁ 2C và 2H đều nằm trên một đường thẳng.
⦁ Góc liên kết . Liên kết ba C≡C gồm 1 liên kết + 2 liên kết π.
+ Nhận xét : Liên kết π kém bền hơn liên kết nên dễ bị phá vỡ khi tham gia phản ứng.
IV. TÍNH CHẤT VẬT LÍ
+ Các alkane, alkyne thường không màu, không mùi, nhẹ hơn nước & ít tan trong nước, nhưng tan trong một số dung môi hữu cơ.
+ Trạng thái của alkene & alkyne :
⦁ C2 ⟶ C4 : Trạng thái khí.
⦁ C5 ⟶ C17 : Trạng thái lỏng.
⦁ Từ C18 trở đi : Trạng thái rắn.
So sánh nhiệt độ sôi, nhiệt độ nóng chảy :
⦁ Các alkene, alkyne có tos, tonc tăng dần khi số C tăng dần (do khối lượng phân tử & lực tương tác Van Der Waals đều tăng dần).
⦁ Đồng phân hình học cis– & trans– : tonc (cis–) < tonc (trans–) (do đồng phân trans- dạng đối xứng ⟶ tinh thể chặt chẽ).
⦁ Còn tos (cis–) < tos (trans–) (do đồng phân trans có tổng moment lưỡng cược thường triệt tiêu hoặc gần triệt tiêu, còn đồng phân cis có tổng moment lưỡng cực không triệt tiêu)
⦁ Các alkane, alkene, alkyne có tos, tonc sấp xỉ nhau. Tuy nhiên khi cùng mạch C : Alkene < Alkane < Alkyne. Ví dụ : C3H6 < C3H8 < C3H4.
Hydrocarbon thơm
A. PHẦN LÝ THUYẾT
I. KHÁI NIỆM, ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP
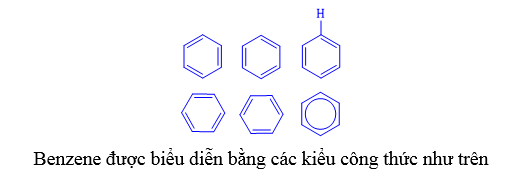
I.1. Biểu diễn cấu tạo của benzene
⦁ benzene có 6 nguyên tử C trong phân tử tạo thành một lục giác đều.
⦁ Cả 6 nguyên tử C và 6 nguyên tử H cùng nằm trên 1 mặt phẳng (gọi là mặt phẳng phân tử).
⦁ Bên trong 1 là hệ liên hợp giữa các liên kết và liên kết π (nhân thơm).
⦁ Các góc liên kết đều bằng 120o.
⦁ Độ dài liên kết C–C đều bằng 139 pm.
II.2. Khái niệm – phân loại – danh pháp
⦁ benzene là 1 hydrocarbon thơm có công thức phân tử là C6H6.
⦁ Khi thay thế các nguyên tử H của vòng benzene bằng các nhóm alkyl như –CH3, –C2H5, –C3H7 (2 đp),… ⟶ alkylbenzene.
⦁ benzene và đồng đẳng (alkylbenzene) có công thức chung là CnH2n–6 (n ≥ 6).
⦁ Arene (hydrocarbon thơm) là những hydrocarbon thơm chứa vòng benzene trong phân tử.
Với benzene và đồng đẳng, bắt đầu từ C8H10 có đồng phân vị trí tương đối của các nhóm alkyl quanh vòng benzene :
⦁ C8H10 : 4 đồng phân
⦁ C9H12 : 9 đồng phân
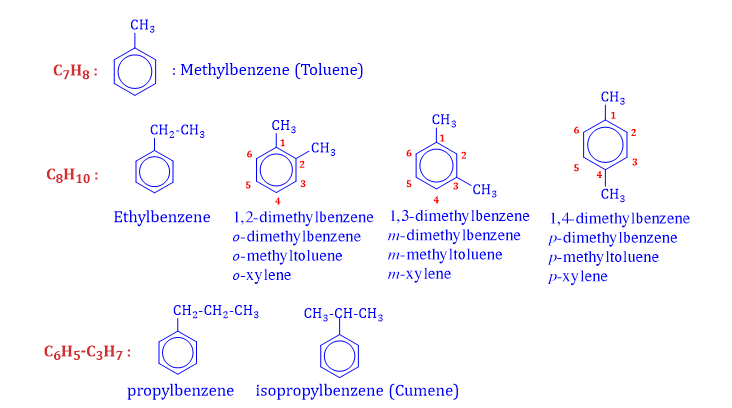
+ Chỉ có 1 nhóm thế (1 nhánh) : Tên nhóm thế + benzene
+ Có 2 nhóm thế (2 nhánh) : Tiền tố (o-, m-, p-) + tên nhánh + tên gốc alkylbenzene
2 nhánh giống nhau : Tiền tố (o-, m-, p-) + “đi” + tên nhánh + benzene.
+ Tổng quát nhất : Số chỉ vị trí nhánh + tên các nhánh + benzene
+ Lưu ý :
⦁ Đánh số C của vòng benzene sao cho tổng số vị trí nhánh là nhỏ nhất.
⦁ Thứ tự gọi tên ưu tiên các nhóm thế : -halogen (-Cl, -Br,…) > -nitro (-NO2),… > -alkyl (-CH3, -C2H5,…).
⦁ Sau đó gọi tên ưu tiên theo thứ tự a, b, c,…
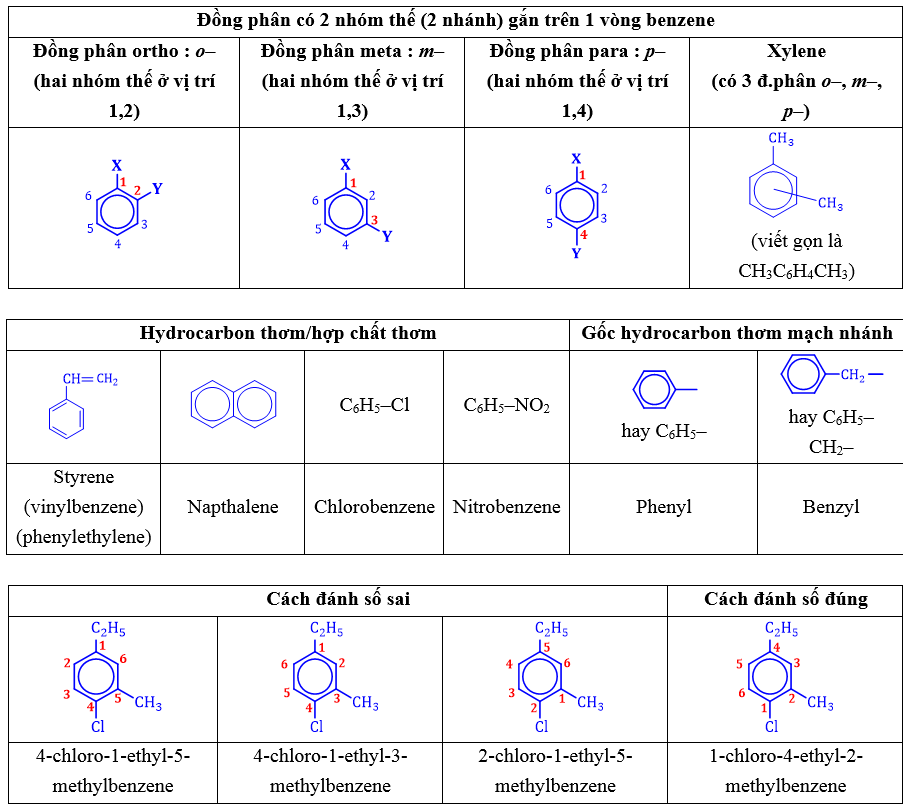
II. TÍNH CHẤT VẬT LÝ
⦁ benzene, toluene, xylene, styrene : Chất lỏng, không màu, trong suốt, dễ cháy, có mùi đặc trưng.
⦁ Napthalene : Chất rắn màu trắng, có mùi đặc trưng (phát hiểu được ở nồng độ thấp),
⦁ Các arene đều độc, phân tử không phân cực hoặc kém phân cực nên không tan trong nước & thường nhẹ hơn nước, tan được trong các dung môi hữu cơ như acetone, diethyl ether, chloroform,…
Nguồn hydrocarbon thơm gây tổn hại đến sức khoẻ con người :
Các hydrocarbon thơm (benzene, toluene, xylene,..) được thêm vào xăng theo một tỉ lệ thể tích nhất định, giúp tăng chỉ số octane của xăng, nhờ đó nhiên liệu được đốt cháy hiệu quả hơn. Trong thành phần của khói thuốc lá có chứa nhiều chất độc hại trong đó có benzene.
III. TÍNH CHẤT HOÁ HỌC
Quy tắc thế của vòng benzene
|
Nhóm thế loại I |
–alkyl(–CH3, –C2H5); – halogen(–Cl, –Br), –OH; – NH2; –OCH3,… |
Ưu tiên thế vào : o– và p– |
|
Nhóm thế loại II |
–NO2; –COOH; –SO3H; –CHO,… |
Ưu tiên thế vào : m– |
1.1. Phản ứng thế & cộng halogen
a. Phản ứng thế halogen hóa
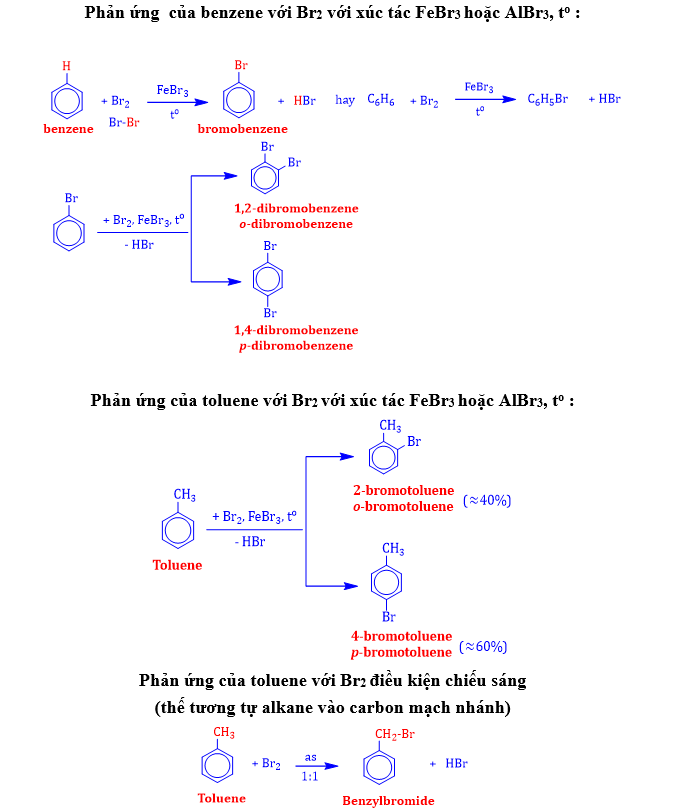
⦁ Trong phản ứng của các arene với halogen có thể thay FeCl3, FeBr3 bằng bột Fe hoặc AlCl3, AlBr3 bằng bột Al.
⦁ Giải thích : Vì phân tử toluene chứa vòng benzene có sẵn nhóm thế –CH3 nên ưu tiên thế vào vị trí o– và p–. Chắc chắn vẫn có sản phẩm thế vào vị trí m– tuy nhiên chiếm hàm lượng rất nhỏ (không đáng kể).
⦁ Phản ứng thế nguyên tử H ở vòng thơm của toluene và các alkylbenzene dễ hơn benzene.
⦁ Phản ứng thế của styrene với Br2 : Ưu tiên thế vào vị trí meta : m– (vì styrene chứa gốc –CH=CH2 là nhóm thế loại II)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm Chuyên đề dạy thêm Hóa học lớp 11 các chương hay khác:
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

