Chuyên đề Cân bằng hoá học lớp 11
Tài liệu chuyên đề Cân bằng hoá học Hóa học lớp 11 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa học 11.
Chuyên đề Cân bằng hoá học lớp 11
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa học 11 (cả 3 sách) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
Khái niệm về cân bằng hóa học
I. PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH
1) Phản ứng 1 chiều
- Trong điều kiện xác định, chất tham gia phản ứng tạo thành chất sản phẩm, không xảy ra phản ứng ngược lại, kí hiệu là mũi tên từ trái sang phải “”
- Ví dụ: Fe (s) + 2HCl (aq) FeCl2 (aq) + H2 (g).
2) Phản ứng thuận nghịch
- Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng.
- Kí hiệu là hai nửa mũi tên ngược chiều nhau “⇌”
- Cho phản ứng thuận nghịch:

II. CÂN BẰNG HÓA HỌC
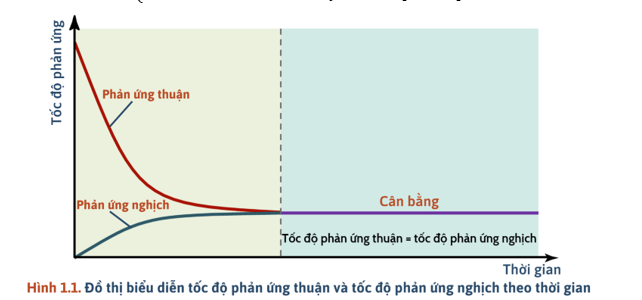
1) Trạng thái cân bằng
- Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch ().
+ Trạng thái cân bằng: phản ứng vẫn diễn ra theo 2 chiều, nồng độ các chất không thay đổi.
- Cho phản ứng thuận nghịch:

+ Thời điểm ban đầu:
+
2) Hằng số cân bằng
- Cho phản ứng thuận nghịch: aA + bB ⇌ cC + dD
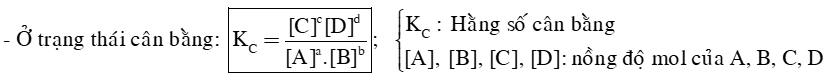
+ Thực nghiệm cho thấy: hằng số cân bằng KC của một phản ứng thuận nghịch chỉ phụ thuộc nhiệt độ và bản chất của phản ứng.
+ KC càng lớn thì phản ứng thuận càng chiếm ưu thế, KC càng nhỏ thì phản ứng nghịch càng chiếm ưu thế.
+ Đối với phản ứng có chất rắn tham gia, không biểu diễn nồng độ của chất rắn trong biểu thức hằng số cân bằng. Ví dụ: C (s) + CO2 (g) ⇌ 2CO (g) .
III. CÁC YẾU TỐ ẢNH HƯỚNG ĐẾN CHUYỂN DỊCH CÂN BẰNG HÓA HỌC
- Nguyên lí Le chatelier (Lơ Sa-tơ-li-ê): Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu sự tác động từ bên ngoài như nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
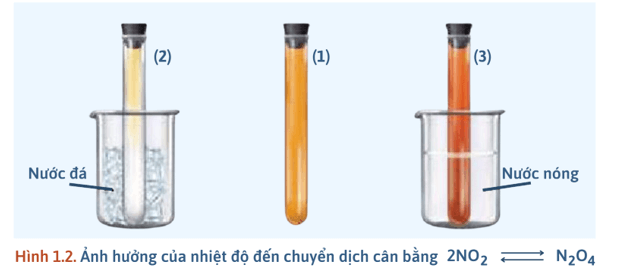
1) Ảnh hưởng của nhiệt độ
- Thí nghiệm: Ảnh hưởng của nhiệt độ đến cân bằng:
+ Chuẩn bị 3 ống nghiệm (1), (2), (3) chứa khí NO2 (có màu giống nhau), 1 cốc nước đá, 1 cốc nước nóng (70 – 80oC).
+ Ống nghiệm 1: Dùng để so sánh.
+ Ống nghiệm 2: Ngâm vào cốc nước đá khoảng 1 – 2 phút → Màu nâu đỏ nhạt dần → NO2 giảm, N2O4 tăng → Cân bằng chuyển dịch theo chiều thuận.
+ Ống nghiệm 3: Ngâm vào cốc nước nóng khoảng 1 – 2 phút → Màu nâu đỏ đậm dần → NO2 tăng, N2O4 giảm → Cân bằng chuyển dịch theo chiều nghịch.
|
- Kết luận: + Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều (, phản ứng tỏa nhiệt). + Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều (, phản ứng thu nhiệt). |
2) Ảnh hưởng của nồng độ
- Thí nghiệm: Ảnh hưởng của nồng độ đến cân bằng:
+ Cho một vài giọt phenolphthalein vào dung dịch CH3COONa, lắc đều, dung dịch có màu hồng nhạt.
+ Chia dung dịch thu được vào ba ống nghiệm với thể tích gần bằng nhau.
+ Ống (1) để so sánh; ống (2) thêm vài tinh thể CH3COONa; ống 3 thêm một vài giọt dung dịch CH3COOH.
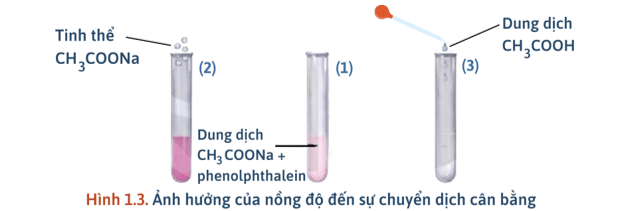
- Quan sát hiện tượng ta thấy:
+ Ống (2): Tăng nồng độ CH3COONa thấy màu sắc đậm lên → NaOH tạo ra nhiều hơn (NaOH làm phenolphthalein từ không màu chuyển sang màu hồng) → Cân bằng chuyển dịch theo chiều thuận.
+ Ống (3): Tăng nồng độ CH3COOH ta thấy màu sắc nhạt đi → CH3COOH tác dụng với NaOH, làm giảm lượng NaOH → Cân bằng chuyển dịch theo chiều nghịch).
|
- Kết luận: + Khi tăng nồng độ, cân bằng chuyển dịch theo chiều làm giảm nồng độ chất đó. + Khi giảm nồng độ, cân bằng chuyển dịch theo chiều làm tăng nồng độ chất đó. (Lưu ý: Tăng hay giảm lượng chất rắn không làm chuyển dịch cân bằng) |
3) Ảnh hưởng của áp suất
- Thí nghiệm: Ảnh hưởng của áp suất đến cân bằng:
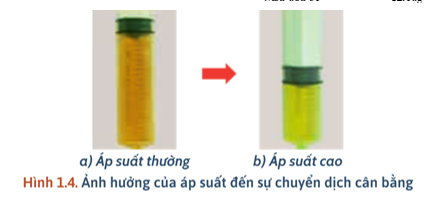
+ Tăng P, màu nâu đỏ nhạt dần → Cân bằng chuyển dịch theo chiều thuận → Số mol khí giảm.
|
- Kết luận: + Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm số mol khí. + Khi giảm áp suất, cân bằng chuyển dịch theo chiều làm tăng số mol khí. (Thay đổi P, cân bằng không chuyển dịch khi: phản ứng không có khí hoặc số mol khí ở 2 vế bằng nhau). |
Cân bằng trong dung dịch nước
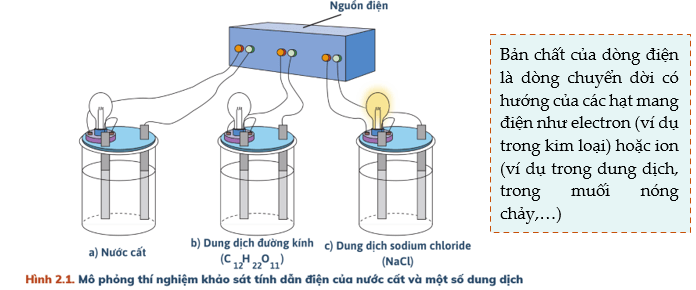
Ta thấy: Cốc đựng nước cất và dung dịch đường kính bóng đèn không sáng → Nước cất, dung dịch đường kính không dẫn điện.
Cốc đựng dung dịch NaCl bóng đèn sáng → Dung dịch NaCl dẫn điện.
|
- Sự điện li là quá trình phân li các chất trong nước tạo thành ion. - Chất điện li là chất khi tan trong nước phân li ra các ion. - Chất không điện li là chất khi tan trong nước không phân li thành các ion - Chất điện li gồm: acid, base, muối. |
1) Chất điện li mạnh
- Là chất khi tan trong nước, các phân tử chất hòa tan đều phân li ra ion

- Gồm: acid mạnh, base mạnh và hầu hết các muối
+ Acid mạnh: HCl, HBr, HI, H2SO4, HNO3, HClO4,…
+ Base mạnh: LiOH, NaOH, KOH, Ca(OH)2,…
+ Hầu hết các muối, trừ HgCl2,.
- Phương trình điện li của chất điện li mạnh, biểu diễn mũi tên 1 chiều “ ”
Ví dụ: NaCl Na+ + Cl – ; HCl H+ + Cl –;NaOH Na+ + OH –
2) Chất điện li yếu
- Là chất khi tan trong nước chỉ một phần số phân tử chất tan phân li ra ion, phần còn lại vẫn tồn tại ở dạng phân tử trong dung dịch.
- Gồm: Acid yếu (CH3COOH, HClO, HF, H2CO3, H2SO3,.), base yếu (Mg(OH)2, Fe(OH)2, Cu(OH)2, NH3,.), muối HgCl2,.
- Quá trình phân li của chất điện li yếu là một phản ứng thuận nghịch, biểu diễn “⇌ ”
Ví dụ: CH3COOH ⇌ CH3COO – + H+; NH3 + H2O ⇌ NH4+ + OH –
Phần I. Đề bài
PHẦN A. CÁC DẠNG BÀI TẬP TỰ LUẬN
DẠNG 1: CHẤT ĐIỆN LI, PHƯƠNG TRÌNH ĐIỆN LI
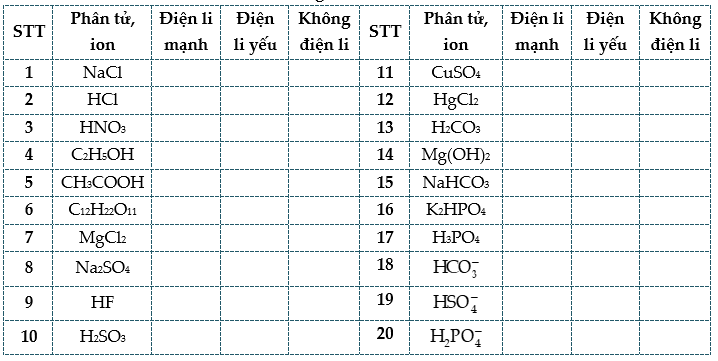
Câu 1: Điền dấu “v” để hoàn thành bảng sau:
Câu 2: Viết các phương trình điện li (nếu có):
|
STT |
Chất |
Phương trình điện li |
|
1 |
HNO3 |
|
|
2 |
HCl |
|
|
3 |
H2SO4 |
|
|
4 |
HClO4 |
|
|
5 |
CH3COOH |
|
|
6 |
H2S |
|
|
7 |
H2CO3 |
|
|
8 |
KOH |
|
|
9 |
NaOH |
|
|
10 |
Ba(OH)2 |
|
|
11 |
NH3+H2O |
|
|
12 |
KHCO3 |
|
|
13 |
KH2PO4 |
|
|
14 |
Na2CO3 |
|
|
15 |
AlCl3 |
|
|
16 |
C2H5OH |
|
|
17 |
FeSO4 |
|
|
18 |
NaHSO4 |
|
|
19 |
Ca(NO3)2 |
|
|
20 |
Fe2(SO4)3 |
|
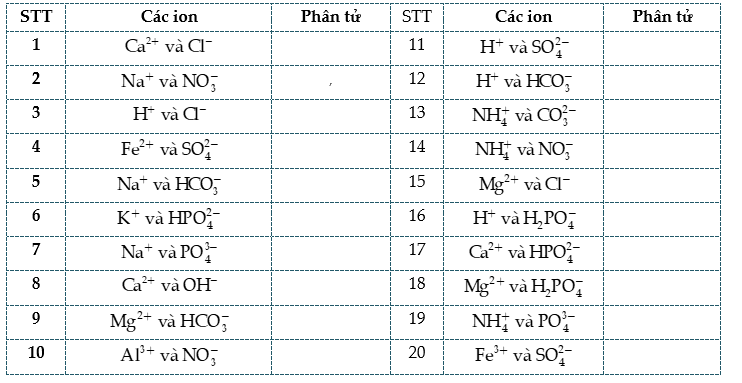
Câu 3: Viết các phân tử mà quá trình phân li của nó phân li ra các ion:
DẠNG 3: TÍNH NỒNG ĐỘ MOL CỦA ION TRONG DUNG DỊCH

Ví dụ 1: Cho 500 mL dung dịch NaOH có khối lượng là 8 gam. Tính nồng độ mol của NaOH
Hướng dẫn giải:
Đổi 500ml = 0,5 lít
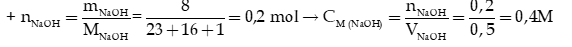
Ví dụ 2: Nồng độ mol của anion trong dung dịch Fe(NO3)2 0,20M là
A. 0,20M.
B. 0,40M.
C. 0,60M.
D. 0,80M.
Hướng dẫn giải:
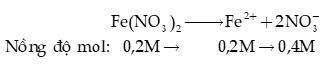
Ví dụ 3: Trộn 100 ml dung dịch Ba(OH)2 0,5M với 100 ml dung dịch KOH 0,5M, thu được dung dịch X. Nồng độ mol/L của ion OH – trong dung dịch X là
A. 0,65M.
B. 0,55M.
C. 0,75M.
D. 1,5M.
Hướng dẫn giải:
Thuyết BRONSTED – LOWRY về acid- base
1) Khái niệm acid – base theo thuyết brønsted – Lowry
Thuyết brønsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.
Trong dung dịch:
H+ + H2O ⇌ H3O+
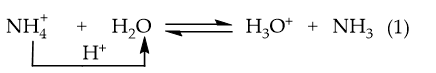
Ví dụ 1: NH4Cl phân li trong nước:
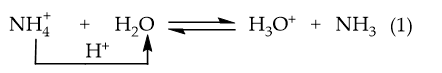
→ Phản ứng thuận là acid (nhường H+), H2O là base (nhận H+).
Phản ứng nghịch: H3O+ là acid, NH3 là base.
Ví dụ 2: NH3 phân li trong nước:
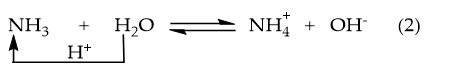
→ Trong phản ứng thuận: NH3 là base (nhận H+); H2O là acid (nhường H+).
Trong phản ứng nghịch: là acid, là base .
Ví dụ 3: phân li trong nước:
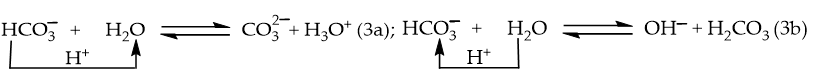
→ vừa có thể nhường H+ vừa có thể nhận H+ → có tính chất lưỡng tính.
Phân tử H2O cũng vừa thể nhường H+ vừa có thể nhận H+ → H2O là chất lưỡng tính.
Các ion thủy phân trong nước tạo H+ hoặc H3O+ là acid, tạo OH – là base.
Ví dụ 4: AlCl3 phân li trong nước:
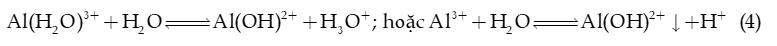
→ Phản ứng (1), (3a), (3b), (4) còn gọi là phản ứng thuỷ phân trong nước.
+ Acid mạnh và base mạnh phân li hoàn toàn trong nước (không tồn tại dạng phân tử trong nước). Acid yếu, base yếu phân li một phần trong nước.
+ AlCl3, FeCl3 có môi trường acid, đất chứa Al3+, Fe3+ là đất chua → Khử chua cần bón vôi.
+ Phèn chua (K2SO4.Al2(SO4)3.24H2O) làm trong nước, chất cầm màu trong phẩm nhuộm.
+ Na2CO3 dùng trong công nghiệp dệt, nhuộm, công nghiệp thủy tinh,…
2) Ưu điểm của thuyết Brønsted – Lowry
- Theo Arrhenius (A-rê-ni-ut), acid là những chất khi tan trong nước phân li ra H+ (proton), base là những chất khi tan trong nước phân li ra OH –.
→ Theo Arrhenius chỉ đúng cho trường hợp dung môi là nước.
- Theo thuyết Brønsted – Lowry, tổng quát hơn thuyết Arrhenius, phân tử không có nhóm OH như NH3 hoặc ion cũng là base.
Phần I. Đề bài
PHẦN A. CÁC DẠNG BÀI TẬP TỰ LUẬN
DẠNG 1: PHƯƠNG TRÌNH THỦY PHÂN CỦA MUỐI
1) Ion không bị thủy phân
+ Cation gốc base mạnh :
+ Anion gốc acid mạnh:
2) Cation gốc base yếu, thủy phân tạo môi trường axit ( )
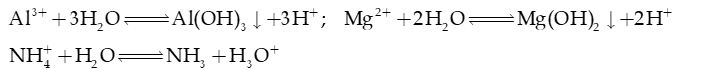
3) Anion gốc acid yếu ( .), thủy phân tạo môi trường base
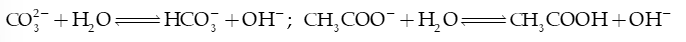
4) Anion gốc acid yếu ( ), thủy phân tạo môi trường acid hoặc base
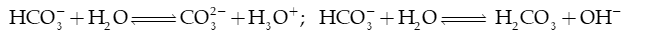
Ví dụ 1: NH4Cl phân li trong nước:
→ Phản ứng thuận là acid (nhường H+), H2O là base (nhận H+).
Phản ứng nghịch: H3O+ là acid, NH3 là base.
→ NH4Cl thủy phân tạo môi trường acid.
Câu 1: Sodium carbonate (Na2CO3) có rất nhiều ứng dụng như dùng trong công nghiệp dệt, nhuộm, công nghiệp thủy tinh,… do sinh ra từ phản ứng thủy phân .
Viết phương trình phản ứng thủy phân , cho biết môi trường của sodium carbonate.
Câu 2: Nước Javel (chứa NaClO và NaCl) được dùng làm chất tẩy rửa, khử trùng. Trong dung dịch, ion ClO- nhận proton của nước để tạo thành HClO.
a) Viết phương trình hóa học của phản ứng xảy ra và xác định chất nào là acid, chất nào là base trong phản ứng trên.
b) Dựa vào phản ứng, hãy cho biết môi trường của nước Javel là acid hay base.
Câu 3: Phèn chua (K2SO4.Al2(SO4)3.24H2O) có ứng dụng làm trong nước, làm chất cầm màu trong công nghiệp nhuộm,… do ion Al3+ thủy phân trong nước tạo kết tủa dạng keo trắng.
a) Viết phương trình điện li của phèn chua.
b) Viết phương trình thủy phân của Al3+.
c) Cho biết môi trường của phèn chua.
Câu 4: Dựa vào thuyết acid – base của Bronsted – Lowry, hãy xác định chất nào là acid, chất nào là base trong các phản ứng sau:
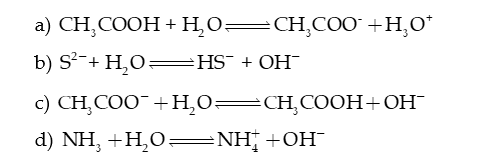
Câu 5: Viết phương trình thủy phân (nếu có), xác định môi trường của dung dịch muối.
|
STT |
Muối |
Phương trình thủy phân |
Môi trường |
|
1 |
Fe(NO3)3 |
|
Base |
|
2 |
Na2CO3 |
|
|
|
3 |
CuSO4 |
|
|
|
4 |
NH4Cl |
|
|
|
|
K2SO4 |
|
|
|
5 |
CH3COONa |
|
|
|
6 |
Al(NO3)3 |
|
|
|
7 |
K2SO3 |
|
|
|
8 |
Ba(NO3)2 |
|
|
|
9 |
Na2S |
|
|
|
10 |
(NH4)2SO4 |
|
|
PHẦN B. CÁC DẠNG BÀI TẬP TRẮC NGHIỆM
Câu 6: Theo thuyết Brønsted – Lowry về acid – base, những chất hoặc ion có khả năng cho H+ là
A. Acid.
B. Base.
C. Lưỡng tính.
D. Muối.
Câu 7: Theo thuyết Brønsted – Lowry về acid – base, những chất hoặc ion có khả năng nhận H+ là
A. Acid.
B. Base.
C. Lưỡng tính.
D. Muối
Câu 8: Theo thuyết Brønsted – Lowry về acid – base, chất nào sau đây là acid?
A. NH3.
B. CH3COOH.
C. C2H5OH.
D. C6H12O6
Câu 9: Theo thuyết Brønsted – Lowry về acid – base, ion nào sau đây không phải là acid?
A. Al3+.
B. .
C. H3O+.
D.
pH của dung dịch. Chất chỉ thị acid- base
1) Tích số ion của nước
- Nước là chất điện li rất yếu: .
Ở 25oC, nồng độ H+ và OH- trong nước là vô cùng nhỏ: [] = []= M .
→ Tích số ion của nước: .
2) pH của dung dịch
- Khái niệm:
pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
+ pH càng nhỏ hơn 7, dung dịch có tính acid càng mạnh.
+ pH càng lớn hơn 7, dung dịch có tính base (tính kiềm) càng mạnh.
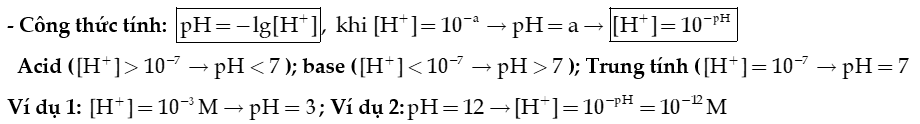
- Thang pH:

- Ý nghĩa của pH trong thực tiễn:
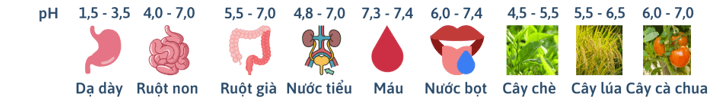
- Xác định pH bằng chất chỉ thị:
Một số chất như: quỳ tím, phenolphthalein, methyl da cam,… có màu sắc khác nhau trong môi trường acid và môi trường base. Những chất như vậy được gọi là chất chỉ thị acid – base.
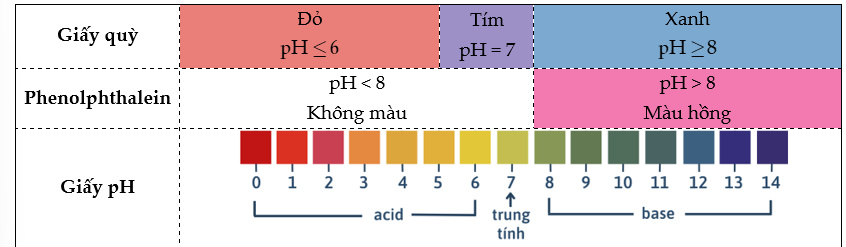
Phần I. Đề bài
DẠNG 1. TÍNH pH CỦA MỘT DUNG DỊCH
1) Tính pH của một dung dịch
- Với một dung dịch chứa các axit ta có:
- Với một dung dịch chứa một hay nhiều bazơ ta có:
2) Biết pH, tính nồng độ mol của ion
- Khi pH < 7 → dung dịch có môi trường acid, ta cần tính nồng độ ion
- Khi pH > 7 → dung dịch có môi trường base ta cần tính nồng độ ion
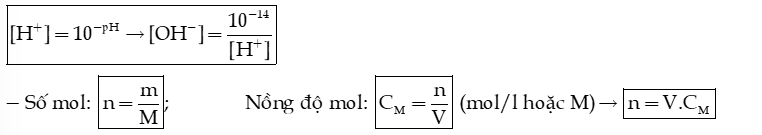
- Khi trộn 2 dung dịch với nhau ta tính mol ion; tính thể tích dung dịch; Tính nồng độ ion theo thể tích thu được; Sau đó tính pH.
Ví dụ 1: Dung dịch H2SO4 nồng độ 0,05M có pH là bao nhiêu?
Hướng dẫn giải:
Ta có:
Ví dụ 2: Dung dịch X gồm NaOH 0,004M và Ba(OH)2 0,003M. Tính pH của dung dịch X.
Hướng dẫn giải:
Ví dụ 3: Trộn 100 mL dung dịch HCl 0,1M với 100 mL dung dịch H2SO4 0,005M thu được dung dịch X.
Tính pH của dung dịch X.
Hướng dẫn giải:

Câu 1: (KNTT – SGK) Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng đất cho vào nước rồi lọc lấy phần dung dịch. Dùng máy đo được giá trị pH là 4,52.
a) Hãy cho biết môi trường của dung dịch là acid, base hay trung tính.
b) Loại đất trên được gọi là đất chua. Hãy đề xuất biện pháp giảm độ chua, tăng độ pH của đất.
Câu 2: (CD - SGK) Bình thường, chỉ số pH của nước tiểu ở người dao động trong khoảng 4,5 – 8,0. Nếu pH của nước tiểu giảm xuống dưới 4,5 thì có nghĩa là bị dư acid, còn cao hơn 8,0 thì có nghĩa là bị dư kiềm. Sỏi thận là khối chất khoáng nhỏ có thể tích tụ trong thận, gây đau khi ngăn cản dòng nước tiểu từ thận xuống niệu quản. Một trong các dấu hiệu của bệnh sỏi thận là nước tiểu bị dư acid hoặc dư kiềm. Đề xuất cách làm đơn giản để có thể tiên lượng (dự đoán có tính khoa học) bệnh sỏi thận.
Câu 3: (CTST-SGK) Một dung dịch có Tính pH và xác định môi trường của dung dịch này.
Câu 4: Hoàn thành bảng sau:
|
STT |
Dung dịch X |
Nồng độ ion H+ |
pH |
|
1 |
HCl 0,01M |
|
|
|
2 |
H2SO4 0,0005M |
|
|
|
3 |
Dung dịch X gồm HCl 0,005M và H2SO4 0,0025M |
|
|
|
4 |
Dung dịch X gồm HNO3 0,04M và HCl 0,06M |
|
|
|
5 |
Dung dịch X gồm H2SO4 0,02M và HCl 0,06M |
|
|
|
6 |
NaOH 0,001M |
|
|
|
7 |
Ba(OH)2 0,005M |
|
|
|
8 |
Dung dịch X gồm KOH 0,005M và Ba(OH)2 0,0025M |
|
|
|
9 |
Dung dịch X gồm NaOH 0,04M và KOH 0,06M |
|
|
|
10 |
Dung dịch X gồm Ba(OH)2 0,02M và NaOH 0,06M |
|
|
Câu 5: Dung dịch H2SO4 0,005 M có pH là
A. 3.
B. 2.
C. 5.
D. 4.
Câu 6: Dung dịch KOH 0,001M có pH là
A. 3.
B. 11.
C. 2.
D. 12.
Câu 7: Hòa tan 0,04gam NaOH vào nước để được 1lit dung dịch. pH của dung dịch bazơ này là
A. 4.
B. 3.
C. 11.
D. 12.
Câu 8: Hoà tan 4,9 g H2SO4 vào nước để được 10 lít dung dịchA . Dung dịch A có pH là
A. 4.
B. 1.
C. 3.
D. 2.
Câu 9: pH của dung dịch A chứa là
A. 3,3.
B. 10,7.
C. 3,0.
D. 11,0.
Câu 10: pH của dung dịch HCl 2.10-4M và H2SO4 4.10-4M là
A. 3.
B. 4.
C. 3,7.
D. 3,1.
Câu 11: Hòa tan 4,9 gam H2SO4 vào nước để được 1 lit dung dịch. pH của dung dịch axit này là
A. 4.
B. 1.
C. 3.
D. 2.
Câu 12: pH dung dịch X gồm HCl 0,01M và H2SO4 0,02M là
A. 4,3.
B. 1,3.
C. 2,3.
D. 3,3.
Chuẩn độ Acid- Base
1) Nguyên tắc: Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ.
+ Dựa vào thể tích của các dung dịch khi phản ứng vừa đủ với nhau, xác định được nồng độ dung dịch chất cần chuẩn độ.
+ Dùng chất chỉ thị acid – base như (giấy quỳ tím, giấy pH, phenolphathlein,…) để xác định pH ở thời điểm tương đương (thời điểm phản ứng vừa đủ).
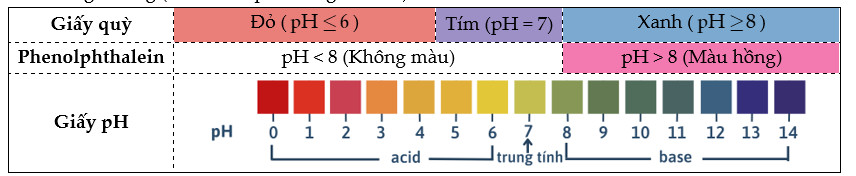
- Chuẩn độ dung dịch acid
+ Dung dịch chuẩn đã biết nồng độ là dung dịch base.
+ Cho dung dịch base đã biết nồng độ phản ứng vừa đủ với dung dịch acid (cần chuẩn độ).
- Chuẩn độ dung dịch base
+ Dung dịch chuẩn đã biết nồng độ là dung dịch acid.
+ Cho dung dịch acid đã biết nồng độ phản ứng vừa đủ với dung dịch base (cần chuẩn độ).
2) Tiến hành chuẩn độ
Thí nghiệm: Chuẩn độ base mạnh bằng dung dịch chuẩn acid mạnh
Chuẩn bị:
- Dung dịch HCl 0,1M; dung dịch NaOH chưa biết nồng độ (khoảng 0,1M); dung dịch phenolphthalein.
- Pipette 10 mL; Burette 25 mL; bình tam giác 100 mL; bình tia nước cất; giá đỡ; kẹp burete.
Tiến hành:
+ Bước 1: Tráng sạch burette bằng nước cất, sau đó tráng lại bằng một ít dung dịch NaOH. Lắp dụng cụ như hình 2.2, xoay vạch đọc thể tích về phía mắt. Cho dung dịch NaOH vào cốc thủy tinh, sau đó rót vào burette (đã khóa) và chỉnh về vạch 0.

+ Bước 2: Dùng pipette lấy dung dịch HCl 0,1M cho vào ba bình tam giác, mỗi bình 10,00 mL. Dùng ống hút nhỏ giọt để lấy chất chỉ thị, nhỏ 1 – 2 giọt phenolphthalein vào các bình tam giác.
+ Bước 3: Vặn khóa burette để dung dịch NaOH trong burette chảy từ từ vào bình tam giác. Quan sát đến khi dung dịch trong bình xuất hiện màu hồng nhạt bền trong khoảng 30 giây thì dừng lại.
+ Bước 4: Đọc thể tích dung dịch NaOH trên vạch của burette.
+ Bước 5: Lặp lại ít nhất 3 lần. Lấy giá trị trung bình của 3 lần chuẩn độ.
Phần I. Đề bài
Câu 1: Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,1M. Để chuẩn độ 10 mL dung dịch HCl này cần 20 mL dung dịch NaOH. Xác định nồng độ của dung dịch HCl trên.
Câu 2: Tính nồng độ, thể tích dung dịch chuẩn độ.
|
STT |
Chuẩn độ dung dịch |
Tính nồng độ, thể tích dung dịch chuẩn độ |
|
1 |
Dùng 10mL dung dịch X gồm NaOH 0,1M và KOH 0,2M để chuẩn độ 20mL dung dịch HCl aM. Tính a |
|
|
2 |
Cho 20 mL dung dịch X gồm NaOH 0,1M và Ba(OH)2 0,15M dùng để chuẩn độ 20 mL dung dịch HCl aM. Tính a |
|
|
3 |
Để chuẩn độ 40mL dung dịch NaOH aM cần dùng 10mL dung dịch X gồm HCl 0,2M và H2SO4 0,1M. Tính a |
|
|
4 |
Để chuẩn độ 25 mL dung dịch NaOH aM cần dùng 10 mL dung dịch X gồm HCl 0,2M và H2SO4 0,3M. Tính a |
|
|
5 |
Để chuẩn độ 10 mL dung dịch X gồm HCl 0,2M và H2SO4 aM cần dùng 20 mL dung dịch NaOH 0,5M. Tính a. |
|
Câu 3: Một mẫu dung dịch H2SO4 (gọi là mẫu X) được phân tích bằng cách thêm 10,0 mL dung dịch NaOH 0,5 M vào 20 mL dung dịch mẫu X rồi lắc đều. Sau khi phản ứng xảy ra, người ta thấy trong hỗn hợp dung dịch còn dư ion . Phần ion dư này cần 10 mL HCl 0,1M để trung hòa. Tính nồng độ mol/L của mẫu X.
Câu 4: a) Lan thực hiện phép chuẩn độ 10,00 mL dung dịch acid nồng độ 0,10 M bằng dung dịch NaOH cùng nồng độ 0,10 M, Lan rất ngạc nhiên khi thấy phải cần 20 mL dung dịch NaOH để đạt tới điểm tương đương. Em hãy giải thích thắc mắc cho Lan.
b) Trong một thí nghiệm khác, Lan thực hiện chuẩn độ 10,00 mL HCl 0,020M. Một lần nữa, Lan rất ngạc nhiên khi chỉ cần 5,00 mL một base mạnh cùng nồng độ 0,020 M để phản ứng hoàn toàn với 10,00 mL HCl đó. Em hãy giải thích cho Lan vì sao không cần một lượng tương đương là 10,00 mL base mà chỉ cần 5,00 mL?
Câu 5: a) 10 mL dung dịch sulfuric acid 5.10-3 M được cho vào một bình định mức dung tích 100 mL.
a1) Tính pH của dung dịch sulfuric acid (cho rằng H2SO4 là acid mạnh phân li trong nước hoàn toàn cả hai proton H+).
a2) Thêm nước vào đến vạch của bình định mức thu được 100 mL dung dịch. Xác định pH của dung dịch pha loãng.
b) Viết phương trình hóa học của phản ứng giữa sulfuric acid với dung dịch sodium hydroxide.
c) Dung dịch pha loãng ở phần a2 được dùng để chuẩn độ 25,0 mL dung dịch sodium hydroxide .
c1) Dự đoán hiện tượng quan sát được khi chuẩn độ đạt đến điểm tương đương nếu dùng phenolphthalein làm chất chỉ thị cho phép chuẩn độ trên.
c2) Xác định thể tích acid cần dùng khi phép chuẩn độ kết thúc.
Câu 6: Cho ba dung dịch có cùng nồng độ: hydrochloric acid (HCl), ethanoic acid (acetic acid, CH3COOH) và sodium hydroxide (NaOH). Khi chuẩn độ riêng một thể tích như nhau của dung dịch HCl và dung dịch CH3COOH bằng dung dịch NaOH, phát biểu nào sau đây đúng?
A. Trước khi chuẩn độ, pH của hai acid bằng nhau.
B. Tại các điểm tương đương, dung dịch của cả hai phép chuẩn độ đều có giá trị pH bằng 7.
C. Cần dùng một thể tích sodium hydroxide để đạt đến điểm tương đương.
D. Giá trị pH của hai acid tăng như nhau cho đến khi đạt điểm tương đương.
Câu 7: Chuẩn độ 20 mL dung dịch hỗn hợp HCl 0,1M + HNO3 a mol/L cần dùng hết 16,5 mL dung dịch hỗn hợp KOH 0,1M và Ba(OH)2 0,05M. Giá trị của a là
A. 0,07.
B. 0,08.
C. 0,065.
D. 0,068.
Câu 8: Chuẩn độ 20 mL dung dịch HCl chưa biết nồng độ đã dùng hết 17 mL dung dịch NaOH 0,12M. Xác định nồng độ mol của dung dịch HCl.
A. 0,102M.
B. 0,12M.
C. 0.08M.
D. 0,112M.
Câu 9: Cho 10 mL dung dịch X gồm hỗn hợp HCl 1M và H2SO4 0,5M. Thể tích dung dịch NaOH 1M cần để chuẩn độ dung dịch X là
A. 10mL.
B. 15mL.
C. 20mL.
D. 25mL.
Ôn tập chương Cân bằng hoá học
Phần I. Đề bài
DẠNG 1: CÂN BẰNG HÓA HỌC
Câu 1: Viết biểu thức hằng số cân bằng cho các phản ứng sau:
a) Phản ứng điều chế ester:
b) Phản ứng hình thành thạch nhũ:
c) Phản ứng điều chế SO3:
d) Phản ứng điều chế HI:
Câu 2: Khi tổng hợp NH3 từ N2 và H2 thấy rằng nồng độ ở trạng thái cân bằng của N2 là 0,02M; của H2 là 2M và của NH3 là 0,6M. Tính hằng số cân bằng của phản ứng.
Câu 3: Trong một bình kín, nồng độ ban đầu của SO2 và O2 tương ứng là 4M và 2M. Tính hằng số cân bằng của phản ứng: , biết rằng khi đạt trạng thái cân bằng đã có 80% SO2 đã phản ứng.
Câu 4: Trong một bình kín, nồng độ ban đầu của SO2 và O2 tương ứng là 4M và aM. Phản ứng: có hằng số cân bằng là 40, biết rằng khi đạt trạng thái cân bằng đã có 90% SO2 đã phản ứng. Tính giá trị của a.
Câu 5: Cho biết phản ứng sau: CO (g) + H2O (g) ⇌ CO2 (g) + H2 (g)
Ở 700oC hằng số cân bằng KC của phản ứng là 1,873. Tính nồng độ H2O và CO ở trạng thái cân bằng, biết rằng hỗn hợp ban đầu có 0,400 mol H2O và 0,200 mol CO trong bình kín dung tích 10 lít ở 700oC.
Câu 6: Cho vào bình kín (dung dịch 1 L) 1 mol H2 và 1 mol I2, sau đó thực hiện phản ứng ở 350oC – 500oC theo phương trình hóa học sau:
Ở trạng thái cân bằng có sự tạo thành 1,56 mol HI. Tính hằng số cân bằng của phản ứng trên.
Câu 7: Bromine chloride phân hủy tạo thành bromine và chlorine theo phương trình hóa học sau: .
Ở nhiệt độ xác định, hằng số cân bằng của phản ứng trên có giá trị 11,1. Giả sử BrCl được cho vào vào bình kín có dung tích 1 L. Kết quả phân tích cho biết hỗn hợp phản ứng ở trạng thái cân bằng có 4 mol Cl2. Tính nồng độ mol của BrCl ở trạng thái cân bằng.
Câu 8: Iodine bị phân hủy bởi nhiệt theo phản ứng sau: I2 (g)⇌ 2I (g)
Ở 727oC hằng số cân bằng của phản ứng KC = 3,80.10‑5. Cho 0,2 mol I2 vào một bình kín dung tích 5 lít ở 727oC. Tính nồng độ của I2 và I ở trạng thái cân bằng.
Câu 9: Cho 0,8 mol SO2 và a mol O2 vào một bình dung tích 2 lít được giữ ở một nhiệt độ không đổi. Phản ứng trong bình xảy ra như sau: 2SO2(g) + O2(g) ⇌ 2SO3(g)
Khi phản ứng đạt đến trạng thái cân bằng, lượng SO3 trong bình là 0,6 mol, hằng số cân bằng là 20. Tính giá trị của a.
Câu 10: Khi đung nóng 0,5 mol HI trong một bình kín 2 lít, xảy ra phản ứng sau: 2HI (g)⇌ H2 (g) + I2 (g). Ở một nhiệt độ T, hằng số KC của phản ứng trên là . Hãy tính nồng độ HI khi phản ứng đạt trạng thái cân bằng.
DẠNG 2. CHUYỂN DỊCH CÂN BẰNG HÓA HỌC
Câu 11: Sulfur trioxide được tạo thành bằng cách oxi hóa sulfur dioxide bằng oxygen hoặc lượng dư không khí ở nhiệt độ 450oC – 500oC, chất xúc tác vanadium (V) oxide (V2O5) theo phương trình hóa học: .
Cân bằng hóa học sẽ chuyển dịch theo chiều nào khi:
a) Tăng nhiệt độ của hệ phản ứng?
b) Tăng nồng độ của khí SO2?
c) Tăng nồng độ của khí O2?
Câu 12: Cho phản ứng:
Hoàn thành bảng sau:
|
Yếu tố bên ngoài |
Cân bằng chuyển dịch theo chiều |
Yếu tố bên ngoài |
Cân bằng chuyển dịch theo chiều |
|
Tăng nhiệt độ |
|
Giảm nồng độ NH3 |
|
|
Giảm nhiệt độ |
|
Tăng nồng độ NH3 |
|
|
Tăng nồng độ N2 |
|
Tăng nồng độ H2 |
|
|
Giảm nồng độ H2 |
|
Giảm nồng độ H2 |
|
|
Tăng áp suất |
|
Giảm áp suất |
|
Câu 13: Cho các cân bằng sau:
a)
b)
c)
d)
Nếu giảm áp suất và giữ nguyên nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích.
DẠNG 3: CHẤT ĐIỆN LI, NỒNG ĐỘ ION
Câu 14: Viết các phương trình điện li (nếu có):
|
STT |
Chất |
Phương trình điện li |
|
1 |
HNO3 |
|
|
2 |
CH3COOH |
|
|
3 |
H2CO3 |
|
|
4 |
KOH |
|
|
5 |
Ba(OH)2 |
|
|
6 |
NH3+H2O |
|
|
7 |
KHSO3 |
|
|
8 |
Na2CO3 |
|
|
9 |
NaHSO4 |
|
|
10 |
Fe2(SO4)3 |
|
Câu 15: Tính nồng độ mol/L của các ion trong dung dịch
|
1 |
2 lít dung dịch có hòa tan 12 gam NaOH |
|
|
2 |
0,5 lít dung dịch có hoàn tan 0,1 mol FeCl3 |
|
|
3 |
Trộn 200 mL dung dịch NaOH 0,3M với 300mL dung dịch Ba(OH)2 0,1M |
|
|
4 |
Trộn 100mL dung dịch NaCl 0,2M với 150mL dung dịch MgCl2 0,4M |
|
|
5 |
Trộn 200mL dung dịch HCl 0,5M với 300mL dung dịch H2SO4 0,4M |
|
|
6 |
Trộn 500mL nước có hòa tan 12 gam NaOH với 300mL nước có hòa tan 11,2 gam KOH. |
|
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm Chuyên đề dạy thêm Hóa học lớp 11 các chương hay khác:
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

