Thuyết BRONSTED – LOWRY về acid- base lớp 11 (Chuyên đề dạy thêm Hóa 11)
Tài liệu Thuyết BRONSTED – LOWRY về acid- base Hóa học lớp 11 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa học 11.
Thuyết BRONSTED – LOWRY về acid- base lớp 11 (Chuyên đề dạy thêm Hóa 11)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa học 11 (cả 3 sách) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
1) Khái niệm acid – base theo thuyết brønsted – Lowry
Thuyết brønsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.
Trong dung dịch:
H+ + H2O ⇌ H3O+
Ví dụ 1: NH4Cl phân li trong nước:
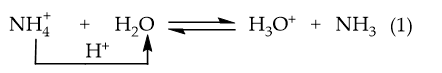
→ Phản ứng thuận là acid (nhường H+), H2O là base (nhận H+).
Phản ứng nghịch: H3O+ là acid, NH3 là base.
Ví dụ 2: NH3 phân li trong nước:
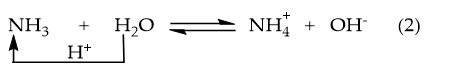
→ Trong phản ứng thuận: NH3 là base (nhận H+); H2O là acid (nhường H+).
Trong phản ứng nghịch: là acid, là base .
Ví dụ 3: phân li trong nước:
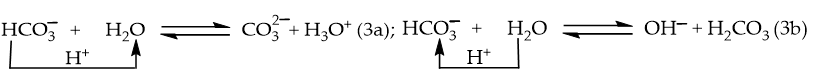
→ vừa có thể nhường H+ vừa có thể nhận H+ → có tính chất lưỡng tính.
Phân tử H2O cũng vừa thể nhường H+ vừa có thể nhận H+ → H2O là chất lưỡng tính.
Các ion thủy phân trong nước tạo H+ hoặc H3O+ là acid, tạo OH – là base.
Ví dụ 4: AlCl3 phân li trong nước:
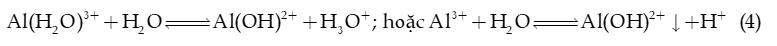
→ Phản ứng (1), (3a), (3b), (4) còn gọi là phản ứng thuỷ phân trong nước.
+ Acid mạnh và base mạnh phân li hoàn toàn trong nước (không tồn tại dạng phân tử trong nước). Acid yếu, base yếu phân li một phần trong nước.
+ AlCl3, FeCl3 có môi trường acid, đất chứa Al3+, Fe3+ là đất chua → Khử chua cần bón vôi.
+ Phèn chua (K2SO4.Al2(SO4)3.24H2O) làm trong nước, chất cầm màu trong phẩm nhuộm.
+ Na2CO3 dùng trong công nghiệp dệt, nhuộm, công nghiệp thủy tinh,…
2) Ưu điểm của thuyết Brønsted – Lowry
- Theo Arrhenius (A-rê-ni-ut), acid là những chất khi tan trong nước phân li ra H+ (proton), base là những chất khi tan trong nước phân li ra OH –.
→ Theo Arrhenius chỉ đúng cho trường hợp dung môi là nước.
- Theo thuyết Brønsted – Lowry, tổng quát hơn thuyết Arrhenius, phân tử không có nhóm OH như NH3 hoặc ion cũng là base.
Phần I. Đề bài
PHẦN A. CÁC DẠNG BÀI TẬP TỰ LUẬN
DẠNG 1: PHƯƠNG TRÌNH THỦY PHÂN CỦA MUỐI
1) Ion không bị thủy phân
+ Cation gốc base mạnh :
+ Anion gốc acid mạnh:
2) Cation gốc base yếu, thủy phân tạo môi trường axit ( )
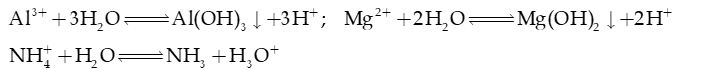
3) Anion gốc acid yếu ( .), thủy phân tạo môi trường base
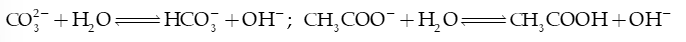
4) Anion gốc acid yếu ( ), thủy phân tạo môi trường acid hoặc base
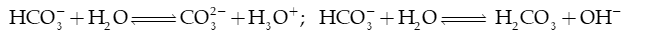
Ví dụ 1: NH4Cl phân li trong nước:
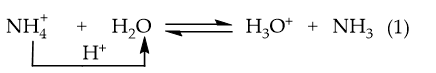
→ Phản ứng thuận là acid (nhường H+), H2O là base (nhận H+).
Phản ứng nghịch: H3O+ là acid, NH3 là base.
→ NH4Cl thủy phân tạo môi trường acid.
Câu 1: Sodium carbonate (Na2CO3) có rất nhiều ứng dụng như dùng trong công nghiệp dệt, nhuộm, công nghiệp thủy tinh,… do sinh ra từ phản ứng thủy phân .
Viết phương trình phản ứng thủy phân , cho biết môi trường của sodium carbonate.
Câu 2: Nước Javel (chứa NaClO và NaCl) được dùng làm chất tẩy rửa, khử trùng. Trong dung dịch, ion ClO- nhận proton của nước để tạo thành HClO.
a) Viết phương trình hóa học của phản ứng xảy ra và xác định chất nào là acid, chất nào là base trong phản ứng trên.
b) Dựa vào phản ứng, hãy cho biết môi trường của nước Javel là acid hay base.
Câu 3: Phèn chua (K2SO4.Al2(SO4)3.24H2O) có ứng dụng làm trong nước, làm chất cầm màu trong công nghiệp nhuộm,… do ion Al3+ thủy phân trong nước tạo kết tủa dạng keo trắng.
a) Viết phương trình điện li của phèn chua.
b) Viết phương trình thủy phân của Al3+.
c) Cho biết môi trường của phèn chua.
Câu 4: Dựa vào thuyết acid – base của Bronsted – Lowry, hãy xác định chất nào là acid, chất nào là base trong các phản ứng sau:
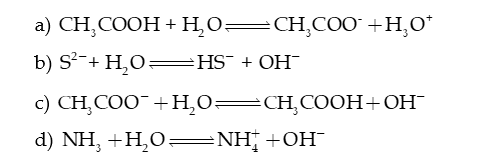
Câu 5: Viết phương trình thủy phân (nếu có), xác định môi trường của dung dịch muối.
|
STT |
Muối |
Phương trình thủy phân |
Môi trường |
|
1 |
Fe(NO3)3 |
|
Base |
|
2 |
Na2CO3 |
|
|
|
3 |
CuSO4 |
|
|
|
4 |
NH4Cl |
|
|
|
|
K2SO4 |
|
|
|
5 |
CH3COONa |
|
|
|
6 |
Al(NO3)3 |
|
|
|
7 |
K2SO3 |
|
|
|
8 |
Ba(NO3)2 |
|
|
|
9 |
Na2S |
|
|
|
10 |
(NH4)2SO4 |
|
|
PHẦN B. CÁC DẠNG BÀI TẬP TRẮC NGHIỆM
Câu 6: Theo thuyết Brønsted – Lowry về acid – base, những chất hoặc ion có khả năng cho H+ là
A. Acid.
B. Base.
C. Lưỡng tính.
D. Muối.
Câu 7: Theo thuyết Brønsted – Lowry về acid – base, những chất hoặc ion có khả năng nhận H+ là
A. Acid.
B. Base.
C. Lưỡng tính.
D. Muối
Câu 8: Theo thuyết Brønsted – Lowry về acid – base, chất nào sau đây là acid?
A. NH3.
B. CH3COOH.
C. C2H5OH.
D. C6H12O6
Câu 9: Theo thuyết Brønsted – Lowry về acid – base, ion nào sau đây không phải là acid?
A. Al3+.
B. .
C. H3O+.
D.
Câu 10: Phân tử hay ion nào sau đây không có trong dung dịch NaOH?
A. Na+.
B. .
C. NaOH.
D. H3O+
Câu 11: Phân tử hay ion nào sau đây không có trong dung dịch HCl?
A. HCl.
B. H+.
C. Cl-.
D. H2O
Câu 12: Theo thuyết Brønsted – Lowry về acid – base, ion nào sau đây là acid?
A. CH3COO-.
B. .
C. .
D. Al3+
Câu 13: Theo thuyết Brønsted – Lowry về acid – base, chất nào sau đây là base?
A. CH3COOH.
B. HCl.
C. NH3.
D. HF
Câu 14: Các chất hay ion chỉ có tính acid là
A. .
B. .
C. .
D. .
Câu 15: Ion nào sau đây khi thủy phân trong nước vừa có thể tạo môi trường acid vừa có thể tạo môi trường base?
A. .
B. .
C. .
D. .
Câu 16: Cho phương trình: . Phát biểu nào sau đây là đúng?
A. H2O là base.
B. là base.
C. là base.
D. là acid.
Câu 17: Trong phương trình sau: , theo phản ứng nghịch, ion hay chất nào đóng vai trò base?
A. CH3COOH.
B. H2O.
C. H3O+.
D. CH3COO-
Câu 18: Cho phương trình: . Phát biểu nào sau đây là đúng?
A. NH4+ là base.
B. NH4+ là acid.
C. H2O là acid.
D. H3O+ là base.
Câu 19: Chất nào sau đây thủy phân trong nước tạo môi trường base?
A. Na2CO3.
B. NaCl.
C. CuSO4.
D. CH3COOH.
Câu 20: Chất nào sau đây thủy phân trong nước tạo môi trường acid?
A. K2SO4.
B. FeCl3.
C. NaOH.
D. Na2S.
Câu 21: Chất nào sau đây không có phản ứng thủy phân trong nước?
A. KCl.
B. KHS.
B. Na2SO3.
D. AlCl3.
Câu 22: Các chất hay ion có tính base là
A. , , CH3COO−.
B. , , Cl−.
C. , Na+, ZnO.
D. , Na+, Al(OH)3.
Câu 23: Các chất hay ion chỉ có tính base là
A. , CH3COO−.
B. Cl−, .
C. , Al2O3.
D. CH3COO−, .
Câu 24: Cho các chất và ion: a) ; b) ; c) ; d) CH3COO−; e) Al2O3. Các chất hay ion chỉ có tính acid là
A. a, b.
B. b, c.
C. c, d.
D. d, e.
Câu 25: Cho các chất và ion: a) ; b) Na+; c) S2−; d) ; e) NH3. Các chất hay ion chỉ có tính base là
A. a, b, c.
B. b, d, e.
C. c, d, e.
D. a, c, e.
Câu 26: Acid nào sau đây phân li hoàn toàn trong nước:
A. H3PO4.
B. H2S.
C. H2SO4.
D. HF
Câu 27: Acid nào sau đây không phân li hoàn toàn trong nước:
A. HCl.
B. HClO4.
C. HNO3.
D. H2CO3
Câu 28: Base nào sau đây phân li hoàn toàn trong nước?
A. KOH.
B. Cu(OH)2.
C. NH3OH.
D. Fe(OH)3
Câu 29: Base nào sau đây không phân li hoàn toàn trong nước?
A. Ba(OH)2.
B. NaOH.
C. Ca(OH)2.
D. Al(OH)3
Câu 30: Cho 4 dung dịch có cùng nồng độ mol là NaCl; CH3COONa; CH3COOH; H2SO4. Dung dịch có độ dẫn điện lớn nhất là
A. NaCl.
B. CH3COONa.
C. CH3COOH.
D. H2SO4.
Câu 31: Chất nào sau đây là chất điện li mạnh?
A. SO3.
B. H2SO3.
C. HCl.
D. C2H5OH.
Câu 32: Chất nào sau đây không dẫn điện được?
A. KCl rắn, khan.
B. CaCl2 nóng chảy.
C. NaOH nóng chảy.
D. HBr trong nước.
Câu 33: Chất nào sau đây không phải là chất điện li trong nước?
A. HCl.
B. CH3COOH.
C. glucose.
D. NaOH
Câu 34: Phương trình điện li nào sau đây không đúng?

Câu 35: Các dung dịch sau đây có cùng nồng độ mol, dung dịch nào dẫn điện tốt nhất?
A. Ca(OH)2.
B. H2SO4.
C. NH4NO3.
D. Na3PO4.
Câu 36: Chọn định nghĩa acid, base theo Brønsted - Lowry:
A. Acid là chất cho H+, base là chất cho OH−.
B. Acid là chất nhận H+, base là chất cho H+.
C. Acid là cho H+, base là chất nhận OH-.
D. Acid là cho H+, base là chất nhận H+.
Câu 37: Theo thuyết Brønsted - Lowry, NH4Cl là acid vì
A. tác dụng được với acid cho muối và nước.
B. tác dụng được với muối cho muối mới và base mới.
C. chứa ion có khả năng cho proton H+.
D. chứa ion Cl− có khả năng cho proton.
Câu 38: Cho hai phản ứng sau:
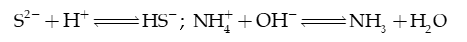
Kết luận nào sau đây đúng?
A. S2− là acid, là base.
B. S2− là base, là acid.
C. S2− là acid, là acid.
D. S2− là base, là base.
Câu 39: Cho 2 phản ứng:
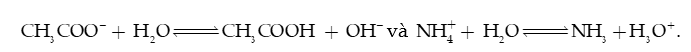
Vai trò của ion CH3COO− và ở hai phản ứng trên là
A. CH3COO− là acid, là base.
B. CH3COO− là base, là acid.
C. CH3COO− là acid, là acid.
D. CH3COO− là base, là base.
................................
................................
................................
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm Chuyên đề dạy thêm Hóa học lớp 11 các chủ đề hay khác:
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

