pH của dung dịch. Chất chỉ thị acid- base lớp 11 (Chuyên đề dạy thêm Hóa 11)
Tài liệu pH của dung dịch. Chất chỉ thị acid- base Hóa học lớp 11 gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa học 11.
pH của dung dịch. Chất chỉ thị acid- base lớp 11 (Chuyên đề dạy thêm Hóa 11)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa học 11 (cả 3 sách) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
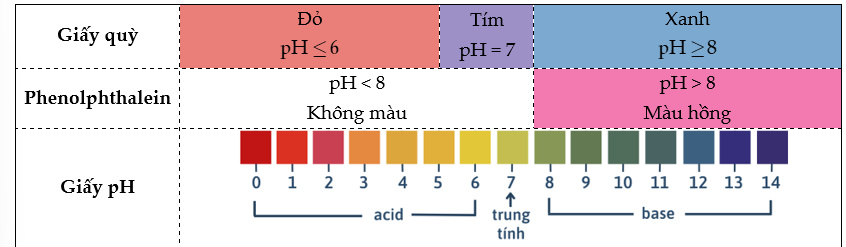
1) Tích số ion của nước
- Nước là chất điện li rất yếu: .
Ở 25oC, nồng độ H+ và OH- trong nước là vô cùng nhỏ: [] = []= M .
→ Tích số ion của nước: .
2) pH của dung dịch
- Khái niệm:
pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
+ pH càng nhỏ hơn 7, dung dịch có tính acid càng mạnh.
+ pH càng lớn hơn 7, dung dịch có tính base (tính kiềm) càng mạnh.
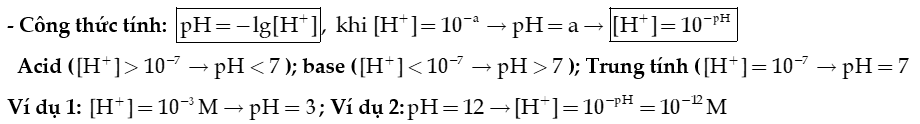
- Thang pH:

- Ý nghĩa của pH trong thực tiễn:
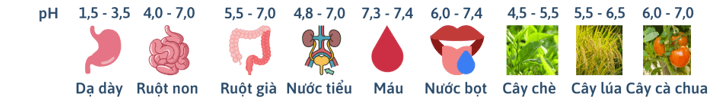
- Xác định pH bằng chất chỉ thị:
Một số chất như: quỳ tím, phenolphthalein, methyl da cam,… có màu sắc khác nhau trong môi trường acid và môi trường base. Những chất như vậy được gọi là chất chỉ thị acid – base.
Phần I. Đề bài
DẠNG 1. TÍNH pH CỦA MỘT DUNG DỊCH
1) Tính pH của một dung dịch
- Với một dung dịch chứa các axit ta có:
- Với một dung dịch chứa một hay nhiều bazơ ta có:
2) Biết pH, tính nồng độ mol của ion
- Khi pH < 7 → dung dịch có môi trường acid, ta cần tính nồng độ ion
- Khi pH > 7 → dung dịch có môi trường base ta cần tính nồng độ ion
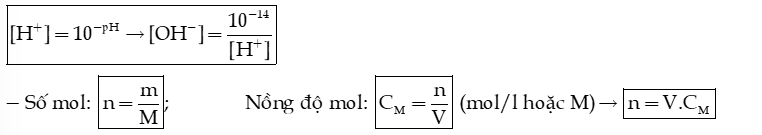
- Khi trộn 2 dung dịch với nhau ta tính mol ion; tính thể tích dung dịch; Tính nồng độ ion theo thể tích thu được; Sau đó tính pH.
Ví dụ 1: Dung dịch H2SO4 nồng độ 0,05M có pH là bao nhiêu?
Hướng dẫn giải:
Ta có:
Ví dụ 2: Dung dịch X gồm NaOH 0,004M và Ba(OH)2 0,003M. Tính pH của dung dịch X.
Hướng dẫn giải:
Ví dụ 3: Trộn 100 mL dung dịch HCl 0,1M với 100 mL dung dịch H2SO4 0,005M thu được dung dịch X.
Tính pH của dung dịch X.
Hướng dẫn giải:

Câu 1: (KNTT – SGK) Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng đất cho vào nước rồi lọc lấy phần dung dịch. Dùng máy đo được giá trị pH là 4,52.
a) Hãy cho biết môi trường của dung dịch là acid, base hay trung tính.
b) Loại đất trên được gọi là đất chua. Hãy đề xuất biện pháp giảm độ chua, tăng độ pH của đất.
Câu 2: (CD - SGK) Bình thường, chỉ số pH của nước tiểu ở người dao động trong khoảng 4,5 – 8,0. Nếu pH của nước tiểu giảm xuống dưới 4,5 thì có nghĩa là bị dư acid, còn cao hơn 8,0 thì có nghĩa là bị dư kiềm. Sỏi thận là khối chất khoáng nhỏ có thể tích tụ trong thận, gây đau khi ngăn cản dòng nước tiểu từ thận xuống niệu quản. Một trong các dấu hiệu của bệnh sỏi thận là nước tiểu bị dư acid hoặc dư kiềm. Đề xuất cách làm đơn giản để có thể tiên lượng (dự đoán có tính khoa học) bệnh sỏi thận.
Câu 3: (CTST-SGK) Một dung dịch có Tính pH và xác định môi trường của dung dịch này.
Câu 4: Hoàn thành bảng sau:
|
STT |
Dung dịch X |
Nồng độ ion H+ |
pH |
|
1 |
HCl 0,01M |
|
|
|
2 |
H2SO4 0,0005M |
|
|
|
3 |
Dung dịch X gồm HCl 0,005M và H2SO4 0,0025M |
|
|
|
4 |
Dung dịch X gồm HNO3 0,04M và HCl 0,06M |
|
|
|
5 |
Dung dịch X gồm H2SO4 0,02M và HCl 0,06M |
|
|
|
6 |
NaOH 0,001M |
|
|
|
7 |
Ba(OH)2 0,005M |
|
|
|
8 |
Dung dịch X gồm KOH 0,005M và Ba(OH)2 0,0025M |
|
|
|
9 |
Dung dịch X gồm NaOH 0,04M và KOH 0,06M |
|
|
|
10 |
Dung dịch X gồm Ba(OH)2 0,02M và NaOH 0,06M |
|
|
Câu 5: Dung dịch H2SO4 0,005 M có pH là
A. 3.
B. 2.
C. 5.
D. 4.
Câu 6: Dung dịch KOH 0,001M có pH là
A. 3.
B. 11.
C. 2.
D. 12.
Câu 7: Hòa tan 0,04gam NaOH vào nước để được 1lit dung dịch. pH của dung dịch bazơ này là
A. 4.
B. 3.
C. 11.
D. 12.
Câu 8: Hoà tan 4,9 g H2SO4 vào nước để được 10 lít dung dịchA . Dung dịch A có pH là
A. 4.
B. 1.
C. 3.
D. 2.
Câu 9: pH của dung dịch A chứa là
A. 3,3.
B. 10,7.
C. 3,0.
D. 11,0.
Câu 10: pH của dung dịch HCl 2.10-4M và H2SO4 4.10-4M là
A. 3.
B. 4.
C. 3,7.
D. 3,1.
Câu 11: Hòa tan 4,9 gam H2SO4 vào nước để được 1 lit dung dịch. pH của dung dịch axit này là
A. 4.
B. 1.
C. 3.
D. 2.
Câu 12: pH dung dịch X gồm HCl 0,01M và H2SO4 0,02M là
A. 4,3.
B. 1,3.
C. 2,3.
D. 3,3.
Câu 13: pH của dung dịch KOH 0,06M và NaOH 0,04M là
A. 1.
B. 2.
C. 13.
D. 12,8.
Câu 14: pH của dung dịch KOH 0,004M và Ba(OH)2 0,003M là
A. 12.
B. 2.
C. 13.
D. 11,6.
Câu 15: Nồng độ mol/L của dung dịch H2SO4 có pH = 2 là
A. 0,010 M.
B. 0,020 M.
C. 0,005 M.
D. 0,002 M.
Câu 16: Nồng độ mol/L của dung dịch Ba(OH)2 có pH = 12 là
A. 0,005 M.
B. 0,010 M.
C. 0,050 M.
D. 0,100 M.
Câu 17: Trộn 200 mL dung dịch H2SO4 0,05 M với 300 mL dung dịch HCl 0,1 M thu được dung dịch Y. pH của dung dịch Y là
A. 1.
B. 4.
C. 3.
D. 1,2
Dạng 2: Tính pH khi trộn dung dịch acid với dung dịch base
1) Tính pH của dung dịch thu được

Ví dụ: Trộn 100 mL dung dịch (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 mL dung dịch (gồm H2SO4 0,0375M và HCl 0,0125M), thu được dung dịch X. Giá trị pH của dung dịch X là
A. 7. B. 2. C. 1. D. 6.
Hướng dẫn giải:
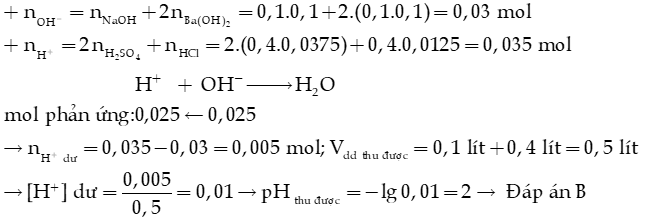
Câu 18: (CTST-SGK) Tính pH của dung dịch thu được sau khi trộn 40 mL dung dịch HCl 0,5M với 60 mL dung dịch NaOH 0,5M.
Câu 19: Tính pH của dung dịch thu được:
|
STT |
Trộn 2 dung dịch |
Tính pH của dung dịch thu được |
|
1 |
Trộn 100 mL dung dịch X gồm NaOH 0,2M và KOH 0,4M với 100 mL dung dịch H2SO4 0,2M thu được dung dịch Z. |
|
|
2 |
Trộn 100 mL dung dịch NaOH 0,2M với 300 mL dung dịch HCl 0,2M thu được dung dịch X |
|
|
3 |
Trộn 100 mL dung dịch NaOH 0,1M với 100 mL dung dịch X gồm HCl 0,1M và H2SO4 0,1M thu được dung dịch X |
|
|
4 |
Trộn 300 mL dung dịch HCl 0,01M với 100 mL dung dịch X gồm NaOH 0,02M và Ba(OH)2 0,007M |
|
|
5 |
Trộn 200 mL dung dịch X gồm HCl 0,15M và H2SO4 0,1M với 300 mL dung dịch Y gồm NaOH 0,2M và KOH 0,15M |
|
Câu 20: Trộn 100mL dung dịch H2SO4 0,1M với 150 mL dung dịch NaOH 0,2M. Dung dịch tạo thành có pH là
A. 13,6.
B. 12,6.
C. 13.
D. 1,3.
Câu 21: Cho 100,0 mL dung dịch H2SO4 0,05M vào 100,0 mL dung dịch NaOH 0,12M thu được dung dịch X. pH của dung dịch X là
A. 7,0.
B. 2,0.
C. 13,0.
D. 12,0.
Câu 22: Cho 40mL dung dịch HCl 0,85M vào 160mL dung dịch gồm Ba(OH)2 0,08M; KOH 0,04M. pH của dung dịch thu được bằng
A. 2.
B. 3.
C. 12.
D. 10.
Câu 23: Trộn 200 mL dung dịch H2SO4 0,05M với 300 mL dung dịch NaOH 0,06M. pH của dung dịch tạo thành là
A. 2,7.
B. 1,6.
C. 1,9.
D. 2,4.
................................
................................
................................
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm Chuyên đề dạy thêm Hóa học lớp 11 các chủ đề hay khác:
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

