Chuyên đề dạy thêm Hóa học 11 năm 2026 (sách mới)
Tài liệu chuyên đề dạy thêm Hóa 11 sách mới gồm các dạng bài tập từ cơ bản đến nâng cao với phương pháp giải chi tiết và bài tập tự luyện đa dạng giúp Giáo viên có thêm tài liệu giảng dạy Hóa học 11.
Chuyên đề dạy thêm Hóa học 11 năm 2026 (sách mới)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thử Chuyên đề dạy thêm Hóa 11 Xem thử Các dạng bài tập Hóa 11
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa 11; Các dạng bài tập Hóa 11 (sách mới) bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
Chuyên đề dạy thêm Hóa học 11 Kết nối tri thức
Chuyên đề dạy thêm Hóa học 11 Chân trời sáng tạo
Chuyên đề dạy thêm Hóa học 11 Cánh diều
Chuyên đề Cân bằng hoá học
Chuyên đề Nitrogen – sulfur
Chuyên đề Đại cương về hoá học hữu cơ
Chuyên đề Hydrocarbon
Chuyên đề Dẫn xuất halogen - alcohol - phenol
Chuyên đề Hợp chất carbonyl - carboxylic acid
Chuyên đề Cân bằng hoá học lớp 11
Chủ đề 1: Khái niệm về cân bằng hóa học
I. PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH
1) Phản ứng 1 chiều
- Trong điều kiện xác định, chất tham gia phản ứng tạo thành chất sản phẩm, không xảy ra phản ứng ngược lại, kí hiệu là mũi tên từ trái sang phải “”
- Ví dụ: Fe (s) + 2HCl (aq) FeCl2 (aq) + H2 (g).
2) Phản ứng thuận nghịch
- Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng.
- Kí hiệu là hai nửa mũi tên ngược chiều nhau “⇌”
- Cho phản ứng thuận nghịch:

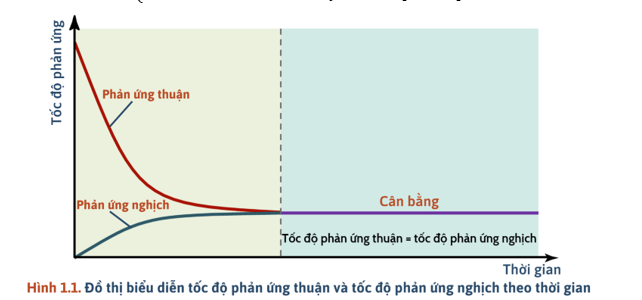
II. CÂN BẰNG HÓA HỌC
1) Trạng thái cân bằng
- Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch ().
+ Trạng thái cân bằng: phản ứng vẫn diễn ra theo 2 chiều, nồng độ các chất không thay đổi.
- Cho phản ứng thuận nghịch:

+ Thời điểm ban đầu:
+
2) Hằng số cân bằng
- Cho phản ứng thuận nghịch: aA + bB ⇌ cC + dD
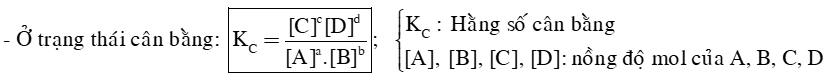
+ Thực nghiệm cho thấy: hằng số cân bằng KC của một phản ứng thuận nghịch chỉ phụ thuộc nhiệt độ và bản chất của phản ứng.
+ KC càng lớn thì phản ứng thuận càng chiếm ưu thế, KC càng nhỏ thì phản ứng nghịch càng chiếm ưu thế.
+ Đối với phản ứng có chất rắn tham gia, không biểu diễn nồng độ của chất rắn trong biểu thức hằng số cân bằng. Ví dụ: C (s) + CO2 (g) ⇌ 2CO (g) .
III. CÁC YẾU TỐ ẢNH HƯỚNG ĐẾN CHUYỂN DỊCH CÂN BẰNG HÓA HỌC
- Nguyên lí Le chatelier (Lơ Sa-tơ-li-ê): Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu sự tác động từ bên ngoài như nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
1) Ảnh hưởng của nhiệt độ
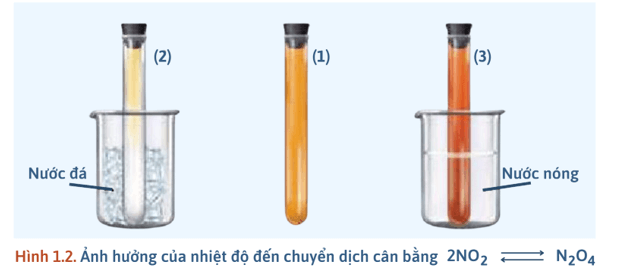
- Thí nghiệm: Ảnh hưởng của nhiệt độ đến cân bằng:
+ Chuẩn bị 3 ống nghiệm (1), (2), (3) chứa khí NO2 (có màu giống nhau), 1 cốc nước đá, 1 cốc nước nóng (70 – 80oC).
+ Ống nghiệm 1: Dùng để so sánh.
+ Ống nghiệm 2: Ngâm vào cốc nước đá khoảng 1 – 2 phút → Màu nâu đỏ nhạt dần → NO2 giảm, N2O4 tăng → Cân bằng chuyển dịch theo chiều thuận.
+ Ống nghiệm 3: Ngâm vào cốc nước nóng khoảng 1 – 2 phút → Màu nâu đỏ đậm dần → NO2 tăng, N2O4 giảm → Cân bằng chuyển dịch theo chiều nghịch.
|
- Kết luận: + Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều (, phản ứng tỏa nhiệt). + Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều (, phản ứng thu nhiệt). |
2) Ảnh hưởng của nồng độ
- Thí nghiệm: Ảnh hưởng của nồng độ đến cân bằng:
+ Cho một vài giọt phenolphthalein vào dung dịch CH3COONa, lắc đều, dung dịch có màu hồng nhạt.
+ Chia dung dịch thu được vào ba ống nghiệm với thể tích gần bằng nhau.
+ Ống (1) để so sánh; ống (2) thêm vài tinh thể CH3COONa; ống 3 thêm một vài giọt dung dịch CH3COOH.
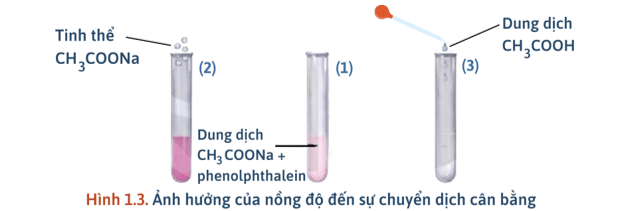
- Quan sát hiện tượng ta thấy:
+ Ống (2): Tăng nồng độ CH3COONa thấy màu sắc đậm lên → NaOH tạo ra nhiều hơn (NaOH làm phenolphthalein từ không màu chuyển sang màu hồng) → Cân bằng chuyển dịch theo chiều thuận.
+ Ống (3): Tăng nồng độ CH3COOH ta thấy màu sắc nhạt đi → CH3COOH tác dụng với NaOH, làm giảm lượng NaOH → Cân bằng chuyển dịch theo chiều nghịch).
|
- Kết luận: + Khi tăng nồng độ, cân bằng chuyển dịch theo chiều làm giảm nồng độ chất đó. + Khi giảm nồng độ, cân bằng chuyển dịch theo chiều làm tăng nồng độ chất đó. (Lưu ý: Tăng hay giảm lượng chất rắn không làm chuyển dịch cân bằng) |
3) Ảnh hưởng của áp suất
- Thí nghiệm: Ảnh hưởng của áp suất đến cân bằng:
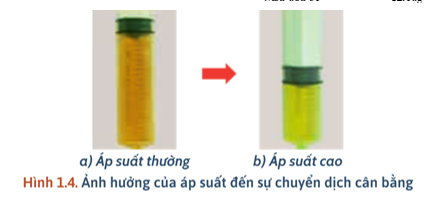
+ Tăng P, màu nâu đỏ nhạt dần → Cân bằng chuyển dịch theo chiều thuận → Số mol khí giảm.
|
- Kết luận: + Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm số mol khí. + Khi giảm áp suất, cân bằng chuyển dịch theo chiều làm tăng số mol khí. (Thay đổi P, cân bằng không chuyển dịch khi: phản ứng không có khí hoặc số mol khí ở 2 vế bằng nhau). |
Chủ đề 2: Cân bằng trong dung dịch nước
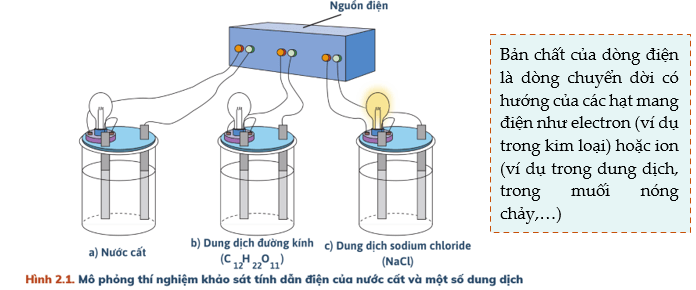
Ta thấy: Cốc đựng nước cất và dung dịch đường kính bóng đèn không sáng → Nước cất, dung dịch đường kính không dẫn điện.
Cốc đựng dung dịch NaCl bóng đèn sáng → Dung dịch NaCl dẫn điện.
|
- Sự điện li là quá trình phân li các chất trong nước tạo thành ion. - Chất điện li là chất khi tan trong nước phân li ra các ion. - Chất không điện li là chất khi tan trong nước không phân li thành các ion - Chất điện li gồm: acid, base, muối. |
1) Chất điện li mạnh
- Là chất khi tan trong nước, các phân tử chất hòa tan đều phân li ra ion

- Gồm: acid mạnh, base mạnh và hầu hết các muối
+ Acid mạnh: HCl, HBr, HI, H2SO4, HNO3, HClO4,…
+ Base mạnh: LiOH, NaOH, KOH, Ca(OH)2,…
+ Hầu hết các muối, trừ HgCl2,.
- Phương trình điện li của chất điện li mạnh, biểu diễn mũi tên 1 chiều “ ”
Ví dụ: NaCl Na+ + Cl – ; HCl H+ + Cl –;NaOH Na+ + OH –
2) Chất điện li yếu
- Là chất khi tan trong nước chỉ một phần số phân tử chất tan phân li ra ion, phần còn lại vẫn tồn tại ở dạng phân tử trong dung dịch.
- Gồm: Acid yếu (CH3COOH, HClO, HF, H2CO3, H2SO3,.), base yếu (Mg(OH)2, Fe(OH)2, Cu(OH)2, NH3,.), muối HgCl2,.
- Quá trình phân li của chất điện li yếu là một phản ứng thuận nghịch, biểu diễn “⇌ ”
Ví dụ: CH3COOH ⇌ CH3COO – + H+; NH3 + H2O ⇌ NH4+ + OH –
Phần I. Đề bài
PHẦN A. CÁC DẠNG BÀI TẬP TỰ LUẬN
DẠNG 1: CHẤT ĐIỆN LI, PHƯƠNG TRÌNH ĐIỆN LI
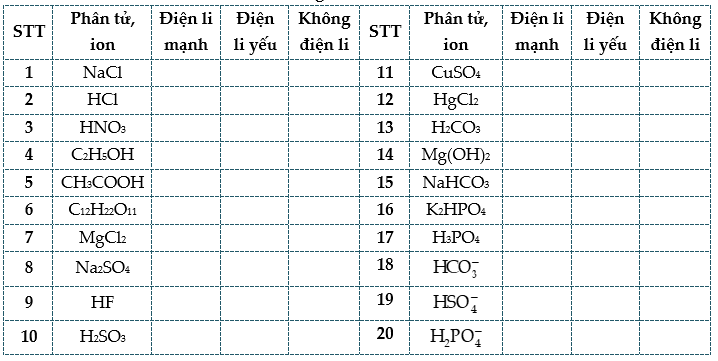
Câu 1: Điền dấu “v” để hoàn thành bảng sau:
Câu 2: Viết các phương trình điện li (nếu có):
|
STT |
Chất |
Phương trình điện li |
|
1 |
HNO3 |
|
|
2 |
HCl |
|
|
3 |
H2SO4 |
|
|
4 |
HClO4 |
|
|
5 |
CH3COOH |
|
|
6 |
H2S |
|
|
7 |
H2CO3 |
|
|
8 |
KOH |
|
|
9 |
NaOH |
|
|
10 |
Ba(OH)2 |
|
|
11 |
NH3+H2O |
|
|
12 |
KHCO3 |
|
|
13 |
KH2PO4 |
|
|
14 |
Na2CO3 |
|
|
15 |
AlCl3 |
|
|
16 |
C2H5OH |
|
|
17 |
FeSO4 |
|
|
18 |
NaHSO4 |
|
|
19 |
Ca(NO3)2 |
|
|
20 |
Fe2(SO4)3 |
|
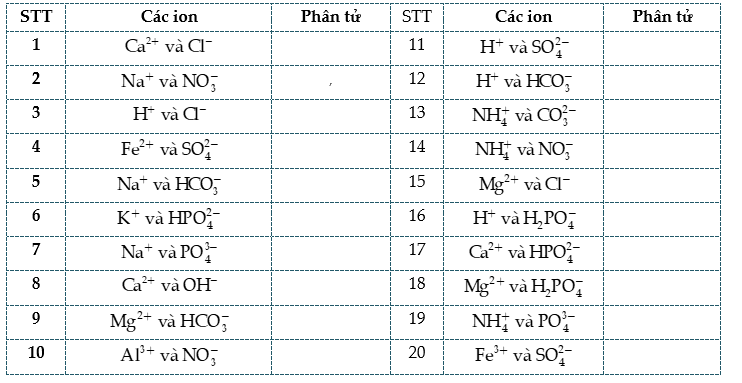
Câu 3: Viết các phân tử mà quá trình phân li của nó phân li ra các ion:
DẠNG 3: TÍNH NỒNG ĐỘ MOL CỦA ION TRONG DUNG DỊCH

Ví dụ 1: Cho 500 mL dung dịch NaOH có khối lượng là 8 gam. Tính nồng độ mol của NaOH
Hướng dẫn giải:
Đổi 500ml = 0,5 lít
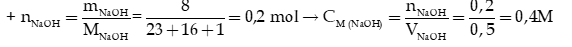
Ví dụ 2: Nồng độ mol của anion trong dung dịch Fe(NO3)2 0,20M là
A. 0,20M.
B. 0,40M.
C. 0,60M.
D. 0,80M.
Hướng dẫn giải:
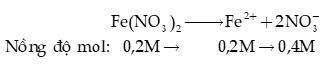
Ví dụ 3: Trộn 100 ml dung dịch Ba(OH)2 0,5M với 100 ml dung dịch KOH 0,5M, thu được dung dịch X. Nồng độ mol/L của ion OH – trong dung dịch X là
A. 0,65M.
B. 0,55M.
C. 0,75M.
D. 1,5M.
Hướng dẫn giải:

................................
................................
................................
Trên đây tóm tắt nội dung có trong Chuyên đề dạy thêm Hóa 11, để mua tài liệu mời Thầy/Cô xem thử:
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm đề thi, giáo án lớp 11 các môn học hay khác:
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

