NaOH + KHSO3 → K2SO3 + Na2SO3 + H2O | NaOH ra Na2SO3 | KHSO3 ra K2SO3 | KHSO3 ra Na2SO3
Phản ứng NaOH + KHSO3 hay NaOH ra Na2SO3 hoặc KHSO3 ra K2SO3 hoặc KHSO3 ra Na2SO3 thuộc loại phản ứng trao đổi đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về KHSO3 có lời giải, mời các bạn đón xem:
2NaOH + 2KHSO3 → K2SO3 + Na2SO3 + 2H2O
Điều kiện phản ứng
- điều kiện thường.
Cách thực hiện phản ứng
- Nhỏ từ từ KHSO3 vào ống nghiệm có chứa NaOH.
Hiện tượng nhận biết phản ứng
- Sản phẩm tạo thành tạo kết tủa trắng với muối của Bari.
Bạn có biết
- KHSO3 có thể phản ứng với các dung dịch kiềm để thu được muối sunfit.
Ví dụ minh họa
Ví dụ 1:
KHSO3 không phản ứng với dung dịch nào sau đây?
A. K2CO3. B. NaOH. C. KOH. D. H2SO4.
Hướng dẫn giải
K2CO3 không phản ứng với KHSO3.
Đáp án A.
Ví dụ 2:
Dẫn khí CO2 vào ống nghiệm chứa KHSO3, sản phẩm thu được là
A. K2CO3. B. KOH. C. K2S. D. Không có phản ứng xảy ra.
Hướng dẫn giải
CO2 không phản ứng với KHSO3.
Đáp án D.
Ví dụ 3:
Cho 0,4g NaOH hòa tan vào nước được dung dịch X. Lượng dung dịch X trên phản ứng vừa đủ với dung dịch KHSO3. Khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 1,58 gam. B, 1,42 gam. C. 0,78 gam. D. 1,26 gam.
Hướng dẫn giải
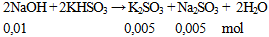
khối lượng muối = 0,005 (158 + 126) = 1,42 gam.
Đáp án B.
Xem thêm các phương trình hóa học hay khác:
- Ca(OH)2 + 2KHSO3 → K2SO3 + CaSO3 + 2H2O
- Ba(OH)2 + 2KHSO3 → K2SO3 + BaSO3 + 2H2O
- 2KHSO3 -to→ K2SO3 +SO2 + H2O
- KHSO3 + HCl → KCl + SO2 + H2O
- KHSO3 + HBr → KBr + SO2 + H2O
- 2KHSO3 + H2SO4 → K2SO4 + 2SO2 + 2H2O
- KHSO3 + KHSO4 → K2SO4 + SO2 + H2O
- 2KHSO3 + 2NaHSO4 → K2SO4 + Na2SO4+ 2SO2 + 2H2O
- 2KHSO3 + Ba(HSO4)2 → K2SO4 + BaSO4+ 2SO2 + 2H2O
- 2KHSO3 + Ca(HSO4)2 → K2SO4 + CaSO4+ 2SO2 + 2H2O
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



