Đề thi Giữa kì 1 Hóa học 9 có đáp án (3 đề)
Tuyển chọn 3 đề thi Giữa kì 1 Hóa học 9 có đáp án năm 2025 chọn lọc được các Giáo viên nhiều năm kinh nghiệm biên soạn và sưu tầm từ đề thi Hóa học 9 của các trường THCS. Hi vọng bộ đề thi này sẽ giúp học sinh ôn tập và đạt kết quả cao trong các bài thi Giữa Học kì 1 môn Hóa học 9.
Đề thi Giữa kì 1 Hóa học 9 có đáp án (3 đề)
Chỉ từ 50k mua trọn bộ Đề thi Hóa học 9 Giữa kì 1 theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
ĐỀ BÀI
Câu 1 (2 điểm). Nêu các tính chất hóa học của bazơ? Mỗi tính chất minh họa bằng một phản ứng hóa học?
Câu 2 (2 điểm). Cho các chất sau: CaO, SO2, HCl, NaOH, P2O5, H2S, Na2O, Ca(OH)2.
Hãy cho biết chất nào thuộc oxit bazơ, oxit axit, bazơ, axit, muối.
Câu 3 (2 điểm). Trình bày phương pháp hóa học phân biệt các dung dịch sau chứa trong lọ mất nhãn: HCl, KOH, Na2SO4, KCl.
Câu 4 (2 điểm). Hoàn thành sơ đồ phản ứng sau:
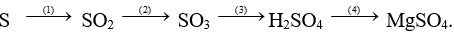
Câu 5 (2 điểm). Hòa tan 9,2g hỗn hợp gồm: Mg và MgO vào dung dịch HCl vừa đủ. Sau phản ứng thu được 1,12 lít khí ở đktc.
a) Viết các phương trình hóa học xảy ra.
b) Tính khối lượng mỗi chất có trong hỗn hợp ban đầu.
HƯỚNG DẪN GIẢI:
Câu 1:
- Các bazơ có các tính chất hóa học sau:
+ Đổi màu quỳ tím thành xanh, hoặc dung dịch phenolphtalein không màu thành đỏ.
+ Tác dụng với oxit axit và axit tạo thành muối và nước.
+ Một số dung dịch bazơ tác dụng được với một số dung dịch muối tạo thành muối mới và bazơ mới.
+ Bazơ không tan bị nhiệt phân hủy tạo thành oxit và nước.
- Các phương trình hóa học minh họa:
2NaOH + SO2 → Na2SO3 + H2O
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
2NaOH + MgCl2 → Mg(OH)2 ↓ + 2NaCl
Cu(OH)2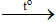 CuO + H2O
CuO + H2O
Câu 2: Trong các chất: CaO, SO2, HCl, NaOH, P2O5, H2S, Na2O, Ca(OH)2.
- Chất thuộc oxit bazơ: CaO; Na2O.
- Chất thuộc oxit axit: SO2; P2O5.
- Chất thuộc bazơ: NaOH; Ca(OH)2.
- Chất thuộc axit: HCl; H2S.
- Không có chất nào trong dãy là muối.
Câu 3:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng quỳ tím:
+ Quỳ tím hóa đỏ: HCl
+ Quỳ tím hóa xanh: KOH
+ Quỳ tím không đổi màu: Na2SO4; KCl
- Phân biệt Na2SO4, KCl dùng Ba(OH)2.
+ Có kết tủa trắng: Na2SO4
+ Không hiện tượng: KCl
Phương trình hóa học:
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4 (↓ trắng)
KCl + Ba(OH)2 → không phản ứng.
Câu 4:
S + O2 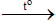 SO2
SO2
2SO2 + O2 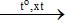 2SO3
2SO3
SO3 + H2O → H2SO4
Mg + H2SO4 → MgSO4 + H2
Câu 5 (2 điểm)
a/ Mg + 2HCl → MgCl2 + H2
MgO + 2HCl → MgCl2 + H2O
b/
nMg = nkhí = 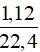 = 0,05 mol
= 0,05 mol
mMg = 0,05.24 = 1,2 gam; mMgO = 9,2 – 1,2 = 8 gam.
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 2)

ĐỀ BÀI
Câu 1: ( 3 điểm) Viết phương trình hóa học hoàn thành sơ đồ chuyển hóa sau:
Na → Na2O → NaOH → NaCl → NaOH → Na2SO3 → SO2.
Câu 2: (4 điểm)
a. (2 điểm): Trình bày phương pháp hóa học phân biệt 3 dung dịch riêng biệt đựng trong lọ mất nhãn là: KOH, KNO3, KCl. Viết phương trình hóa học minh họa.
b. (2 điểm): Có những loại phân bón hóa học: NH4NO3; Ca(H2PO4)2
- Hãy cho biết tên hóa học các loại phân bón trên.
- Nguyên tố hóa học nào có trong phân bón NH4NO3. Tính thành phần phần trăm nguyên tố dinh dưỡng có trong phân bón NH4NO3.
Câu 3: (2 điểm) Cho 500 gam dung dịch BaCl2 tác dụng hoàn toàn với 100 gam dung dịch H2SO4 có nồng độ 19,8%. Sau phản ứng thu được kết tủa A và dung dịch B.
a. Viết phương trình hóa học xảy ra.
b. Tính khối lượng kết tủa A tạo thành.
c. Tính nồng độ phần trăm của dung dịch B.
Câu 4 (1 điểm): Nung một tấn đá vôi có thành phần chính là CaCO3 đến khi phản ứng kết thúc thu được 448kg vôi sống. Viết phương trình hóa học và tính hiệu suất sau khi nung.
HƯỚNG DẪN GIẢI:
Câu 1:
4Na + O2 → 2Na2O
Na2O + H2O → 2NaOH
NaOH + HCl → NaCl + H2O
2NaCl + 2H2O 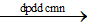 2NaOH + H2 + Cl2
2NaOH + H2 + Cl2
2NaOH + SO2 → Na2SO3 + H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
Câu 2:
a. Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng quỳ tím.
+ Quỳ tím hóa xanh: KOH
+ Quỳ tím không đổi màu: KNO3, KCl
- Phân biệt KNO3 và KCl dùng AgNO3
+ Có kết tủa trắng: KCl
+ Không hiện tượng: KNO3
Phương trình hóa học:
KCl + AgNO3 → KNO3 + AgCl (↓ trắng)
b.
- Phân đạm: NH4NO3
- Phân lân: Ca(H2PO4)2
- Nguyên tố dinh dưỡng có trong NH4NO3 là nitơ.
%mN = 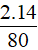 .100% = 35%
.100% = 35%
Câu 3:
a/ Phương trình hóa học:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
b/
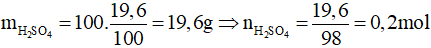
Theo PTHH có nA = naxit = 0,2 mol
Vậy mA = 0,2.233 = 46,6 gam.
c) Dung dịch B chứa HCl 0,4 mol
Bảo toàn khối lượng có:
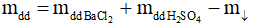 =500 + 100 - 46,6 = 553,4
=500 + 100 - 46,6 = 553,4
C% = 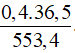 .100% = 2,64%
.100% = 2,64%
Câu 4:
CaCO3 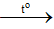 CaO + CO2
CaO + CO2
100g → 56 gam
1000kg → 560kg
Vậy H = 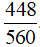 .100% = 80%
.100% = 80%
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 3)
Phần I: Trắc nghiệm khách quan (3 điểm)
Câu 1. Dãy chất nào dưới đây gồm các oxit tác dụng được với nước?
A. CaO, CuO, SO3, Na2O. |
B. CaO, N2O5, K2O, CuO. |
C. Na2O, BaO, N2O, FeO. |
D. SO3, CO2, BaO, CaO. |
Câu 2. Dãy chất nào dưới đây gồm các oxit tác dụng được với dung dịch HCl?
A. CaO, Na2O, SO2 |
B. FeO, CaO, MgO |
C. CO2, CaO, ZnO |
D. MgO, CaO, NO |
Câu 3. Oxit bazơ nào sau đây được dùng để làm khô nhiều nhất?
A. CuO |
B. FeO |
C. CaO |
D. ZnO |
Câu 4. Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng?
A. Ag, Fe, Mg |
B. Fe, Cu, Al |
C. Al, Mg, Zn |
D. Zn, Cu, Mg |
Câu 5. Để làm sạch khí O2 có lẫn tạp chất là khí CO2 và khí SO2 có thể dùng chất nào dưới đây?
A. Ca(OH)2 |
B. CaCl2 |
C. NaHSO3 |
D. H2SO4 |
Câu 6. Nhỏ từ từ dung dịch H2SO4 vào ống nghiệm đựng Cu(OH)2 thấy?
A. Cu(OH)2 không tan
B. Cu(OH)2 tan dần, dung dịch không màu.
C. Cu(OH)2 tan dần, dung dịch màu xanh lam và có khí bay ra
D. Cu(OH)2 tan dần, dung dịch có màu xanh lam.
Câu 7. Chất nào dưới đây không tác dụng được với axit H2SO4 đặc, nguội
A. Cu |
B. Al |
C. Mg |
D. Zn |
Câu 8. Dung dịch kiềm không có những tính chất hóa học nào sau đây?
A. Làm quì tím chuyển sang màu xanh
B. Tác dụng với axit
C. Tác dụng với dung dịch oxit axit
D. Bị nhiệt phân hủy tạo thành oxit bazơ
Câu 9. Cặp chất có thể tồn tại được trong cùng một dung dịch là
A. NaCl và NaOH |
B. KOH và H2SO4 |
C. Ca(OH)2 và HCl |
D. NaOH và FeCl2 |
Câu 10. Loại phân đạm có hàm lượng nitơ cao nhất là
A. (NH4)2SO4 |
B.NH4NO3 |
C.CO(NH2)2 |
D.NH4Cl |
Câu 11. Dãy gồm các phân bón hóa học đơn là
A. KCl, NH4Cl, (NH4)2SO4 và Ca(H2PO4)2
B. KCl, KNO3, Ca3(PO4)2 và Ca(H2PO4)2
C. K2SO4, NH4NO3, (NH4)3PO4 và Ca(H2PO4)2
D. KNO3, KCl, NH4H2PO4 và K2SO4.
Câu 12. Cho các chất: SO2, NaOH, MgCO3, CaO và HCl. Số cặp chất phản ứng được với nhau là
A. 2 |
B. 4 |
C. 3 |
D. 5 |
Phần II: Tự luận (7 điểm)
Câu 1 (2 điểm):
a/ Cho các chất sau: CaO, SO2, HCl, NaOH, P2O5, H2SO3, Na2O, Ca(OH)2.
Hãy cho biết chất nào thuộc oxit bazơ, oxit axit, bazơ, axit, muối?
b/ Hoàn thành sơ đồ phản ứng sau:
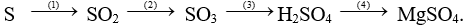
Câu 2 (2 điểm): Trình bày phương pháp hóa học nhận biết các dung dịch đựng trong các lọ mất nhãn sau: HCl, NaOH, Na2SO4, NaCl.
Câu 3 (3 điểm): Biết 8 (gam) CuO phản ứng vừa đủ với 200 gam dung dịch axit clohiđric.
a) Tính khối lượng muối có trong dung dịch thu được sau phản ứng.
b) Tính nồng độ phần trăm dung dịch axit cần dùng.
ĐÁP ÁN:
Phần I: Trắc nghiệm
1 - D |
2 - B |
3 - C |
4 - C |
5 - A |
6 - D |
7 - B |
8 - D |
9 - A |
10 - C |
11 - A |
12 - D |
Câu 4. Đáp án A
Dẫn hỗn hợp khí qua dung dịch nước vôi trong (Ca(OH)2) dư. Khí CO2 và SO2 phản ứng bị giữ lại, khí O2 không phản ứng thoát ra khỏi dung dịch thu được O2 tinh khiết.
CO2 + Ca(OH)2 → CaCO3 (↓) + H2O
SO2 + Ca(OH)2 → CaSO3 (↓) + H2O
Câu 6: Đáp án D
Cu(OH)2(rắn) + H2SO4 (không màu) → CuSO4 + 2H2O
Hiện tượng: Cu(OH)2 tan dần, sau phản ứng thu được dung dịch có màu xanh lam.
Câu 9. Đáp án A
NaCl + NaOH → không phản ứng
2KOH + H2SO4 → K2SO4 + 2H2O
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
2NaOH + FeCl2 → Fe(OH)2 (↓) + 2NaCl
Câu 12. Đáp án D
Các cặp chất xảy ra phản ứng hóa học là: SO2 và NaOH; SO2 và CaO; NaOH và HCl; MgCO3 và HCl; CaO và HCl.
Phần II: Tự luận
Câu 1.
a) Oxit bazơ: CaO; Na2O
Oxit axit: SO2; P2O5
Axit: HCl, H2SO3.
Bazơ: NaOH; Ca(OH)2.
b) 1) S + O2 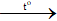 SO2
SO2
2) 2SO2 + O2 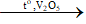 2SO3
2SO3
3) SO3 + H2O → H2SO4
4) Mg + H2SO4 (loãng) → MgSO4 + H2 (↑)
Câu 2:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng quỳ tím:
+ Quỳ tím chuyển sang màu đỏ → HCl
+ Quỳ tím chuyển sang màu xanh → NaOH
+ Quỳ tím không đổi màu → Na2SO4, NaCl (nhóm I)
- Phân biệt nhóm I: Dùng BaCl2
+ Có kết tủa trắng → Na2SO4
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
+ Không hiện tượng → NaCl
Câu 3:
nCuO = 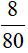 = 0,1mol
= 0,1mol
CuO + 2HCl → CuCl2 + H2O
a) Theo PTHH có: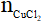 =
= 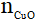 = 0,1 mol
= 0,1 mol
Khối lượng muối có trong dung dịch sau phản ứng là:
mmuối = 0,1. 135 = 13,5 gam.
b) Theo PTHH có: nHCl = 2.nCuO = 0,2 mol
Khối lượng chất tan có trong 200 gam dung dịch axit clohiđric là:
mHCl = 0,2.36,5 = 7,3 gam
Nồng độ phần trăm của dung dịch HCl cần dùng là:
C% = .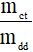 .100% =
.100% = 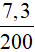 .100% = 3,65%.
.100% = 3,65%.
................................
................................
................................
Trên đây tóm tắt một số nội dung miễn phí trong bộ Đề thi Hóa học 9 năm 2026 mới nhất, để mua tài liệu trả phí đầy đủ, Thầy/Cô vui lòng xem thử:
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Đề thi các môn học lớp 9 năm 2025 học kì 1 và học kì 2 được biên soạn bám sát cấu trúc ra đề thi mới Tự luận và Trắc nghiệm giúp bạn giành được điểm cao trong các bài thi lớp 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 9 (các môn học)
- Giáo án điện tử lớp 9 (các môn học)
- Giáo án Toán 9
- Giáo án Ngữ văn 9
- Giáo án Tiếng Anh 9
- Giáo án Khoa học tự nhiên 9
- Giáo án Vật Lí 9
- Giáo án Hóa học 9
- Giáo án Sinh học 9
- Giáo án Địa Lí 9
- Giáo án Lịch Sử 9
- Giáo án GDCD 9
- Giáo án Tin học 9
- Giáo án Công nghệ 9
- Đề thi lớp 9 (các môn học)
- Đề thi Ngữ Văn 9 (có đáp án)
- Đề thi Toán 9 (có đáp án)
- Đề thi Tiếng Anh 9 mới (có đáp án)
- Đề thi Tiếng Anh 9 (có đáp án)
- Đề thi Khoa học tự nhiên 9 (có đáp án)
- Đề thi Lịch Sử và Địa Lí 9 (có đáp án)
- Đề thi GDCD 9 (có đáp án)
- Đề thi Tin học 9 (có đáp án)
- Đề thi Công nghệ 9 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

