Bộ 3 đề thi Hóa học 9 Học kì 1 năm 2025 tải nhiều nhất
Với Bộ 3 đề thi Hóa học 9 Học kì 1 năm 2025 tải nhiều nhất, chọn lọc giúp học sinh ôn tập và đạt kết quả cao trong bài thi Học kì 1 Hóa học 9.
Bộ 3 đề thi Hóa học 9 Học kì 1 năm 2025 tải nhiều nhất
Chỉ từ 150k mua trọn bộ Đề thi Hóa học 9 Học kì 1 theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
(Thí sinh không được sử dụng tài liệu)
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Khi thả một cây đinh sắt sạch vào dung dịch CuSO4 loãng, có hiện tượng sau:
A. Sủi bọt khí, màu xanh của dung dịch nhạt dần.
B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần.
C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu.
D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần.
Câu 2: Bazơ nào sau đây không tan trong nước.
A. NaOH B. KOH C. Ca(OH)2 D. Cu(OH)2
Câu 3: Phương trình hóa học nào sau đây không đúng?
A. 2Fe + 3Cl2 → 2FeCl3
B. 2CO2 + Ca(OH)2 → Ca(HCO3)2
C. 2NaCl + H2SO4 → Na2SO4 + 2HCl
D. Fe + CuSO4 → FeSO4 + Cu
Câu 4: Dãy phi kim tác dụng với oxi tạo thành oxit axit là:
A. S, C, P. B. S, C, Cl2.
C. C, P, Br2. D. C, Cl2, Br2.
Câu 5: Muối nào sau đây không tan.
A. K2SO3 B. Na2SO3 C. CuCl2 D. BaSO4
Câu 6: Có các chất đựng riêng biệt trong mỗi ống nghiệm sau đây: Al, Fe, CuO, CO2, FeSO4, H2SO4. Lần lượt cho dung dịch NaOH vào mỗi ống nghiệm trên. Dung dịch NaOH phản ứng với:
A. Al, CO2, FeSO4, H2SO4 B. Fe, CO2, FeSO4, H2SO4
C. Al, Fe, CuO, FeSO4 D. Al, Fe, CO2, H2SO4
Câu 7: Dãy chất gồm các oxit bazơ là:
A. CuO, NO, MgO, CaO. B. CuO, CaO, MgO, Na2O.
C. CaO, CO2, K2O, Na2O. D. K2O, FeO, P2O5, Mn2O7.
Câu 8: Có một mẫu Fe bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với:
A. Dung dịch NaOH dư B. Dung dịch H2SO4 loãng
C. Dung dịch HCl dư D. Dung dịch HNO3 loãng
Câu 9: Cho 5,6 g sắt vào dung dịch đồng sunfat dư. Khối lượng đồng thu được là:
A. 6,4 g B. 12,8 g C. 64 g D. 128 g
Câu 10: Cho 0,1 mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
A. 20,4 B. 1,36 g C. 13,6 g D. 27,2 g
Câu 11: X là nguyên tố phi kim có hoá trị III trong hợp chất với khí hiđro. Biết thành phần phần trăm khối lượng của hiđro trong hợp chất là 17,65%. X là nguyên tố:
A. C B. S C. N D. P
Câu 12: Ngâm một lá Zn dư vào 200 ml dung dịch AgNO3 1M. Khi phản ứng kết thúc khối lượng Ag thu được là:
A. 6,5 gam B. 10,8 gam C. 13 gam D. 21,6 gam
Câu 13: Axit nào sau đây dễ bay hơi.
A. H2SO3 B. H2SO4 C. HCl D. HNO3
Câu 14: Chất nào sau đây góp phần nhiều nhất vào sự hình thành mưa axit?
A. CO2 B. SO2 C. N2 D. O3
Câu 15: Phản ứng nào dưới đây là phản ứng trao đổi?
A. 2Na + 2H2O → 2NaOH + H2
B. BaO + H2O → Ba(OH)2
C. Zn + H2SO4 → ZnSO4 + H2
D. BaCl2 + H2SO4 → BaSO4 + 2HCl
Câu 16. Kim loại X có những tính chất hóa học sau:
- Phản ứng với oxit khi nung nóng.
- Phản ứng với dung dịch AgNO3.
- Phản ứng với dung dịch H2SO4 loãng giải phóng khí H2 và muối của kim loại hóa trị II. Kim loại X là:
A. Cu B. Fe C. Al D. Na.
Câu 17: Axit làm quỳ tím hóa
A. Xanh B. đỏ C. Hồng D. Vàng
Câu 18: Những tính chất vật lí chung của kim loại là:
A. Tính dẻo, có ánh kim và rất cứng.
B. Tính dẻo, tính dẫn điện, nhiệt độ nóng chảy cao.
C. Tính dẫn điện, dẫn nhiệt, có ánh kim, có khối lượng riêng lớn.
D. Tính dẻo, tính dẫn điện, dẫn nhiệt, và có ánh kim.
Câu 19: Nguyên liệu sản xuất nhôm là quặng:
A. Hematit B. Manhetit C. Bôxit D. Pirit.
Câu 20: Kim loại nào sau đây nhẹ nhất (có khối lượng riêng nhỏ nhất)?
A. Liti (Li) B. Na (Natri )
C. Kali (K) D. Rubiđi (Rb)
II - TỰ LUẬN (3 điểm)
Câu 1: (1 điểm) Bằng phương pháp hóa học hãy nhận biết dung dịch các chất chứa trong các lọ bị mất nhãn sau: HCl, KOH, NaNO3, Na2SO4.
Câu 2: (2 điểm) Cho hỗn hợp gồm Fe, Mg có khối lượng 8g tác dụng hết với dung dịch HCl thu được 4,48 lít khí H2 (đktc).
a) Viết phương trình hóa học của Fe và Mg với dung dịch HCl.
b) Tính tỉ lệ theo số mol của Fe và của Mg trong hỗn hợp ban đầu.

Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 2)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Chất nào dưới đây là muối trung hòa?
A. Ba(OH)2 B. Ca(NO3)2 C. H3PO4 D. CuO
Câu 2: Dung dịch nào làm quỳ tím chuyển sang màu đỏ?
A. Dung dịch axit B. Dung dịch kiềm
C. Dung dịch muối D. Dung dịch cồn
Câu 3: Có những chất khí sau: CO2; H2; O2; SO2; CO. Khí nào làm đục nước vôi trong?
A. CO2 B. CO2; CO; H2
C. CO2; SO2 D. CO2; CO; O2
Câu 4: Dung dịch H2SO4 tác dụng với dãy chất là:
A. Fe, CaO, HCl, BaCl2 B. Cu, BaO, NaOH, Na2CO3
C. Mg, CuO, HCl, NaCl D. Zn, BaO, NaOH, Na2CO3
Câu 5: Trong các loại phân bón hoá học sau loại nào là phân đạm?
A. KCl B. Ca3(PO4)2 C. K2SO4 D.(NH2)2CO
Câu 6: Muối nào dưới đây không bị nhiệt phân hủy
A. KMnO4 B. KClO3 C. KNO3 D. KCl
Câu 7: Cho dãy các kim loại sau: Fe, W, Hg, Cu kim loại trong dãy có nhiệt độ nóng chảy thấp nhất:
A. W B. Cu C. Hg D. Fe
Câu 8: Dãy nào dưới đây gồm các dung dịch muối tác dụng được với kim loại Mg?
A. ZnCl2, Fe(NO3)2 và CuSO4
B. CaCl2, NaCl và Cu(NO3)2
C. CaCl2, NaNO3 và FeCl3
D. Ca(NO3)2, FeCl2 và CuSO4
Câu 9: Dãy nào dưới đây được sắp xếp theo thứ tự giảm dần mức độ hoạt động hóa học
A. K, Ag, Fe, Zn B. Ag, Fe, K, Zn
C. K, Zn, Fe, Ag D. Ag, Fe, Zn, K
Câu 10: Để phân biệt 3 kim loại Fe, Mg và Al cần dùng
A. Dung dịch HCl và dung dịch NaOH
B. H2O và dung dịch HCl
C. Dung dịch NaOH và H2O
D. Dung dịch CuCl2 và H2O
Câu 11: Phản ứng không tạo ra muối Fe(III):
A. Fe tác dụng với dung dịch HCl
B. Fe2O3 tác dụng với dung dịch HCl
C. Fe3O4 tác dụng với dung dịch HCl
D. Fe(OH)3 tác dụng với dung dịch H2SO4
Câu 12: Để loại bỏ khí CO2 có lẫn trong hỗn hợp (O2; CO2). Người ta cho hỗn hợp đi qua dung dịch chứa:
A. HCl B. Na2SO4 C. NaCl D. Ca(OH)2
Câu 13: Nhỏ vài giọt dung dịch FeCl3 vào ống nghiệm đựng 1ml dung dịch NaOH, thấy xuất hiện
A. chất không tan màu nâu đỏ
B. chất không tan màu trắng
C. chất tan không màu
D. chất không tan màu xanh lơ
Câu 14: Thực hiện các thí nghiệm sau:
(1) Đốt dây sắt trong bình khí clo dư
(2) Cho Fe vào dung dịch HNO3 đặc, nguội
(3) Cho Fe vào dung dịch HCl loãng, dư
(4) Cho Fe vào dung dịch H2SO4 loãng, dư
(5) Cho Fe vào dung dịch H2SO4 đặc, nóng
Số thí nghiệm tạo ra muối Fe(II) là:
A. 3 B. 4 C. 2 D. 1
Câu 15: Khí lưu huỳnh đioxit SO2 được tạo thành từ cặp chất là
A. K2SO4 và HCl. B. K2SO4 và NaCl.
C. Na2SO4 và CuCl2 D. Na2SO3 và H2SO4
Câu 16: Dung dịch của chất X có pH > 7 và khi tác dụng với dung dịch kali sunfat tạo ra chất không tan. Chất X là.
A. BaCl2 B. NaOH C. Ba(OH)2 D. H2SO4
Câu 17: Nhỏ từ từ dung dịch axit clohiđric vào cốc đựng một mẩu đá vôi cho đến dư axit. Hiện tượng nào sau đây xảy ra?
A. Sủi bọt khí, đá vôi không tan
B. Đá vôi tan dần, không sủi bọt khí.
C. Không sủi bọt khí, đá vôi không tan
D. Sủi bọt khí, đá vôi tan dần.
Câu 18: Cặp chất nào dưới đây không thể tồn tại trong cùng một dung dịch.
A. NaNO3 và HCl B. NaNO3 và BaCl2
C. K2SO4 và BaCl2 D. BaCO3 và NaCl
Câu 19: Cho 3,2g hỗn hợp CuO và Fe2O3 tác dụng hết với dung dịch HCl thu được 2 muối có tỉ lệ mol 1 : 1. Số mol HCl đã tham gia phản ứng là:
A. 0,1 mol B. 0,15 mol C. 0,2 mol D. 0,25 mol
Câu 20: Nếu hàm lượng của sắt là 70% thì đó là oxit nào trong các oxit sau:
A. FeO B. Fe2O3
C. Fe3O4 D. Không có oxit nào phù hợp
Câu 21: Cho 14,5 g hỗn hợp Mg, Zn, Fe tác dụng hết với dung dịch H2SO4 loãng thấy thoát ra 6,72 lít H2 ở đktc. Cô cạn dung dịch sau phản ứng thì khối lượng muối khan thu được là:
A. 34,2 g B. 43,3 g C. 33,4 g D. 33,8 g
Câu 22: Oxit bazơ nào sau đây được dùng làm chất hút ẩm (chất làm khô) trong phòng thí nghiệm?
A. CuO B. ZnO C. CaO D. PbO
Câu 23: Cặp chất nào sau đây tác dụng với nhau tạo thành muối kết tủa:
A. Na2O và H2SO4 B. Na2SO4 và BaCl2
C. NaOH và H2SO4 D. NaOH và MgCl2
Câu 24: Kim loại X có những tính chất hoá học sau :
- Phản ứng với oxi khi nung nóng
- Phản ứng với dung dịch AgNO3 giải phóng Ag
- Phản ứng với dung dịch H2SO4 loãng giải phóng khí H2 và muối của kim loại hoá trị II
Kim loại X là:
A. Cu B. Na C. Al D. Fe
Câu 25: Dãy kim loại nào sau đây được sắp xếp theo chiều tăng dần mức độ hoạt động hoá học
A. Pb, Fe, Ag, Cu B. Fe, Pb, Ag, Cu
C. Ag, Cu, Pb, Fe D. Ag, Cu, Fe, Pb
Câu 26: Để phân biệt được 2 dung dịch Na2CO3 và Na2SO4 có thể dùng dung dịch:
A. BaCl2 B. KNO3 C. NaOH D. HCl
Câu 27: X là một oxit sắt. Biết 1,6g X tác dụng vừa hết với 30ml dung dịch HCl 2M. X là oxit nào của sắt?
A. FeO B. Fe2O3
C. Fe3O4 D. Không xác định được
Câu 28: Cho các phát biểu sau:
(1) Phân amoni nitrat NH4NO3 chứa 21% nitơ
(2) Phân photphat tự nhiên có thành phần chính là Ca3(PO4)2, tan chậm trong đất chua
(3) Các phân bón KCl, K2SO4, Ca(H2PO4)2 và (NH2)2CO đều là phân bón đơn
(4) Cu(OH)2, Fe(OH)3, Al(OH)3, Ba(OH)2 đều bị nhiệt phân hủy cho oxit và nước
(5) SO2, SO3, N2O5, P2O5, CO, CO2 là những oxit axit
(6) Các bazơ Mg(OH)2, Fe(OH)2, Ca(OH)2 đều có thể làm quỳ tím hóa xanh
Số phát biểu sai là:
A. 2 B. 3 C. 4 D. 5
Câu 29: Biết rằng 4,48 lít (đktc) hỗn hợp hai khí CO2 và SO2 có tỷ khối đối với hiđro là 29,5. Dẫn 4,48 lít (đktc) hỗn hợp trên qua dung dịch Ba(OH)2 dư. Sau phản ứng thu được bao nhiêu gam kết tủa ?
A. 40,4 B. 23 C. 21 D. 42,4
Câu 30: Công thức cấu tạo của đá vôi là:
A. CaCO3 B. Ca(NO3)2 C. Ca2O D. CaO
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 3)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Oxit axit là:
A. Những oxit tác dụng với dung dịch axit tạo thành muối và nước.
B. Những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
C. Những oxit không tác dụng với dung dịch bazơ và dung dịch axit.
D. Những oxit chỉ tác dụng được với muối.
Câu 2: Chất tác dụng với nước tạo ra dung dịch bazơ là:
A. CO2 B. Na2O C. SO2 D. P2O5
Câu 3: Có 3 oxit màu trắng: MgO, Al2O3, Na2O. Có thể nhận biết được các chất đó bằng thuốc thử sau:
A. Chỉ dùng quì tím. B. Chỉ dùng axit
C. Chỉ dùng phenolphtalein D. Dùng nước
Câu 4: Một oxit của photpho có thành phần phần trăm của P bằng 43,66%. Biết phân tử khối của oxit bằng 142 đvC. Công thức hoá học của oxit là:
A. P2O3. B. P2O5. C. PO2. D. P2O4.
Câu 5: Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là:
A. Fe, Cu, Mg. B. Zn, Fe, Cu.
C. Zn, Fe, Al. D. Fe, Zn, Ag
Câu 6: Kẽm tác dụng với dung dịch axit clohiđric sinh ra:
A. Dung dịch có màu xanh lam và chất khí màu nâu.
B. Dung dịch không màu và chất khí có mùi hắc.
C. Dung dịch có màu vàng nâu và chất khí không màu
D. Dung dịch không màu và chất khí cháy được trong không khí.
Câu 7: Để phân biệt 2 dung dịch HCl và H2SO4 loãng. Ta dùng một kim loại:
A. Mg B. Ba C. Cu D. Zn
Câu 8: Dung dịch axit clohiđric tác dụng với đồng(II) hiđroxit tạo thành dung dịch màu:
A. Vàng đậm. B. Đỏ.
C. Xanh lam. D. Da cam.
Câu 9: Trung hoà 100 ml dung dịch H2SO4 1M bằng V (ml) dung dịch NaOH 1M. V là:
A. 50 ml B. 200 ml C. 300 ml D. 400 ml
Câu 10: Sục 2,24 lít khí CO2 vào dung dịch chứa 0,2 mol NaOH. Dung dịch thu được sau phản ứng chứa:
A. NaHCO3 B. Na2CO3
C. Na2CO3 và NaOH D. NaHCO3 và NaOH
Câu 11: NaOH có tính chất vật lý nào sau đây?
A. Natri hiđroxit là chất rắn không màu, ít tan trong nước
B. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt
C. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh và không tỏa nhiệt
D. Natri hiđroxit là chất rắn không màu, không tan trong nước, không tỏa nhiệt.
Câu 12: Điện phân dung dịch NaCl bão hoà, có màng ngăn giữa hai điện cực, sản phẩm thu được là:
A. NaOH, H2, Cl2 B. NaCl, NaClO, H2, Cl2
C. NaCl, NaClO, Cl2 D. NaClO, H2 và Cl2
Câu 13: Trong các loại phân bón hóa học sau, loại nào là phân đạm?
A. KCl B. Ca3(PO4)2
C. K2SO4 D. (NH2)2CO
Câu 14: Cặp chất nào sau đây không thể tồn tại trong 1 dung dịch (phản ứng với nhau)?
A. NaOH, MgSO4 B. KCl, Na2SO4
C. CaCl2, NaNO3 D. ZnSO4, H2SO4
Câu 15: Trong các loại phân bón hoá học sau loại nào là phân đạm?
A. KCl B. Ca3(PO4)2 C. K2SO4 D. (NH2)2CO
Câu 16: Khối lượng của nguyên tố N có trong 200 g (NH4)2SO4 là
A. 42,42 g B. 21,21 g C. 24,56 g D. 49,12 g
Câu 17: Trong các kim loại sau đây, kim loại dẫn điện tốt nhất là:
A. Nhôm (Al) B. Bạc (Ag)
C. Đồng (Cu) D. Sắt (Fe)
Câu 18: Kim loại được dùng làm đồ trang sức vì có ánh kim rất đẹp, đó là các kim loại:
A. Ag, Cu. B. Au, Pt. C. Au, Al. D. Ag, Al.
Câu 19: Cho một bản nhôm có khối lượng 70g vào dung dịch CuSO4. Sau một thời gian lấy bản nhôm ra cân có khối lượng 76,9g. Khối lượng đồng bám vào bản nhôm là:
A. 19,2g B. 10,6g C. 16,2g D. 9,6g
Câu 20: Cho 10,5g hỗn hợp 2 kim loại Cu và Zn vào dd H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần % theo khối lượng của Cu và Zn lần lượt là:
A. 61,9% và 38,1% B. 38,1% và 61,9%
C. 65% và 35% D. 35% và 65%
Câu 21: Hoà tan hoàn toàn 32,5 gam một kim loại M (hoá trị II) bằng dung dịch H2SO4 loãng được 11,2 lít khí hiđro (ở đktc). M là
A. Zn B. Fe C. Mg D. Cu
Câu 22: Nguyên liệu sản xuất nhôm là quặng:
A. Hematit B. Manhetit C. Bôxit D. Pirit.
Câu 23: Cho 10,8 g một kim loại M (hóa trị III) phản ứng với khí clo tạo thành 53,4g muối. Kim loại M là:
A. Na B. Fe C. Al D. Mg.
Câu 24: Gang là hợp kim của sắt với cacbon và một lượng nhỏ các nguyên tố khác như: Si, Mn, S,… trong đó hàm lượng cacbon chiếm:
A. Từ 2% đến 6% B. Dưới 2%
C. Từ 2% đến 5% D. Trên 6%
Câu 25: Một tấn quặng manhetit chứa 81,2% Fe3O4. Khối lượng Fe có trong quặng là:
A. 858 kg B. 885 kg
C. 588 kg D. 724 kg
Câu 26: Clo hoá 33,6g một kim loại A ở nhiệt độ cao thu được 97,5g muối ACl3. A là kim loại:
A. Al B. Cr C. Au D. Fe
Câu 27: Kim loại nào dưới đây tan được trong dung dịch kiềm:
A. Mg B. Al C. Fe D. Ag
Câu 28: Dịch vị dạ dày thường có pH trong khoảng 2,0 – 3,0. Những người bị bệnh viêm loát dạ dày, tá tràng thì lượng axit HCl tiết ra quá nhiều do đó dịch vị dạ dày có pH < 2. Để chữa bệnh này, người bệnh phải uống thuốc muối trước bữa ăn. Thuốc muối là chất nào dưới đây?
A. NaHCO3 B. Na2CO3
C. NH4HCO3 D. (NH4)2CO3
Câu 29: Cho 3,9g K tác dụng với 101,8 g nước. Nồng độ phần trăm của dung dịch thu được là:
A. 3,5% B. 5,3% C. 6,3% D. 3,6%
Câu 30: Cho phản ứng: BaCO3 + 2X → H2O + Y + CO2
X và Y lần lượt là:
A. H2SO4 và BaSO4 B. HCl và BaCl2
C. H3PO4 và Ba3(PO4)2 D. H2SO4 và BaCl2
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 4)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
I – TRẮC NGHIỆM (7 ĐIỂM)
Câu 1: Chất khí nào sau đây là nguyên nhân gây ra hiệu ứng nhà kính?
A. CO2 B. O2 C. N2 D. H2
Câu 2: Cho 7,2 gam một loại oxit sắt tác dụng hoàn toàn với khí hiđro cho 5,6 gam sắt. Công thức oxit sắt là:
A. FeO. B. Fe2O3. C. Fe3O4. D. FeO2.
Câu 3: Để tách riêng Fe2O3 ra khỏi hỗn hợp BaO và Fe2O3 ta dùng:
A. Nước. B. Giấy quì tím.
C. Dung dịch HCl. D. dung dịch NaOH.
Câu 4: Sản phẩm của phản ứng phân hủy canxicacbonat bởi nhiệt là:
A. CaO và CO B. CaO và CO2
C. CaO và SO2 D. CaO và P2O5
Câu 5: Dẫn hỗn hợp khí gồm CO2 , CO , SO2 lội qua dung dịch nước vôi trong (dư), khí thoát ra là:
A. CO B. CO2
C. SO2 D. CO2 và SO2
Câu 6: Oxit nào sau đây khi tác dụng với nước tạo ra dung dịch có pH > 7?
A. CO2 B. SO2
C. CaO D. P2O5
Câu 7: Dãy các chất không tác dụng được với dung dịch HCl là:
A. Al, Fe, Pb.
B. Al2O3, Fe2O3, Na2O.
C. Al(OH)3, Fe(OH)3, Cu(OH)2.
D. BaCl2, Na2SO4, CuSO4.
Câu 8: Chất phản ứng được với dung dịch HCl tạo ra một chất khí có mùi hắc, nặng hơn không khí và làm đục nước vôi trong:
A. Zn B. Na2SO3 C. FeS D. Na2CO3
Câu 9: Khi nhỏ từ từ H2SO4 đậm đặc vào đường chứa trong cốc hiện tượng quan sát được là:
A. Sủi bọt khí, đường không tan.
B. Màu trắng của đường mất dần, không sủi bọt.
C. Màu đen xuất hiện và có bọt khí sinh ra.
D. Màu đen xuất hiện, không có bọt khí sinh ra.
Câu 10: Dung dịch KOH phản ứng với dãy oxit:
A. CO2; SO2; P2O5; Fe2O3
B. Fe2O3; SO2; SO3; MgO
C. P2O5; CO2; Al2O3; SO3
D. P2O5; CO2; CuO; SO3
Câu 11: Trung hoà hoàn toàn 200ml dung dịch KOH 0,5M bằng 200g dung dịch HCl a%. Nồng độ phần trăm của dung dịch (a%) là:
A. 1,825% B. 3,650% C. 18,25% D. 36,50%
Câu 12: Để phân biệt hai dung dịch NaOH và Ba(OH)2 đựng trong hai lọ mất nhãn ta dùng thuốc thử:
A. Quỳ tím B. HCl C. NaCl D. H2SO4
Câu 13: Những cặp nào sau đây có phản ứng xảy ra:
1. Zn + HCl →
2. Cu + HCl →
3. Cu + ZnSO4 →
4. Fe + CuSO4 →
A. 1; 2 B. 3; 4 C. 1; 4 D. 2; 3
Câu 14: Trong tự nhiên muối natri clorua có nhiều trong:
A. Nước biển. B. Nước mưa.
C. Nước sông. D. Nước giếng.
Câu 15: Cho 0,1 mol Ba(OH)2 vào dung dịch NH4NO3 dư thì thể tích thoát ra ở đktc là:
A. 2,24 lít B. 4,48 lít C. 22,4 lít D. 44,8 lít
Câu 16: Trong các kim loại sau đây, kim loại dẫn điện tốt nhất là:
A. Nhôm (Al) B. Bạc (Ag) C. Đồng (Cu) D. Sắt (Fe)
Câu 17: Kim loại vừa tác dụng với dd HCl vừa tác dụng được với dung dịch KOH:
A. Fe, Al B. Ag, Zn C. Al, Cu D. Al, Zn
Câu 18: Cho vào dung dịch HCl một cây đinh sắt, sau một thời gian thu được 11,2 lít khí hiđro (đktc). Khối lượng sắt đã phản ứng là:
A. 28 gam B. 12,5 gam C. 8 gam D. 36 gam
Câu 19: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học giảm dần:
A. Na, Mg, Zn B. Al, Zn, Na
C. Mg, Al, Na D. Pb, Al, Mg
Câu 20: Thành phần chính của đất sét là Al2O3.2SiO2.2H2O. Phần trăm khối lượng của nhôm trong hợp chất trên là:
A. 20,93 % B. 10,46 % C. 24,32 % D. 39,53 %.
II - TỰ LUẬN (3 điểm)
Câu 1: (2 điểm)
Viết phương trình hóa học biểu diễn các chuyển đổi sau đây:
Câu 2: (3 điểm)
Hòa tan hoàn toàn 4,8 gam magie vào dung dịch axit clohidric 10%, sau phản ứng thu được dung dịch A và khí B.
a) Viết phương trình phản ứng xảy ra?
b) Tính thể tích khí B thoát ra (đktc)
c) Tính khối lượng dung dịch Axit clohidric 10% đã dùng?
d) Tính nồng độ phần trăm của dung dịch A tạo thành sau phản ứng?
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 5)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
I - TRẮC NGHIỆM (7 Điểm)
Câu 1: Oxit tác dụng với nước tạo ra dung dịch làm quỳ tím hóa xanh là:
A. CO2 B. P2O5 C. Na2O D. MgO
Câu 2: Dãy oxit tác dụng với dung dịch NaOH:
A. CuO, Fe2O3, SO2, CO2.
B. CaO, CuO, CO, N2O5.
C. CO2, SO2, P2O5, SO3.
D. SO2, MgO, CuO, Ag2O.
Câu 3: Công thức hoá học của sắt oxit, biết Fe(III) là:
A. Fe2O3. B. Fe3O4. C. FeO. D. Fe3O2.
Câu 4: Cặp chất tác dụng với nhau sẽ tạo ra khí lưu huỳnh đioxit là:
A. CaCO3 và HCl B. Na2SO3 và H2SO4
C. CuCl2 và KOH D. K2CO3 và HNO3
Câu 5: CuO tác dụng với dung dịch H2SO4 tạo thành:
A. Dung dịch không màu.
B. Dung dịch có màu lục nhạt.
C. Dung dịch có màu xanh lam.
D. Dung dịch có màu vàng nâu.
Câu 6: Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M.
Thể tích dung dịch HCl đã dùng là:
A. 2,5 lít B. 0,25 lít C. 3,5 lít D. 1,5 lít
Câu 7: Hoà tan 23,5 g kali oxit vào nước được 0,5 lít dung dịch A. Nồng độ mol của dung dịch A là:
A. 0,25M. B. 0,5M. C. 1M. D. 2M.
Câu 8: Cho một mẫu giấy quỳ tím vào dung dịch NaOH. Thêm từ từ dung dịch HCl vào cho đến dư ta thấy màu giấy quì:
A. Màu đỏ không thay đổi
B. Màu đỏ chuyển dần sang xanh.
C. Màu xanh không thay đổi
D. Màu xanh chuyển dần sang đỏ.
Câu 9: Cặp chất cùng tồn tại trong dung dịch (không tác dụng được với nhau) là:
A. NaOH, KNO3 B. Ca(OH)2, HCl
C. Ca(OH)2, Na2CO3 D. NaOH, MgCl2
Câu 10: NaOH rắn có khả năng hút nước rất mạnh nên có thể dùng làm khô một số chất. NaOH làm khô khí ẩm nào sau đây?
A. H2S B. H2 C. CO2 D. SO2
Câu 11: MgCO3 tác dụng với dung dịch HCl sinh ra:
A. Chất khí cháy được trong không khí
B. Chất khí làm vẫn đục nước vôi trong.
C. Chất khí duy trì sự cháy và sự sống.
D. Chất khí không tan trong nước.
Câu 12: Dung dịch tác dụng được với Mg(NO3)2
A. AgNO3 B. HCl C. KOH D. KCl
Câu 13: Để làm sạch dung dịch ZnSO4 có lẫn CuSO4 ta dùng kim loại
A. Al B. Cu C. Fe D. Zn
Câu 14: Để có được dung dịch NaCl 32%, thì khối lượng NaCl cần lấy hoà tan vào 200 gam nước là:
A. 90g B. 94,12g C. 100g D. 141,18g
Câu 15: Để nhận biết 2 loại phân bón hoá học là: NH4NO3 và NH4Cl. Ta dùng dung dịch:
A. NaOH B. Ba(OH)2 C. AgNO3 D. BaCl2
Câu 16: Trong các kim loại sau đây, kim loại dẻo nhất là:
A. Đồng (Cu) B. Nhôm (Al)
C. Bạc (Ag) D. Vàng (Au)
Câu 17: Cho 10 gam hỗn hợp gồm Al và Cu vào dung dịch HCl dư thấy thoát ra 6,72 lít khí hiđro (ở đktc). Phần trăm của nhôm trong hỗn hợp là :
A. 81 % B. 54 % C. 27 % D. 40 %
Câu 18: Người ta có thể dát mỏng được nhôm thành thìa, xoong, chậu, giấy gói bánh kẹo là do nhôm có tính
A. dẻo B. dẫn điện C. dẫn nhiệt D. ánh kim
Câu 19: Có chất rắn màu đỏ bám trên dây nhôm khi nhúng dây nhôm vào dung dịch
A. AgNO3 B. CuCl2 C. Axit HCl D. Fe2(SO4)3
Câu 20: Thép là hợp kim của sắt với cacbon và một số nguyên tố khác trong đó hàm lượng cacbon chiếm:
A. Trên 2% B. Dưới 2%
C. Từ 2% đến 5% D. Trên 5%
II - TỰ LUẬN (3 điểm)
Câu 1. (1 điểm) Viết phương trình hóa học hoàn thành sơ đồ chuyển hóa sau (ghi rõ điều kiện nếu có)
Câu 2: (2 điểm) Hòa tan 13,9 g hỗn hợp hai kim loại nhôm và sắt trong 200 ml dung dịch HCl vừa đủ. Sau phản ứng thu được hỗn hợp muối và 7,84 lít khí H2 (đktc).
a) Tính thành phần phần trăm về khối lượng của mỗi kim loại trong hỗn hợp
b) Tính nồng độ mol của dung dịch HCl phản ứng.
c) Cô cạn dung dịch sau phản ứng thu được bao nhiêu gam muối khan?
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 6)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Chất nào dưới đây là muối trung hòa ?
A. Ba(OH)2 B. Ca(NO3)2 C. H3PO4 D. CuO
Câu 2: Dung dịch nào làm quỳ tím chuyển sang màu đỏ ?
A. Dung dịch axit B. Dung dịch kiềm
C. Dung dịch muối D. Dung dịch cồn
Câu 3: Nung muối canxi cacbonat ở nhiệt độ trên 900oC thu được khí gì ?
A. SO2 B. CO2 C. O2 D. SO3
Câu 4: Dãy kim loại nào sau đây tác dụng được với nước ở nhiệt độ thường?
A. Na, K, Ba, Ca B. Fe, Na, Ca, Li
C. Al, Mg, K, Ba D. Na, K, Ca, Mg
Câu 5: Cho 2,7g Nhôm vào dung dịch axit clohiđric dư. Thể tích khí hiđro thoát ra (đktc) là:
A. 3,36 lít B. 2,24 lít C. 6,72 lít D. 4,48 lít
Câu 6: Kim loại nào dưới đây không tác dụng được với dung dịch HNO3 đặc nguội và H2SO4 đặc, nguội ?
A. Al B. Fe
C. Mg D. Cả A và B đều đúng
Câu 7: Nguyên liệu dùng để sản xuất axit sunfuric trong công nghiệp là:
A. FeS và oxi B. Lưu huỳnh, không khí và nước
C. SO2 và nước D. FeS và nước
Câu 8: Cho các phản ứng sau:
Có bao nhiêu phản ứng được dùng để điều chế SO2 trong công nghiệp?
A. 3 B. 2 C. 4 D. 5
Câu 9: Cho các phát biểu sau:
(1) Phân amoni nitrat NH4NO3 chứa 21% nitơ
(2) Phân photphat tự nhiên có thành phần chính là Ca3(PO4)2, tan chậm trong đất chua
(3) Các phân bón KCl, K2SO4, Ca(H2PO4)2 và (NH2)2CO đều là phân bón đơn
(4) Cu(OH)2, Fe(OH)3, Al(OH)3, Ba(OH)2 đều bị nhiệt phân hủy cho oxit và nước
(5) SO2, SO3, N2O5, P2O5, CO, CO2 là những oxit axit
(6) Các bazơ Mg(OH)2, Fe(OH)2, Ca(OH)2 đều có thể làm quỳ tím hóa xanh
Số phát biểu sai là:
A. 2 B. 3 C. 4 D. 5
Câu 10: Khử 16 g CuO ở nhiệt độ cao, hiệu suất 70% thì thu được bao nhiêu gam chất rắn?
A. 13,76 B. 8,96 C. 12,8 D. 14,62
Câu 11: Biết rằng 4,48 lít (đktc) hỗn hợp hai khí CO2 và SO2 có tỷ khối đối với hiđro là 29,5. Dẫn 4,48 lít (đktc) hỗn hợp trên qua dung dịch Ba(OH)2 dư. Sau phản ứng thu được bao nhiêu gam kết tủa ?
A. 40,4 B. 23 C. 21 D. 42,4
Câu 12: Đặt 2 cốc nhỏ lên 2 đĩa cân, rót dung dịch HCl vào 2 cốc, khối lượng axit ở 2 cốc bằng nhau. Hai đĩa cân ở vị trí thăng bằng. Thêm vào cốc thứ nhất một lá sắt nhỏ, cốc thứ hai một lá nhôm nhỏ. Khối lượng của 2 lá kim loại bằng nhau. Hãy cho biết vị trí của 2 đĩa cân trong trường hợp cả 2 lá kim loại đều tan hết.
A. 2 đĩa cân ở vị trí thăng bằng
B. Đĩa cân đặt cốc 2 sẽ ở vị trí thấp hơn so với vị trí của đĩa cân đặt cốc 1
C. Đĩa cân đặt cốc 1 sẽ ở vị trí thấp hơn so với vị trí của đĩa cân đặt cốc 2
D. Chưa đủ dữ kiện để xác định
Câu 13: Dãy các bazơ bị nhiệt phân huỷ tạo thành oxit bazơ tương ứng và nước:
A. Cu(OH)2; Zn(OH)2; Al(OH)3; Mg(OH)2
B. Cu(OH)2; Zn(OH)2; Al(OH)3; NaOH
C. Fe(OH)3; Cu(OH)2; KOH; Mg(OH)2
D. Fe(OH)3; Cu(OH)2; Ba(OH)2; Mg(OH)2
Câu 14: Cặp chất nào dưới đây không xảy ra phản ứng
A. Fe và CuCl2 B. Zn và Al(NO3)3
C. Cu và AgNO3 D. Fe và AgNO3
Câu 15: Dãy kim loại nào dưới đây được sắp xếp theo thứ tự tăng dần mức độ hoạt động hóa học
A. K, Al, Fe, Ag B. Al, K, Ag, Fe
C. Ag, Fe, Al, K D. Fe, Ag, K, Al
Câu 16: Ở một số vùng nông thôn, về mùa đông còn xảy ra hiện tượng có người bị chết ngạt do ngộ độc khí than khi dùng bếp than để sưởi trong nhà. Đó là do
A. khí CO sinh ra khi than cháy không hoàn toàn.
B. khí CO2 sinh ra khi than cháy.
C. do nhiệt độ quá cao
D. do khí N2 sinh ra khi đốt than.
Câu 17: Muối Fe(NO3)2 có lẫn ít muối AgNO3. Có thể dùng kim loại nào sau đây để làm sạch dung dịch Fe(NO3)2?
A. Zn B. Fe C. Cu D. Ag
Câu 18: Để phân biệt 3 gói bột: Fe, Cu và Al có thể dùng các dung dịch
A. NaOH và FeCl2 B. HCl và CuCl2
C. Ca(OH)2 và NaCl D. HCl và NaOH
Câu 19: Cho 5,4 gam Al vào dung dịch NaOH loãng, dư, sau phản ứng thu được V lít khí H2 (ở đktc)
A. 4,48 lít B. 6,72 lít
C. 8,96 lít D. 5,04 lít
Câu 20: Pha dung dịch chứa 1g NaOH với dung dịch chứa 1g HCl sau phản ứng thu được dung dịch có môi trường:
A. Axit B. Bazơ C. Trung tính D. Không xác định
Câu 21: Hoà tan hoàn toàn 32,5 gam một kim loại M (hoá trị II) bằng dung dịch H2SO4 loãng được 11,2 lít khí hiđro (ở đktc). M là
A. Zn B. Fe C. Mg D. Cu
Câu 22: Cho một lá Fe vào dung dịch CuSO4, sau một thời gian lấy lá sắt ra, khối lượng dung dịch thay đổi như thế nào?
A. Tăng so với ban đầu
B. Giảm so với ban đầu
C. Không tăng, không giảm so với ban đầu
D. Tăng gấp đôi so với ban đầu
Câu 23: Nhôm là kim loại
A. dẫn điện và nhiệt tốt nhất trong số tất cả kim loại.
B. dẫn điện và nhiệt đều kém
C. dẫn điện tốt nhưng dẫn nhiệt kèm.
D. dẫn điện và nhiệt tốt nhưng kém hơn đồng.
Câu 24: Nhận định sơ đồ phản ứng sau:
Al → X → Al2(SO4)3→ AlCl3
X có thể là:
A. Al2O3 B. Al(OH)3 C. H2SO4 D. Al(NO3)3
Câu 25: Hòa tan 12g hỗn hợp gồm Al, Ag vào dung dịch H2SO4 loãng, dư. Phản ứng kết thúc thu được 13,44 lít khí H2 (đktc). Thành phần % khối lượng của Al, Ag trong hỗn hợp lần lượt là
A. 70% và 30% B. 90% và 10%
C. 10% và 90% D. 30% và 70%
Câu 26: Phản ứng tạo ra muối sắt(III) sunfat là:
A. Sắt phản ứng với H2SO4 đặc, nóng.
B. Sắt phản ứng với dung dịch H2SO4 loãng
C. Sắt phản ứng với dung dịch CuSO4
D. Sắt phản ứng với dung dịch Al2(SO4)3
Câu 27: Hoà tan hết 12g một kim loại (hoá trị II) bằng dung dịch H2SO4 loãng thu được 6,72 lít khí H2 (đktc). Kim loại này là:
A. Zn B. Fe C. Ca D. Mg
Câu 28: Cho lá sắt có khối lượng 5,6g vào dung dịch đồng(II) sunfat, sau một thời gian phản ứng nhấc lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô và cân lại thấy khối lượng lá sắt là 6,4g. Khối lượng muối tạo thành là:
A. 15,5 gam B. 16 gam C. 17,2 gam D. 15,2 gam
Câu 29: Thép là hợp kim của sắt với cacbon và một số nguyên tố khác trong đó hàm lượng cacbon chiếm:
A. Trên 2% B. Từ 0,01 - 2%
C. Từ 2% đến 5% D. Trên 5%
Câu 30: Dùng thuốc thử nào sau đây để phân biệt các chất chứa trong các ống nghiệm mất nhãn: HCl, KOH, NaNO3, Na2SO4.
A. Dùng quì tím và dung dịch CuSO4.
B. Dùng dung dịch phenolphtalein và dung dịch BaCl2.
C. Dùng quì tím và dung dịch BaCl2.
D. Dùng dung dịch phenolphtalein và dung dịch H2SO4.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 7)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Dung dịch H2SO4 tác dụng với dãy chất là
A. Fe, CaO, HCl. B. Cu, BaO, NaOH.
C. Mg, CuO, HCl. D. Zn, BaO, NaOH.
Câu 2: Để phân biệt 2 dung dịch HCl và H2SO4. Người ta dùng thuốc thử là
A. Quỳ tím. B. Zn.
C. dung dịch NaOH. D. dung dịch BaCl2.
Câu 3: Chất gây ô nhiễm và mưa axit là
A. Khí O2. B. Khí SO2. C. Khí N2. D. Khí H2.
Câu 4: Chất tác dụng được với HCl và CO2:
A. Sắt B. Nhôm C. Kẽm D. Dung dịch NaOH.
Câu 5: Phương pháp được dùng để sản xuất khí sunfurơ trong công nghiệp.
A. Phân hủy canxi sunfat ở nhiệt độ cao.
B. Đốt cháy lưu huỳnh trong oxi.
C. Cho đồng tác dụng với axit sunfuric đặc, nóng.
D. Cho muối natrisunfit tác dụng với axit clohiđric.
Câu 6: Dùng Canxi oxit để làm khô khí:
A. Khí CO2 B. Khí SO2 C. Khí HCl D. CO
Câu 7: Dung dịch axit mạnh không có tính chất là
A. Tác dụng với oxit axit tạo thành muối và nước.
B. Tác dụng với bazơ tạo thành muối và nước.
C. Tác dụng với nhiều kim loại giải phóng khí hiđrô.
D. Làm đổi màu quỳ tím thành đỏ.
Câu 8: Hòa tan 23,5 gam K2O vào nước. Sau đó dùng 250ml dung dịch HCl để trung hòa dung dịch trên. Tính nồng độ mol HCl cần dùng.
A. 1,5M B. 2,0M C. 2,5M D. 3,0M
Câu 9: Khí lưu huỳnh đioxit SO2 được tạo thành từ cặp chất là
A. K2SO4 và HCl. B. K2SO4 và NaCl.
C. Na2SO4 và CuCl2 D. Na2SO3 và H2SO4
Câu 10: Dung dịch của chất X có pH > 7 và khi tác dụng với dung dịch kali sunfat tạo ra chất không tan. Chất X là.
A. BaCl2 B. NaOH C. Ba(OH)2 D. H2SO4.
Câu 11: Nhỏ một giọt quỳ tím vào dung dịch KOH, dung dịch có màu xanh; nhỏ từ từ dung dịch H2SO4 cho tới dư, vào dung dịch có màu xanh trên thì
A. màu xanh vẫn không thay đổi.
B. màu xanh nhạt dần rồi mất hẳn.
C. màu xanh nhạt dần rồi mất hẳn, rồi chuyển sanh màu đỏ
D. màu xanh đậm thêm dần.
Câu 12: Để phân biệt 3 gói bột: Fe, Cu và Al có thể dùng các dung dịch
A. NaOH và FeCl2 B. HCl và CuCl2
C. Ca(OH)2 và NaCl D. HCl và NaOH
Câu 13: Có những chất khí sau: CO2; H2; O2; SO2; CO. Khi nào làm đục nước vôi trong.
A. CO2 B. CO2; CO; H2
C. CO2; SO2 D. CO2; CO; O2
Câu 14: CaO phản ứng được với tất cả các chất trong dãy
A. NaOH; CaO; H2O B. CaO; K2SO4; Ca(OH)2
C. H2O; Na2O; BaCl2 D. CO2; H2O; HCl
Câu 15: Khí CO tác dụng được với tất cả các chất trong dãy nào sau đây?
A. Fe2O3, CuO, O2, PbO B. CuO, CaO, C, O2
C. Al2O3, C, O2, PbO D. Fe2O3, Al2O3, CaO, O2
Câu 16: Đốt cháy 48 gam lưu huỳnh với khí oxi, sau phản ứng thu được 96 gam khí sunfurơ. Khối lượng của oxi tác dụng là:
A. 40g B. 44g C. 48g D. 52g
Câu 17: Để hòa tan hoàn toàn 1,3 g kẽm thì cần 14,7g dung dịch H2SO4 20%. Khi phản ứng kết thúc khối lượng hiđro thu được là:
A. 0,03g B. 0,04g C. 0,05g D. 0,06g
Câu 18: Hòa tan hoàn toàn 14,40 gam kim loại M (hóa trị II) trong dung dịch H2SO4 loãng, dư thu được 13,44 lít khí H2 (đktc). Kim loại M là:
A. Mg B. Ca C. Be D. Ba
Câu 19: Phản ứng giữa các chất nào sau đây không tạo ra muối sắt(II)?
A. Fe với dung dịch HCl
B. Fe với dung dịch HgCl2
C. FeO với dung dịch H2SO4 loãng
D. Fe với Cl2
Câu 20: Khối lượng Fe có thể điều chế được 200 tấn quặng hematit chứa 60% Fe2O3 là
A. 42 tấn B. 64 tấn C. 80 tấn D. 78,13 tấn
Câu 21: Đinh sắt không bị ăn mòn trong trường hợp nào sau đây?
A. Để đinh sắt trong không khí khô.
B. Ngâm đinh sắt trong ống nghiệm đựng nước có hòa tan khí oxi.
C. Ngâm đinh sắt trong ống nghiệm đựng nước muối
D. Ngâm đinh sắt trong ống nghiệm đựng nước có nhỏ vài giọt axit HCl
Câu 22: Để sản xuất gang trong công nghiệp, cần có các nguyên liệu:
A. Quặng pirit sắt (FeS2), than cốc, không khí và chất phụ gia
B. Sắt phế thải, than cốc, không khí và chất phụ gia.
C. Sắt phế thải, không khí và chất phụ gia
D. Quặng sắt hemantit (Fe2O3) hoặc manhetit (Fe3O4), tha cốc, không khí và chất phụ gia
Câu 23: Muối Fe(NO3)2 có lẫn ít muối AgNO3. Có thể dùng kim loại nào sau đây để làm sạch dung dịch Fe(NO3)2?
A. Zn B. Fe C. Cu D. Ag
Câu 24: Cho 5,4 gam hỗn hợp 2 kim loại Fe và Zn tác dụng hoàn toàn với 90 ml dung dịch HCl 2M. Khối lượng muối thu được là
A. 11,79 gam B. 11,5 gam
C. 15,71 gam D. 17,19 gam
Câu 25: Cho 5,4 gam Al vào dung dịch NaOH loãng, dư, sau phản ứng thu được V lít khí H2 (ở đktc)
A. 4,48 lít B. 6,72 lít C. 8,96 lít D. 5,04 lít
Câu 26: Các đồ vật bằng nhôm bền trong không khí và nước là do:
A. Có một lớp Al(OH)3 bên ngoài bảo vệ
B. Có một lớp Al2O3 bên ngoài bảo vệ
C. Nhôm không tan trong nước
D. Nhôm bền, không bị oxi hóa
Câu 27: Kim loại X có nhiệt độ nóng chảy cao nhất, được sử dụng làm dây tóc bóng đèn. Kim loại X là:
A. Vonfram B. Sắt C. Thủy ngân D. Vàng
Câu 28: Dãy nào dưới đây được sắp xếp theo thứ tự giảm dần mức độ hoạt động hóa học
A. K, Ag, Fe, Zn B. Ag, Fe, K, Zn
C. K, Zn, Fe, Ag D. Ag, Fe, Zn, K
Câu 29. Trong số các kim loại X, Y, Z, T thì chỉ có:
X và Y đứng trước H trong dãy hoạt động hóa học kim loại
X và T đẩy được Z ra khỏi dung dịch muối tương ứng.
Dãy sắp xếp các kim loại theo chiều giảm dần mức độ hoạt động hóa học là
A. X, Y, Z, T B. X, Y, T, Z
C. Z, T, X, Y D. Y, X, T, Z
Câu 30. Khi cho kim loại Mg (dư) vào dung dịch gồm 2 muối Cu(NO3)2 và AgNO3, sản phẩm thu được gồm
A. hai kim loại và một muối B. ba kim loại và một muối
C. ba kim loại và hai muối D. hai kim loại và 2 muối
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 8)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Trong tự nhiên muối natri clorua có nhiều trong:
A. Nước giếng. B. Nước mưa. C. Nước sông. D. Nước biển.
Câu 2: Muốn pha loãng axit sunfuric đặc ta phải:
A. Rót nhanh axit đặc vào nước.
B. Rót từ từ axit đặc vào nước.
C. Rót từ từ nước vào axit đặc.
D. Rót nước vào axit đặc.
Câu 3: Trong các oxit sau: SO2; CuO; P2O5; N2O5, oxit bazơ là:
A. SO2 B. P2O5 C. CuO D. N2O5
Câu 4: Trong các chất sau đây chất nào chứa hàm lượng sắt nhiều nhất?
A. FeO B. FeS2 C. Fe2O3 D. Fe3O4
Câu 5: Có ba lọ không nhãn, mỗi lọ đựng một dung dịch các chất sau: NaOH, Ba(OH)2, NaCl. Thuốc thử để nhận biết cả ba chất là:
A. Quỳ tím và dung dịch HCl
B. Phenolphtalein và dung dịch BaCl2
C. Quỳ tím và dung dịch K2CO3
D. Quỳ tím và dung dịch NaCl
Câu 6: Cho 8,1g một kim loại (hoá trị III) tác dụng với khí clo có dư thu được 40,05g muối. Xác định kim loại đem phản ứng:
A. Au B. Cr C. Al D. Fe
Câu 7: Trong các kim loại sau đây, kim loại có độ cứng lớn nhất là:
A. Crom (Cr) B. Nhôm (Al) C. Sắt (Fe) D. Natri (Na)
Câu 8: Phương trình hóa học nào sau đây không đúng?
A. 2Fe + 3Cl2 → 2FeCl3
B. 2CO2 + Ca(OH)2 → Ca(HCO3)2
C. 2NaCl + H2SO4 → Na2SO4 + 2HCl
D. Fe + CuSO4 → FeSO4 + Cu
Câu 9: Trong các loại phân bón sau, loại phân bón nào có lượng đạm cao nhất?
A. NH4Cl B. NH4NO3 C. (NH4)2SO4 D. (NH2)2CO
Câu 10: Đun nóng 6,.4 g lưu huỳnh và 1,3 g kẽm. Sau phản ứng thu được các chất với khối lượng là:
A. 2,17g Zn và 0,89 g S B. 5,76 g S và 1,94 g ZnS
C. 2,12 g ZnS D. 7,7 g ZnS
Câu 11: Chất làm quỳ tím ẩm chuyển sang màu đỏ là:
A. MgO B. CaO C. SO2 D. K2O
Câu 12: Dung dịch có độ bazơ mạnh nhất trong các dung dịch có giá trị pH sau:
A. pH = 8 B. pH = 12 C. pH = 10 D. pH = 14
Câu 13: Khi thả một cây đinh sắt sạch vào dung dịch CuSO4 loãng, có hiện tượng sau:
A. Sủi bọt khí, màu xanh của dung dịch nhạt dần.
B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần.
C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu.
D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Câu 14: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học tăng dần:
A. K, Al, Mg, Cu, Fe B. Cu, Fe, Mg, Al, K
C. Cu, Fe, Al, Mg, K D. K, Cu, Al, Mg, Fe
Câu 15: Ngâm lá sắt có khối lượng 56 gam vào dung dịch AgNO3 , sau một thời gian lấy lá sắt ra rửa nhẹ cân được 57,6 gam. Vậy khối lượng Ag sinh ra là
A. 10,8 g B. 21,6 g C. 1,08 g D. 2,16 g
Câu 16: Nhôm bền trong không khí là do
A. nhôm nhẹ, có nhiệt độ nóng chảy cao
B. nhôm không tác dụng với nước.
C. nhôm không tác dụng với oxi.
D. có lớp nhôm oxit mỏng bảo vệ.
Câu 17: Cho 14,5 g hỗn hợp Mg, Zn, Fe tác dụng hết với dung dịch H2SO4 loãng thấy thoát ra 6,72 lít H2 ở đktc. Cô cạn dung dịch sau phản ứng thì khối lượng muối khan thu được là:
A. 34,2 g B. 43,3 g C. 33,4 g D. 33,8 g
Câu 18: Dùng thuốc thử nào sau đây để phân biệt các chất chứa trong các ống nghiệm mất nhãn: HCl, KOH, NaNO3, Na2SO4.
A. Dùng quì tím và dung dịch CuSO4.
B. Dùng dung dịch phenolphtalein và dung dịch BaCl2.
C. Dùng quì tím và dung dịch BaCl2.
D. Dùng dung dịch phenolphtalein và dung dịch H2SO4.
Câu 19: Cặp chất nào dưới đây không thể tồn tại trong cùng một dung dịch.
A. NaNO3 và HCl B. NaNO3 và BaCl2
C. K2SO4 và BaCl2 D. BaCO3 và NaCl
Câu 20: Gang là hợp kim của sắt với cacbon và một lượng nhỏ các nguyên tố khác như: Si, Mn, S, …trong đó hàm lượng cacbon chiếm:
A. Từ 2% đến 5% B. Từ 2% đến 6%
C. Trên 6% D. Dưới 2%
II - TỰ LUẬN: (3 điểm)
Câu 1: (1,0 điểm)
Sau một lần đi tham quan nhà máy, khi về lớp làm bài tập tường trình thầy giáo có đặt ra một câu hỏi thực tế: “Khí SO2 và CO2 do nhà máy thải ra gây ô nhiễm không khí rất nặng. Vậy em hãy nêu lên cách để loại bỏ bớt lượng khí trên trước khi thải ra môi trường”. Bạn Ân cảm thấy rất khó và không biết cách trả lời em hãy hỗ trợ bạn ấy để giải quyết câu hỏi này.
Câu 2: (2 điểm) Cho m gam hỗn hợp X gồm Fe và Cu vào dung dịch H2SO4 loãng, dư thu được 4,48 lít khí (đktc) và thấy còn 8,8 gam chất rắn không tan. Lấy phần chất rắn không tan ra thu được 250 ml dung dịch Y.
a) Xác định phần trăm về khối lượng các chất trong X.
b) Dung dịch Y tác dụng vừa đủ với BaCl2 thu được 69,9 gam kết tủa. Tính nồng độ mol các chất trong Y.
c) Nếu cho 12 gam X vào 300 ml dung dịch AgNO3 0,8M. Sau một thời gian thu được 28 gam chất rắn Z. Tính khối lượng của Ag có trong Z?
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 9)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Kim loại được dùng làm vật liệu chế tạo vỏ máy bay do có tính bền và nhẹ, đó là kim loại:
A. Na B. Zn C. Al D. K
Câu 2: Dãy kim loại tác dụng được với dung dịch Cu(NO3)2 tạo thành Cu kim loại:
A. Al, Zn, Fe B. Zn, Pb, Au C. Mg, Fe, Ag D. Na, Mg, Al
Câu 3: Để điều chế dung dịch Ba(OH)2, người ta cho:
A. BaO tác dụng với dung dịch HCl
B. BaCl2 tác dụng với dung dịch Na2CO3
C. BaO tác dụng với dung dịch H2O
D. Ba(NO3)2 tác dụng với dung dịch Na2SO4
Câu 4: Dãy các kim loại nào sau đây được sắp xếp theo chiều hoạt động hóa học giảm dần?
A. Cu, Ag, Fe, Al, Mg, K B. K, Mg, Al, Fe, Cu, Ag.
C. Ag, Cu, Fe, Al, Mg, K. D. K, Mg, Al, Cu, Ag, Fe.
Câu 5: Khí CO được dùng làm chất đốt trong công nghiệp bị lẫn các tạp chất là các khí CO2, SO2, Cl2, HCl. Để làm sạch khí CO người ta dùng.....
A. dung dịch Ca(OH)2 dư. B. dung dịch NaCl dư.
C. dung dịch HCl dư. D. nước dư.
Câu 6: Cho từ từ dung dịch NaOH vào dung dịch FeCl3, lọc lấy kết tủa nung trong không khí đến khối lượng không đổi thu được chất rắn A. Chất rắn A là:
A. Fe(OH)2 B. Fe2O3 C. FeO D. Fe3O4
Câu 7: Các chất nào sau đây là bazơ:
A. NaOH; BaO; KOH; Ca(OH)2
B. KOH, Cu(OH)2; Ca(OH)2
C. Ba(OH)2; MgCl2; Al(OH)3
D. HCl; H2SO4, HNO3
Câu 8: Để nhận biết các chất rắn: Na2SO4; Ba(OH)2; NaOH cần ít nhất mấy hoá chất:
A. 1 B. 2 C. 3 D. 4
Câu 9: Có những khí sau: CO2, H2, O2, SO2. Khí nào làm đục nước vôi trong:
A. CO2, O2 B. CO2, H2, SO2
C. CO2, SO2 D. CO2, O2, H2
Câu 10: Cho 1,84 hỗn hợp 2 muối ACO3 và BCO3 tác dụng hết với dung dịch HCl thu được 0,672 lít CO2 (đktc) và dung dịch X. Khối lượng muối trong dung dịch X là:
A. 1,17g B. 3,17g C. 2,17g D. 4,17g
Câu 11: Cho 4,2 g hỗn hợp 2 kim loại Mg và Zn phản ứng hoàn toàn với dung dịch HCl được 2,24 lít H2 ở đktc. Khối lượng muối tạo ra trong dung dịch là:
A. 9,75g B. 9,5g C. 6,75g D. 1,30g
Câu 12: Để trung hoà 200 ml dung dịch hỗn hợp chứa HCl 0,3M và H2SO4 0,1M cần dùng V lít dung dịch Ba(OH)2 0,2M. V có giá trị là:
A. 400 ml B. 500 ml C. 300 ml D. 250 ml
Câu 13: Kim loại nào sau đây có tính dẫn điện tốt nhất trong số tất cả các kim loại?
A. Vàng B. Bạc C. Đồng D. Nhôm
Câu 14: Có 3 dung dịch: NaOH, HCl, H2SO4 có cùng nồng độ mol. Chỉ dùng thêm một chất nào cho dưới đây để nhận biết?
A. Quỳ tím B. Phenolphtalein
C. Dung dịch AgNO3 D. Dung dịch BaCl2
Câu 15: Trộn hai dung dịch nào sau đây sẽ có kết tủa xuất hiện?
A. Dung dịch BaCl2 và dung dịch AgNO3
B. Dung dịch Na2SO4 và dung dịch AlCl3
C. Dung dịch NaCl và dung dịch KNO3
D. Dung dịch ZnSO4 và dung dịch CuCl2
Câu 16: Phân đạm có phần trăm nitơ cao nhất là:
A. Amoni nitrat (NH4NO3) B. Anomi sunfat ((NH4)2SO4)
C. Ure (CO(NH2)2) D. Kali nitrat (KNO3)
Câu 17: Cho 23g Na tác dụng với 100g nước. Nồng độ phần trăm của dung dịch thu được là:
A. 32,8% B. 23,8% C. 30,8% D. 29,8%
Câu 18: Nung một mẫu thép có khối lượng 10g trong khí O2 dư thấy sinh ra 0,1568 lít CO2 ở đktc. Phần trăm cacbon trong mẫu thép là:
A. 0,64% B. 0,74% C. 0,84 % D. 0,48 %
Câu 19: Sau một ngày lao động người ta phải làm vệ sinh các thiết bị, máy móc, dụng cụ lao động bằng kim loại. Việc làm này có mục đích chính là gì?
A. Để kim loại sáng bóng đẹp mắt.
B. Để không gây ô nhiễm môi trường
C. Để không làm bẩn quần áo khi lao động
D. Để kim loại đỡ ăn mòn
Câu 20: Cho phát biểu đúng về hiđro clorua ở điều kiện thường:
A. Là chất khí tan nhiều trong nước
B. Là chất khí không tan trong nước
C. Là chất lỏng tan nhiều trong nước
D. Là chất lỏng không tan trong nước
II – TỰ LUẬN (3 ĐIỂM)
Câu 1 (1 điểm): Nêu hiện tượng xảy ra trong các trường hợp sau:
a) Cho đinh sắt vào dung dịch đồng (II) sunfat.
b) Cho dung dịch BaCl2 vào dung dịch H2SO4 loãng.
c) Cho vài giọt phenolphtalein vào dung dịch NaOH sau đó thêm dung dịch axit HCl dư.
Câu 2 (1 điểm): Viết các phương trình hoá học thực hiện những chuyển đổi hoá học sau:
Câu 3 (1 điểm): Biết 2,24 lít khí cacbonic (đktc) tác dụng hết với 200 ml dung dịch Ba(OH)2, sản phẩm thu được là muối trung hòa và nước.
a) Viết phương trình xảy ra.
b) Tính nồng độ mol của dung dịch Ba(OH)2 cần dùng.
c) Tính khối lượng kết tủa thu được.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 10)
(Thí sinh không được sử dụng tài liệu)
Họ và tên thí sinh:..................................................................... Lớp: ........................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31,
Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Có thể dùng một hóa chất nào sau đây để nhận biết các lọ dung dịch không dán nhãn, không màu: NaCl, Ba(OH)2 H2SO4.
A. Dung dịch NaOH B. Quỳ tím
C. Dung dịch BaCl2 D. Phenolphtalein
Câu 2: Chất nào sau đây tác dụng được với dung dịch axit H2SO4 loãng
A. CO2 B. HCl C. Zn D. Cu
Câu 3: Cặp kim loại nào sau đây phản ứng với nước ở nhiệt độ thường?
A. Na; Fe. B. Mg; K. C. K; Na. D. Al; Cu.
Câu 4: Cặp chất nào dưới đây có thể tác dụng được với dung dịch NaOH ?
A. CaO, MgO. B. KOH, Ba(OH)2.
C. Fe2O3, CO. D. CO2, SO2.
Câu 5: Chất có thể tác dụng với nước cho 1 dung dịch làm quỳ tím chuyển màu thành đỏ
A. MgO B. CO C. CaO D. SO3
Câu 6: Phương pháp điều chế khí clo trong phòng thí nghiệm là
A. điện phân nóng chảy muối ăn có màng ngăn xốp.
B. cho MnO2 tác dụng với dung dịch HCl đặc.
C. điện phân nóng chảy muối ăn.
D. điện phân dung dịch NaCl bão hòa có màng ngăn xốp.
Câu 7: Dung dịch ZnSO4 có lẫn tạp chất CuSO4. Dùng kim loại nào sau đây để làm sạch dung dịch ZnSO4
A. Fe B. Zn C. Mg D. Cu
Câu 8: Lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây
A. K2SO4 + HCl B. Na2SO4 + CuCl2
C. K2SO3 + HCl D. Na2SO4 + NaCl
Câu 9: Dãy gồm các chất là oxit bazơ:
A. CO, Fe2O3, Mn2O7 B. SiO2, Fe2O3, CO
C. ZnO, Mn2O7, Al2O3 D. CaO, CuO, MgO
Câu 10: Cặp chất nào dưới đây phản ứng với nhau để chỉ tạo thành muối và nước?
A. Natri cacbonat và axit clohiđric
B. Natri cacbonat và canxi clorua
C. Kẽm với axit clohiđric
D. Natri hiđroxit và axit clohiđric
Câu 11: Cho bột đồng qua dung dịch axit sunfuric đặc, đun nóng. Chất khí sinh ra là:
A. SO2 B. CO2 C. SO3 D. H2
Câu 12: Hòa tan 0,25 mol NaCl vào nước, thu được 2 lít dung dịch NaCl. Vậy nồng độ mol của dung dịch trên là
A. 0,125 M B. 0,25 M C. 1,25 M D. 0,5 M
Câu 13: Nhỏ từ từ dung dịch NaOH vào dung dịch CuCl2 đến khi kết tủa không tạo thêm được nữa thì dừng. Lọc lấy kết tủa đem nung thì chất rắn thu được là:
A. CuO B. CuO2 C. Cu D. Cu2O
Câu 14: Dãy gồm các chất phản ứng với nước ở điều kiện thường là
A. SO2, CuO, K2O B. Fe3O4, CuO, SiO2
C. SO2, NaOH, Zn. D. CO2, K2O, Na, K
Câu 15: Dãy gồm các chất đều là oxit axit
A. SiO2, CuO, P2O5 B. Al2O3, NO,SiO2
C. P2O5, N2O5, SO2 D. Mn2O7,NO, N2O5
Câu 16: Hòa tan oxit A vào nước thu đựơc dung dịch có pH > 7.
A có thể là oxit nào?
A. P2O5. B. SO2. C. CaO. D. CO2.
Câu 17: Cho 0,1 mol dung dịch NaCl tác dụng vừa đủ với dung dịch AgNO3 thu được kết tủa trắng AgCl. Khối lượng kết tủa là
A. 14,35g. B. 15,35g. C. 16,35g. D. 17g.
Câu 18: Cho 2,4 g kim loại Mg phản ứng hết với H2SO4. Vậy số mol của kim loại Mg là
A. 1 mol B. 0,01 mol C. 0,2 mol D. 0,1 mol
Câu 19: Dãy các chất đều phản ứng với dung dịch HCl là
A. CaO, Al2O3, Na2SO3, H2SO3
B. NaOH, Al, CuSO4, CuO
C. Cu(OH)2, Cu, CuO, Fe
D. NaOH, Al, CaCO3, Al2O3
Câu 20: Axit nào tác dụng được với Mg tạo ra khí H2:
A. H2SO4 đặc, HCl B. HCl, H2SO4(l)
C.HNO3(l), H2SO4(l) D.HNO3đặc, H2SO4đặc
II – Tự luận (3 điểm)
Câu 1: (1 điểm) Hoàn thành phương trình hóa học của các phản ứng sau:
a) HNO3 + KOH →
b) NaOH + FeCl3 →
c) H2SO4 + BaCl2 →
d) Fe + CuSO4 →
Câu 2: (1 điểm) Chỉ dùng thêm quỳ tím, hãy nhận biết các dung dịch riêng biệt đựng trong 4 lọ mất nhãn sau: H2SO4, KNO3, Ba(OH)2, K2SO4. Viết phương trình phản ứng xảy ra.
Câu 3: (1 điểm) Cho hỗn hợp A gồm Mg và MgCO3 tác dụng với dung dịch HCl dư. Dẫn khí thu được qua dung dịch nước vôi trong dư thu được 10g kết tủa và 2,8 lít khí không màu ở đktc.
a) Viết các phương trình hóa học xảy ra?
b) Tính thành phần phần trăm theo khối lượng của các chất trong hỗn hợp A.
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Bộ đề thi năm 2025 các lớp các môn học được Giáo viên nhiều năm kinh nghiệm tổng hợp và biên soạn theo Thông tư mới nhất của Bộ Giáo dục và Đào tạo, được chọn lọc từ đề thi của các trường trên cả nước.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

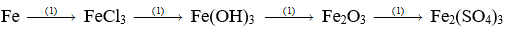






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

