8+ Đề thi học sinh giỏi Hóa học 9 (có lời giải)
Với bộ Đề thi học sinh giỏi Hóa học 9 chọn lọc được tổng hợp từ đề thi chọn HSG Hóa 9 của các Phòng Giáo dục và Sở giáo dục trên cả nước giúp học sinh ôn tập và đạt kết quả cao trong bài thi học sinh giỏi Hóa 9.
8+ Đề thi học sinh giỏi Hóa học 9 (có lời giải)
Chỉ từ 150k mua trọn bộ đề thi học sinh giỏi Hóa học 9 theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Đề thi học sinh giỏi Hóa học 9 trường THCS Đoàn Lập năm 2025
Đề thi học sinh giỏi Hóa học 9 trường THCS Lê Quý Đôn năm 2025
Đề thi học sinh giỏi Hóa học 9 trường THCS Cửu Long năm 2025
Đề thi học sinh giỏi Hóa học 9 trường THCS Nguyễn Công Trứ năm 2025
Phòng Giáo dục và Đào tạo .....
Đề thi chọn học sinh giỏi
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 150 phút
(không kể thời gian phát đề)
Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S = 32;
Cl = 35,5; K = 39; Ca = 40; Mn = 55; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137.
Câu 1.
Viết phương trình hóa học của phản ứng xảy ra trong các trường hợp sau:
a. Cho K đến dư vào dung dịch Al2(SO4)3.
b. Đun nóng dung dịch NaHCO3.
c. Cho Fe3O4 vào dung dịch HCl.
d. Cho dung dịch NaHSO4 vào dung dịch NaAlO2.
e. Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2.
f. Sục CO2 vào dung dịch K2CO3.
Câu 2.
a. Có ba gói phân hoá học bị mất nhãn là phân kali, supephotphat kép, đạm ure có thành phần chính lần lượt là KCl, Ca(H2PO4)2, (NH2)2CO, còn lại là tạp chất trơ. Hãy nhận biết ba gói phân bón đó bằng phương pháp hóa học.
b. Trình bày phương pháp tinh chế NaCl từ hỗn hợp rắn gồm NaCl, MgCl2, BaCl2 và CaCl2.
Câu 3.
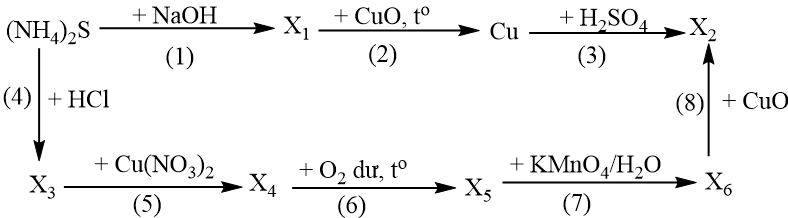
Cho sơ đồ phản ứng sau:
Các chất X1, X2, X3, X4, X5, X6 khác nhau. Viết phương trình hóa học của các phản ứng trong sơ đồ trên.
Câu 4.
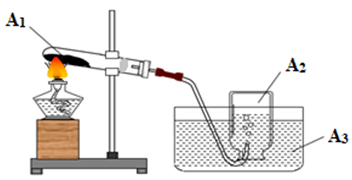
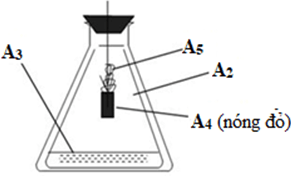
Cho các hình vẽ sau:
|
Hình 1: Mô tả thí nghiệm chế khí O2. |
Hình 2: Mô tả thí nghiệm thử tính chất hóa học của oxi. |
a. Xác định các chất A1, A2, A3, A4, A5 ở hai hình vẽ trên. Biết khối lượng mol của các chất thỏa mãn: MA1 + MA2 = 190; MA1 - MA4 = 146; MA3 + MA5 + MA5 = 86.
b. Cho biết vai trò của các chất A3, A4 trong hình 2.
Câu 5.
Hòa tan hoàn toàn 28,4 gam hỗn hợp X gồm CaCO3 và RCO3 (số mol CaCO3 gấp hai lần số mol RCO3; R là kim loại) bằng dung dịch HCl dư. Lượng khí CO2 sinh ra hấp thụ hoàn toàn bởi 250 ml dung dịch NaOH 2M, thu được dung dịch A. Thêm BaCl2 dư vào dung dịch A, thu được 39,4 gam kết tủa. Xác định R.
Câu 6.
Nung m gam hỗn hợp X gồm Fe3O4 và Al trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp Y. Chia Y làm 2 phần:
Phần 1: Cho tác dụng với dung dịch NaOH dư, thu được 0,06 mol H2, dung dịch Z và 20,16 gam chất rắn không tan.
Phần 2: Cho tác dụng với dung dịch HCl dư, thu được 0,63 mol H2.
Tính phần trăm khối lượng các chất trong hỗn hợp X.
Câu 7.
Hòa tan hoàn toàn 31,68 gam tinh thể muối kép clorua X (các kim loại trong X có hóa trị không đổi) vào nước dư, thu được dung dịch Y. Chia Y thành 2 phần bằng nhau:
Phần 1: Tác dụng vừa đủ với 90 ml dung dịch KOH 1M, thu được 2,61 gam kết tủa M(OH)2 và dung dịch Z chứa một muối duy nhất.
Phần 2: Tác dụng với dung dịch AgNO3 dư, thu được 25,83 gam kết tủa AgCl.
Xác định công thức hóa học của X.
Câu 8.
Hòa tan hoàn toàn m gam hỗn hợp X gồm Na2CO3; MgO; a mol Fe3O4 và a mol KHCO3 trong 336 gam dung dịch H2SO4 17,5%. Sau khi kết thúc các phản ứng, thu được dung dịch Y và khí CO2. Dung dịch Y chứa (m + 39,18) gam muối sunfat trung hòa và 288,9 gam H2O. Tính giá trị của m.
Câu 9.
Hoà tan hoàn toàn 7,68 gam Mg bằng m gam dung dịch HNO3 48%, thu được dung dịch X (chỉ chứa muối) và 0,16 mol hỗn hợp khí Y gồm NO, NO2 có tỉ khối so với H2 là 19. Tính nồng độ phần trăm của Mg(NO3)2 trong dung dịch X.
Câu 10.
a. Hỗn hợp X gồm Na (x mol), Al (y mol) và Fe (z mol); hỗn hợp Y gồm 27y gam Al và (11,5x + 28z) gam kim loại M có hóa trị II. Hòa tan hoàn toàn hỗn hợp X hoặc hỗn hợp Y bằng dung dịch H2SO4 loãng, đều thu được b mol H2. Xác định M.
b. Cho 14 gam hỗn hợp X gồm Cu, CuO, Fe2O3 và Fe3O4 tác dụng với dung dịch HCl vừa đủ, sau phản ứng thu được dung dịch Y. Sục từ từ khí H2S đến dư vào dung dịch Y, thu được m gam kết tủa Z. Hòa tan hết Z trong lượng dư dung dịch HNO3 đặc, nóng, thu được 0,64 mol khí NO2 (sản phẩm khử duy nhất của HNO3). Mặt khác, dung dịch Y tác dụng vừa đủ với dung dịch chứa 0,098 mol KMnO4 trong H2SO4 loãng, dư. Biết các phản ứng xảy ra hoàn toàn. Tính giá trị của m.
Đáp án và thang điểm
|
Câu |
Đáp án |
Thang điểm |
|
1 |
a. 2K + 2H2O → 2KOH + H2 6KOH + Al2(SO4)3 → 2Al(OH)3 + 3K2SO4 Al(OH)3 + KOH → KAlO2 + 2H2O b. 2NaHCO3 → Na2CO3 + CO2 + H2O c. Fe3O4 + 8HCl→ FeCl2 + 2FeCl3 + 4H2O d. 2NaAlO2 + 8NaHSO4 → 5Na2SO4 + Al2(SO4)3 + 4H2O e. AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag f. CO2 + K2CO3 + H2O →2KHCO3 |
0,25 x 8
|
|
2 |
a. Dùng dd Ca(OH)2. Không hiện tượng: KCl |
0,25 |
|
Tạo khí làm xanh quỳ ẩm và kết tủa: (NH2)2CO. (NH2)2CO + 2H2O → (NH4)2CO3 (NH4)2CO3 + Ca(OH)2 →CaCO3 +2NH3 + 2H2O |
0,5 |
|
|
Tạo kết tủa trắng: Ca(H2PO4)2. Ca(H2PO4)2 + Ca(OH)2 2CaHPO4¯ + 2H2O Hoặc Ca(H2PO4)2 + 2Ca(OH)2 Ca3(PO4)2¯ + 4H2O. |
0,25 |
|
|
b. Hòa tan hỗn hợp rắn vào nước được dd gồm: NaCl, MgCl2, BaCl2, CaCl2. Cho dd Na2CO3 dư vào dd vừa thu được ta có các phản ứng sau: MgCl2 + Na2CO3 → 2NaCl + MgCO3↓ BaCl2 + Na2CO3 → 2NaCl + BaCO3↓ CaCl2 + Na2CO3 → 2NaCl + CaCO3↓ |
0,5 |
|
|
Lọc bỏ kết tủa thu được dd gồm NaCl và Na2CO3. Cho dung dịch HCl dư vào dung dịch vừa thu được ta có phản ứng sau: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O Sau phản ứng thu được dd gồm NaCl và HCl. Đem cô cạn dd ta thu được NaCl khan. |
0,5 |
|
|
3 |
Các phương trình phản ứng: (1) (NH4)2S + 2NaOH 2NH3 + Na2S + 2H2O (2) 2NH3 + 3CuO 3Cu + N2 + 3H2O (3) Cu + 2H2SO4 đặc CuSO4 + SO2 + 2H2O (4) (NH4)2S + 2HCl 2NH4Cl + H2S (5) H2S + Cu(NO3)2 CuS + 2HNO3 (6) 2CuS + 3O2 2CuO + 2SO2 (7) 5SO2 + 2KMnO4 + 2H2O K2SO4 + 2MnSO4 + 2H2SO4 (8) H2SO4 + CuO CuSO4 + H2O |
0,25 x 8 |
|
4 |
a. Xác định các chất * A2 là khí O2 (M = 32) MA1 = 158 A1: KMnO4 MA4 = 12 A4: C |
0,5 0,5
|
|
* A3: H2O MA5 = 56 A5: Fe. |
0,5 |
|
|
b. Vai trò của A3, A4. * Mẩu than A4 đóng vai trò cháy trước tạo nhiệt độ đủ lớn cho sắt cháy C + O2 → CO2 |
0,5 |
|
|
* Vai trò của A3 (H2O) trong thí nghiệm 2 là để bảo vệ ống nghiệm không bị vỡ do Fe3O4 nóng chảy rơi xuống. 3Fe + 2O2 Fe3O4 |
0,5 |
|
|
5 |
Gọi số mol RCO3 trong 28,4 gam hỗn hợp là x, số mol CaCO3 trong hỗn hợp là 2x mol. (MR+60)x +200x =28,4 (I) |
0,25 |
|
CaCO3 + 2HCl → CaCl2 + H2O + CO2 2x 2x RCO3 + 2HCl → RCl2 + H2O + CO2 x x Dd A tác dụng với BaCl2 có phản ửng Na2CO3 + BaCl2 → 2NaCl + BaCO3. 0,2 0,2 nNaOH =0,5; nBaCO3 = 0,2 = nNa2CO3 < nNaOH Có 2 trường hợp xảy ra |
0,75 |
|
|
Trường hợp 1: Dung dịch A có Na2CO3 và NaHCO3. CO2 + NaOH → NaHCO3 (3) CO2 + 2NaOH → Na2CO3 + H2O (4) Từ (3) và (4) có nCO2= 0,3 mol 3x =0,3 MR=24 (Mg) |
0,5 |
|
|
* Trường hợp 2: Tạo muối Na2CO3 và NaOH dư., chỉ có phản ứng CO2 + 2NaOH →Na2CO3 + H2O (4) 0,2 0,2 MR = 166, không có kim loại nào thỏa mãn. |
0,5 |
|
|
6 |
8Al + 3Fe3O4 9Fe + 4Al2O3 (1) Vì Y tan trong kiềm sinh ra khí nên trong Y có Al, Fe, Al2O3. |
0,5 |
|
Phần 1 tác dụng với dd NaOH. 2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2. Al2O3 + 2NaOH 2NaAlO2 + H2O Chất rắn còn lại là Fe: nFe = 0,36 mol Số mol H2 = 0,06 nAl = 0,04 |
0,5 |
|
|
Phần 2 (nAl =0,04k; nFe =0,36k) tác dụng với dd HCl dư 2Al + 6HCl 2AlCl3 + 3H2 (1) Al2O3 + 6HCl 2AlCl3 + 3H2O (2) Fe + 2HCl FeCl2 + H2 (3) 0,06k + 0,36k = 0,63 k=1,5 |
0,5 |
|
|
Tổng số mol Fe trong Y là 0,9 mol; Al trong Y là 0,1 mol Từ (1) có nFe3O4 = 0,3; nAl2O3 = 0,4. nAl ban đầu = 0,9 mol %mAl = 25,88% nFe3O4 = 0,3 mol %mFe3O4 =74,12% |
0,5 |
|
|
7 |
Dd Y + KOH tạo M(OH)2 Y có MCl2. Z chỉ có 1 muối nên là muối KCl |
0,5 |
|
Đặt số mol KCl; MCl2 trong ½ dd Y lần lượt là x, y. Phần 2: KCl + AgNO3 AgCl + KNO3 x x MCl2 + 2AgNO3 2AgCl + M(NO3)2 y 2y => x + 2y = 0,18 |
0,5 |
|
|
- Phần 1: MCl2 + 2KOH M(OH)2 + 2KCl y 2y y 2y 2y = nKOH = 0,09 y = 0,045; x = 0,09. 0,045(MM +34) = 2,61 MM = 24 (Mg). |
0,5 |
|
|
Ban đầu các muối trong X: KCl (0,18 mol), MgCl2(0,09 mol) Do mX =31,68 > (mKCl + mMgCl2) = 21,96 Muối dạng ngậm H2O nH2O(X) = 0,54 mol |
0,25 |
|
|
Trong X: nKCl : nMgCl2 : nH2O = 0,18 : 0,09 : 0,54 = 2:1:6 Công thức của X: 2KCl.MgCl2.6H2O |
0,25 |
|
|
8 |
Na2CO3 + H2SO4 Na2SO4 + CO2 + H2O (1) MgO + H2SO4 MgSO4 + H2O (2) Fe3O4 + 4H2SO4 FeSO4 + Fe2(SO4)3 + 4H2O (3) 2KHCO3 + H2SO4 K2SO4 + 2H2O + 2CO2 (4) Hoặc nH2SO4 = 0,6 (mol)nH2O trong dd H2SO4 = 15,4 (mol) |
0,5 |
|
* nH2O trong ddY = 16,05 (mol) nFe3O4 = 0,1 (mol) |
0,5 |
|
|
7,92 (gam) |
0,5 |
|
|
nH2SO4 phản ứng = nNa2CO3 + nKHCO3 + nMgO + 4nFe3O4 nMgO =0,07 mX = 44,48 (gam) |
0,5 |
|
|
9 |
nNO = nNO2 = 0,08 |
0,5 |
|
Bảo toàn e có nNH4NO3 = 0,04 mol |
0,5 |
|
|
BT Nitơ có nHNO3 pứ =0,88 mol mdd HNO3 = 115,5 gam |
0,5 |
|
|
Khối lượng ddX = 117,1 gam C%Mg(NO3)2 = 40,44% |
0,5 |
|
|
10 |
a. Cho X (x mol Na; y mol Al; z mol Fe) + H2SO4 loãng, dư. 2Na + H2SO4 Na2SO4 + H2 Fe + H2SO4 FeSO4 + H2 2Al + 3H2SO4 Al2(SO4)3 + 3H2 Từ (1), (2), (3) x + 3y + 2z = 2b M + H2SO4 MSO4 + H2 (4). |
0,5 |
|
Ta có Từ (3), (4) 2nM + 3y = 2b |
0,25 |
|
|
x + 2z = 23 < M < 28 M là Mg. |
0,25 |
|
|
b. Quy đổi hỗn hợp X thành Fe, Cu và O ta có sơ đồ: |
0,25 |
|
|
Bảo toàn ClnHCl = 3a + 2b + 2c (mol) Bảo toàn H nH2O = 1,5a + b + c (mol) Bảo toàn khối lượng 80a + 72b + 80c = 14 (1) |
0,25 |
|
|
Khi cho dung dịch Y tác dụng với H2S thu được kết tủa là CuS và S. CuCl2 + H2SCuS↓ + 2HCl 2FeCl3 + H2S 2FeCl2 + S↓+ 2HCl Khi cho kết tủa Z tác dụng với HNO3 thu được 0,64 mol khí NO2. CuS + 10HNO3 Cu(NO3)2 + 8NO2 + H2SO4 + 4H2O S + 6HNO3 H2SO4 + 6NO2 + 2H2O 3a + 8c = 0,64 (2) |
0,25 |
|
|
Khi cho dd Y tác dụng với 0,098 mol KMnO4 trong dd H2SO4 ta có: 10FeCl2 + 6KMnO4 + 24H2SO4 5Fe2(SO4)3 + 3K2SO4 + 6MnSO4 + 24H2O +10Cl2. 10FeCl3 + 6KMnO4 + 24H2SO4 5Fe2(SO4)3 + 3K2SO4 + 6MnSO4 + H2O + 15Cl2. 5CuCl2 + 2KMnO4 + 8H2SO4 5CuSO4 + K2SO4 + 2MnSO4 + 8H2O + 5Cl2. 3a + 3b + 2c = 0,49 (3) Từ (1), (2), (3) ta có: a = 0,08 (mol); b = 0,05 (mol); c = 0,05 (mol) mkết tủa Z = 0,05.96 + 0,04.32 = 6,08 (gam) |
0,25 |
|
Xem thêm đề thi lớp 9 các môn học có đáp án hay khác:
Tài liệu giáo án lớp 9 các môn học chuẩn khác:
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Đề thi các môn học lớp 9 năm 2025 học kì 1 và học kì 2 được biên soạn bám sát cấu trúc ra đề thi mới Tự luận và Trắc nghiệm giúp bạn giành được điểm cao trong các bài thi lớp 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 9 (các môn học)
- Giáo án điện tử lớp 9 (các môn học)
- Giáo án Toán 9
- Giáo án Ngữ văn 9
- Giáo án Tiếng Anh 9
- Giáo án Khoa học tự nhiên 9
- Giáo án Vật Lí 9
- Giáo án Hóa học 9
- Giáo án Sinh học 9
- Giáo án Địa Lí 9
- Giáo án Lịch Sử 9
- Giáo án GDCD 9
- Giáo án Tin học 9
- Giáo án Công nghệ 9
- Đề thi lớp 9 (các môn học)
- Đề thi Ngữ Văn 9 (có đáp án)
- Đề thi Toán 9 (có đáp án)
- Đề thi Tiếng Anh 9 mới (có đáp án)
- Đề thi Tiếng Anh 9 (có đáp án)
- Đề thi Khoa học tự nhiên 9 (có đáp án)
- Đề thi Lịch Sử và Địa Lí 9 (có đáp án)
- Đề thi GDCD 9 (có đáp án)
- Đề thi Tin học 9 (có đáp án)
- Đề thi Công nghệ 9 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

