Đề thi giữa Học kì 2 Hóa học 9 có đáp án (6 đề)
Với Đề thi giữa Học kì 2 Hóa học 9 có đáp án (6 đề), chọn lọc giúp học sinh ôn tập và đạt kết quả cao trong bài thi Giữa kì 2 Hóa học 9.
Đề thi giữa Học kì 2 Hóa học 9 có đáp án (6 đề)
Chỉ từ 150k mua trọn bộ Đề thi Hóa học 9 Giữa kì 2 theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Mức độ hoạt động hóa học mạnh hay yếu của phi kim được xét căn cứ vào khả năng và mức độ phản ứng của phi kim đó với
A. Kim loại và hiđro B. Oxi và kim loại
C. Hiđro và oxi D. Cả oxi, kim loại và hiđro
Câu 2: Cho 19,5 gam kim loại M hóa trị II tác dụng với khí clo dư thì thu được 40,8 gam muối. Kim loại M là
A. Zn B. Fe C. Mg D. Cu
Câu 3: Tính chất hóa học của clo là
A. Tác dung với hầu hết kim loại
B. Tác dụng với hiđro
C. Tác dụng với nước, với dung dịch kiềm
D. A, B, C đều đúng
Câu 4: Nguyên liệu được dùng để điều chế khí clo trong phòng thí nghiệm là
A. H2SO3 B. HNO3 C. HCl đặc D. H2SO4
Câu 5: Đốt cháy hoàn toàn 20,4 gam hỗn hợp X gồm Al, Zn trong khí clo dư, thu được 41,7 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 6,72 lít B. 4,48 lít C. 5,60 lít D. 3,36 lít
Câu 6: Hòa tan hoàn toàn 34,8 gam MnO2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được bao nhiêu lít khí Cl2 (đktc)?
A. 8,96 lít B. 13,44 lít C. 9,60 lít D. 10,04 lít
Câu 7: Khử hoàn toàn 4,46 gam PbO bằng C dư ở nhiệt độ cao, thu được khối lượng Pb là
A. 2,56 gam B. 3,36 gam C. 4,14 gam D. 5,15 gam
Câu 8: Kim cương và than chì là 2 dạng thù hình của cacbon vì
A. Đều do nguyên tố cacbon tạo nên
B. Đều có cấu tạo tinh thể như nhau
C. Đều có tính chất vật lí tương tự nhau
D. Cả A và B đều đúng
Câu 9: Nhận xét nào sau đây đúng?
A. CO và CO2 đều là oxit axit
B. CO không phải oxit axit, CO2 là oxit axit
C. CO là chất có tính khử, CO2 là oxit axit
D. CO là oxit axit, CO2 không tạo muối
Câu 10: Cho dung dịch K2CO3 tác dụng với dung dịch Ca(OH)2 hiện tượng của phản ứng là
A. Sủi bọt khí B. Kết tủa trắng
C. Không có hiện tượng D. Dung dịch chuyển sang màu xanh
Câu 11: Phương trình hóa học nào sau đây đúng?
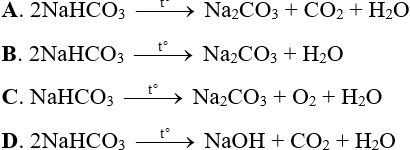
Câu 12: Khối lượng kết tủa tạo ra, khi cho 5,3 gam Na2CO3 tác dụng vừa đủ với dung dịch Ca(OH)2 là
A. 4 gam B. 5 gam C. 6 gam D. 7 gam
Câu 13: Trong công nghiệp, Si được điều chế bằng cách nào?
A. Nung hỗn hợp gồm Mg và cát nghiền mịn
B. Dùng than cốc khử silic đioxit trong lò điện
C. Nung monosilan (SiH4) ở khoảng
D. Nung SiH4 với Na ở khoảng
Câu 14: Trong một chu kì tuần hoàn, khi đi từ trái qua phải thì
A. Độ âm điện giảm dần B. Ái lực điện tử giảm dần
C. Năng lượng ion giảm dần D. Bán kính nguyên tử giảm dần
Câu 15: Cho các nguyên tố sau: O, N, P hãy cho biết thứ tự sắp sếp đúng theo chiều tính phi kim tăng dần
A. O, N, P B. P, N, O C. N, P, O D. O, P, N
Câu 16: Hợp chất hữu cơ là
A. Hợp chất khó tan trong nước
B. Hợp chất của cacbon và một số nguyên tố khác trừ N, Cl, O
C. Hợp chất của cacbon trừ CO, CO2, H2CO3, muối cacbonat kim loại, muối xianua, cacbua, …
D. Hợp chất có nhiệt độ sôi cao
Câu 17: Chất nào sau đây không thuộc loại chất hữu cơ?
A. CH4 B. CH3Cl C. CH3COONa D. CO2
Câu 18: Thành phần phần trăm về khối lượng của nguyên tố C trong CH3Cl là
A. 23,76% B. 24,57% C. 25,60% D. 26,70%
Câu 19: Cho phân tử chất hữu cơ A có hai nguyên tố C và H, biết tỉ khối hơi của A so với H2 là 28. Công thức phân tử chất hữu cơ A là
A. C6H6 B. C5H10 C. C3H6 D. C4H8
Câu 20: Một hợp chất hữu cơ có công thức C3H7Cl, có số công thức cấu tạo là
A. 1 B. 2 C. 3 D. 4
Câu 21: Cho các phát biểu sau:
(1) Trong các hợp chất hữu cơ, cacbon luôn có hóa trị IV, hiđro có hóa trị I, oxi có hóa trị II.
(2) Những nguyên tử cacbon trong phân tử hợp chất hữu cơ có thể liên kết trực tiếp với nhau tạo thành mạch cacbon.
(3) Công thức cấu tạo cho biết thành phần của phân tử và trật tự liên kết giữa các nguyên tử trong phân tử.
(4) Có 2 loại mạch cacbon: mạch không phân nhánh (mạch thẳng), mạch nhánh.
Số phát biểu đúng là
A. 1 B. 2 C. 3 D. 4
Câu 22: Phân tử metan CH4 có cấu tạo
A. Dạng đường thẳng B. Hình chóp tứ diện
C. Dạng tam giác phẳng D. Dạng hình vuông phẳng
Câu 23: Đốt cháy 4,8 gam metan trong oxi, sau phản ứng thu được V lít khí CO2. Giá trị của V là
A. 3,36 lít B. 4,48 lít C. 5,60 lít D. 6,72 lít
Câu 24: Ứng dụng nào sau đây không phải là ứng dụng của etilen
A. Điều chế P.E
B. Điều chế rượu etylic và axit axetic
C. Dùng để ý trái cây mau chín
D. Điều chế khí gas
Câu 25: Đốt cháy hoàn toàn 4,48 lít khí etilen ở đktc cần dùng V lít khí oxi ở đktc. Giá trị của V là
A. 11,20 lít B. 12,56 lít C. 13,44 lít D. 14,65 lít
Câu 26: Khí X có tỉ khối đối với hiđro là 13. Khí X là
A. CH4 B. C2H4 C. C2H2 D. C2H6
Câu 27: Tính thể tích dung dịch brom 2M cần để tác dụng với 0,448 lít khí axetilen?
A. 0,01 lít B. 0,04 lít C. 0,03 lít D. 0,02 lít
Câu 28: Chất nào sau đây làm mất màu dung dịch brom
A. CH4 B. C2H2
C. C2H4 D. Cả B và C đều đúng
Câu 29: Tính chất vật lý của benzen là
A. Benzen là chất lỏng, không màu
B. Benzen độc
C. Benzen không tan trong nước
D. Cả A, B, C đều đúng
Câu 30: Đun nóng brom với 3,9 gam benzen (có bột sắt), người ta thu được 4,71 gam brombenzen. Hiệu suất của phản ứng là
A. 60% B. 70% C. 80% D. 90%
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 1
1D |
2A |
3D |
4C |
5A |
6A |
7C |
8A |
9B |
10B |
11A |
12B |
13B |
14D |
15B |
16C |
17D |
18A |
19D |
20B |
21C |
22B |
23D |
24D |
25C |
26C |
27D |
28D |
29D |
30A |
Câu 1:
Đáp án D
Mức độ hoạt động mạnh hay yếu của phi kim căn cứ vào khả năng của phi kim đó phản ứng với cả oxi, kim loại và hiđro.
Câu 2:
Đáp án A
Phương trình phản ứng:
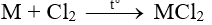
Theo phương trình phản ứng ta có:

Suy ra
suy ra M = 65
Vậy M là Zn.
Câu 3:
Đáp án D
Tính chất hóa học của clo là:
+ Tác dụng với hầu hết kim loại
+ Tác dụng với hiđro
+ Tác dụng với nước
+ Tác dụng với dung dịch kiềm
Câu 4:
Đáp án C
Nguyên liệu được dùng để điều chế khí clo trong phòng thí nghiệm là HCl đặc
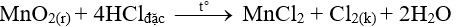
Câu 5:
Đáp án A
Áp dụng định luật bảo toàn khối lượng ta có: mX + mClo = mmuối
Suy ra:
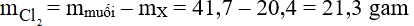
Số mol của Cl2 là:

Vậy thể tích khí clo ở đktc là:
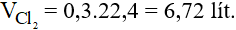
Câu 6:
Đáp án A
Số mol của MnO2 là:
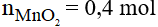
Phương trình phản ứng:
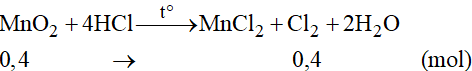
Theo phương trình phản ứng ta có:
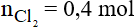
Thể tích khí Cl2 ở đktc là:
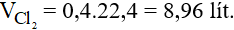
Câu 7:
Đáp án C
Số mol của PbO là:
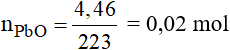
Phương trình phản ứng:
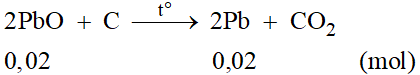
Theo phương trình phản ứng ta có: nPb = 0,02 mol
Vậy khối lượng Pb thu được là: mPb = 0,02.207 = 4,14 gam
Câu 8:
Đáp án A
Kim cương và than chì là 2 dạng thù hình của cacbon vì đều do nguyên tố cacbon tạo nên.
Câu 9:
Đáp án B
CO là oxit trung tính (oxit không tạo muối)
CO2 là oxit axit.
Câu 10:
Đáp án B
Cho dung dịch K2CO3 tác dụng với dung dịch Ca(OH)2 hiện tượng của phản ứng là xuất hiện kết tủa trắng (CaCO3)
Phương trình phản ứng:
K2CO3 + Ca(OH)2 → CaCO3↓ trắng + 2KOH
Câu 11:
Đáp án A
Phương trình phản ứng đúng:
Câu 12:
Đáp án B
Số mol của Na2CO3 là:
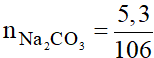
= 0,05 mol
Phương trình phản ứng:
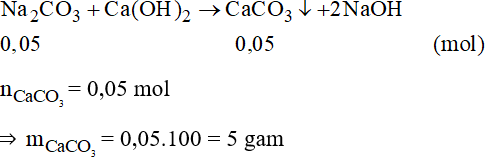
Câu 13:
Đáp án B
Trong công nghiệp, Si được điều chế bằng cách dùng than cốc khử silic đioxit trong lò điện.
Câu 14:
Đáp án D
Trong một chu kì tuần hoàn, khi đi từ trái qua phải thì bán kính nguyên tử giảm dần.
Câu 15:
Đáp án B
Ta có:
+ P và N cùng thuộc nhóm VA.
Theo quy luật biến đổi xác định được tính phi kim của P < N
+ O và N cùng thuộc chu kỳ 2.
Theo quy luật biến đổi xác định được tính phi kim của N < O
Vậy chiều tăng dần tính phi kim là: P < N < O.
Câu 16:
Đáp án C
Hợp chất hữu cơ là hợp chất của cacbon trừ CO, CO2, H2CO3, muối cacbonat kim loại, muối xianua, cacbua, …
Câu 17:
Đáp án D
Hợp chất hữu cơ là hợp chất của cacbon trừ CO, CO2, H2CO3, muối cacbonat kim loại, muối xianua, cacbua, …
⇒ Chất không thuộc loại chất hữu cơ là CO2
Câu 18:
Đáp án A
Thành phần phần trăm về khối lượng của nguyên tố C trong CH3Cl là
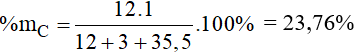
Câu 19:
Đáp án D
Ta có :
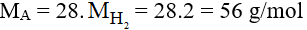
Vậy công thức phân tử chất hữu cơ A là C4H8.
Câu 20:
Đáp án B
Có hai công thức cấu tạo là:
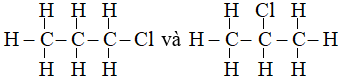
Câu 21:
Đáp án C
Số phát biểu đúng là (1), (2), (3)
Phát biểu (4) sai vì có 3 loại mạch cacbon: mạch không phân nhánh (mạch thẳng), mạch nhánh và mạch vòng.
Câu 22:
Đáp án B
Phân tử metan CH4 có cấu tạo chóp tứ điện.
Câu 23:
Đáp án D
Số mol CH4 là:
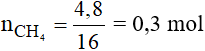
Phương trình phản ứng:
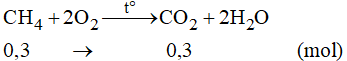
Theo phương trình phản ứng ta có:

Vậy thể tích CO2 thu được là: V = 0,3.22,4 = 6,72 lít.
Câu 24:
Đáp án D
Ứng dụng của etilen là:
+ Etilen dùng để điều chế axit axetic, rượu etylic, đicloetan, polime (PE, PVC), …
+ Etilen dùng kích thích quả mau chín.
Câu 25:
Đáp án C
Số mol của C2H4 là:
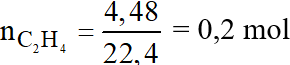
Phương trình phản ứng:
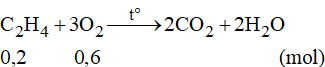
Theo phương trình phản ứng ta có:
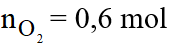
Vậy thể tích O2 cần dùng là: V = 0,6.22,4 = 13,44 lít.
Câu 26:
Đáp án C
Ta có: MX = 13.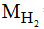 = 13.2 = 26
= 13.2 = 26
Vậy X là:
Câu 27:
Đáp án D
Số mol C2H2 là:
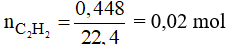
Phương trình phản ứng:
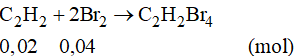
Theo phương trình phản ứng ta có:
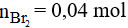
Vậy thể tích dung dịch brom cần dùng là:
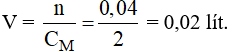
Câu 28:
Đáp án D
Metan không làm mất màu dung dịch brom.
C2H2 và C2H4 làm mất màu dung dịch brom.
Câu 29:
Đáp án D
Tính chất vật lý của benzen là
+ Benzen là chất lỏng, không màu
+ Benzen độc
+ Benzen không tan trong nước
Câu 30:
Đáp án A
Số mol của C6H6 là:
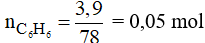
Phương trình phản ứng:
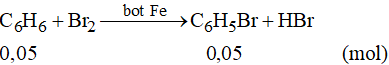
Theo phương trình phản ứng ta có:
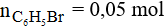
Khối lượng C6H5Br trên lý thuyết là:
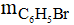 = 0,05.157 = 7,85 gam
= 0,05.157 = 7,85 gam
Hiệu suất của phản ứng là:
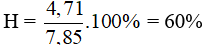
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 2)
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Dãy gồm các nguyên tố phi kim là
A. C, Mg, P, Ca B. S, Fe, Na, N
C. P, C, S, Si D. Cu, Fe, Cl, I
Câu 2: Ở điều kiện thường, phi kim nào sau đây tồn tại ở thể khí?
A. Lưu huỳnh B. Clo C. Cacbon D. Photpho
Câu 3: Trong công nghiệp, clo được điều chế bằng phương pháp gì?
A. Điện phân nóng chảy B. Nhiệt phân
C. Thủy phân D. Điện phân dung dịch
Câu 4: Chất được dùng để làm khô khí clo ẩm là
A. NaOH khan B. CaO
C. Na2SO3 khan D. Dung dịch H2SO4 đặc
Câu 5: Ứng dụng của Cacbon là
A. Than chì được dùng làm điện cực, chất bôi trơn, ruột bút chì…
B. Kim cương được dùng làm đồ trang sức quý hiếm, mũi khoan, dao cắt kính...
C. Cacbon vô định hình dùng làm mặt nạ phòng độc, chất khử mùi…
D. A, B, C đều đúng
Câu 6: CO có tính chất
A. Oxit axit, chất khí độc, có tính khử mạnh
B. Chất khí không màu, rất độc, oxit bazơ
C. Chất khí không màu, rất độc, oxit trung tính, có tính khử mạnh
D. Chất khí, không màu, không mùi, có tính oxi hóa mạnh
Câu 7: Cho m gam than (C) tác dụng với dung dịch HNO3 đặc, nóng, dư. Sau phản ứng thu được 13,44 lít hỗn hợp hai khí ở đktc. Giá trị của m là
A. 1,12 gam B. 1,44 gam C. 2,11 gam D. 2,34 gam
Câu 8: Hòa tan hoàn toàn 34,8 gam MnO2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được bao nhiêu lít khí Cl2 (đktc)?
A. 8,96 lít B. 13,44 lít C. 9,60 lít D. 10,04 lít
Câu 9: Cho 5,4 gam bột nhôm tác dụng với khí clo dư thì thu được m gam muối. Giá trị của m là
A. 49,6 gam B. 24, 8 gam C. 26,7 gam D. 53,4 gam
Câu 10: Đốt cháy 6,2 gam photpho bình chứa khí oxi, thu được m gam điphotpho pentaoxit. Giá trị của m là
A. 11,8 gam B. 12,6 gam C. 13,4 gam D. 14,2 gam
Câu 11: Khử hoàn toàn 6,4 gam Fe2O3 bằng khí CO dư. Sản phẩm khí thu được cho vào bình đựng nước vôi trong dư thu được m gam kết tủa màu trắng. Giá trị của m là
A. 10 gam B. 11 gam C. 12 gam D. 14 gam
Câu 12: Nhận xét nào sau đây đúng?
A. CO và CO2 đều là oxit axit
B. CO không phải oxit axit, CO2 là oxit axit
C. CO là chất có tính khử, CO2 là oxit axit
D. CO là oxit axit, CO2 không tạo muối
Câu 13: Dẫn luồng khí CO qua hồn hợp Al2O3, CuO, Fe2O3, ZnO (nung nóng). Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là
A. Al, Cu, Fe, Zn B. Al, Cu, Fe, ZnO
C. Al2O3, Cu, Fe, Zn D. Al2O3, Cu, Fe, ZnO
Câu 14: Nung hoàn toàn hỗn hợp 2 muối CaCO3 và MgCO3 thu được 3,8 gam hai oxit và 1,68 lít CO2 (đktc). Khối lượng hỗn hợp muối ban đầu là
A. 8,2 gam B. 5,9 gam C. 6,8 gam D. 7,1 gam
Câu 15: Trong các muối sau, muối nào là muối hiđrocacbonat?
A. NaHSO3 B. MgCO3 C. Na2CO3 D. Ca(HCO3)2
Câu 16: Công nghiệp silicat gồm
A. sản xuất đồ gốm B. sản xuất thủy tinh
C. sản xuất xi măng D. Cả A, B, C đều đúng
Câu 17: Đại lượng nào của nguyên tố hóa học biến thiên tuần hoàn?
A. Số lớp electron và số electron ở lớp ngoài cùng của nguyên tử
B. Nguyên tử khối
C. Điện tích hạt nhân và số electron của nguyên tử
D. Số electron ở lớp ngoài cùng của nguyên tử
Câu 18: Nguyên tố X có điện tích hạt nhân là 11+, nguyên tử X có 3 lớp electron, lớp ngoài cùng có 1 electron, ta xác định được
A. Nguyên tử X có điện tích hạt nhân là 11+ suy ra X ở ô 11
B. Nguyên tử X có 3 lớp electron nên X ở chu kỳ 3
C. Nguyên tử X có 1e ở lớp ngoài cùng nên X ở nhóm IA
D. Cả A, B, C đều đúng
Câu 19: Ô nguyên tố cho biết
A. Số hiệu nguyên tử
B. Tên nguyên tố, kí hiệu hóa học
C. Nguyên tử khối
D. Cả A, B, C đều đúng
Câu 20: Thành phần phần trăm về khối lượng của nguyên tố C trong CH3Cl là
A. 23,76% B. 24,57% C. 25,60% D. 26,70%
Câu 21: Dãy nào sau đây là dẫn xuất của hiđrocacbon?
A. CH3NO2, CaCO3, C6H6
B. C2H6O, C6H6, CH3NO2
C. CH3NO2, C2H6O, C2H3O2Na
D. C2H6O, C6H6, CaCO3
Câu 22: Phân loại mạch cacbon gồm
A. Mạch không phân nhánh (mạch thẳng)
B. Mạch nhánh
C. Mạch vòng
D. Cả A, B, C đều đúng
Câu 23: Trong các hợp chất hữu cơ, cacbon luôn có hoá trị là
A. I B. II C. III D. IV
Câu 24: Một hợp chất A chứa 3 nguyên tố C, H, O có tỉ lệ khối lượng là mC : mH : mO = 18 : 3 : 16. Hợp chất A có công thức đơn giản nhất trùng với công thức phân tử. Công thức của hợp chất A là
A. C4H8O2 B. C4H8O C. C3H6O2 D. C3H6O
Câu 25: Ứng dụng của metan là
A. Metan cháy tỏa nhiều nhiệt nên được đùng làm nhiên liệu trong đời sống và trong sản xuất
B. Metan là nguyên liệu dùng điều chế hiđro
C. Metan còn được dùng để điều chế bột than và nhiều chất khác
D. Cả A, B, C đều đúng
Câu 26: Điều kiện để xảy ra phản ứng giữa metan và khí clo là
A. Có ánh sáng B. Có axit làm xúc tác
C. Có sắt làm xúc tác D. Có nhiệt độ
Câu 27: Đốt cháy hoàn toàn m gam khí metan thu được 13,44 lít khí CO2 ở đktc. Giá trị của m là
A. 10,2 gam B. 7,8 gam C. 8,8 gam D. 9,6 gam
Câu 28: Cho 14 gam etilen vào dung dịch brom thấy dung dịch vừa đủ mất màu, khối lượng brom tham gia phản ứng là
A. 80 gam B. 40 gam C. 60 gam D. 50 gam
Câu 29: Sản phẩm trùng hợp etilen là
A. Poli etilen B. Poli vinyl clorua
C. Poli epilen D. Poli propilen
Câu 30: Cấu tạo phân tử axetilen gồm
A. 2 liên kết đôi và 1 liên kết 3
B. 1 liên kết đôi và 1 liên kết 3
C. 2 liên kết đơn và 1 liên kết đôi
D. 2 liên kết đơn và 1 liên kết 3
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 2
1C |
2B |
3D |
4D |
5D |
6C |
7B |
8A |
9C |
10D |
11C |
12B |
13C |
14D |
15D |
16D |
17D |
18D |
19D |
20A |
21C |
22D |
23D |
24C |
25D |
26A |
27D |
28A |
29A |
30D |
Câu 1:
Đáp án C
Dãy gồm các nguyên tố phi kim là: P, C, S, Si.
Các nguyên tố: Mg, Ca, Fe, Na, Cu là các nguyên tố kim loại.
Câu 2:
Đáp án B
+ Photpho, cacbon, lưu huỳnh là các phi kim tồn tại trạng thái rắn ở điều kiện thường
+ Clo là phi kim tồn tại trạng thái khí ở điều kiện thường.
Câu 3:
Đáp án D
Trong công nghiệp, clo được điều chế bằng phương pháp điện phân dung dịch NaCl bão hòa, có màng ngăn xốp.
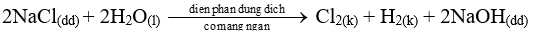
Câu 4:
Đáp án D
Chất được dùng để làm khô khí clo ẩm là dung dịch H2SO4 đặc, vì Cl2 và H2SO4 đặc đều là những chất oxi hóa mạnh nên không phản ứng với nhau.
Câu 5:
Đáp án D
Tùy thuộc vào tính chất của mỗi dạng thù hình, người ta sử dụng cacbon trong đời sống, sản xuất và trong kĩ thuật, ví dụ:
+ Than chì được dùng làm điện cực, chất bôi trơn, ruột bút chì…
+ Kim cương được dùng làm đồ trang sức quý hiếm, mũi khoan, dao cắt kính...
+ Cacbon vô định hình dùng làm mặt nạ phòng độc, chất khử mùi…
Câu 6:
Đáp án C
CO có tính chất là chất khí không màu, rất độc, oxit trung tính, có tính khử mạnh.
Câu 7:
Đáp án B
Gọi số mol của C là x mol
Số mol của hỗn hợp hai khí là: n = 0,6 mol
Phương trình phản ứng:
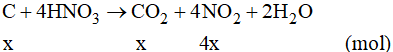
Theo phương trình phản ứng, ta có x + 4x = 0,6 suy ra x = 0,12 mol
Vậy khối lượng của C là: m = 0,12.12 = 1,44 gam.
Câu 8:
Đáp án A
Số mol của MnO2 là:
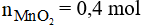
Phương trình phản ứng:
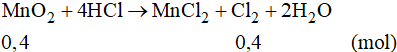
Theo phương trình phản ứng ta có:
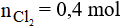
Thể tích khí Cl2 ở đktc là:
Câu 9:
Đáp án C
Số mol của nhôm là: nAl = 0,2 mol
Phương trình phản ứng:
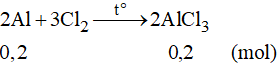
Theo phương trình phản ứng ta có :

Vậy khối lượng AlCl3 thu được là:
m = 0,2.133,5 = 26,7 gam.
Câu 10:
Đáp án D
Số mol của P là: nP = 0,2 mol
Phương trình phản ứng:

Theo phương trình phản ứng ta có:
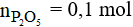
Vậy khối lượng của P2O5 là: m = 0,1.142 = 14,2 gam.
Câu 11:
Đáp án C
Số mol của Fe2O3 là:
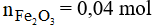
Phương trình phản ứng:
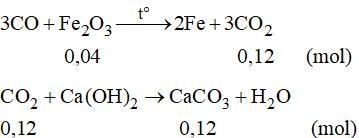
Số mol của CaCO3 là:
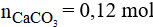
Vậy khối lượng CaCO3 là: m = 0,12.100 = 12 gam.
Câu 12:
Đáp án B
CO là oxit trung tính (oxit không tạo muối)
CO2 là oxit axit.
Câu 13:
Đáp án C
Khí CO chỉ khử được các oxit kim loại đứng sau Al vậy nên khử được CuO, Fe2O3, ZnO.
Câu 14:
Đáp án D
Số mol của khí CO2 là:

Khối lượng của CO2 là:
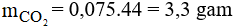
Phương trình phản ứng:
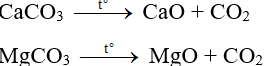
Áp dụng định luật bảo toàn khối lượng ta có:
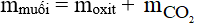
suy ra mmuối = 3,8 + 3,3 = 7,1 gam.
Câu 15:
Đáp án D
Muối hiđrocacbonat là Ca(HCO3)2
Muối hiđrocacbonat có công thức dạng M(HCO3)n
Câu 16:
Đáp án D
Công nghiệp silicat gồm
+ sản xuất đồ gốm
+ sản xuất thủy tinh
+ sản xuất xi măng
Công nghiệp silicat gồm sản xuất đồ gốm, thủy tinh, xi măng.
Câu 17:
Đáp án D
Đại lượng của nguyên tố hóa học biến thiên tuần hoàn là: số electron ở lớp ngoài cùng của nguyên tử.
Câu 18:
Đáp án D
Nguyên tố X có điện tích hạt nhân là 11+, nguyên tử X có 3 lớp electron, lớp ngoài cùng có 1 electron, ta xác định được:
+ Nguyên tử X có điện tích hạt nhân là 11+ suy ra X ở ô 11
+ Nguyên tử X có 3 lớp electron nên X ở chu kỳ 3
+ Nguyên tử X có 1e ở lớp ngoài cùng nên X ở nhóm IA
Câu 19:
Đáp án D
Ô nguyên tố cho biết: Số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố đó.
Câu 20:
Đáp án A
Thành phần phần trăm về khối lượng của nguyên tố C trong CH3Cl là
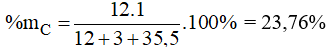
Câu 21:
Đáp án C
+ Dẫn xuất của hiđrocacbon: ngoài cacbon và hiđro, trong phân tử còn có các nguyên tố khác như oxi, clo, … (C2H6O, CH3Cl, …)
+ Dãy chất là dẫn xuất của hiđrocacbon là CH3NO2, C2H6O, C2H3O2Na
Câu 22:
Đáp án D
Có 3 loại mạch cacbon: mạch không phân nhánh (mạch thẳng), mạch nhánh và mạch vòng.
Câu 23:
Đáp án D
Trong các hợp chất hữu cơ, cacbon luôn có hoá trị là IV.
Câu 24:
Đáp án C
Gọi công thức phân tử của A là: CxHyOz ,ta có:
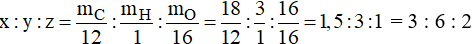
Vậy công thức của hợp chất A là: C3H6O2
Câu 25:
Đáp án D
Ứng dụng của metan là
+ Metan cháy tỏa nhiều nhiệt nên được đùng làm nhiên liệu trong đời sống và trong sản xuất
+ Metan là nguyên liệu dùng điều chế hiđro
+ Metan còn được dùng để điều chế bột than và nhiều chất khác
Câu 26:
Đáp án A
Điều kiện để xảy ra phản ứng giữa metan và khí clo là có ánh sáng
Phương trình phản ứng:
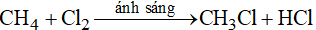
Câu 27:
Đáp án D
Số mol của CO2 là:
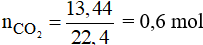
Phương trình phản ứng:
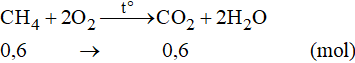
Theo phương trình phản ứng ta có:
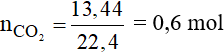
Vậy khối lượng của CH4 là: m = 0,6.16 = 9,6 gam.
Câu 28:
Đáp án A
Số mol của C2H4 là:
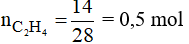
Phương trình phản ứng:
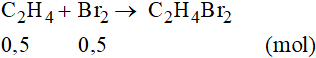
Theo phương trình phản ứng ta có:
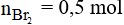
Vậy khối lượng brom tham gia phản ứng là:
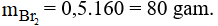
Câu 29:
Đáp án A
Sản phẩm trùng hợp etilen là: Poli etilen
Ở điều kiện thích hợp (nhiệt độ, áp suất, xúc tác) các phân tử etilen kết hợp với nhau tạo ra chất có kích thước và khối lượng rất lớn gọi là poli etilen (PE).
Phương trình phản ứng:
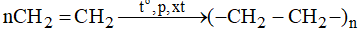
Câu 30:
Đáp án D
Cấu tạo phân tử axetilen gồm: 2 liên kết đơn và 1 liên kết 3
Axetien có công thức cấu tạo: H – C ≡ C– H
Trong phân tử axetilen có một liên kết ba giữa hai nguyên tử cacbon.
Trong liên kết ba, có hai liên kết kém bền, dễ đứt lần lượt trong các phản ứng hóa học.
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 3)
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Chất nào tác dụng với khí oxi tạo thành oxit bazơ?
A. Photpho B. Lưu huỳnh C. Clo D. Magie
Câu 2: Nguyên liệu được dùng để điều chế khí clo trong phòng thí nghiệm là
A. H2SO3 B. HNO3 C. HCl đặc D. H2SO4
Câu 3: Sục Cl2 vào nước, thu được nước clo màu vàng nhạt. Trong nước clo có chứa các chất là
A. Cl2, H2O B. HCl, HClO
C. HCl, HClO, H2O D. Cl2, HCl, HClO, H2O
Câu 4: Trong các dạng tồn tại của cacbon, dạng nào hoạt động hóa học mạnh nhất?
A. Tinh thể kim cương
B. Tinh thể than chì
C. Cacbon vô định hình
D. Các dạng đều hoạt động mạnh như nhau
Câu 5: Đốt cháy cacbon bởi O2, nếu dư thừa oxi thì sau phản ứng thu được khí nào?
A. CO2 B. O2
C. CO2 và CO dư D. CO2 và O2 dư
Câu 6: Dạng thù hình của nguyên tố là
A. Các hợp chất khác nhau của một nguyên tố hóa học
B. Các đơn chất khác nhau do nguyên tố đó tạo nên
C. Các nguyên tố có hình dạng khác nhau
D. Các đơn chất có hình dạng khác nhau
Câu 7: Cho 19,5 gam kim loại M hóa trị II tác dụng với khí clo dư thì thu được 40,8 gam muối. Kim loại M là
A. Zn B. Fe C. Mg D. Cu
Câu 8: Cho dung dịch NaOH 1M để tác dụng vừa đủ với 2,24 lít khí clo (đktc). Nồng độ mol của muối natri clorua thu được là
A. 2M B. 1M C. 0,5M D. 1,5M
Câu 9: Khử hoàn toàn 6,4 gam Fe2O3 bằng khí CO dư. Sản phẩm khí thu được cho vào bình đựng nước vôi trong dư thu được m gam kết tủa màu trắng. Giá trị của m là
A. 10 gam B. 11 gam C. 12 gam D. 14 gam
Câu 10: Sự tạo thành thạch nhũ trong các hang động của mỏ đá vôi là do có phản ứng:
A. CaCO3 + CO2 + H2O → Ca(HCO3)2.
B. Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH.
C. CaCO3 → CaO + H2O.
D. Ca(HCO3)2 → CaCO3 + CO2 + H2O.
Câu 11: Quá trình thổi khí CO2 vào dung dịch NaOH, muối tạo ra theo thứ tự là:
A. NaHCO3, Na2CO3 B. Na2CO3, NaHCO3
C. Na2CO3 D. Không đủ dữ liệu xác định
Câu 12: Nguyên tố phổ biến thứ hai ở vỏ trái đất là
A. oxi B. cacbon C. silic D. sắt
Câu 13: Bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo nguyên tắc:
A. Chiều nguyên tử khối tăng dần.
B. Chiều điện tích hạt nhân tăng dần.
C. Tính kim loại tăng dần.
D. Tính phi kim tăng dần.
Câu 14: Dãy nào sau đây thể hiện mức độ hoạt động hóa học của kim loại tăng dần:
A. Be, Fe, Ca, Cu. B. Ca, K, Mg, Al.
C. Al, Zn, Co, Ca. D. Ni, Mg, Li, Cs.
Câu 15: Dãy các chất sau là hiđrocacbon:
A. CH4, C2H2, C2H5Cl B. C6H6, C3H4, HCHO
C. C2H2, C2H5OH, C6H12 D. C3H8, C3H4, C3H6
Câu 16: Hợp chất hữu cơ nào sau đây chỉ gồm liên kết đơn?
A. C3H8; C2H2. B. C3H8; C4H10
C. C4H10; C2H2 D. C4H10; C6H6(benzen)
Câu 17: Chọn câu đúng trong các câu sau:
A. Hóa học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất có trong tự nhiên.
B. Hóa học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất của cacbon.
C. Hóa học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất hữu cơ.
D. Hóa học hữu cơ là ngành hóa học chuyên nghiên cứu các chất trong cơ thể sống.
Câu 18: Công thức đơn giản nhất của hợp chất hữu cơ A là CH2Cl. Biết MA = 99. Công thức phân tử của A là
A. CH2Cl2 B. C2H4Cl2 C. CHCl3 D. C2H2Cl3
Câu 19: Chọn câu đúng trong các câu sau:
A. Metan có nhiều trong khí quyển
B. Metan có nhiều trong mỏ khí, mỏ dầu, mỏ than
C. Metan có nhiều trong nước biển
D. Metan sinh ra trong quá trình thực vật bị phân hủy.
Câu 20: Những phát biểu nào sau đây không đúng?
1) Metan tác dụng với clo khi có ánh sáng.
2) Metan là chất khí, không màu, không mùi, nặng hơn không khí.
3) Metan cháy tỏa nhiều nhiệt nên được dùng làm nhiên liệu trong đời sống và trong sản xuất.
4) Hỗn hợp giữa metan và clo là hỗn hợp nổ.
5) Trong phân tử metan có bốn liên kết đơn C-H.
6) Metan tác dụng với clo ở điều kiện thường.
A. 1, 3, 5. B. 1, 2, 6. C. 2, 4, 6. D. 2, 4, 5
Câu 21: Đốt cháy hoàn toàn 11,2 lít khí metan. Biết các thể tích khí đo ở điều kiện tiêu chuẩn. Thể tích khí oxi cần dùng và thể tích khí cacbonic tạo thành lần lượt là
A. 22,4 lít và 22,4 lít. B. 11,2 lít và 22,4 lít.
C. 22,4 lít và 11,2 lít. D. 11,2 lít và 22,4 lít.
Câu 22: Sản phẩm chủ yếu của một hợp chất hữu cơ khi cháy là
A.khí nitơ và hơi nước.
B.khí cacbonic và khí hiđro.
C. khí cacbonic và cacbon.
D. khí cacbonic và hơi nước.
Câu 23: Dẫn 5,6 lít (đktc) khí metan và etilen đi qua bình đựng dung dịch nước brom, đã làm mất màu hoàn toàn dung dịch có chứa 4 gam brom. Thể tích khí metan (đktc) trong hỗn hợp là
A. 0,56 lít. B. 5,04 lít. C. 0,28 lít. D. 3,36 lít
Câu 24: Cho các hợp chất sau: CH4, C2H6, C2H4, H2. Có bao nhiêu chất tác dụng với dung dịch nước brom ở nhiệt độ thường?
A. 1 B. 2 C. 3 D. 4
Câu 25: Tính chất vật lí của etilen là
A. Chất lỏng, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
B. Chất khí, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
C. Chất khí, không màu, không mùi, ít tan trong nước và nặng hơn không khí.
D. Chất khí, không màu, không mùi, tan tốt trong nước và nhẹ hơn không khí.
Câu 26: Liên kết C≡C trong phân tử axetilen có
A. một liên kết kém bền dễ đứt ra trong các phản ứng hóa học.
B. hai liên kết kém bền nhưng chỉ có một liên kết bị đứt ra trong phản ứng hóa học.
C. hai liên kết kém bền dễ đứt lần lượt trong các phản ứng hóa học.
D. ba liên kết kém bền dễ đứt lần lượt trong các phản ứng hóa học.
Câu 27: Khi đốt khí axetilen, số mol CO2 và H2O được tạo thành theo tỉ lệ là
A. 1 : 1. B. 1 : 2 C. 1 : 3. D. 2 : 1.
Câu 28: Tính chất nào không phải của benzen là
A. Dễ thế. B. Khó cộng.
C. Bền với chất oxi hóa. D. Kém bền với các chất oxi hóa.
Câu 29: Ở nông thôn có thể dùng phân gia súc, gia cầm, rác hữu cơ để ủ trong các hầm Bio-gas. Dưới ảnh hưởng của các vi sinh vật yếm khí, chất hữu cơ sẽ phân hủy tạo ra một loại phân bón chất lượng cao. Bio-gas dùng để đun nấu trong gia đình. Nên phát triển các hầm Bio-gas vì
A. Vốn đầu tư không lớn.
B. Đảm bảo vệ sinh môi trường và mầm các bệnh bị tiêu diệt
C. Có nguồn năng lượng sạch và thuận tiện.
D. Tất cả các lý do trên.
Câu 30: Phương pháp hiện đại để điều chế axetilen hiện nay là
A. Nhiệt phân metan ở nhiệt độ cao
B. Nhiệt phân canxi cacbua ở nhiệt độ cao
C. Nhiệt phân benzen ở nhiệt độ cao
D. Nhiệt phân etilen ở nhiệt độ cao
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 3
1D |
2C |
3D |
4C |
5D |
6B |
7A |
8C |
9C |
10D |
11B |
12C |
13B |
14D |
15D |
16B |
17C |
18B |
19B |
20C |
21C |
22D |
23B |
24A |
25B |
26C |
27D |
28D |
29D |
30A |
Câu 1:
Đáp án D
Phương trình phản ứng:
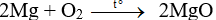
Câu 2:
Đáp án C
Nguyên liệu được dùng để điều chế khí clo trong phòng thí nghiệm là HCl đặc
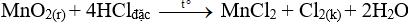
Câu 3:
Đáp án D
Cl2 có phản ứng thuận nghịch với nước:
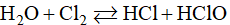
Vậy trong nước clo có chứa Cl2, HCl, HClO, H2O.
Câu 4:
Đáp án C
Trong các dạng tồn tại của cacbon, dạng hoạt động hóa học mạnh nhất là: Cacbon vô định hình.
Câu 5:
Đáp án D
Đốt cháy cacbon bởi O2, nếu dư thừa oxi thì sau phản ứng thu được hỗn hợp khí là
CO2 và O2 dư.
Câu 6:
Đáp án B
Dạng thù hình của một nguyên tố hóa học là những đơn chất khác nhau do nguyên tố đó tạo nên.
Câu 7:
Đáp án A
Phương trình phản ứng:
M + Cl2 → MCl2
Theo phương trình phản ứng ta có:
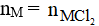
Suy ra:

suy ra M = 65
Vậy M là Zn.
Câu 8:
Đáp án C
Số mol của Cl2 là:
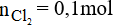
Phương trình phản ứng:
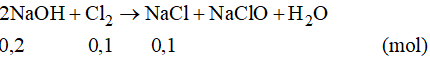
Theo phương trình phản ứng ta có: nNaOH = 0,2 mol
Suy ra :
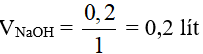
Nồng độ mol của NaCl là:
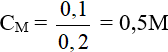
Câu 9:
Đáp án C
Số mol của Fe2O3 là:
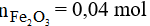
Phương trình phản ứng:
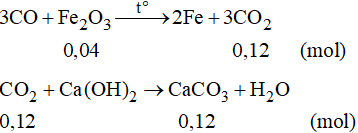
Số mol của CaCO3 là:
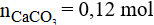
Vậy khối lượng CaCO3 là: m = 0,12.100 = 12 gam.
Câu 10:
Đáp án D
Thạch nhũ là CaCO3
Sự tạo thành thạch nhũ trong các hang động của mỏ đá vôi là do có phản ứng:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Câu 11:
Đáp án B
Ban đầu tạo muối NaCO3
CO2 + 2NaOH → Na2CO3 + H2O
Sau đó, CO2 dư tiếp tục xảy ra phản ứng:
CO2 + Na2CO3 + H2O → 2NaHCO3
Câu 12:
Đáp án C
Nguyên tố phổ biến thứ hai ở vỏ trái đất là silic
Câu 13:
Đáp án B
Bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo chiều điện tích hạt nhân tăng dần.
Câu 14:
Đáp án D
Dãy thể hiện mức độ hoạt động hóa học của kim loại tăng dần là: Ni, Mg, Li, Cs.
Loại A vì Ca có tính kim loại mạnh hơn Cu.
Loại B vì Mg có tính kim loại mạnh hơn Al
Loại C vì Al có tính kim loại mạnh hơn Zn
Câu 15:
Đáp án D
+ Hi đrocacbon: Phân tử chỉ có hai nguyên tố cacbon và hiđro (CH4, C2H4, C6H6)
+ Dẫn xuất của hiđrocacbon: ngoài cacbon và hiđro, trong phân tử còn có các nguyên tố khác như oxi, clo, … (C2H6O, CH3Cl, …)
Dãy các chất sau là hiđrocacbon là: C3H8, C3H4, C3H6
Câu 16:
Đáp án B
Hợp chất hữu cơ chỉ gồm liên kết đơn là C3H8; C4H10
Cấu 17:
Đáp án C
Câu đúng là: Hóa học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất hữu cơ
Câu 18:
Đáp án B
Công thức đơn giản nhất (CTĐGN) là CH2Cl
⇒ Công thức phân tử (CTPT): (CH2Cl)n
Vì MA = 99 ⇒ (12 + 2 + 35,5).n = 99 ⇒ n = 2
⇒ CTPT: C2H4Cl2
Câu 19:
Đáp án B
Câu đúng là: Metan có nhiều trong mỏ khí, mỏ dầu, mỏ than
Câu 20:
Đáp án C
Các phát biểu không đúng: 2, 4, 6
2) Metan là chất khí, không màu, không mùi, nặng hơn không khí ⇒ Sai, khí metan nhẹ hơn không khí.
4) Hỗn hợp giữa Metan và Clo là hỗn hợp nổ ⇒ Sai.
6) Metan tác dụng với Clo ở điều kiện thường ⇒ Sai, phải có chiếu sáng thì phản ứng mới xảy ra
Câu 21:
Đáp án C
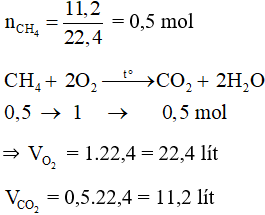
Câu 22:
Đáp án D
Vì các hợp chất hữu cơ có chứa C và thường có H nên khi đốt cháy thì sản phẩm thu được chủ yếu là CO2 và H2O
Câu 23:
Đáp án B
Dẫn 2 khí qua dung dịch nước brom chỉ có C2H4 phản ứng:
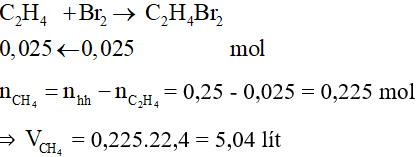
Câu 24:
Đáp án A
Chất tác dụng với dung dịch nước brom là C2H4 vì trong phân tử C2H4 có liên kết đôi
CH2 = CH2 + Br2 → CH2Br = CH2Br
Câu 25:
Đáp án B
Tính chất vật lí của etilen là: Chất khí, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
Câu 26:
Đáp án C
Liên kết C≡C trong phân tử axetilen có hai liên kết kém bền dễ đứt lần lượt trong các phản ứng hóa học.
Câu 27:
Đáp án D
Phương trình đốt cháy axetilen:
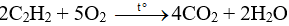
⇒ CO2 và H2O tạo thành theo tỉ lệ 4 : 2 = 2 : 1
Câu 28:
Đáp án D
Tính chất nào không phải của benzen là kém bền với các chất oxi hóa.
Câu 29:
Đáp án D
Nên phát triển các hầm Bio-gas vì
- Vốn đầu tư không lớn
- Đảm bảo vệ sinh môi trường và mầm các bệnh bị tiêu diệt
- Có nguồn năng lượng sạch và thuận tiện
Câu 30:
Đáp án A
Phương pháp hiện đại để điều chế axetilen hiện nay là nhiệt phân metan ở nhiệt độ cao
Phương trình phản ứng:
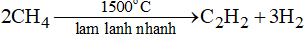
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 4)
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Ở điều kiện thường, phi kim có thể tồn tại ở trạng thái
A. lỏng và khí. B. rắn và lỏng.
C. rắn và khí. D. rắn, lỏng, khí.
Câu 2: Đốt cháy hoàn toàn 2,8 gam hỗn hợp cacbon và lưu huỳnh cần 3,36 lít O2 (đktc). Khối lượng mỗi chất trong hỗn hợp lần lượt là
A. 0,2 gam và 0,8 gam. B. 1,2 gam và 1,6 gam.
C. 1,3 gam và 1,5 gam. D. 1,0 gam và 1,8 gam.
Câu 3: Nước clo là dung dịch hỗn hợp các chất
A. HCl; HClO; H2O. B. HCl; HClO2; Cl2; H2O.
C. NaCl; NaClO. D. HCl; HClO; Cl2; H2O.
Câu 4: Cho 11,2 gam bột sắt tác dụng với khí clo dư. Sau phản ứng thu được 32,5 gam muối sắt. Khối lượng khí clo tham gia phản ứng là
A. 21,3 gam. B. 20,50 gam.
C. 10,55 gam. D. 10,65 gam.
Câu 5: Do có tính hấp phụ, nên cacbon vô định hình được dùng làm
A. điện cực, chất khử. B. trắng đường, mặt nạ phòng hơi độc.
C. ruột bút chì, chất bôi trơn. D. mũi khoan, dao cắt kính.
Câu 6: Cho 1 mol Ba(OH)2 phản ứng với 1 mol CO2. Muối tạo thành là
A. BaCO3. B. Ba(HCO3)2.
C. BaCO3 và Ba(HCO3)2. D. BaCO3 và Ba(OH)2 dư.
Câu 7: Dãy gồm các chất bị phân hủy bởi nhiệt là
A. Na2CO3, Mg(OH)2, Ca(HCO3)2, BaCO3.
B. MgCO3, BaCO3, Ca(HCO3)2, NaHCO3.
C. K2CO3, KOH, MgCO3, Ca(HCO3)2.
D. NaHCO3, KHCO3, Na2CO3, K2CO3.
Câu 8: Nhận định nào sau đây về tính chất của silic là sai?
A. Silic là phi kim hoạt động hóa học yếu hơn cacbon, clo.
B. Ở nhiệt độ cao, silic phản ứng với oxi tạo thành silic đioxit
C. Silic là chất rắn, màu xám.
D. Silic dẫn điện tốt nên được dùng làm pin mặt trời.
Câu 9: Dãy các kim loại nào sau đây được sắp xếp theo chiều tính kim loại tăng dần?
A. K, Na, Li, Rb. B. Li, K, Rb, Na.
C. Na, Li, Rb, K. D. Li, Na, K, Rb.
Câu 10: Nguyên tử của nguyên tố X có 3 lớp electron, lớp electron ngoài cùng có 7 electron. Vị trí và tính chất cơ bản của nguyên tố X là
A. thuộc chu kỳ 3, nhóm VII là kim loại mạnh.
B. thuộc chu kỳ 7, nhóm III là kim loại yếu.
C. thuộc chu kỳ 3, nhóm VII là phi kim mạnh.
D. thuộc chu kỳ 3, nhóm VII là phi kim yếu.
Câu 11: Nguyên tử cacbon có thể liên kết trực tiếp với nhau tạo thành các dạng mạch cacbon là
A. mạch vòng.
B. mạch thẳng, mạch nhánh.
C. mạch vòng, mạch thẳng, mạch nhánh.
D. mạch nhánh.
Câu 12: Phản ứng hóa học đặc trưng của metan là
A. phản ứng cộng. B. phản ứng thế.
C. phản ứng tách. D. phản ứng trùng hợp.
Câu 13: Đốt cháy hoàn toàn 5,6 lít khí etilen ở đktc cần dùng lượng oxi (ở đktc) là
A. 11,2 lít. B. 16,8 lít.
C. 22,4 lít. D. 33,6 lít.
Câu 14: Dãy các chất nào sau đây đều làm mất màu dung dịch brom?
A. CH4; C6H6. B. CH4; C2H6.
C. CH4; C2H4. D. C2H4; C2H2.
Câu 15: Phản ứng đặc trưng của benzen là
A. phản ứng cháy.
B. phản ứng trùng hợp.
C. phản ứng thế với brom (có bột sắt xúc tác).
D. phản ứng hóa hợp với brom (có bột sắt xúc tác).
Câu 16: Để dập tắt đám cháy nhỏ do xăng, dầu người ta dùng biện pháp
A. phun nước vào ngọn lửa.
B. phủ cát vào ngọn lửa.
C. thổi oxi vào ngọn lửa.
D. phun dung dịch muối ăn vào ngọn lửa.
Câu 17: Thành phần chủ yếu của khí thiên nhiên là
A. hiđro. B. metan. C. etilen. D. axetilen.
Câu 18: Khí nào sau đây khi cháy không gây ô nhiễm môi trường?
A. CH4. B. H2. C. C4H10. D. CO.
Câu 19: Thể tích khí oxi (ở đktc) cần dùng để đốt cháy hoàn toàn 1 kg than có chứa 4% tạp chất không cháy là
A. 1,792 m3. B. 4,48 m3.
C. 3,36 m3. D. 6,72 m3.
Câu 20: Khí tham gia phản ứng trùng hợp là
A. CH4. B. C2H4. C. C3H8. D. C2H6.
Câu 21: Trùng hợp 14 gam etilen (với hiệu suất 100 %) ở điều kiện thích hợp thì thu được khối lượng polietilen là
A. 7 gam. B. 14 gam. C. 28 gam. D. 56 gam.
Câu 22: Từ bột Fe và một hoá chất X có thể điều chế trực tiếp được FeCl3. Vậy X là
A. Dung dịch HCl. B. Dung dịch CuCl2.
C. Khí clo. D. Cả A, B, C đều được.
Câu 23: Khối lượng C cần dùng để khử hoàn toàn 8 gam CuO thành kim loại là
A. 3,6 gam. B. 1,2 gam. C. 2,4 gam. D. 0,6 gam.
Câu 24: Khí CO dùng làm chất đốt trong công nghiệp có lẫn tạp chất là CO2 và SO2. Có thể làm sạch CO bằng
A. CuSO4 khan. B. H2SO4 đặc.
C. dung dịch BaCl2. D. dung dịch nước vôi trong.
Câu 25: Nhận xét nào sau đây không đúng?
A. Hợp chất hữu cơ có ở xung quanh ta.
B. Hợp chất hữu cơ là hợp chất của cacbon.
C. Khi đốt cháy các hợp chất hữu cơ đều thấy tạo ra CO2.
D. Đốt cháy hợp chất hữu cơ luôn thu được CO2 và H2O.
Câu 26: Cho 0,56 lít (đktc) hỗn hợp khí metan và axetilen tác dụng với dung dịch brom dư, lượng brom đã tham gia phản ứng là 5,6 gam. Thành phần phần trăm về thể tích của axetilen trong hỗn hợp ban đầu lần lượt là
A. 20%. B. 70%. C. 40%. D. 60%.
Câu 27: Số liên kết đơn trong phân tử C4H10 là
A. 10. B. 13. C. 14. D. 12.
Câu 28: Axetilen tham gia phản ứng cộng H2O (xúc tác H2SO4) thu được sản phẩm là
A. C2H5OH B. CH3COOH
C. CH3CHO D. C2H4(OH)2
Câu 29: Khử hoàn toàn 2,4 gam đồng (II) oxit bằng khí CO. Thể tích khí CO cần dùng (đktc) là
A. 0,224 lít B. 0,672 lít
C. 0,448 lít D. 0,560 lít
Câu 30: Tính khối lượng benzen cần dùng để điều chế 15,7 gam brombenzen, biết hiệu suất phản ứng đạt 80%.
A. 7,80 gam B. 8,80 gam
C. 9,75 gam D. 10,08 gam
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 4
1D |
2B |
3D |
4A |
5B |
6A |
7B |
8D |
9D |
10C |
11C |
12B |
13B |
14D |
15C |
16B |
17B |
18B |
19A |
20B |
21B |
22C |
23D |
24D |
25D |
26B |
27B |
28C |
29B |
30C |
Câu 1:
Đáp án D
Ở điều kiện thường phi kim tồn tại ở cả ba trạng thái:
- Rắn: lưu huỳnh, photpho, cacbon,…
- Lỏng: brom
- Khí: oxi, clo, hiđro, nitơ
Câu 2:
Đáp án B
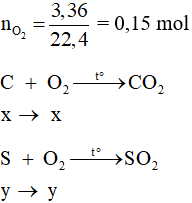
Theo bài ra ta có hệ phương trình:
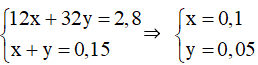
⇒ mC = 0,1.12 = 1,2 gam
mS = 0,05.32 = 1,6 gam
Câu 3:
Đáp án D
Clo phản ứng với nước theo phương trình:
Cl2 + H2O ⇄ HCl + HClO
Nước clo là dung dịch hỗn hợp các chất: HCl; HClO; Cl2; H2O.
Câu 4:
Đáp án A
Áp dụng định luật bảo toàn khối lượng:
mFe + = m muối sắt
Suy ra:
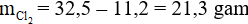
Câu 5:
Đáp án B
Cacbon vô định hình (than gỗ, than xương,…) có tính hấp phụ (giữ trên bề mặt của chúng các chất khí, chất hơi, chất tan trong dung dịch). Nhờ tính chất này mà cacbon vô định hình được dùng để làm trắng đường, chế tạo mặt nạ phòng độc.
Câu 6:
Đáp án A
Phản ứng theo tỉ lệ 1 : 1
Ba(OH)2 + CO2 → BaCO3 + H2O
Câu 7:
Đáp án B
Lưu ý: Muối cacbonat dễ bị phân hủy bởi nhiệt (trừ muối cacbonat trung hòa của kim loại kiềm)
Dãy gồm các chất bị phân hủy bởi nhiệt là: MgCO3, BaCO3, Ca(HCO3)2, NaHCO3.
Câu 8:
Đáp án D
Silic dẫn điện kém. Tinh thể silic tinh khiết là chất bán dẫn nên silic được dùng làm vật liệu bán dẫn trong kỹ thuật điện tử và chế tạo pin mặt trời.
Câu 9:
Đáp án D
Trong một nhóm A, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân tính kim loại của các nguyên tố tăng dần.
Trong nhóm IA, sắp xếp theo chiều tính kim loại tăng dần là: Li, Na, K, Rb
Câu 10:
Đáp án C
X có 3 lớp electron ⇒ thuộc chu kì 3
X có 7 electron lớp ngoài cùng ⇒ thuộc nhóm VII là phi kim mạnh.
Câu 11:
Đáp án C
Có ba dạng mạch cacbon là: mạch vòng, mạch thẳng, mạch nhánh.
Câu 12:
Đáp án B
Phản ứng hóa học đặc trưng của metan là phản ứng thế.
Metan không có phản ứng cộng, phản ứng tách và phản ứng trùng hợp.
Câu 13:
Đáp án B
Ta có:
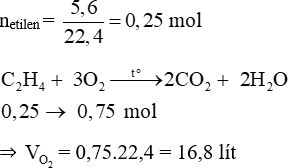
Câu 14:
Đáp án D
Etilen (C2H4) và axetilen (C2H2) đều làm mất màu dung dịch brom.
Metan (CH4) không làm mất màu dung dịch brom
Câu 15:
Đáp án C
Tính chất hóa học đặc trưng của benzen là dễ thế, khó cộng.
Benzen tham gia phản ứng thế với brom theo phương trình:
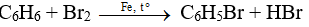
Câu 16:
Đáp án B
Để dập tắt đám cháy nhỏ do xăng, dầu người ta dùng biện pháp: phủ cát vào ngọn lửa
Mục địch là để ngăn cách ngọn lửa với oxi trong không khí.
Câu 17:
Đáp án B
Thành phần chủ yếu của khí thiên nhiên là metan (CH4)
Câu 18:
Đáp án B
Khí H2 khi cháy không gây ô nhiễm môi trường

Các khí còn lại cháy đều tạo CO2 là khí gây hiệu ứng nhà kính.
Câu 19:
Đáp án A
Khối lượng cacbon có trong 1kg than trên là:
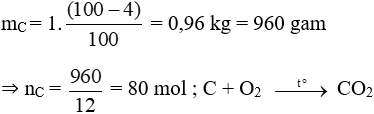
Theo phương trình:
⇒ = 80.22,4 = 1792 lít = 1,792 m3
Câu 20:
Đáp án B
Khí tham gia phản ứng trùng hợp là etilen (C2H4)

Câu 21:
Đáp án B

Bảo toàn khối lượng có:
mtrước = msau
⇒ mpoli etilen = metilen = 14 gam.
Câu 22:
Đáp án C
X là khí clo (Cl2):
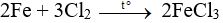
Câu 23:
Đáp án D
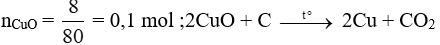
Theo phương trình:
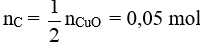
→ mC = 0,05.12 = 0,6 gam.
Câu 24:
Đáp án D
Cho hỗn hợp khí qua lượng dư nước vôi trong; CO2 và SO2 phản ứng với nước vôi trong bị giữ lại; CO không phản ứng thoát ra khỏi dung dịch thu được CO tinh khiết.
CO2 + Ca(OH)2 (dư) → CaCO3 ↓ + H2O
SO2 + Ca(OH)2 (dư) → CaSO3 ↓ + H2O
Câu 25:
Đáp án D
Nhận xét không đúng: Đốt cháy hợp chất hữu cơ luôn thu được CO2 và H2O.
Giải thích: Hợp chất hữu cơ chắc chắn có cacbon nên đốt cháy luôn thu được CO2. Hợp chất hữu cơ có thể không có H (ví dụ như: CCl4, NaOOC-COONa)
Câu 26
Đáp án B

Cho hỗn hợp khí qua dung dịch brom dư chỉ có axetilen phản ứng

Câu 27:
Đáp án B
Có 13 liên kết đơn trong phân tử C4H10.
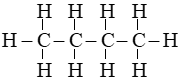
Câu 28:
Đáp án C
Phương trình phản ứng:
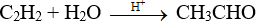
Câu 29:
Đáp án B
Số mol CuO là: nCuO = 0,03 mol
Phương trình phản ứng:

Theo phương trình phản ứng ta có: nCO = 0,03 mol
Thể tích khí CO cần dùng (đktc) là: VCO = 0,03.22,4 = 0,672 lít.
Câu 30:
Đáp án C
Số mol C6H5Br là:
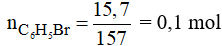
Phương trình phản ứng:
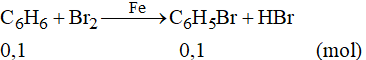
Theo phương trình phản ứng ta có:
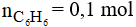
Khối lượng benzen theo lý thuyết là:
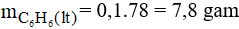
Vì hiệu suất đạt 80% suy ra khối lượng benzen cần dùng là:
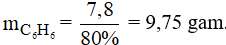
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 5)
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
I. TRẮC NGHIỆM (7 ĐIỂM)
Câu 1: Hỗn hợp khí X gồm O2, Cl2, CO2, SO2. Để thu được O2 tinh khiết, người ta dẫn X qua:
A. nước brom B. dung dịch NaOH
C. dung dịch HCl D. nước clo
Câu 2: Để phân biệt SO2 và CO2 có thể dùng một hóa chất nào sau đây?
A. Dung dịch BaCl2 B. Dung dịch NaOH
C. Dung dịch H2SO4 D. Dung dịch Brom.
Câu 3: Dung dịch hỗn hợp hai muối natri clorua và natri hipoclorit được gọi là gì?
A. Nước gia-ven B. Nước muối
C. Nước axeton D. Nước cất
Câu 4: Clo tác dụng với sắt dư, sau phản ứng thu được là:
A. FeCl3 B. FeCl2 C. Fe D. Fe và FeCl3
Câu 5: Có 3 khí đựng riêng biệt trong 3 lọ là oxi, clo, hiđroclorua. Để phân biệt các khí đó có thể dùng một hóa chất là
A. quì tím ẩm B. dung dịch NaOH
C. dung dịch AgNO3 D. dung dịch brom
Câu 6: Cho dung dịch NaOH 1M để tác dụng vừa đủ với 1,12 lít khí clo (đktc). Nồng độ mol của muối natri clorua thu được là
A. 0,05M. B. 0,5M. C. 1,0M. D. 1,5M.
Câu 7: Dẫn luồng khí CO qua hỗn hợp Al2O3, CuO, MgO, Fe2O3 (nung nóng). Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là
A. Al2O3, Cu, MgO, Fe. B. Al, Fe, Cu, Mg.
C. Al2O3, Cu, Mg, Fe. D. Al2O3, Fe2O3, Cu, MgO.
Câu 8: “Nước đá khô” không nóng chảy mà thăng hoa nên được dùng để tạo môi trường lạnh và khô rất tiện cho việc bảo quản thực phẩm. Nước đá khô là
A. CO rắn. B. SO2 rắn.
C. H2O rắn. D. CO2 rắn.
Câu 9: Cho khí CO dư đi qua ống chứa 0,2 mol MgO và 0,2 mol CuO nung nóng đến phản ứng hoàn toàn, thu được x gam chất rắn. Giá trị của x là
A. 17,6 B. 4,8 C. 20,8 D. 24,0
Câu 10: Cho m gam hỗn hợp muối A2CO3 và MCO3 tác dụng hết với 300 ml dung dịch H2SO4 0,5M. Thể tích khí CO2 sinh ra ở đktc là
A. 2,24 lít B. 4,48 lít C. 3,36 lít D. 6,72 lít
Câu 11: Phát biểu nào sau đây là không đúng:
A. Bảng tuần hoàn gồm có các ô nguyên tố, các chu kì và các nhóm
B. Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, sắp xếp theo Z tăng dần
C. Bảng tuần hoàn có 7 chu kì, số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử
D. Bảng tuần hoàn có 8 nhóm A, 8 nhóm B, 18 cột trong đó nhóm A có 8 cột và nhóm B có 10 cột
Câu 12: Chất hữu cơ là:
A. hợp chất khó tan trong nước.
B. hợp chất của cacbon và một số nguyên tố khác trừ N, Cl, O
C. hợp chất của cacbon trừ CO, CO2, H2CO3, muối cacbonat, muối cacbua và xianua.
D. hợp chất có nhiệt độ sôi cao.
Câu 13: Số công thức cấu tạo mạch hở có thể có của C4H8 là
A. 3 B. 4 C. 5 D. 6
Câu 14: Vitamin A là một chất dinh dưỡng thiết yếu cho con người. Trong thực phẩm, vitamin A tồn tại ở dạng chính là retinol (chứa C, H, O) trong đó thành phần % khối lượng H và O tương ứng là 10,49% và 5,594%. Xác định công thức phân tử của retinol là:
A. C18H30O B. C22H26O C. C21H18O D. C20H30O
Câu 15: Phản ứng của metan đặc trưng cho liên kết đơn là:
A. Phản ứng cháy B. Phản ứng cộng
C. Phản ứng thế D. Phản ứng trùng hợp
Câu 16: Chất nào sau đây vừa làm mất màu dung dịch brom, vừa tham gia phản ứng trùng hợp?
A. CH4. B. CH3CH2OH.
C. CH3-CH3. D. CH2=CH-CH3.
Câu 17: Cấu tạo phân tử axetilen gồm
A. hai liên kết đơn và một liên kết ba.
B. hai liên kết đơn và một liên kết đôi.
C. một liên kết ba và một liên kết đôi.
D. hai liên kết đôi và một liên kết ba.
Câu 18: Cấu tạo đặc biệt của phân tử benzen là:
A. Phân tử có vòng 6 cạnh
B. Phân tử có 3 vòng liên kết đôi
C. Phân tử có vòng 6 cạnh chứa 3 liên kết đôi xen kẽ 3 liên kết đơn
D. Phần tử có vòng 6 cạnh chứa liên kết đôi và liên kết đơn
Câu 19: Để sử dụng nhiên liệu có hiệu quả cần phải cung cấp không khí hoặc oxi:
A. Vừa đủ B. Thiếu
C. Dư D. Cả ba cách trên đều đúng.
Câu 20: Đốt cháy hòa toàn 15,6 gam benzen rồi hấp thụ sản phẩm cháy vào bình đựng dung dịch nước vôi trong dư. Khối lượng dung dịch tăng hay giảm bao nhiêu gam?
A. tăng 56,4 gam. B. giảm 28,2 gam.
C. giảm 56,4 gam. D. tăng 28,2 gam
II. TỰ LUẬN (3 ĐIỂM)
Câu 1: (1 điểm) Trình bày phương pháp hóa học để nhận biết các chất khí đựng trong các lọ khí riêng biệt sau: CH4; C2H2; CO2
Câu 2: (2 điểm) Dẫn 5,6 lít hỗn hợp khí metan CH4 và axetilen C2H2 (ở đktc) đi qua dung dịch brom dư, thấy có 32 gam brom phản ứng.
a) Viết phương trình phản ứng xảy ra.
b) Tính thành phần phần trăm theo thể tích các khí có trong hỗn hợp.
c) Tính thể tích khí oxi ở đktc cần dùng để đốt cháy hoàn toàn hỗn hợp trên.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 5
1B |
2D |
3A |
4D |
5A |
6B |
7A |
8D |
9C |
10C |
11C |
12C |
13A |
14D |
15C |
16D |
17A |
18C |
19A |
20C |
I. TRẮC NGHIỆM (7 ĐIỂM)
Câu 1:
Đáp án B
Để thu được O2 tinh khiết, người ta dẫn X qua dung dịch NaOH vì Cl2, CO2 và SO2 đều có phản ứng (dung dịch NaOH giữ lại Cl2, CO2 và SO2) còn O2 không có phản ứng.
2NaOH + Cl2 → NaCl + NaClO + H2O
CO2 + 2NaOH → Na2CO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O
Câu 2:
Đáp án D
Để phân biệt SO2 và CO2 có thể dùng dung dịch brom. SO2 làm mất màu dung dịch brom còn CO2 thì không.
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Câu 3:
Đáp án A
Dung dịch hỗn hợp hai muối natri clorua (NaCl) và natri hipoclorit (NaClO) được gọi là nước gia-ven
Câu 4:
Đáp án D
Clo tác dụng với sắt xảy ra phản ứng:
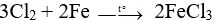
Tuy Fe dư nhưng đây không phải trong dung dịch, do đó Fe không tiếp tục phản ứng với FeCl3 để tạo ra FeCl2
Vậy sau phản ứng thu được gồm Fe và FeCl3.
Câu 5:
Đáp án A
Để phân biệt 3 khí O2, Cl2 và HCl ta dùng giấy quỳ tím ẩm.
- O2 không làm đổi màu quỳ
- Cl2 làm mất màu quỳ tím ẩm (do HClO sinh ra có tính tẩy màu)
Cl2 + H2O ⇄ HCl + HClO
- HCl làm quỳ tím ẩm hóa đỏ (vì HCl tan vào nước tạo thành axit HCl)
Câu 6:
Đáp án B
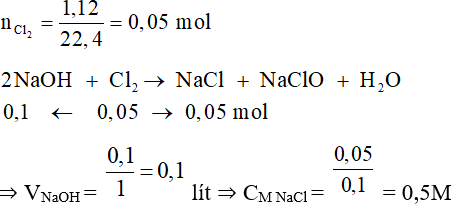
Câu 7:
Đáp án A
Khí CO chỉ khử được các oxit kim loại đứng sau Al ⇒ khử được CuO và Fe2O3
Câu 8:
Đáp án D
Nước đá khô là CO2 rắn
Câu 9:
Đáp án C
MgO không phản ứng với CO
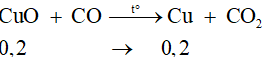
Chất rắn gồm MgO và Cu
⇒ x = mMgO + mCu = 0,2.40 + 0,2.64 = 20,8 gam
Câu 10:
Đáp án C
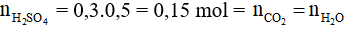
Hỗn hợp muối cacbonat tác dụng với dung dịch H2SO4 thu được
Câu 11:
Đáp án C
Phát biểu không đúng là: Bảng tuần hoàn có 7 chu kì, số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử.
Số thứ tự của chu kì bằng số lớp electron trong nguyên tử
Câu 12:
Đáp án C
Chất hữu cơ là: hợp chất của cacbon trừ CO, CO2, H2CO3, muối cacbonat, muối cacbua và xianua.
Câu 13:
Đáp án A
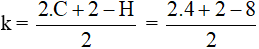
⇒ π = 1 (vì v = 0) ⇒ trong phân tử có 1 liên kết đôi
1. CH2=CH-CH2-CH3
2. CH3-CH=CH-CH3
3. CH3-C(CH3)=CH2
Câu 14:
Đáp án D
Vì A chỉ chứa C, H và O
⇒ %mC = 100% - %mH - %mO = 100% - 10,49% - 5,594% = 83,916%
Suy ra:
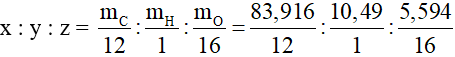
= 6,993 : 10,49 : 0,349 = 20 : 30 : 1
Vì renitol chứa một nguyên tử O ⇒ z = 1
⇒ x = 20 và y = 30
⇒ Công thức phân tử của retinol là C20H30O
Câu 15:
Đáp án C
Phản ứng của metan đặc trưng cho liên kết đơn là: phản ứng thế
Câu 16:
Đáp án D
Chất vừa làm mất màu dung dịch brom, vừa tham gia phản ứng trùng hợp là chất có liên kết đôi (giống etilen)
⇒ CH2 = CH-CH3
Câu 17:
Đáp án A
- Công thức cấu tạo của axetilen: H – C ≡ C – H.
⇒ cấu tạo phân tử axetilen gồm: và 2 liên kết đơn C – H.
+ Có 1 liên kết ba giữa 2 nguyên tử cacbon
+ Trong liên kết ba có 2 liên kết kém bền, dễ bị đứt lần lượt trong phản ứng hóa học
Câu 18:
Đáp án C
Cấu tạo đặc biệt của phân tử benzen là: Phân tử có vòng 6 cạnh chứa 3 liên kết đôi xen kẽ 3 liên kết đơn
Câu 19:
Đáp án A
Để sử dụng nhiên liệu có hiệu quả cần phải cung cấp không khí hoặc oxi vừa đủ.
Nếu dư hoặc thiếu oxi sẽ gây lãng phí nhiên liệu đồng thời dễ xảy ra cháy nổ.
Câu 20:
Đáp án C
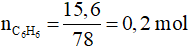
Phương trình hóa học:
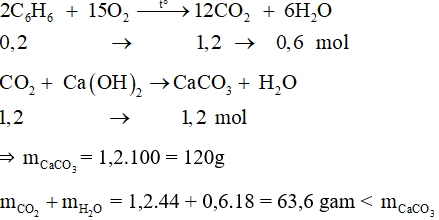
⇒ Khối lượng dung dịch giảm là: 120 − 63,6 = 56,4 (g)
II. TỰ LUẬN (3 ĐIỂM)
Câu 1:
Dẫn lần lượt các khí đã cho vào dung dịch nước brom, khí nào làm mất màu dung dịch brom là C2H2, hai khí còn lại là CH4 và CO2
C2H2 + 2Br2 → C2H2Br4
Dẫn 2 khí còn lại vào dung dịch nước vôi trong Ca(OH)2 dư, khí làm đục nước vôi trong là CO2, còn lại là CH4
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Câu 2:
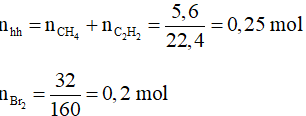
a) Phương trình hóa học: C2H2 + 2Br2 → C2H2Br4
b) Theo phương trình ta có :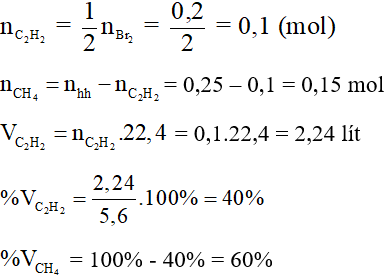
c) Phương trình hóa học phản ứng đốt cháy hỗn hợp khí trên:
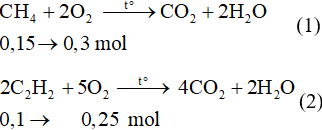
Từ (1) và (2) ta có: = 0,3 + 0,25 = 0,55 mol
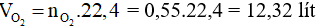
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
năm 2025
Bài thi môn: Hóa học 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 6)
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Hai phi kim tác dụng với nhau tạo sản phẩm không làm đổi màu giấy quỳ ẩm là
A. Hiđro và clo B. Photpho và oxi
C. Lưu huỳnh và oxi D. Hiđro và oxi
Câu 2: Phi kim có mức hoạt động hóa học yếu nhất là
A. Flo B. Oxi C. Clo D. Silic
Câu 3: Khí clo không tác dụng với
A. Dung dịch NaOH B. Khí O2
C. Dung dịch Ca(OH)2 D. H2O
Câu 4: Đốt cháy cacbon bởi O2, nếu dư thừa oxi thì sau phản ứng thu được khí nào?
A. CO2 B. O2
C. CO2 và CO dư D. CO2 và O2 dư
Câu 5: Khử hoàn toàn 2,4 gam đồng (II) oxit bằng khí CO. Thể tích khí CO cần dùng (đktc) là
A. 0,224 lít B. 0,672 lít
C. 0,448 lít D. 0,560 lít
Câu 6: Khí CO không khử được oxit nào sau đây ở nhiệt độ cao?
A. CuO B. ZnO C. PbO D. CaO
Câu 7: Ứng dụng của CO2 được dùng để
A. Chữa cháy
B. Bảo quản thực phẩm
C. Dùng trong sản xuất nước giải khát có gas, sản xuất sođa, phân đạm, …
D. A, B, C đều đúng
Câu 8: Điều nào sau đây không đúng cho phản ứng của CO và O2
A. Phản ứng tỏa nhiệt
B. Phản ứng thu nhiệt
C. Phản ứng không xảy ra ở điều kiện thường
D. Phản ứng kèm theo sự giảm thể tích
Câu 9: Chọn đáp án đúng nhất. Tất cả muối cacbonat đều
A. Không tan trong nước
B. Tan trong nước
C. Bị nhiệt phân tạo ra oxit kim loại và cacbon đioxit
D. Bị nhiệt phân trừ muối cacbonat của kim loại kiềm
Câu 10: Khối lượng kết tủa tạo ra, khi cho 5,3 gam Na2CO3 tác dụng vừa đủ với dung dịch Ca(OH)2 là
A. 4 gam B. 5 gam C. 6 gam D. 7 gam
Câu 11: Dung dịch H2CO3 làm quỳ tím chuyển thành màu gì?
A. Đỏ B. Xanh C. Tím D. Vàng
Câu 12: Công nghiệp silicat gồm
A. sản xuất đồ gốm B. sản xuất thủy tinh
C. sản xuất xi măng D. Cả A, B, C đều đúng
Câu 13: Thể tích của dung dịch KOH 1M ở điều kiện thường cần dùng để tác dụng hoàn toàn với 2,24 lít khí Cl2 (đktc) là
A. 0,2 lít B. 0,3 lít C. 0,4 lít D. 0,5 lít
Câu 14: Trong một chu kỳ, theo chiều tăng dần của điện tích hạt nhân
A. Tính phi kim giảm dần B. Tính kim loại không đổi
C. Tính phi kim tăng dần D. Tính kim loại tăng dần
Câu 15: Nhiệt phân hoàn toàn 50 gam CaCO3 thu được V lít khí ở đktc. Biết hiệu suất phản ứng là H = 80%. Giá trị của V là
A. 7,89 lít B. 8,96 lít C. 9,06 lít D. 10,01 lít
Câu 16: Hợp chất hữu cơ được chia thành mấy loại?
A. 1 B. 2 C. 3 D. 4
Câu 17: Hợp chất vô cơ và hợp chất hữu cơ khác nhau ở điểm nào?
A. Hợp chất hữu cơ kém bền hơn hợp chất vô cơ
B. Hợp chất hữu cơ thường có số lượng nhiều hơn hợp chất vô cơ
C. Hợp chất hữu cơ thường chứa C, H và có thể có O, Cl, …
D. Cả A, B, C đều đúng
Câu 18: Trong thành phần phân tử hợp chất hữu cơ nhất thiết phải có nguyên tố
A. Nitơ B. Oxi C. Hiđro D. Cacbon
Câu 19: Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết
A. Ion B. Hiđro C. Kim loại D. Cộng hóa trị
Câu 20: Một hợp chất X chứa 2 nguyên tố C, H có tỉ lệ khối lượng là mC : mH = 6 : 1. Hợp chất X có khối lượng mol phân tử là 56. Công thức phân tử của hợp chất X là
A. C5H10 B. C3H6 C. C5H9 D. C4H8
Câu 21: Một hợp chất hữu cơ có công thức C3H7Cl, có số công thức cấu tạo là
A. 1 B. 2 C. 3 D. 4
Câu 22: Công thức cấu tạo dưới đây là của hợp chất nào?
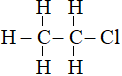
A. C2H5Cl B. C3H6Cl C. C4H8Cl D. C2H6Cl
Câu 23: Thành phần phần trăm về khối lượng của các nguyên tố cacbon và hiđro trong CH4 lần lượt là
A. 40% và 60% B. 80% và 20%
C. 75% và 25% D. 50% và 50%
Câu 24: Đốt cháy 8,4 gam etilen bằng oxi, sau phản ứng thu được V lít khí CO2 ở đktc. Giá trị của V là
A. 10,08 lít B. 13,44 lít C. 11,56 lít D. 12,56 lít
Câu 25: Cho 14 gam etilen vào dung dịch brom thấy dung dịch vừa đủ mất màu, khối lượng brom tham gia phản ứng là
A. 80 gam B. 40 gam C. 60 gam D. 50 gam
Câu 26: Trong phòng thí nghiệm người ta thu khí axetilen bằng phương pháp nào là tốt nhất trong các phương pháp sau
A. Đẩy không khí B. Đẩy nước
C. Đẩy nước brom D. Cả A, B đều đúng
Câu 27: Tính thể tích dung dịch brom 2M cần để tác dụng với 0,448 lít khí axetilen?
A. 0,01 lít B. 0,04 lít C. 0,03 lít D. 0,02 lít
Câu 28: Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại đó là
A. Etan B. Axetilen C. Etilen D. Metan
Câu 29: Đốt cháy benzene trong không khí tạo ra CO2 và H2O có tỉ lệ là
A. 1 : 2 B. 1 : 3 C. 3 : 1 D. 2 : 1
Câu 30: Đun nóng brom với 3,9 gam benzen (có bột sắt), người ta thu được 4,71 gam brombenzen. Hiệu suất của phản ứng là
A. 60% B. 70% C. 80% D. 90%
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 6
1D |
2D |
3B |
4D |
5B |
6D |
7D |
8B |
9D |
10B |
11A |
12D |
13A |
14C |
15B |
16B |
17D |
18D |
19D |
20D |
21B |
22A |
23C |
24B |
25A |
26D |
27D |
28B |
29D |
30A |
Câu 1:
Đáp án D
Phương trình phản ứng:
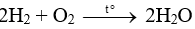
Nước là môi trường trung tính nên không làm quỳ đổi màu.
Câu 2:
Đáp án D
Theo bảng tuần hoàn các nguyên tố hóa học thì thứ tự của các phi kim này là:
F > Cl > O > Si
Câu 3:
Đáp án B
Khí clo không tác dụng với khí O2
Khí clo tác dụng với: dung dịch NaOH, Ca(OH)2, H2O
Phương trình phản ứng:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Cl2 + Ca(OH)2 → CaOCl2 + H2O
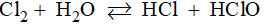
Câu 4:
Đáp án D
Đốt cháy cacbon bởi O2, nếu dư thừa oxi thì sau phản ứng thu được hỗn hợp khí là
CO2 và O2 dư
Câu 5:
Đáp án B
Số mol CuO là: nCuO = 0,03 mol
Phương trình phản ứng:
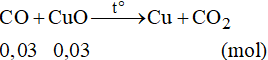
Theo phương trình phản ứng ta có: nCO = 0,03 mol
Thể tích khí CO cần dùng (đktc) là: VCO = 0,03.22,4 = 0,672 lít.
Câu 6:
Đáp án D
Ở nhiệt độ cao, khí CO không khử được oxit là: CaO
CO chỉ khử được những oxit của kim loại đứng sau Al trong dãy hoạt động hóa học.
Câu 7:
Đáp án D
Ứng dụng của CO2 được dùng để
+ Chữa cháy
+ Bảo quản thực phẩm
+ Dùng trong sản xuất nước giải khát có gas, sản xuất sođa, phân đạm, …
Câu 8:
Đáp án B
Điều không đúng cho phản ứng của CO và O2 là: Phản ứng thu nhiệt.
Câu 9:
Đáp án D
Tất cả muối cacbonat đều bị nhiệt phân trừ muối cacbonat của kim loại kiềm.
Câu 10:
Đáp án B
Số mol của Na2CO3 là:

Phương trình phản ứng:
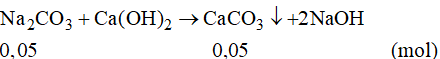
Số mol của CaCO3 là:
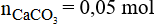
Khối lượng CaCO3 là:
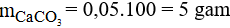
Câu 11:
Đáp án A
Dung dịch axit H2CO3 làm quỳ tím chuyển thành màu đỏ.
Câu 12:
Đáp án D
Công nghiệp silicat gồm
+ sản xuất đồ gốm
+ sản xuất thủy tinh
+ sản xuất xi măng
Công nghiệp silicat gồm sản xuất đồ gốm, thủy tinh, xi măng.
Câu 13:
Đáp án A
Số mol Cl2 là:
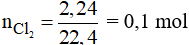
Phương trình phản ứng:
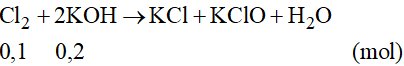
Thể tích của dung dịch KOH 1M là:
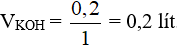
Câu 14:
Đáp án C
Trong một chu kỳ, theo chiều tăng của điện tích hạt nhân thì năng lượng ion hóa, độ âm điện tăng dần đồng thời bán kính nguyên tử giảm dần làm cho khả năng nhận electron tăng nên tính phi kim tăng.
Câu 15:
Đáp án B
Số mol của CaCO3 phản ứng là:
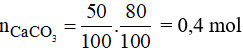
Phương trình phản ứng:
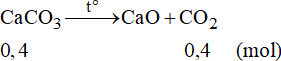
Theo phương trình phản ứng ta có:
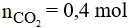
Vậy thể tích khí CO2 là: V = 0,4.22,4 = 8,96 lít.
Câu 16:
Đáp án B
Hợp chất hữu cơ được chia thành 2 loại:
+ Hiđrocacbon: phân tử chỉ có 2 nguyên tố là cacbon và hiđro (CH4, C2H4, …)
+ Dẫn xuất của hiđrocacbon: ngoài cacbon và hiđro, trong phân tử còn có các nguyên tố khác như oxi, clo, … (C2H6O, CH3Cl, …)
Câu 17:
Đáp án D
Hợp chất vô cơ và hợp chất hữu cơ khác nhau ở điểm:
+ Hợp chất hữu cơ kém bền hơn hợp chất vô cơ
+ Hợp chất hữu cơ thường có số lượng nhiều hơn hợp chất vô cơ
+ Hợp chất hữu cơ thường chứa C, H và có thể có O, Cl, …
Câu 18:
Đáp án D
Trong thành phần phân tử hợp chất hữu cơ nhất thiết phải có nguyên tố cacbon.
Câu 19:
Đáp án D
Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết cộng hóa trị.
Câu 20:
Đáp án D
Gọi công thức phân tử của hợp chất X là: CxHy
Ta có:
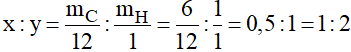
Suy ra công thức đơn giản của hợp chất X là:

Công thức phân tử của hợp chất X có dạng
MX = 56 = n.(12 + 2), suy ra n = 4
Vậy công thức phân tử của hợp chất X là: C4H8
Câu 21:
Đáp án B
Có hai công thức cấu tạo là:
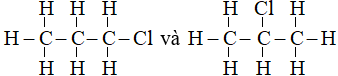
Câu 22:
Đáp án A
Công thức cấu tạo trên là của hợp chất: C2H5Cl
Câu 23:
Đáp án C
Ta có:
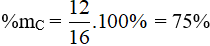
%mH = 100% - 75% = 25%
Câu 24:
Đáp án B
Số mol của C2H4 là:
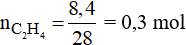
Phương trình phản ứng:
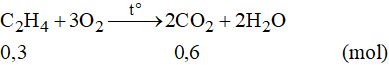
Theo phương trình phản ứng ta có:
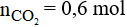
Vậy thể tích khí CO2 thu được là: V = 0,6.22,4 = 13,44 lít.
Câu 25:
Đáp án A
Số mol của C2H4 là:
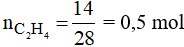
Phương trình phản ứng:
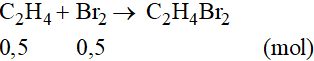
Theo phương trình phản ứng ta có:
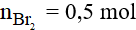
Vậy khối lượng brom tham gia phản ứng là:
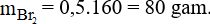
Câu 26:
Đáp án D
Trong phòng thí nghiệm người ta thu khí axetilen bằng phương pháp nào là tốt nhất trong các phương pháp sau
+ Đẩy không khí
+ Đẩy nước
Câu 27:
Đáp án D
Số mol C2H2 là:
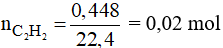
Phương trình phản ứng:
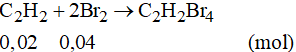
Theo phương trình phản ứng ta có
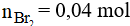
Vậy thể tích dung dịch brom cần dùng là:
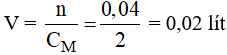
Câu 28:
Đáp án B
Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại đó là: Axetilen
Câu 29:
Đáp án D
Phương trình phản ứng:
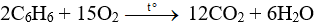
Theo phương trình phản ứng ta có tỉ lệ CO2 : H2O = 12 : 6 = 2 : 1
Câu 30:
Đáp án A
Số mol của C6H6 là:
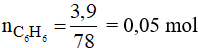
Phương trình phản ứng:
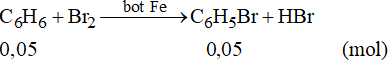
Theo phương trình phản ứng ta có:
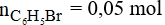
Khối lượng C6H5Br trên lý thuyết là:
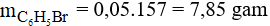
Hiệu suất của phản ứng là:
................................
................................
................................
Trên đây tóm tắt một số nội dung miễn phí trong bộ Đề thi Hóa học 9 năm 2026 mới nhất, để mua tài liệu trả phí đầy đủ, Thầy/Cô vui lòng xem thử:
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Bộ đề thi năm 2025 các lớp các môn học được Giáo viên nhiều năm kinh nghiệm tổng hợp và biên soạn theo Thông tư mới nhất của Bộ Giáo dục và Đào tạo, được chọn lọc từ đề thi của các trường trên cả nước.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

