Đề thi Học kì 1 Hóa học 11 có đáp án (6 đề)
Đề thi Học kì 1 Hóa học 11 có đáp án (6 đề)
Với Đề thi Học kì 1 Hóa học 11 có đáp án (6 đề), chọn lọc giúp học sinh ôn tập và đạt kết quả cao trong bài thi Học kì 1 Hóa học 11.
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Fe=56, Al=27, N=14, S=32, Cu=64)
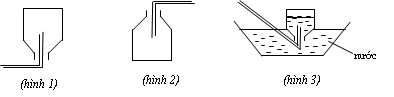
Câu 1: Một học sinh đã điều chế và thu khí NH3 theo sơ đồ sau đây, nhưng kết quả thí nghiệm không thành công. Lí do chính là:
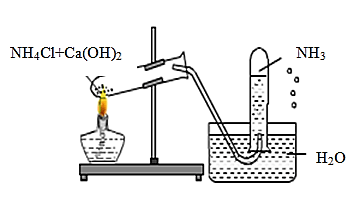
A. NH3 không được điều chế từ NH4Cl và Ca(OH)2.
B. NH3 không được thu bằng phương pháp đẩy nước mà là đẩy không khí.
C. Thí nghiệm trên xảy ra ở điều kiện thường nên không cần nhiệt độ.
D. Ống nghiệm phải để hướng xuống chứ không phải hướng lên.
Câu 2: Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của:
A. N B. K2O C. P D. P2O5
Câu 3: Sục V lít CO2 (đkc) vào 100 ml dung dịch Ca(OH)2 2M thu được 10 gam kết tủa. V có giá trị là:
A. 2,24 lít hoặc 6,72 lít. B. 2,24 lít.
C. 6,72 lít. D. 2,24 lít hoặc 4,48 lít.
Câu 4: Hiđroxit nào sau đây không phải là hiđroxit lưỡng tính:
A. Cr(OH)3. B. Al(OH)3.
C. Zn(OH)2. D. Ba(OH)2.
Câu 5: Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là:
A. 2,24 lít. B. 11,2 lít. C. 4,48 lít. D. 6,72 lít.
Câu 6: Cho dãy các chất sau: Al, NaHCO3, (NH4)2CO3, NH4Cl, Al2O3, Zn, K2CO3, K2SO4. Có bao nhiêu chất trong dãy vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch NaOH?
A. 5. B. 2. C. 3. D. 4.
Câu 7: Cho N (Z = 7). Cấu hình electron của nitơ là?
A. 1s22s22p4. B. 1s22s22p6.
C. 1s22s22p3. D. 1s22s22p5.
Câu 8: Photpho trắng được bảo quản bằng cách ngâm trong:
A. benzen. B. ete. C. dầu hoả. D. nước.
Câu 9: “Nước đá khô” không nóng chảy mà thăng hoa nên được dùng để tạo môi trường lạnh và khô rất tiện cho việc bảo quản thực phẩm. Nước đá khô là:
A. H2O rắn. B. CO2 rắn. C. SO2 rắn. D. CO rắn.
Câu 10: Dẫn luồng khí CO qua hỗn hợp Al2O3, CuO, MgO, Fe2O3 đun nóng, sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là:
A. Al2O3, Cu, MgO, Fe. B. Al; Fe, Cu, Mg.
C. Al2O3, Cu, Mg, Fe. D. Al2O3, Cu, MgO, Fe2O3.
Câu 11: Khi cho quỳ tím vào dung dịch HCl 0,10M thì quỳ tím đổi sang màu:
A. vàng. B. xanh. C. trắng. D. đỏ.
Câu 12: Phân đạm giúp cho cây phát triển nhanh, cho nhiều hạt, củ, quả. Hiện nay người ta chủ yếu sử dụng đạm urê để bón cho cây trồng. Công thức phân tử của đạm urê là:
A. NaNO3. B. (NH2)2CO. C. NH4NO3. D. NH4Cl.
Câu 13: Một dung dịch có nồng độ [ OH- ] = 2,5.10-10 mol/l. Môi trường của dung dịch này là:
A. Kiềm. B. Axit.
C. Trung tính D. Lưỡng tính.
Câu 14: Những kim loại nào sau đây không tác dụng được với dung dịch HNO3 đặc, nguội?
A. Fe, Al B. Zn, Pb C. Mn, Ni D. Cu, Ag
Câu 15: Chất nào sau đây không dẫn điện được?
A. Nước ở hồ, nước mặn. B. Nước biển.
C. KCl rắn, khan. D. Dung dịch KCl trong nước.
Câu 16: Dung dịch X có chứa a mol Na+, b mol Mg2+, c mol Cl- và d mol SO42- . Biểu thức nào sau đây đúng:
A. a + b = c + d. B. a + 2b = c + 2d.
C. a + 2b = c + d. D. a + 2b = - c - 2d.
Câu 17: Cho từ từ dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2. Hiện tượng xảy ra là?
A. có kết tủa trắng. B. không có hiện tượng.
C. có mùi khai bay lên và có kết tủa trắng. D. có khí mùi khai bay lên.
Câu 18: Cho 20 gam NaOH vào dung dịch chứa 39,2 gam H3PO4. Hỏi muối nào được tạo thành? Khối lượng là bao nhiêu?
A. Na3PO4: 50 gam.
B. Na2HPO4: 14,2 gam và Na3PO4: 49,2 gam.
C. Na3PO4: 50 gam và Na2HPO4: 22,5 gam.
D. NaH2PO4: 36 gam và Na2HPO4: 14,2 gam.
Câu 19: Cho các phản ứng hóa học sau:
(1) (NH4)2SO4 + BaCl2 →
(2) CuSO4 + Ba(NO3)2 →
(3) Na2SO4 + BaCl2 →
(4) H2SO4 + BaSO3 →
(5) (NH4)2SO4 + Ba(OH)2 →
(6) Fe2(SO4)3 + Ba(NO3)2 →
Dãy gồm các phản ứng có cùng một phương trình ion thu gọn là:
A. (1), (3), (5), (6). B. (3), (4), (5), (6).
C. (2), (3), (4), (6). D. (1), (2), (3), (6).
Câu 20: Để phân biệt các dung dịch riêng biệt gồm NaOH, NaCl, BaCl2, Ba(OH)2 chỉ cần dùng thuốc thử
A. H2O và CO2. B. quỳ tím.
C. dung dịch H2SO4. D. dung dịch (NH4)2SO4.
Câu 21: Cho cân bằng hoá học: N2 (k) + 3H2 (k) ⇄ 2NH3 (k). Phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi:
A. thay đổi áp suất của hệ. B. thay đổi nồng độ N2.
C. thay đổi nhiệt độ. D. thêm chất xúc tác Fe.
Câu 22: Phản ứng nhiệt phân không đúng là:
A. 2KNO3 −to→ 2KNO2 + O2.
B.NH4NO3 −to→ N2 + 2H2O.
C. NH4Cl −to→ NH3 + HCl.
D. 2NaHCO3 −to→ Na2CO3 + CO2 + H2O.
Câu 23: Nhận định nào sau đây về muối cacbonat là đúng: Tất cả muối cacbonat đều
A. tan trong nước
B. bị nhiệt phân tạo ra oxit kim loại và cacbon đioxit.
C. không tan trong nước.
D. bị nhiệt phân trừ muối cacbonat của kim loại kiềm.
Câu 24: Tổng số liên kết π và vòng ứng với công thức C5H12O2 là:
A. 2 B. 0 C. 3 D. 1
Câu 25: Hai khoáng vật của photpho là:
A. apatit và photphorit. B. photphorit và đolomit.
C. photphorit và cacnalit. D. apatit và đolomit.
Câu 26: Dung dịch X chứa 0,1 mol Na+ ; 0,2 mol Ba2+ ; 0,15 mol Cl- và y mol OH- . Khối lượng chất rắn thu được sau khi cô cạn dung dịch X bằng (giả sử chỉ có nước bay hơi)
A. 40,975 gam B. 37,575 gam
C. 64,975 gam D. 57,675 gam
Câu 27: Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8 đun nóng X thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là
A. 50% B. 40% C. 25% D. 36%.
Câu 28: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 60,0%; %mH = 8,0%, còn lại là oxi. Tỉ khối hơi của X so với CO2 nhỏ hơn 3. Công thức phân tử của X là
A. C3H8O B. C3H8O2 C. C5H8O2 D. C5H8O.
Câu 29: Đốt cháy hoàn toàn 100 ml hợp chất hữu cơ X, cần hết 300 ml O2, thu được 200 ml CO2 và 300 ml hơi nước. Các khí được đo ở cùng nhiệt độ, áp suất. Công thức phân tử của X là
A. C2H6O B. C2H6O2 C. C2H4O D. C3H6O2.
Câu 30: Phát biểu nào dưới đây không đúng?
A. SiO2 là oxit axit.
B. dung dịch đậm đặc của NaSiO3 và K2SiO3 được gọi là thủy tinh lỏng.
C. Sục khí CO2 vào dung dịch Ca(OH)2 dư, dung dịch bị vẩn đục.
D. SiO2 tan tốt trong dung dịch HCl.
--- Hết ---
Giám thị không giải thích thêm
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
1. B |
2. D |
3. A |
4. D |
5. C |
6. A |
7. C |
8. D |
9. B |
10. A |
11. D |
12. B |
13. B |
14. A |
15. C |
16. B |
17. C |
18. D |
19. D |
20. D |
21. D |
22. B |
23. D |
24. B |
25. A |
26. A |
27. C |
28. C |
29. A |
30. D |
Câu 1:
NH3 tan rất tốt trong nước, nên không được thu bằng phương pháp đẩy nước mà phải thu bằng phương pháp đẩy không khí và ống nghiệm phải úp xuống vì NH3 nhẹ hơn không khí.
Đáp án B
Câu 2:
Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của P2O5.
Đáp án D
Câu 3:
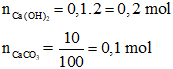
* TH1: Ca(OH)2 dư, dung dịch sau phản ứng chỉ chứa 1 muối
Phương trình phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
Bảo toàn nguyên tố C: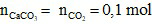
VCO2= 0,1. 22,4 = 2,24 lít
* TH2: Dung dịch sau phản ứng chứa hai muối
Phương trình phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O (2)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (3)
Ta có: 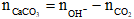
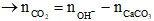 = 0,2.2 – 0,1 = 0,3 mol
= 0,2.2 – 0,1 = 0,3 mol
=> VCO2 = 0,3.22,4 = 6,72 lít
Đáp án A
Câu 4:
Các hiđroxit lưỡng tính thường gặp như Al(OH)3, Zn(OH)2, Cr(OH)3,…
Ba(OH)2 là 1 bazơ mạnh.
Đáp án D
Câu 5:
mFe phản ứng = 20 – 3,2 = 16,8 gam
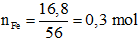
Sau phản ứng Fe còn dư nên muối thu được là muối sắt (II).
Áp dụng định luật bảo toàn electron:
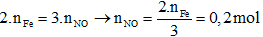
VNO = 0,2.22,4 = 4,48 lít
Đáp án C
Câu 6:
Các chất tác dụng được với dung dịch NaOH và HCl là:
Al, NaHCO3, (NH4)2CO3, Al2O3, Zn.
Đáp án A
Câu 7:
Cấu hình electron của nitơ là 1s22s22p3.
Đáp án C
Câu 8:
Photpho trắng được bảo quản bằng cách ngâm trong nước.
Đáp án D
Câu 9:
Nước đá khô là CO2 hóa rắn.
Đáp án B
Câu 10:
CO khử được những oxit kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại.
Đáp án A
Câu 11:
Dung dịch HCl 0,1M có môi trường axit nên làm quỳ tím hóa đỏ.
Đáp án D
Câu 12:
Công thức hóa học của phân đạm urê là (NH2)2CO.
Đáp án B
Câu 13:
[ OH- ] < 10-7
=> Môi trường axit
Đáp án B
Câu 14:
Các kim loại Fe, Al không tác dụng với axit H2SO4 đặc nguội.
Đáp án A
Câu 15:
KCl rắn, khan không dẫn được điện, nhưng dung dịch KCl trong nước hoặc KCl nóng chảy sẽ dẫn được điện.
Đáp án C
Câu 16:
Áp dụng định luật bảo toàn điện tích ta có:
a + 2b = c + 2d
Đáp án B
Câu 17:
Phương trinh hóa học:
(NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O
=> Có mùi khai bay lên (NH3) và có kết tủa trắng BaSO4.
Đáp án C
Câu 18:
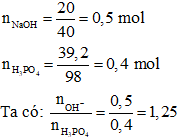
=> Sau phản ứng chất thu được là: Na2HPO4 và NaH2PO4
Ta có phương trình:
2NaOH + H3PO4 → Na2HPO4 + 2H2O (1)
NaOH + H3PO4 → NaH2PO4 + H2O (2)
Gọi số mol Na2HPO4; NaH2PO4 lần lượt là x, y
=> Ta có hệ phương trình:
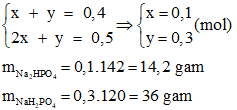
Đáp án D
Câu 19:
Phương trình ion của các phương trình:
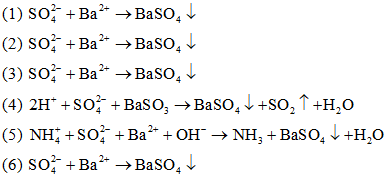
Đáp án D
Câu 20:
NaOH |
NaCl |
BaCl2 |
Ba(OH)2 |
|
(NH4)2SO4 |
Xuất hiện khí có mùi khai |
Không hiện tượng |
Xuất hiện kết tủa trắng |
Xuất hiện kết tủa trắng và khí có mùi khai bay ra |
Đáp án D
Câu 21:
Cân bằng hóa học không bị dịch chuyển khi thêm chất xúc tác Fe vì chất xúc tác chỉ có tác dụng làm phản ứng nhanh đạt đến trạng thái cân bằng.
Đáp án D
Câu 22:
NH4NO3 N2O + 2H2O
Đáp án B
Câu 23:
Tất cả muối cacbonat đều bị nhiệt phân trừ muối cacbonat của kim loại kiềm.
Đáp án D
Câu 24:
Tổng số liên kết π + Vòng = 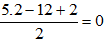
Đáp án B
Câu 25:
Hai khoáng vật của photpho là apatit và photphorit.
Đáp án A
Câu 26:
Áp dụng định luật bảo toàn điện tích ta có:
=0,1.1 + 0,2.2 = 0,15.1 + y.1 → y = 0,35 mol
Khối lượng chất rắn thu được là:
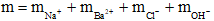
= 0,1.23 + 0,2.137 + 0,15.35,5 + 0,35.17 = 40,975 gam
Đáp án A
Câu 27:
Ta có: 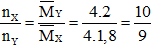
Giả sử nX = 10 mol, nY = 9 mol
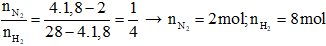
→ Hiệu suất tính theo N2.
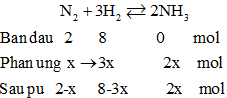
→ 2 – x + 8 – 3x + 2x = 9
→ x = 0,5
Hiệu suất của phản ứng là: 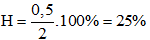
Đáp án C
Câu 28:
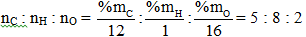
Công thức đơn giản nhất: C5H8O2⇒ Công thức phân tử: (C5H8O2)n
MX = (5.12 + 8 + 16.2).n < 44.3 ⇒ n < 1,4
⇒ n = 1 ⇒ Công thức phân tử: C5H8O2.
Đáp án C
Câu 29:
Phương trình đốt cháy:
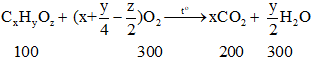
Bảo toàn nguyên tố C: 100x = 200 ⇒ x = 2
Bảo toàn nguyên tố H: 100y = 300.2 ⇒ y = 6
Bảo toàn nguyên tố C: 100z + 300.2 = 200.2 + 200.1 ⇒ z = 1
⇒ Công thức phân tử: C2H6O.
Đáp án A
Câu 30:
SiO2 không tan trong axit HCl.
Đáp án D

Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 2)
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Fe=56, Al=27, N=14, S=32, Cu=64)
Câu 1: Chọn phát biểu đúng.
A. Silic có tính oxi hóa mạnh hơn cacbon.
B. Cacbon có tính oxi hóa mạnh hơn silic.
C. Silic có tính khử yếu hơn cacbon.
D. Silic và cacbon có tính oxi hóa bằng nhau.
Câu 2: Chất có thể dùng làm khô khí NH3 là
A. P2O5. B. CuSO4 khan. C. H2SO4 đặc.. D. CaO.
Câu 3: Cho các hợp chất: CaC2, CO2, HCHO, CH3COOH, C2H5OH, NaCN, CaCO3. Số hợp chất hữu cơ trong các hợp chất đã cho là:
A. 1. B. 2. C. 4. D. 3.
Câu 4: Trong các chất sau chất nào được gọi là hiđrocacbon?
A. CH4. B. C2H6O.
C. CH3Cl. D. C12H22O11.
Câu 5: Trong những dãy chất sau đây, dãy nào có các chất là đồng phân của nhau?
A. C2H5OH, CH3OCH3.. B. CH3OCH3, CH3CHO.
C. CH3CH3CH2OH, C2H5OH. D. C4H10, C6H6.
Câu 6:Khi đốt cháy chất hữu cơ X bằng oxi không khí thu được hỗn hợp khí và hơi gồm CO2, H2O, N2. Điều đó chứng tỏ phân tử chất X
A. chắc chắn phải có các nguyên tố C, H, O, N.
B. chắc chắn phải có các nguyên tố C, H, N có thể có nguyên tố O.
C. chỉ có các nguyên tố C, H.
D. chắc chắn phải có các nguyên tố C, O, N.
Câu 7: Thuốc nổ đen là hỗn hợp
A. KNO3, C và S. B. KNO3 và S.
C. KClO3, C và S. D. KClO3 và S.
Câu 8: Sự điện li là quá trình
A. hòa tan các chất vào nước.
B. phân li ra ion của các chất trong nước.
C. phân li thành các phân tử hòa tan.
D. phân li của axit trong nước.
Câu 9: Điều khẳng định đúng là:
A. dung dịch có môi trường bazơ thì pH > 7.
B. dung dịch có môi trường trung tính thì pH < 7.
C. dung dịch có môi trường axit thì pH = 7.
D. dung dịch có môi trường trung tính thì pH > 7.
Câu 10: Trong các chất sau, chất có độ cứng lớn nhất là
A. silic. B. kim cương.
C. than chì. D. thạch anh.
Câu 11: Chất được dùng để chữa bệnh đau dạ dày là:
A. CO. B. CO2 tinh thể
C. SiO2. D. NaHCO3.
Câu 12: Những ion có thể cùng tồn tại trong một dung dịch là
A. Na+, Ca2+, H2SO4-, CO32- . B. Na+, Mg2+, OH-,NO3- .
C. Na+, Ba2+, OH-, Cl-. D. Ag+, H+, Cl-, SO42- .
Câu 13: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
A. các chất phản ứng phải là chất điện li mạnh.
B. một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
C. các chất phản ứng phải là những chất dễ tan.
D. phản ứng phải là thuận nghịch.
Câu 14:Khí N2 tương đối trơ ở nhiệt độ thường là do:
A. Phân tử nitơ có liên kết ba bền vững.
B. Nitơ có bán kính nguyên tử nhỏ.
C. Nitơ có độ âm điện lớn.
D. Phân tử nitơ phân cực.
Câu 15:Cấu hình electron của nguyên tử photpho (Z = 15) là
A. 1s22s22p63s23p5. B. 1s22s22p3.
C. 1s22s22p63s23p3. D.1s22s22p63s23p2.
Câu 16:Các chất có cấu tạo và tính chất hóa học tương tự nhau, chúng chỉ hơn kém nhau một hay nhiều nhóm metylen (-CH2-) được gọi là
A. đồng phân. B. đồng vị.
C. đồng đẳng. D. đồng khối.
Câu 17: Chất được dùng để khắc chữ lên thủy tinh là
A. dung dịch H2SO4. B. dung dịch HNO3.
C. dung dịch HCl. D. dung dịch HF.
Câu 18: Phản ứng nitơ thể hiện tính khử là
A. N2 + 6Li → 2Li3N. B. N2 + 2Al → 2AlN.
C. N2 + O2 → 2NO. D. N2 + 3H2 → 2NH3.
Câu 19: Trong phản ứng sau: 4HNO3 + C → CO2 + 4NO2 + 2H2O. Cacbon là
A. chất bị khử. B. chất oxi hóa.
C. chất khử. D. chất nhận electron.
Câu 20: Công thức phân tử của phân urê là
A. (NH4)2CO3. B. NH2CO.
C. (NH2)2CO3. D. (NH2)2CO.
Câu 21: Cho phản ứng hóa học: NaOH + HCl → NaCl + H2O
Phản ứng hóa học nào sau đây có cùng phương trình ion thu gọn với phản ứng trên?
A. 2KOH + FeCl2 → Fe(OH)2 + 2KCl
B. NaOH + NaHCO3 → Na2CO3 + H2O
C. NaOH + NH4Cl → NaCl + NH3 + H2O
D. KOH + HNO3 → KNO3 + H2O
Câu 22: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 60,0%; %mH = 8,0%, còn lại là oxi. Tỉ khối hơi của X so với CO2 nhỏ hơn 3. Công thức phân tử của X là
A. C3H8O B. C3H8O2 C. C5H8O2 D. C5H8O.
Câu 23: Hấp thụ hoàn toàn 0,336 lít khí CO2 (đktc) vào 200 ml dung dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan?
A. 2,44 gam B. 2,22 gam
C. 2,31 gam D. 2,58 gam.
Câu 24: Cho 2,8 gam hỗn hợp X gồm Cu và Ag phản ứng hoàn toàn với dung dịch HNO3 dư, thu được 0,04 mol NO2 (sản phẩm khử duy nhất của N+5 ) và dung dịch chứa m gam muối. Giá trị của m là
A. 4,48 B. 3,62 C. 3,42 D. 5,28.
Câu 25: Một loại phân supephotphat kép có chứa 69,62% muối canxi đihiđrophotphat, còn lại gồm các chất không chứa photpho. Độ dinh dưỡng của loại phân lân này là
A. 48,52% B. 42,25% C. 39,76% D. 45,75%.
Câu 26: Cho 0,1 mol P2O5 vào dung dịch chứa 0,35 mol KOH. Dung dịch thu được có các chất:
A. K3PO4, K2HPO4 B. K2HPO4, KH2PO4
C. K3PO4, KOH D. H3PO4, KH2PO4
Câu 27: Phản ứng nhiệt phân nào sau đây không đúng?
A. 2KNO3 −to→ 2KNO2 + O2↑ B. NH4NO2 −to→ N2↑ + 2H2O
C. NH4Cl −to→ NH3 + HCl D. NaHCO3 −to→ NaOH + CO2↑
Câu 28: Để khắc chữ lên thủy tinh người ta dựa vào phản ứng:
A. SiO2 + Na2CO3 → Na2SiO3 + CO2↑
B. SiO2 + 4HF → SiF4 + 2H2O
C. SiO2 + 2NaOH → Na2SiO3 + H2O
D. SiO2 + 2Mg → 2MgO + Si
Câu 29: Tính chất đặc biệt của kim cương là:
A. Rất mềm B. Cản quang
C. Rất cứng D. Có ánh kim
Câu 30: Trong thực tế, người ta thường dùng muối nào để làm xốp bánh?
A. NH4HCO3. B. BaSO4. C. NaCl. D. NH4Cl.
--- Hết ---
Giám thị không giải thích thêm
Đáp án và hướng dẫn giải
1. B |
2. D |
3. D |
4. A |
5. A |
6. B |
7. A |
8. B |
9. A |
10. B |
11. D |
12. C |
13. B |
14. A |
15. C |
16. C |
17. D |
18. C |
19. C |
20. D |
21. D |
22. C |
23. C |
24. D |
25. B |
26. B |
27. D |
28. B |
29. C |
30. A |
Câu 1:
Trong các phản ứng thì silic thể hiện tính khử hoặc tính oxi hóa. Tính oxi hóa của silic yếu hơn của cacbon.
Đáp án B
Câu 2:
Chất làm làm khô khí NH3 phải có tác dụng hút ẩm và không phản ứng với NH3.
→ Có thể dùng CaO làm khô khí NH3.
Đáp án D
Câu 3:
Các hợp chất hữu cơ gồm HCHO, CH3COOH, C2H5OH.
→ Có 3 chất hữu cơ.
Đáp án D
Câu 4:
Hiđrocacbon là hợp chất hữu cơ chỉ chứa C và H.
Đáp án A
Câu 5:
Các chất là đồng phân của nhau khi có cùng công thức phân tử và công thức cấu tạo khác nhau.
Đáp án A
Câu 6:
Khi đốt cháy chất hữu cơ X bằng oxi không khí thu được hỗn hợp khí và hơi gồm CO2, H2O, N2 → X chắc chắn chứa các nguyên tố C, H, N và có thể có nguyên tố O.
Đáp án B
Câu 7:
Thuốc nổ đen là hỗn hợp gồm KNO3, C và S.
Đáp án A
Câu 8:
Sự điện li là quá trình các chất khi tan trong nước phân li thành các ion.
Đáp án B
Câu 9:
Dung dịch có môi trường bazo thì pH > 7.
Dung dịch có môi trường axit thì pH < 7.
Dung dịch có môi trường trung tính thì pH = 7.
Đáp án A
Câu 10:
Chất có độ cứng lớn nhất là kim cương.
Đáp án B
Câu 11:
Chất được dùng để chữa bệnh đau dạ dày là NaHCO3, chất này sẽ trung hòa bớt lượng axit trong dạ dày.
Đáp án D
Câu 12:
Những ion có thể cùng tồn tại trong một dung dịch khi chúng không phản ứng với nhau.
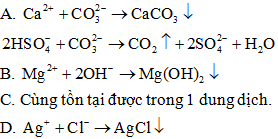
Đáp án C
Câu 13:
Phản ứng trao đổi ion trong dung dịch các chất điện li xảy ra khi một số ion trong dung dịch kết hợp được với nhau tạo thành một trong các loại chất sau: chất khí, chất kết tủa, chất điện li yếu.
Đáp án B
Câu 14:
Khí N2 tương đối trơ ở nhiệt độ thường là do nitơ có liên kết ba bền vững.
Đáp án A
Câu 15:
Cấu hình electron của nguyên tử photpho là 1s22s22p63s23p3.
Đáp án C
Câu 16:
Các chất có cấu tạo và tính chất hóa học tương tự nhau, chúng chỉ hơn kém nhau một hay nhiều nhớm metylen (-CH2-) được gọi là đồng đẳng.
Đáp án C
Câu 17:
Dung dịch axit HF tác dụng được với SiO2 (thành phần chính của thủy tinh).
→ Dung dịch axit HF được ứng dụng để khắc chữ lên thủy tinh.
Đáp án D
Câu 18:
Nitơ thể hiện tính khử khi tác dụng với oxi.
Đáp án C
Câu 19:
Trong phản ứng này, C là chất khử còn HNO3 là chất oxi hóa.
Đáp án C
Câu 20:
Công thức của phân ure là (NH2)2CO.
Đáp án D
Câu 21:
Phương trình: NaOH + HCl → NaCl + H2O
Có phương trình ion:
→ Bản chất phản ứng là phản ứng trung hòa giữa kiềm và axit mạnh.
Đáp án D
Câu 22:
nC : nH : nO =  = 5 : 8 : 2
= 5 : 8 : 2
Công thức đơn giản nhất: C5H8O2⇒ Công thức phân tử: (C5H8O2)n
MX = (5.12 + 8 + 16.2).n < 44.3 ⇒ n < 1,4
⇒ n = 1 ⇒ Công thức phân tử: C5H8O2.
Đáp án C
Câu 23:
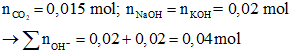
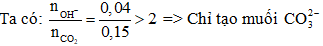
Bảo toàn nguyên tố C: 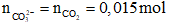
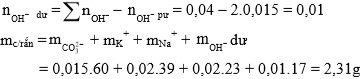
Đáp án C
Câu 24:
Quá trình nhận electron
2HNO3 + 1e → NO2 + NO3- + H2O
→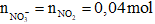
mmuối = mKL + 62.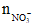 = 2,8 + 62.0,04 = 5,28 gam
= 2,8 + 62.0,04 = 5,28 gam
Đáp án D
Câu 25:
Giả sử tính trong 100 gam phân thì khối lượng của muối canxi đihiđrophotphat là:
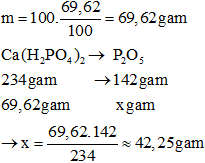
⇒ Độ dinh dưỡng của phân lân này là
Đáp án B
Câu 26:
P2O5 + 3H2O → 2H3PO4
→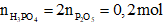
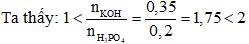
Dung dịch thu được có các muối KH2PO4 và K2HPO4.
Đáp án B
Câu 27:
2NaHCO3 −to→ Na2CO3 + CO2↑ + H2O
Đáp án D
Câu 28:
Để khắc chữ lên thủy tinh người ta dựa vào phản ứng:
SiO2 + 4HF → SiF4 + 2H2O
Đáp án B
Câu 29:
Tính chất đặc biệt của kim cương là rất cứng nên được dùng làm mũi khoan, dao cắt kính, …
Đáp án C
Câu 30:
Trong thực tế, người ta thường dùng muối NH4HCO3 để làm xốp bánh.
Đáp án A
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 3)
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Fe=56, Al=27, N=14, S=32, Cu=64)
Câu 1. Dung dịch KOH 0,001M cần pha loãng bằng nước bao nhiều lầm để được dung dịch có pH = 9?
A. 80 lần B. 90 lần
C. 100 lần D. 110 lần
Câu 2. Biết độ điện li của dung dịch axit CH3COOH 1,2M là 1,5%. Nồng độ mol/l của ion CH3COO- trong dung dịch trên là:
A. 0,018M B. 0,015M
C. 0,012 M D. 0,014M.
Câu 3. Sau khi trộn 100ml dung dịch HCl 1M với 400ml dung dịch NaOH 0,375M thì pH dung dịch sau khi pha trộn là:
A. 11,0 B. 11,5
C. 13,0 D. 14,0
Câu 4. Cho 1,92 gam Cu tác dụng vừa hết với V lít dung dịch HNO3 0,1M loãng giải phóng khí NO. Giá trị của V là:
A. 0,80 lít B. 0,85 lít
C. 0,90 lít. D. 0,95 lít.
Câu 5. Ngâm một vật bằng đồng có khối lượng 10 gam vào 250 gam dung dịch AgNO3 4%. Khi lấy vật ra thì lượng AgNO3 trong dung dịch giảm 17%. Khối lượng của vật sau phản ứng là:
A. 10,50 gam B. 11,25 gam
C. 10,76 gam D. 9,50 gam.
Câu 6. Cho 19,2 gam đồng tác dụng hết với dung dịch HNO3 thu được hỗn hợp khí gồm NO và NO2, có tỉ khối hơi đối với H2 là 21. Thể tích hỗn hợp khí thu được (ở đktc) là:
A. 3,36 lít B. 8,96 lít C. 6,72 lít D. 4,48 lít.
Câu 7. Cho 0,15 mol hỗn hợp NaHCO3 và MgCO3 tác dụng hết với dung dịch HCl. Khí thoát ra được dẫn vào dung dịch Ca(OH)2 dư thu được kết tủa có khối lượng là:
A. 8 gam B. 15 gam C. 20 gam D. 34 gam.
Câu 8. Khử 32 gam Fe2O3 bằng khí CO dư ở nhiệt độ cao. Dẫn sản phẩm sinh ra vào bình Ca(OH)2 dư, thu được a gam kết tủa. Giá trị của a là:
A. 57,3 gam B. 58,2 gam
C. 59,0 gam D. 60,0 gam.
Câu 9. Dãy gồm các ion cùng tồn tại trong một dung dịch là
A. K+, Ba2+, OH- , Cl- . B. Mg2+, Ba2+, Cl- ,CO32- .
C. Na+, K+, OH- , HCO3- . D. Na+, Ag+ , NO3- ,Cl- .
Câu 10. Phản ứng hóa học, trong đó cacbon có tính khử là
A. 2C + Ca → CaC2 B. C + 2H2 → CH4
C.C + CO2 → 2CO D. 3C + 4Al → Al4C3
Câu 11. Cho các hợp chất: C2H6; C2H2; C2H4O2; C2H6O; C6H12O6. Hợp chất nào sau đây có hàm lượng cacbon cao nhất?
A. C2H6 B. C2H2
C. C6H12O6 D. C2H4O2
Câu 12. Đốt cháy hoàn toàn một hiđrocacbon (X) thu được 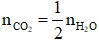 . Vậy X là:
. Vậy X là:
A. C2H6 B. C3H6 C. CH4 D. C2H4
Câu 13: Kim cương và than chì là các dạng:
A. đồng hình của cacbon. B. đồng vị của cacbon.
C. đồng phân của cacbon. D. thù hình của cacon.
Câu 14: Khí nitơ có thể được tạo thành trong phản ứng hóa học nào sau đây?
A. Đốt cháy NH3 trong oxi có mặt chất xúc tác platin.
B. Nhiệt phân NH4NO2.
C. Nhiệt phân AgNO3.
D. Nhiệt phân NH4NO3.
Câu 15: Dung dịch A chứa 0,23 gam ion Na+ ; 0,12 gam ion Mg2+ ; 0,355 gam ion Cl- và m gam ion SO42- . Số gam muối khan sẽ thu được khi cô cạn dung dịch A là
A. 1,185. B. 1,190. C. 1,200. D. 1,158.
Câu 16: Chất nào sau đây có tên gọi là amoni hiđrosunfat?
A. NH4HSO4. B. (NH4)2SO4. C. NH4HCO3. D. NH4SO4
Câu 17: Trong công nghiệp, nitơ điều chế bằng cách:
A. dùng than nóng đỏ tác dụng hết với không khí ở nhiệt độ cao.
B. dùng đồng để oxi hoá hết oxi của không khí ở nhiệt độ cao.
C. hoá lỏng không khí và chưng cất phân đoạn.
D. dùng H2 tác dụng hết oxi không khí ở nhiệt độ cao rồi ngưng tụ hơi nước.
Câu 18: Cho dung dịch NH3 dư vào dung dịch nhôm sunfat thì
A. xuất hiện kết tủa rồi kết tủa tan do Al(OH)3 là hiđroxit lưỡng tính.
B. xuất hiện kết tủa rồi kết tủa tan do tạo phức.
C. xuất hiện kết tủa không tan trong dung dịch NH3 dư.
D. xuất hiện kết tủa và có khí không màu không mùi thoát ra.
Câu 19: Cho 0,05 mol Mg tan hết trong dung dịch HNO3 thấy thoát ra 0,01 mol khí X là sản phẩm khử duy nhất (đktc). X là
A. NO2. B. N2. C. NO. D. N2O.
Câu 20: N2 thể hiện tính khử trong phản ứng với
A. Li. B. H2 C. Mg. D. O2.
Câu 21: Nhiệt phân hoàn toàn 18,9 gam muối nitrat của một kim loại hóa trị II, thu được 5,6 lít hỗn hợp khí ở đktc. Kim loại đó là
A. Fe. B. Cu. C. Mg. D. Zn.
Câu 22: Trong phản ứng Cu + HNO3 → Cu(NO3)2 + NO + H2O.
Tổng các hệ số (các số nguyên, tối giản) cân bằng trong phương trình của phản ứng oxi hóa - khử này là
A. 20. B. 18. C. 10. D. 24.
Câu 23: Sản phẩm của phản ứng nhiệt phân Cu(NO3)2 là:
A. Cu(NO3)2, NO2 và O2. B. CuO, NO và O2.
C. CuO, NO2 và O2. D. Cu(NO2)2 và O2.
Câu 24: Dãy chất nào sau đây, trong nước đều là chất điện li mạnh?
A. H3PO4, Fe(NO3)3. B. MgCl2, Ba(OH)2.
C. CH3COOH, BaCl2. D. H2SO4, H2S.
Câu 25: Nồng độ mol của cation trong dung dịch Ba(NO3)2 0,45M là
A. 0,45M. B. 1,35M. C. 1,00M. D. 0,90M.
Câu 26: Cặp chất nào sau đây là đồng đẳng của nhau?
A. CH3OH, CH3OCH3. B. CH3OCH3, CH3CHO.
C. CH3OH, C2H5OH. D. CH3CH2OH, C3H6(OH)2.
Câu 27: Số công thức cấu tạo có thể có ứng với các công thức phân tử C4H10 là
A. 1 B. 2 C. 3 D. 4.
Câu 28: Thể tích của 1,5 gam chất X bằng thể tích của 0,8 gam khí oxi (đktc cùng điều kiện nhiệt độ, áp suất). Phân tử khối của X là
A. 60 B. 30 C. 120 D. 32.
Câu 29: Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X (C, H, O). Thu được 4,48 lít CO2 (đktc) và 3,6 gam H2O. Biết tỉ khối của X so với CO2 bằng 2. Công thức phân tử của X là
A. C5H12O B. C2H4O C. C3H4O3 D. C4H8O2.
Câu 30: Kết quả phân tích nguyên tố hợp chất X cho biết %mc = 54,54%; %mH = 9,09% còn lại là oxi. Tỉ khối hơi của X so với CO2 bằng 2. Công thức phân tử của X là
A. C5H12O B. C2H4O C. C3H4O3 D. C4H8O2.
--- Hết ---
Giám thị không giải thích thêm
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
1. C |
2. A |
3. C |
4. A |
5. C |
6. D |
7. B |
8. D |
9. A |
10. D |
11. B |
12. C |
13. D |
14. B |
15. A |
16. A |
17. C |
18. C |
19. B |
20. D |
21. D |
22. A |
23. C |
24. B |
25. A |
26. C |
27. B |
28. A |
29. D |
30. D |
Câu 1:
Đáp án C
Giả sử dung dịch ban đầu có thể tích là V lít → nKOH = 0,001.V (lít)
Dung dịch sau phản ứng có thể tích là V’ lít → [OH- ] =10-(14-9)=10-5
→nKOH =nKOH.V'(mol)
→0,001.V= 10-5.V'→V'=100V
→ Cần pha loãng với nước 100 lần.
Câu 2:
Đáp án A
Gọi nồng độ mol/l của ion CH3COO- trong dung dịch trên là x.
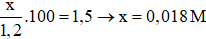
Câu 3:
Đáp án C
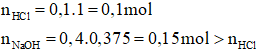
⟹ Sau khi trộn dung dịch có môi trường bazơ.
Sau phản ứng [OH- ] là 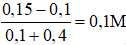
⟹ pH = 14 + lg(0,1)= 13
Câu 4:
Đáp án A
PhnCuương trình hóa học:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
nCu=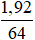 = 0,03 mol
= 0,03 mol
Theo phương trình ta có:nHNO3 =8/3nCu =0,08 mol
⟹ V = 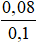 =0,8 lít
=0,8 lít
Câu 5:
Đáp án C
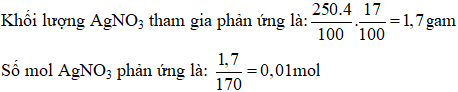
Phương trình hóa học:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
(Ag sinh ra bám vào vật)
⟹nCu pu =1/2nAgNO3 =0.005 mol
Khối lượng của vật là: m = 10 – 0,005.64 + 0,01.108 = 10,76 gam
Câu 6:
Đáp án B
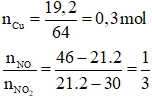
Gọi số mol của khí NO và NO2 lần lượt là a và 3a (mol).
Bảo toàn electron ta có:
2.nCu =3.nNO+ 1.nNO2
⟹ 2.0,3 = 3.a + 1.3a
⟹ a = 0,1
Thể tích hỗn hợp khí là: V = 22,4.(0,1 + 0,1.3) = 8,96 lít
Câu 7:
Đáp án B
Ta có: nCO2 = nhh= 0,15 mol
⟹ nNaCO3 = nCO2 = 0,15 mol
⟹ mNaCO3 = 0,15.100 = 15 gam
Câu 8:
Đáp án D
Phương trình hóa học:
Fe2O3 + 3CO −to→ 2Fe + 3CO2
Ca(OH)2 + CO2 → CaCO3↓ + H2O
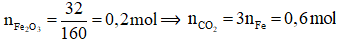
⟹nCaCO3 = nCO2 = 0,6 mol
⟹ a = 0,6.100 = 60 gam
Câu 9:
Đáp án A
Dãy các ion cùng tồn tại được trong dung dịch là K+, Ba2+, OH- ,Cl- .
Các đáp án B, C, D không thể cùng tồn tại trong 1 dung dịch vì có ion phản ứng với nhau.
Ba2++ CO32- → BaCO3↓
Mg2++ CO32- → MgCO3↓
OH- + HCO3- → CO32- + H2O
Ag++ Cl- → AgCl↓
Câu 10:
Đáp án C
Cacbon thể hiện tính khử khi tác dụng với oxi.
Câu 11:
Đáp án B
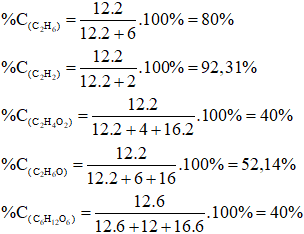
Câu 12:
Đáp án C
Ta có: nCO2=½ nH2O ⟹ C : H = 1 : 4
⟹ Công thức đơn giản nhất là CH4
⟹ Công thức phân tử là (CH4)n.
⟹ n =1, công thức là CH4.
Câu 13:
Đáp án D
Kim cương và than chì là các dạng thù hình của cacon.
Câu 14:
Đáp án B
Phương trình hóa học:
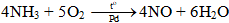
NH4NO2 −to→ N2 + 2H2O
2AgNO3 −to→ 2Ag + 2NO2 + O2
NH4NO3 −to→ N2O + 2H2O
Câu 15:
Đáp án A
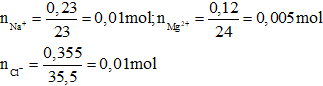
Bảo toàn điện tích ta có:
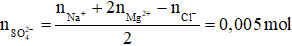
⟹ m = 0,005.96 = 0,48 gam
Khối lượng khối khan là:
mmuối = 0,23 + 0,12 + 0,355 + 0,48 = 1,185 gam
Câu 16:
Đáp án A
Amoni hiđrosunfat có công thức là NH4HSO4.
Câu 17:
Đáp án C
Trong công nghiệp, nitơ điều chế bằng cách hóa lỏng không khí và chưng cất phân đoạn.
Câu 18:
Đáp án C
Cho dung dịch NH3 dư vào dung dịch nhôm sunfat thì xuất hiện kết tủa không tan trong dung dịch NH3 dư.
Phương trình hóa học:
Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3↓ + 3(NH4)2SO4
Câu 19:
Đáp án B
Gọi x là số electron mà N+5 nhận để chuyển thành khí X.
Áp dụng định luật bảo toàn electron ta có:
0,05.2 = 0,01.x ⟹ x = 10
⟹ Khí X là khí N2.
Câu 20:
Đáp án D
N2 thể hiện tính khử khi tác dụng với oxi.
Câu 21:
Đáp án D
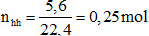
Phương trình hóa học:
2M(NO3)2 −to→ 2MO + 4NO2 + O2
⟹ Nhận thấy: nNO2 = 4nO2 ⟹ nO2 = 0,05 mol; nNO2= 0,2 mol
Theo phương trình: nmuối = 2nO2= 2.0,05 = 0.1 mol
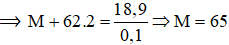
⟹ Kim loại này là Zn.
Câu 22:
Đáp án A
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Câu 23:
Đáp án C
2Cu(NO3)2 −to→ 2CuO + 4NO2 + O2
Câu 24:
Đáp án B
Dãy chất đều là chất điện li mạnh là: MgCl2 và Ba(OH)2.
Câu 25:
Đáp án A
Ba(NO3)2 → Ba2++ 2NO3-
0,45M →0,45M
Câu 26:
Đáp án C
Đồng đẳng là những chất có hơn kém nhau 1 hay nhiều nhóm CH2 và có cấu tạo và tính chất hóa học tương tự nhau.
⟹ CH3OH và C2H5OH là đồng đẳng của nhau.
Câu 27:
Đáp án B
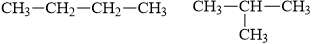
Câu 28:
Đáp án A
Theo bài ta có:
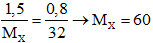
Câu 29:
Đáp án D
Ta có: MX = 44.2 = 88 đvC ⟹ nX =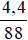 = 0,05 mol
= 0,05 mol
nCO2= 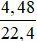 = 0,2 mol; nH2O=
= 0,2 mol; nH2O=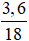 = 0,2 mol
= 0,2 mol
Khối lượng oxi trong X là: mO = mX - mC - mH = 4,4 – 0,2.12 – 2.0,2.1 = 1,6g
⟹ nO(X) = 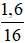 = 0,1 MOL
= 0,1 MOL
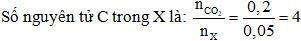
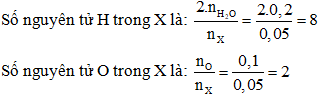
⟹ Công thức của phân tử X là C4H8O2.
Câu 30:
Đáp án D
Ta có: MX = 44.2 = 88 đvC
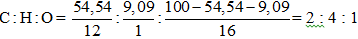
⟹ Công thức đơn giản nhất của X là C2H4O
⟹ Công thức phân tử có dạng (C2H4O)n.
⟹ 44n = 88 ⟹ n = 2
⟹ Công thức phân tử của X là C4H8O2.
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 1
năm 2025
Bài thi môn: Hóa học 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 4)
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; Fe = 56; Cu = 64; Zn = 65; Ag=108; Ba = 137)
I. TRẮC NGHIỆM (6 điểm)
Câu 1: Chất khí nào sau đây được tạo ra từ bình chữa cháy và dùng để sản xuất đá khô?
A. H2O. B. N2. C. CO2. D. CO.
Câu 2: Cho m gam Al phản ứng hoàn toàn với dung dịch HNO3 loãng (dư), thu được 4,48 lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của m là
A. 2,70. B. 4,05. C. 8,10. D. 5,40.
Câu 3: Khí amoniac làm giấy quỳ tím ẩm
A. chuyển thành màu xanh. B. mất màu.
C. chuyển thành màu đỏ. D. không đổi màu.
Câu 4: Phương trình ion: OH- + HCO3-→ CO32- + H2O là của phản ứng xảy ra giữa cặp chất nào sau đây?
A. NaOH + Ba(HCO3)2. B. Ba(HCO3)2 + Ba(OH).
C. NaHCO3 + Ba(OH)2 D. NaHCO3 + NaOH.
Câu 5: Các nguyên tử thuộc nhóm IVA có cấu hình electron lớp ngoài cùng là:
A. ns2np5. B. ns2np3. C. ns2np4. D. ns2np2.
Câu 6: Kim loại bị thụ động trong HNO3 đặc, nguội là
A. Pt, Cu. B. Al, Fe. C. Ag, Fe. D. Pb, Ag.
Câu 7: Chất phản ứng được với NH3 là
A. Na2O. B. AlCl3 (dd).
C. Na2CO3 (dd). D. NaOH (dd).
Câu 8: Nồng độ mol của anion trong dung dịch BaCl2 0,20M là
A. 0,40M. B. 0,20M C. 0,30M. D. 0,10M.
Câu 9: Trong những nhận xét dưới đây về muối amoni, nhận xét nào là đúng?
A. Muối amoni là tinh thể ion, phân tử gồm cation amoni và anion hiđroxit.
B. Tất cả các muối amoni đều dễ tan trong nước, khi tan điện li hòa toàn thành cation amoni và anion gốc axit.
C. Dung dịch muối amoni tác dụng với dung dịch kiềm đặc, nóng cho thoát ra chất khí làm quỳ tím hóa đỏ.
D. Khi nhiệt phân muối amoni luôn luôn có khí amoniac thoát ra.
Câu 10: Cho P tác dụng với Mg, sản phẩm thu được là
A. Mg2P2O7. B. Mg3P2.
C. Mg(PO3)2. D. Mg3(PO4)2.
Câu 11: Các hình vẽ sau mô tả các cách thu khí trong phòng thí nghiệm:
Kết luận nào sau đây đúng?
A. Hình 3: Thu khí N2, H2 và HCl.
B. Hình 2: Thu khí CO2, SO2 và NH3.
C. Hình 3: Thu khí N2, H2 và NH3.
D. Hình 1: Thu khí H2, He và NH3.
Câu 12: Khi nhiệt phân, dãy muối rắn nào dưới đây đều sinh ra kim loại, khí nitơ đioxit và oxi?
A. AgNO3, Hg(NO3)2. B. Cu(NO3)2, Mg(NO3)2.
C. Hg(NO3)2, Mg(NO3)2. D. AgNO3, Cu(NO3)2.
Câu 13: Độ dinh dưỡng của phân lân được tính bằng
A. % P2O5. B. % P.
C. % PO43-. D. Ca(H2PO4)2.
Câu 14: Chất nào sau đây thuộc loại chất điện li yếu?
A. H2SO4. B. KOH. C. CH3COOH. D. NaCl.
Câu 15: Cho dung dịch KOH đến dư vào 50 ml (NH4)2SO4 1M. Đun nóng nhẹ, thu được thể tích khí thoát ra (đktc) là
A. 1,12 lít B. 4,48 lít. C. 0,112 lít. D. 2,24 lít.
Câu 16: Sục 0,15 mol khí CO2 vào 200 ml dung dịch Ba(OH)2 1M, kết thúc phản ứng thu được các chất:
A. Ba(HCO3)2 và Ba(OH)2 dư. B. Ba(HCO3)2.
C. Ba(HCO3)2 và BaCO3. D. BaCO3, Ba(OH)2 dư.
Câu 17: Số liên kết xích-ma (Ϭ) trong phân tử C4H10 là:
A. 10. B. 13. C. 12. D. 14.
Câu 18: Cặp chất nào dưới đây là dồng phân của nhau?
A. CH3CH2CH2OH, CH3OCH2CH3 B. CH3OCH3, CH3CHO
C. CH3OH, C2H5OH D. CH3CH2OH, CH3CH2Br
Câu 19: Chất nào sau đây là dẫn xuất của hiđrocacbon?
A. CH4 B. C2H6 C. C6H6 D. C3H6Br.
Câu 20: Số công thức cấu tạo mạch hở có thể có ứng với các công thức phân tử C2H6O là
A. 3 B. 2 C. 1 D. 4.
II. TỰ LUẬN (4 điểm)
Câu 1 (1,5 điểm): Cho 2,8 gam N2 tác dụng H2 lấy dư. Biết hiệu suất phản ứng đạt 20%. Tính thể tích của NH3 thu được sau phản ứng (đktc)?
Câu 2 (2,5 điểm): Chia 19,4 gam hỗn hợp gồm Mg, Al, Zn thành hai phần bằng nhau. Đốt cháy hoàn toàn phần một trong O2 dư thu được 15,7 gam hỗn hợp oxit. Phần hai hòa tan trong dung dịch HNO3 đặc, nóng dư thu được V (lít) NO2 (sản phẩm khử duy nhất, (đktc)). Tính giá trị của V.
--- Hết ---
Giám thị không giải thích thêm
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I. TRẮC NGHIỆM
1. C |
2. D |
3. A |
4. D |
5. D |
6. B |
7. B |
8. A |
9. B |
10. B |
11. D |
12. A |
13. A |
14. C |
15. D |
16. D |
17. B |
18. A |
19. D |
20. B |
Câu 1:
Đáp án C
Khí CO2 được tạo ra từ bình chữa cháy và dùng để sản xuất đá khô.
Câu 2:
Đáp án D
Phương trình hóa học:
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Ta có: nNO =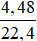 = 0,2 mol
= 0,2 mol
Áp dụng định luật bảo toàn electron :
3nAl = 3nNO ⟹ nAl = nNO = 0,2 mol
⟹ m = 0,2.27 = 5,4 gam
Câu 3:
Đáp án A
Khí amoniac làm giấy quỳ tím ẩm chuyển thành màu xanh vì:
NH3 + H2O ⇄ NH4+ + OH-
⟹ Môi trường bazơ.
Câu 4:
Đáp án D
Phản ứng xảy giữa cặp chất NaHCO3 và NaOH có phương trình ion là:
OH- + HCO3- → CO32- H2O
Câu 5:
Đáp án D
Các nguyên tử thuộc nhóm IVA có cấu hình electron lớp ngoài cùng là ns2np2.
Câu 6:
Đáp án B
Al, Fe bị thụ động trong HNO3 đặc, nguội.
Câu 7:
Đáp án B
3NH3 + 3H2O + AlCl3 → Al(OH)3↓ + 3NH4Cl
Câu 8:
Đáp án A
BaCl2 → Ba2+ + 2Cl-
0,2M →0,4M
Câu 9:
Đáp án B
Tất cả các muối amoni đều dễ tan trong nước, khi tan điện li hòa toàn thành cation amoni và anion gốc axit.
Câu 10:
Đáp án B
Phương trình hóa học:
3Mg + 2P −to→ Mg3P2
Câu 11:
Đáp án D
Hình 1 được áp dụng để thu khí nhẹ hơn không khí.
Hình 2 được áp dụng để thu khí nặng hơn không khí.
Hình 3 được áp dụng để thu khí không tan hoặc ít tan trong nước.
Câu 12:
Đáp án A
Khi nhiệt phân các muối AgNO3 hay Hg(NO3)2 đều sinh ra kim loại, khí NO2 và khí O2.
Câu 13:
Đáp án A
Độ dinh dưỡng của phân lân được tính bằng % về khối lượng của P2O5 trong phân.
Câu 14:
Đáp án C
Chất điện li yếu là CH3COOH.
Phương trình điện li: CH3COOH ⇄ CH3COO- + H+
Câu 15:
Đáp án D
Phương trình hóa học:
2KOH + (NH4)2SO4 →2NH3 + K2SO4 + 2H2O
⟹nNH3 = 2n(NH4)2SO4= 2.0,05.1 = 0,1 mol
⟹ VNH3 = 0,1.22,4 = 2,24 lít
Câu 16:
Đáp án D
Ta có: nBa(OH)2 =0,2.1 = 0,2 mol
Nhận thấy: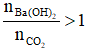 ⟹ Sau phản ứng thu được chứa Ba(OH)2 dư và chất rắn BaCO3.
⟹ Sau phản ứng thu được chứa Ba(OH)2 dư và chất rắn BaCO3.
Câu 17:
Đáp án B
Liên kết xích-ma là liên kết đơn. Liên kết đơn gồm C – C và C – H.
Số liên kết C – C là 4 – 1 = 3 liên kết.
Số liên kết C – H là 10 liên kết.
⟹ Tổng có 13 liên kết xích – ma.
Câu 18:
Đáp án A
Các chất là đồng phân của nhau khi có cùng công thức phân tử và khác nhau về công thức cấu tạo.
Các chất ở đáp án có cùng công thức phân tử là C3H8O.
Câu 19:
Đáp án D
Dẫn xuất hidrocacbon là hợp chất hữu cơ ngoài chứa nguyên tố C và H còn chứa các nguyên tố khác như O, N, S, halogen, ...
Câu 20:
Đáp án B
CH3 – CH2 – OH CH3 – O – CH3
II. Tự luận
Câu 1:
Phương trình hóa học:
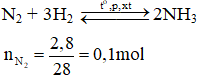
⟹ Theo phương trình: nNH3 = 2nN2 = 2.0,1 = 0,2 mol
Do hiệu suất phản ứng đạt 20% nên lượng NH3 sinh ra thực tế là:
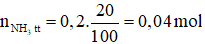
Thể tích khí NH3 thu được là: V = 0,04.22,4 = 0,896 lít
Câu 2:
Ta có: m1 = m2 = 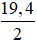 = 9,7 gam
= 9,7 gam
- Phần 1: Phản ứng với oxi
Số mol oxi phản ứng là:
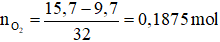
Các quá trình nhường, nhận electron
Al → Al3+ + 3e O2 + 4e → 2O-2
Mg → Mg2+ + 2e
Zn → Zn2+ + 2e.
Bảo toàn electron ta có:
ne nhường = ne nhận ⟹ ne nhường = 0,1875.4 = 0,75 (1)
- Phần 2: hoàn tan trong dung dịch HNO3
Các quá trình nhường, nhận electron
Al → Al3+ + 3e 2H+ + NO3- + e → NO2 + H2O
Mg → Mg2+ + 2e
Zn → Zn2+ + 2e.
Gọi số mol khí NO2 là a mol.
Ta có: ne nhường = ne nhận ⟹ ne nhường = a (2)
Từ (1) và (2) ⟹ 0,75 = a
⟹ VNO2 = 22,4.0,75 = 16,8 lít
........................................................
........................................................
........................................................
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Bộ đề thi năm 2025 các lớp các môn học được Giáo viên nhiều năm kinh nghiệm tổng hợp và biên soạn theo Thông tư mới nhất của Bộ Giáo dục và Đào tạo, được chọn lọc từ đề thi của các trường trên cả nước.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

