Trắc nghiệm Cân bằng hóa học (có lời giải)
Trắc nghiệm Cân bằng hóa học (có lời giải)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Bài 1: Cho cân bằng hóa học:
N2 (k) + 3H2 ⇌ 2NH3 (k)
Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng hóa học không bị chuyển dịch khi
A. thay đổi áp suất của hệ
B. thay đổi nồng độ N2
C. thay đổi nhiệt độ
D. thêm chất xúc tác Fe
Đáp án: D
Bài 2: Cho các cân bằng hóa học sau:
2SO2 (k) + O2 (k) ⇌ 2SO3 (k)
N2 (k) + 3H2 ⇌ 2NH3 (k)
3CO2 (k) + H2 (k) ⇌ CO (k) + H2O (k)
2HI (k) ⇌ H2 (k) + I2 (k)
Khi thay đổi áp suất, các cân bằng hóa học đều không bị chuyển dịch là
A. (1) và (3)
B. (2) và (4)
C. (1) và (2)
D. (3) và (4)
Đáp án: D
Bài 3: Trong một bình kín có cân bằng hóa học sau:
2NO2 (k) ⇌ N2O4 (k)
Tỉ khối hơi của hỗn hợp khí trong bình so với H2 ở nhiệt độ T1 bằng 27,6 và ở nhiệt độ T2 bằng 34,5. Biết T1 > T2.
Phát biểu nào sau đây về cân bằng trên là đúng?
A. Phản ứng thuận là phản ứng tỏa nhiệt.
B. Khi tăng nhiệt độ, áp suất chung của hệ cân bằng giảm.
C. Khi giảm nhiệt độ, áp suất chung của hệ cân bằng tăng.
D. Phản ứng nghịch là phản ứng tỏa nhiệt.
Đáp án: A
Bài 4: Xét cân bằng: N2(k) + 3H2(k) ⇆ 2NH3(k)
Biểu thức hằng số cân bằng của phản ứng là :
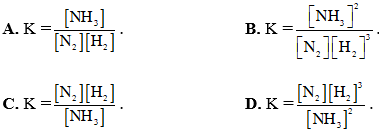
Đáp án: B
Bài 5: Cho các cân bằng:
(1) H2 (k) + I2 (k) ⇆ 2HI (k)
(2) 2NO (k) + O2 (k) ⇆ 2NO2 (k)
(3) CO (k) + Cl2(k) ⇆ COCl2 (k)
(4) CaCO3 (r) ⇆ CaO (r) + CO2 (k)
(5) 3Fe (r) + 4H2O (k) ⇆ Fe3O4 (r) + 4H2 (k)
Các cân bằng chuyển dịch theo chiều thuận khi tăng áp suất là :
A. (1), (4). B. (1), (5).
C. (2), (3), (5). D. (2), (3).
Đáp án: D
Bài 6: Phản ứng : 2SO2 + O2 ⇆ 2SO3 ΔH < 0. Khi giảm nhiệt độ và khi giảm áp suất thì cân bằng của phản ứng trên chuyển dịch tương ứng là :
A. Thuận và thuận. B. Thuận và nghịch.
C. Nghịch và nghịch. D. Nghịch và thuận.
Đáp án: B
Bài 7: Cho cân bằng (trong bình kín) sau:
CO (k) + H2O (k) ⇆ CO2 (k) + H2 (k); ΔH < 0
Trong các yếu tố: (1) tăng nhiệt độ; (2) thêm một lượng hơi nước; (3) thêm một lượng H2; (4) tăng áp suất chung của hệ; (5) dùng chất xúc tác. Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là :
A. (1), (4), (5). B. (1), (2), (3).
C. (2), (3), (4). D. (1), (2), (4).
Đáp án: B
Bài 8: Trong phòng thí nghiệm người ta điều chế NO2 bằng cách cho Cu tác dụng với HNO3 đặc, đun nóng. NO2 có thể chuyển thành N2O4 theo cân bằng :
2NO2 ⇆ N2O4
Cho biết NO2 là khí có màu nâu và N2O4 là khí không màu. Khi ngâm bình chứa NO2 vào chậu nước đá thấy màu trong bình khí nhạt dần. Hỏi phản ứng thuận trong cân bằng trên là :
A. Toả nhiệt.
B. Thu nhiệt.
C. Không toả hay thu nhiệt.
D. Một phương án khác.
Đáp án: A
Bài 9: Người ta cho N2 và H2 vào trong bình kín dung tích không đổi và thực hiện phản ứng:
N2 + 3H2 ⇆ 2NH3
Sau một thời gian, nồng độ các chất trong bình như sau: [N2] = 2M; [H2] = 3M; [NH3] = 2M. Nồng độ mol/l của N2 và H2 ban đầu lần lượt là :
A. 3 và 6. B. 2 và 3.
C. 4 và 8. D. 2 và 4.
Đáp án: A
Gọi nồng độ ban đầu của N2 và H2 là a và b
Ta có: [N2] pư = [H2]pư/3 = ([NH3]tạo thành)/2
a – 2 = (b-3)/3 = 2/2
⇒ a = 3; b = 6
Bài 10: Thực hiện phản ứng tổng hợp amoniac N2 + 3H2 ⇆ 2NH3.
Nồng độ mol ban đầu của các chất như sau: [N2] = 1 mol/l; [H2] = 1,2 mol/l. Khi phản ứng đạt cân bằng nồng độ mol của [NH3] = 0,2 mol/l. Hiệu suất của phản ứng là :
A. 43%. B. 10%.
C. 30%. D. 25%.
Đáp án: D
[N2] = 1 mol/l; [H2] = 1,2 mol/l ⇒ H2 hết; hiệu suất tính theo H2
[NH3] = 0,2 mol/l ⇒ [H2]pư = 0,3 mol/l
H = 0,3 : 1,2 . 100% = 25%
Bài 11: Cho cân bằng hóa học sau:
2SO2 (k) + O2 (k) ⇌ 2SO3 (k) ; ΔH < 0
Cho các biện pháp:
Tăng nhiệt độ;
Tăng áp suất chung của hệ phản ứng;
Hạ nhiệt độ;
Dùng thêm chất xúc tác V2O5;
Giảm nồng độ SO3;
Giảm áp suất chung của hệ phản ứng.
Trong các biện pháp trên, những biện pháp nào làm cân bằng chuyển dịch theo chiều thuận?
A. (1), (2), (4), (5)
B. (2), (3), (5)
C. (2), (3), (4), (6)
D. (1), (2), (5)
Đáp án: B
Bài 12: Cho cân bằng hóa học:
H2 (k) + I2 (k) ⇌ 2HI (k); ΔH > 0
Cân bằng không bị chuyển dịch khi
A. tăng nhiệt độ của hệ
B. giảm nống độ HI
C. tăng nồng độ H2
D. giảm áp suất chung của hệ.
Đáp án: D
Bài 13: Cho cân bằng hóa học:
2SO2 (k) + O2 (k) ⇌ 2SO3 (k)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu nào sau đây đúng khi nói về cân bằng hóa học này?
A. Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
B. Phản ứng nghịch tỏa nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
C. Phản ứng nghịch thu nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
D. Phản ứng thuận tỏa nhiệt, cân bằng chuyển dịch theo chiều nghịch khi tăng nhiệt độ.
Đáp án: D
Bài 14: Cho cân bằng hóa học sau trong bình kín:
2NO2 (k) ⇌ N2O4 (k)
(màu nâu đỏ) (không màu)
Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có
A. ΔH > 0, phản ứng tỏa nhiệt
B. ΔH < 0, phản ứng tỏa nhiệt
C. ΔH > 0, phản ứng thu nhiệt
D. ΔH <0, phản ứng thu nhiệt
Đáp án: B
Bài 15: Cho cân bằng hóa học:
2SO2 (k) + O2 (k) ⇌ 2SO3 (k)
Phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu nào sua đây đúng?
A. Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ
B. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2
C. Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng
D. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3
Đáp án: B
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm Bài tập & Câu hỏi trắc nghiệm Hóa học 10 có lời giải hay khác:
- Trắc nghiệm tổng hợp Tốc độ phản ứng và cân bằng hóa học (có lời giải)
- Trắc nghiệm Ôn tập học kì 2 (có lời giải)
- Trắc nghiệm Bài 1 : Thành phần nguyên tử (có lời giải)
- Trắc nghiệm Bài 2 : Hạt nhân nguyên tử; Nguyên tố hóa học; Đồng vị (có lời giải)
- Trắc nghiệm Bài 3 : Luyện tập: Thành phần nguyên tử (có lời giải)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

