Trắc nghiệm tổng hợp Tốc độ phản ứng và cân bằng hóa học (có lời giải)
Trắc nghiệm tổng hợp Tốc độ phản ứng và cân bằng hóa học (có lời giải)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Bài 1: Cho phản ứng hóa học: A + B → C
Nồng độ ban đầu của A là 1 mol/l, của B là 0,8 mol/l. Sau 10 phút, nồng độ của B chỉ còn 20% nồng độ ban đầu. Tốc độ trung bình của phản ứng là
A. 0,16 mol/l.phút
B. 0,016 mol/l.phút
C. 1,6 mol/l.phút
D. 0,064 mol/l.phút
Đáp án: D
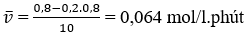
Bài 2: Cân bằng phản ứng H2 + I2 ⇆ 2HI (ΔH < 0) được thiết lập ở toC khi nồng độ các chất ở trạng thái cân bằng là [H2] = 0,8 mol/l; [I2] = 0,6 mol/l ; [HI] = 0,96 mol/l. Hằng số K có giá trị là :
A. 1,92.10-2. B. 1,82.10-2.
C. 1,92. D. 1,82.
Đáp án: C
K = [HI]2/[H2].[I2] = 1,92
Bài 3: Xét phản ứng : 2NO2 (k) ⇆ N2O4 (k). Tỉ khối hơi của hỗn hợp khí thu được so với H2 ở nhiệt độ t1 là 27,6; ở nhiệt độ t2 là 34,5 (t1 > t2). Có 3 ống nghiệm đựng khí NO2 (có nút kín). Sau đó : Ngâm ống thứ nhất vào cốc nước đá; ngâm ống thứ hai vào cốc nước sôi; ống thứ ba để ở điều kiện thường. Một thời gian sau, ta thấy :
A. ống thứ nhất có màu đậm nhất, ống thứ hai có màu nhạt nhất.
B. ống thứ nhất có màu nhạt nhất, ống thứ hai có màu đậm nhất.
C. ống thứ nhất có màu đậm nhất, ống thứ ba có màu nhạt nhất.
D. ống thứ nhất có màu đậm nhất, ống thứ hai và ống thứ ba đều có màu nhạt hơn.
Đáp án: B
Ở nhiệt độ t2 hỗn hợp khí có tỉ khối hơi so với H2 lớn hơn nhiệt độ t1 ⇒ ở nhiệt độ t2 có lượng N2O4 lớn hơn ở nhiệt độ t1. Mà t1 > t2 ⇒ khi giảm nhiệt độ cân bằng chuyển dịch theo chiều thuận (tạo thành N2O4 không màu); khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nghịch (tạo thành NO2 màu nâu).
Bài 4: Cho các cân bằng sau:
(1) 2SO2 (k) + O2 (k) ⇆ 2SO3 (k)
(2) N2 (k) + 3H2 (k) ⇆ 2NH3 (k)
(3) CO2 (k) + H2 (k) ⇆ CO (k) + H2O (k)
(4) 2HI (k) ⇆ H2 (k) + I2 (k)
(5) CH3COOH (l) + C2H5OH (l) ⇆ CH3COOC2H5 (l) + H2O (l)
Khi thay đổi áp suất, nhóm gồm các cân bằng hoá học đều không bị chuyển dịch là :
A. (1) và (2). B. (3) và (4).
C. (3), (4) và (5). D. (2), (4) và (5).
Đáp án: C
Bài 5: Trong bình kín dung tích 1 lít, người ta cho vào 5,6 gam khí CO và 5,4 gam hơi nước. Phản ứng xảy ra là: CO + H2O ⇆ CO2 + H2. Ở 850oC hằng số cân bằng của phản ứng trên là 1. Nồng độ mol của CO và H2O khi đạt đến cân bằng lần lượt là :
A. 0,2 M và 0,3 M. B. 0,08 M và 0,2 M.
C. 0,12 M và 0,12 M. D. 0,08 M và 0,18 M.
Đáp án:
[CO] = 0,2M; [H2O] = 0,3M
Gọi [CO]pư = aM
Tại cân bằng: [CO] = 0,2 – a; [H2O] = 0,3 – a; [CO2] = a; [H2] = a
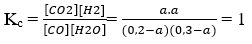
a = 0,12 ⇒ [CO] = 0,08M; [CO2] = 0,18M
Bài 6: Xét cân bằng: N2O4 (k) ⇆ 2NO2 (k) ở 25oC. Khi chuyển dịch sang một trạng thái cân bằng mới nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2
A. tăng 9 lần. B. tăng 3 lần.
C. tăng 4,5 lần. D. giảm 3 lần.
Đáp án: B
Chuyển dịch sang một trạng thái cân bằng mới thì nhiệt độ không đổi ⇒ Kc không đổi
Bài 7: Phản ứng tổng hợp amoniac là: N2 (k) + 3H2 (k) ⇆ 2NH3 (k) (ΔH = –92kJ)
Yếu tố không giúp tăng hiệu suất tổng hợp amoniac là :
A. Tăng nhiệt độ.
B. Tăng áp suất.
C. Lấy amoniac ra khỏi hỗn hợp phản ứng.
D. Bổ sung thêm khí nitơ vào hỗn hợp phản ứng.
Đáp án: A
Bài 8: Cho cân bằng : 2SO2 (k) + O2 (k) ⇆ 2SO3 (k). Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này là :
A. Phản ứng nghịch toả nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
B. Phản ứng thuận toả nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
C. Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
D. Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Đáp án: B
Khi tăng nhiệt độ, tỉ khối của hỗn hợp khí so với H2 giảm ⇒ M khí giảm ⇒ n khí tăng ⇒ cân bằng chuyển dịch theo chiều nghịch
Chiều nghịch là phản ứng thu nhiệt; chiều thuận là phản ứng tỏa nhiệt
Bài 9: Phát biểu nào sau đây đúng?
A. Bất cứ phản ứng nào cũng phải đạt đến trạng thái cân bằng hóa học.
B. Khi phản ứng thuận nghịch ở trạng tahis cân bằng thì phản ứng dừng lại.
C. Chỉ có những phản ứng thuận nghịch mới có trạng thái cân bằng hóa học.
D. Ở trạng thái cân bằng, khối lượng các chất ở hai về của phương trình phản ứng phải bằng nhau.
Đáp án: C
Bài 10: Cho cân bằng hóa học: 2SO2 (k) + O2 (k) ⇌ 2SO3 (k)
Yếu tố nào sau đây không làm nồng độ các chất trong hệ cân bằng biến đổi?
A. biến đổi nhiệt độ
B. biến đổi áp suất
C. sự có mặt chất xúc tác
D. biến đổi dung tích của bình phản ứng
Đáp án: C
Bài 11: Đối với một hệ ở trạng thái cân bằng, nếu thêm vào chất xúc tác thì
A. chỉ làm tăng tốc độ phản ứng thuận
B. chỉ làm tăng tốc dộ phản ứng nghịch
C. làm tăng tốc độ phản ứng thuận và nghịch với số lần như nhau
D. không làm tăng tốc độ của phản ứng thuận và nghịch
Đáp án: C
Bài 12: Xét phản ứng trong quá trình luyện gang:
Fe2O3 (r) + 3CO (kk) ⇌ 2Fe (r) + 3CO2 (k); ΔH > 0
Có các biện pháp:
Tăng nhiệt đô phản ứng
Tăng áp suất chung của hệ
Giảm nhiệt độ phản ứng
Tăng áp suất CO
Trong các biện pháp trên, có bao nhiêu biện pháp làm tăng hiệu suất của phản ứng?
A. 1 B. 2 C. 3 D. 4
Đáp án: B
Bài 13: Trong các phát biểu sau, phát biểu nào phù hợp với một phản ứng thuận nghịch ở trạng thái cân bằng?
A. Phản ứng thuận đã kết thúc
B. Phản ứng nghịch đã kết thúc
C. Cả phản ứng thuận và phản ứng nghịch đã kết thúc
D. Tốc độ pahnr ứng thuận bằng tốc dộ phản ứng nghịch
Đáp án: D
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm Bài tập & Câu hỏi trắc nghiệm Hóa học 10 có lời giải hay khác:
- Trắc nghiệm Ôn tập học kì 2 (có lời giải)
- Trắc nghiệm Bài 1 : Thành phần nguyên tử (có lời giải)
- Trắc nghiệm Bài 2 : Hạt nhân nguyên tử; Nguyên tố hóa học; Đồng vị (có lời giải)
- Trắc nghiệm Bài 3 : Luyện tập: Thành phần nguyên tử (có lời giải)
- Trắc nghiệm Bài 4 : Cấu tạo vỏ nguyên tử (có lời giải)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

