Chuyên đề Hóa học 10 trang 9 Kết nối tri thức
Với Chuyên đề Hóa học 10 trang 9 trong Bài 1: Liên kết hóa học Chuyên đề học tập Hóa học 10 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Chuyên đề Hóa học 10 trang 9.
Chuyên đề Hóa học 10 trang 9 Kết nối tri thức
Câu hỏi 5 trang 9 Chuyên đề Hóa học 10: Công thức của PCl3 theo mô hình VSEPR là
A. AX3.
B. AXE2.
C. AX3E.
D. AX2E.
Lời giải:
Đáp án đúng là: C
Công thức Lewis của PCl3 là:
Theo mô hình VSEPR, công thức phân tử của PCl3 có dạng AX3E vì có 3 nguyên tử Cl liên kết với nguyên tử trung tâm P và có nguyên tử P có 1 cặp electron hóa trị chưa tham gia liên kết.
Câu hỏi 6 trang 9 Chuyên đề Hóa học 10: Viết công thức của một số phân tử sau theo mô hình VSEPR: CCl4, H2S, CO2, SO3 và PH3. Nêu số cặp electron hóa trị liên kết và chưa liên kết trong mỗi phân tử.
Lời giải:
Công thức Lewis của CCl4 là:
Phân tử CCl4: có 4 nguyên tử Cl liên kết với nguyên tử trung tâm C và nguyên tử C không còn cặp electron hóa trị chưa tham gia liên kết nên theo mô hình VSEPR có dạng AX4.
⇒ Số cặp electron hóa trị liên kết là 4.
Công thức Lewis của H2S là:
Phân tử H2S: có 2 nguyên tử H liên kết với nguyên tử trung tâm S và nguyên tử S còn 2 cặp electron hóa trị chưa tham gia liên kết nên theo mô hình VSEPR có dạng AX2E2.
⇒ Số cặp electron hóa trị liên kết là 2.
Công thức Lewis của CO2 là:
Phân tử CO2: có 2 nguyên tử O liên kết với nguyên tử trung tâm C và nguyên tử C không còn cặp electron hóa trị chưa liên kết nên theo mô hình VSEPR có dạng AX2.
⇒ Số cặp electron hóa trị liên kết là 4.
Công thức Lewis của SO3 là:
Phân tử SO3: có 3 nguyên tử O liên kết với nguyên tử trung tâm S và nguyên tử S không còn cặp electron hóa trị chưa liên kết nên theo mô hình VSEPR có dạng AX3.
⇒ Số cặp electron hóa trị liên kết là 6.
Công thức Lewis của PH3 là:
Phân tử PH3: có 3 nguyên tử H liên kết với nguyên tử trung tâm P và nguyên tử P còn 1 cặp electron hóa trị chưa tham gia liên kết nên theo mô hình VSEPR có dạng AX3E.
⇒ Số cặp electron hóa trị liên kết là 3.
Câu hỏi 7 trang 9 Chuyên đề Hóa học 10: Viết công thức theo mô hình VSEPR và cho biết dạng hình học của phân tử OF2. Phân tử này có phân cực không?
Lời giải:
Công thức Lewis của OF2 là:
Trong phân tử OF2 có 2 nguyên tử F liên kết với nguyên tử trung tâm O và xung quanh nguyên tử trung tâm O có 2 cặp electron chưa liên kết nên công thức VSEPR của OF2 là AX2E2.
Do cặp electron chưa tham gia liên kết chiếm khoảng không gian lớn hơn so với cặp electron liên kết, tương tác đẩy giữa cặp electron chưa liên kết lớn hơn tương tác đẩy giữa cặp electron liên kết, nên góc liên kết FOF thực tế bằng 104,5o, nhỏ hơn góc hóa trị theo lí thuyết (109,5o). Phân tử có dạng góc.
⇒ Phân tử OF2 phân cực do phân tử dạng góc và liên kết O – F phân cực.
Câu hỏi 8 trang 9 Chuyên đề Hóa học 10: Dạng hình học của ion là
A. tứ diện đều.
B. tháp tam giác.
C. tam giác phẳng.
D. đường thẳng.
Lời giải:
Đáp án đúng là: A
Ion gồm có 4 nguyên tử H liên kết với nguyên tử trung tâm N bằng 4 cặp electron liên kết (theo mô hình VSEPR có dạng AX4), chiếm bốn khu vực tích điện âm đẩy nhau để góc hóa trị lớn nhất là 109,5o. Bốn cặp electron được phân bố hướng về 4 đỉnh của tứ diện, phân tử có cấu trúc tứ diện, tâm tứ diện là nguyên tử trung tâm N.
Câu hỏi 9 trang 9 Chuyên đề Hóa học 10: Dự đoán dạng hình học của một số phân tử sau: CO2, CS2, BF3, SCl2.
Lời giải:
Phân tử CO2 theo mô hình VSEPR có dạng AX2 nên phân tử có cấu trúc thẳng.
Phân tử CS2 theo mô hình VSEPR có dạng AX2 nên phân tử có cấu trúc thẳng.
Phân tử BF3 theo mô hình VSEPR có dạng AX3 nên phân tử có cấu trúc tam giác phẳng.
Phân tử SCl2 theo mô hình VSEPR có dạng AX2E2 nên phân tử có dạng góc.
Lời giải bài tập Chuyên đề Hóa 10 Bài 1: Liên kết hóa học hay khác:
Xem thêm lời giải bài tập Chuyên đề học tập Hóa học 10 Kết nối tri thức hay, chi tiết khác:
Chuyên đề Hóa học 10 Bài 3: Năng lượng hoạt hóa của phản ứng hóa học
Chuyên đề Hóa học 10 Bài 4: Entropy và biến thiên năng lượng tự do Gibbs
Chuyên đề Hóa học 10 Bài 6: Điểm chớp cháy. Nhiệt độ ngọn lửa. Nhiệt độ tự bốc cháy
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải Chuyên đề Hóa học 10 Kết nối tri thức
- Giải Chuyên đề Hóa học 10 Chân trời sáng tạo
- Giải Chuyên đề Hóa học 10 Cánh diều
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều

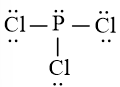
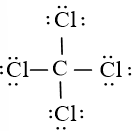
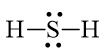
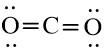
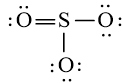
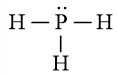
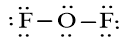



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

