Giải Vở bài tập Hóa 9 Bài 4 trang 16, 17, 18, 19
Bài 4: Một số axit quan trọng
A. AXIT CLOHIĐRIC (HCl)
1. Tính chất
Dung dịch axit clohiđiric là dung dịch bão hòa hiđroclorua, có tính chất của một axit mạnh.
Đổi màu quỳ tím thành đỏ.
Tác dụng với nhiều kim loại (Mg, Al, Zn, Fe,...) sản phẩm là muối clorua và giải phóng khí hiđro
Phương trình hóa học: Fe + 2HCl → FeCl2 + 2H2
Tác dụng với bazơ sản phẩm là muối và nước.
Phương trình hóa học: NaOH + HCl → NaCl + H2O
Tác dụng với oxit bazơ sản phẩm là muối và nước.
Phương trình hóa học: Na2O+ 2HCl → 2NaCl+ H2O
2. Ứng dụng
- Điều chế các muối clorua.
- Làm sạch bề mặt kim loại trước khi hàn.
- Tẩy gỉ kim loại trước khi sơn, tráng, mạ kim loại.
- Dùng trong chế biến thực phẩm, dược phẩm
B. AXIT SUNFURIC (H2SO4)
I. Tính chất vật lí
Axit H2SO4 là chất lỏng sánh, không màu, nặng gấp hai lần nước, không bay hơi, tan dễ dàng trong nước và tỏa nhiều nhiệt.
Muốn pha loãng axit sunfuric đặc phải rót từ từ axit đặc vào lọ đựng sẵn nước rồi khuấy đều. Làm ngược lại sẽ gây nguy hiểm
II. Tính chất hóa học
1. Axit H2SO4 loãng có đầy đủ tính chất của một axit.
- Đổi màu quỳ tím thành đỏ
- Tác dụng với nhiều kim loại thu được sản phẩm là muối sunfat và khí hiđro
Phương trình hóa học: Fe + H2SO4 loãng → FeSO4+ H2
- Tác dụng với bazơ thu được sản phẩm là muối sunfat và nước.
Phương trình hóa học: 2NaOH + H2SO4 loãng → Na2SO4 + 2H2O
- Tác dụng với oxit bazơ thu được sản phẩm là muối sunfat và nước.
Phương trình hóa học: Na2O+ H2SO4 loãng → Na2SO4 + H2O
2. Axit H2SO4 đặc có những tính chất hóa học riêng
a) Tác dụng với nhiều kim loại tạo thành muối sunfat (ứng với hóa trị cao của kim loại nếu kim loại có nhiều hóa trị), không giải phóng khí hiđro
Phương trình hóa học: Cu + H2SO4 đặc → CuSO4 + SO2 + H2O
b) Axit H2SO4 đặc có tính háo nước.
Phương trình hóa học: 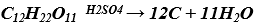
Chú ý: Khi sử dụng axit sunfuric đặc phả hết sức cẩn thận!
III. Ứng dụng
Hàng năm, thế giới sản xuất gần 200 triệu tấn axit H2SO4 . Axit H2SO4 là nguyên liệu của nhiều ngành sản xuất hóa học như sản xuất phân bón, phẩm nhuộm, chế biến dầu mỏ,..
IV. Sản xuất axit H2SO4 bằng phương pháp tiếp xúc.
a) Nguyên liệu chủ yếu là lưu huỳnh (hoặc quặng pirit sắt), không khí và nước.
b) Các công đoạn sản xuất axit H2SO4 gồm :
- Sản xuất lưu huỳnh đioxit
Phương trình hóa học: 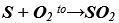
- Sản xuất lưu huỳnh trioxit
Phương trình hóa học: 2SO2 + O2 → 2SO3
- Sản xuất axit H2SO4
Phương trình hóa học: SO3 + H2O → H2SO4
V. Nhận biết axit H2SO4 và muối sunfat
- Thuốc thử nhận biết gốc sunfat (SO42−) trong axit sunfuric muối sunfat là: dung dịch muối bari.
Phương trình hóa học:
H2SO4 + BaCl2 → 2HCl + BaSO4
Na2SO4 + BaCl2 → 2NaCl + BaSO4
Phân biệt axit sunfuric và muối sunfat có thể bằng kim loại như Mg
Xem thêm các bài Giải bài tập Vở bài tập Hóa học 9 hay khác:
Bài tập
Bài tập bổ sung
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Giải vở bài tập Hóa học 9 hay, chi tiết của chúng tôi được biên soạn bám sát nội dung sách Vở bài tập Hóa học lớp 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

