Giải Hóa học 11 trang 35 Kết nối tri thức
Với Giải Hóa học 11 trang 35 trong Bài 5: Ammonia. Muối ammonium Hóa học 11 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 11 trang 35.
Giải Hóa học 11 trang 35 Kết nối tri thức
Hoạt động trang 35 Hóa học 11: Sưu tầm một số hình ảnh để báo cáo, thuyết trình về ứng dụng của ammonia trong thực tiễn. Sử dụng các tính chất vật lí và hoá học để giải thích cơ sở khoa học của các ứng dụng này
Lời giải:
Thuyết trình về ứng dụng của ammonia trong thực tiễn (tham khảo SGK Hoá học 10 – CD):
Gần đây, mỗi năm có khoảng hàng trăm triệu tấn ammonia được sản xuất trên toàn cầu. Trong đó, có khoảng 80% được sử dụng cho sản xuất phân đạm ammonium, urea ((NH2)2CO),... để cung cấp nguyên tố nitrogen cho đất và cây trồng. Các phân đạm ammonium được tổng hợp bằng cách cho ammonia phản ứng với dung dịch acid tương ứng. Chẳng hạn, phản ứng dưới đây dùng để tạo ra phân bón với thành phần chính là ammonium sulfate.
2NH3(aq) +H2SO4 (aq) → (NH4)2SO4 (aq)
Ammonia còn là nguyên liệu quan trọng để sản xuất nitric acid, sản xuất một số chất gây nổ sử dụng trong khai thác quặng mỏ như ammonium nitrate,...
Giống như nitrogen lỏng, ammonia lỏng cũng được sử dụng với vai trò chất làm lạnh trong một số hệ thống làm lạnh công nghiệp.
Ngoài ra, ammonia lỏng được sử dụng làm dung môi để hoà tan một số chất. Nhiều phản ứng cũng được thực hiện trong dung môi ammonia lỏng.
Hoạt động trang 35 Hóa học 11: Vận dụng kiến thức về cân bằng hoá học, tốc độ phản ứng, biến thiên enthalpy để giải thích các điều kiện của phản ứng sản xuất ammonia, cụ thể:
1. Nếu tăng hoặc giảm nhiệt độ sẽ ảnh hưởng đến sự chuyển dịch cân bằng và tốc độ phản ứng như thế nào?
2. Nếu giảm áp suất, cân bằng chuyển dịch theo chiều nào? Tại sao không thực hiện ở áp suất cao hơn?
3. Vai trò của chất xúc tác trong phản ứng là gì?
Lời giải:
Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ 400 oC – 450 oC,áp suất 150 – 200 bar, xúc tác Fe.
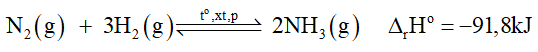
1) Vì DrHo = -91,8 kJ < 0 nên phản ứng thuận toả nhiệt. Vậy:
+ Nếu tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch (tức chiều phản ứng thu nhiệt) làm giảm hiệu suất phản ứng.
+ Nếu giảm nhiệt độ, cân bằng chuyển dịch theo chiều thuận (tức chiều phản ứng toả nhiệt) làm tăng hiệu suất phản ứng.
Tuy nhiên, khi thực hiện phản ứng ở nhiệt độ quá thấp thì tốc độ của phản ứng nhỏ, phản ứng diễn ra chậm. Thực tế, người ta đã chọn nhiệt độ phù hợp, khoảng 400 oC - 450 oC.
2. Khi giảm áp suất, cân bằng chuyển dịch theo chiều làm tăng áp suất của hệ - tức chiều làm tăng số mol khí, hay chiều nghịch.
Quá trình sản xuất NH3 được thực hiện ở áp suất 150 – 200 bar mà không thực hiện ở áp suất cao hơn. Điều này được giải thích như sau: Khi thực hiện ở áp suất cao sẽ thu
được nồng độ NH3 tại thời điểm cân bằng lớn, tuy nhiên khi tăng áp suất thì
sự tăng nồng độ NH3 không tăng nhanh chỉ tăng chậm. Ngoài ra, khi tăng áp suất thì
tiêu tốn năng lượng và yêu cầu thiết bị phải chịu được áp suất cao, do đó phải
tính toán chính xác khi tăng áp suất để mang lại hiệu quả kinh tế cao nhất. Thực tế chứng minh quá trình sản xuất NH3 được thực hiện ở áp suất 150 – 200 bar đem lại hiệu quả cao nhất.
3. Việc sử dụng chất xúc tác là bột sắt có tác dụng làm cho phản ứng nhanh đạt tới trạng thái cân bằng.
Lời giải Hóa 11 Bài 5: Ammonia. Muối ammonium hay khác:
Xem thêm lời giải bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Xem thêm các tài liệu học tốt lớp 11 hay khác:
- Giải sgk Hóa học 11 Kết nối tri thức
- Giải Chuyên đề học tập Hóa 11 Kết nối tri thức
- Giải SBT Hóa học 11 Kết nối tri thức
- Giải lớp 11 Kết nối tri thức (các môn học)
- Giải lớp 11 Chân trời sáng tạo (các môn học)
- Giải lớp 11 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

