Giải Hóa học 12 trang 67 Kết nối tri thức
Với Giải Hóa học 12 trang 67 trong Bài 15: Thế điện cực và nguồn điện hoá học Hóa học 12 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa 12 trang 67.
Giải Hóa học 12 trang 67 Kết nối tri thức
Mở đầu trang 67 Hóa học 12: Pin điện hoá là nguồn năng lượng được sử dụng phổ biến trong nhiều thiết bị như đèn pin, điện thoại, laptop, máy tính cầm tay, đồng hồ, xe đạp điện, xe máy điện, ô tô, máy bay không người lái.... Pin điện hoá có cấu tạo như thế nào? Phản ứng oxi hóa - khử đóng vai trò gì trong hoạt động của pin điện hoá? Làm thế nào để lắp ráp được một số pin điện hoá đơn giản?
Lời giải:
- Cấu tạo của pin điện hoá: Pin Galvani là pin điện hoá có cấu tạo gồm hai điện cực, mỗi điện cực ứng với một cặp oxi hoá – khử và thường nối với nhau qua cầu muối.
- Vai trò của phản ứng oxi hoá – khử trong hoạt động của pin điện hoá: Trong pin điện hoá, quá trình oxi hoá và quá trình khử xảy ra trên hai điện cực và electron được truyền từ chất khử sang chất oxi hoá qua dây dẫn. Khi đó, năng lượng của phản ứng hoá học sẽ chuyển thành năng lượng điện.
- Lắp ráp pin điện hoá đơn giản:
Chuẩn bị:
Hoá chất: các thanh kim loại: kẽm, đồng, nhôm, sắt; quả chanh (hoặc quả cam, quả chuối, củ khoai tây,...).
Dụng cụ: dây điện có sẵn kẹp cá sấu hai đầu, vôn kế.
Tiến hành:
- Chọn hai điện cực là hai kim loại khác nhau, ví dụ như thanh kẽm và thanh đồng.
- Cắm hai thanh kim loại vào quả chanh.
- Nối cực âm của vôn kế với thanh kẽm và cực dương của vôn kế với thanh đồng.
Chú ý: Không để hai thanh kim loại tiếp xúc với nhau.
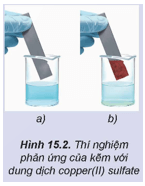
Hoạt động trang 67 Hóa học 12: Nhúng một thanh kẽm vào cốc đựng dung dịch copper(II) sulfate (Hình 15.2a), sau một thời gian nhấc thanh kẽm ra thì thấy xuất hiện một lớp đồng màu đỏ bám vào thanh kẽm (Hình 15.2b).
1. Viết phương trình hoá học dạng ion rút gọn của phản ứng oxi hoá – khử xảy ra trong thí nghiệm.
2. Viết quá trình oxi hoá nguyên tử Zn và quá trình khử ion Cu2+. Chỉ ra dạng oxi hoá và dạng khử trong mỗi quá trình.
3. Biểu diễn dạng oxi hoá và dạng khử của mỗi nguyên tố trên như sau: dạng oxi hoá/ dạng khử.
Lời giải:
1. Phương trình ion thu gọn:
Zn + Cu2+ → Zn2+ + Cu
2. Quá trình oxi hoá nguyên tử Zn:
Quá trình khử ion Cu2+:
Lời giải Hóa 12 Bài 15: Thế điện cực và nguồn điện hoá học hay khác:
Xem thêm lời giải bài tập Hóa học lớp 12 Kết nối tri thức hay, chi tiết khác:
Hóa 12 Bài 19: Tính chất vật lí và tính chất hoá học của kim loại
Hóa 12 Bài 20: Kim loại trong tự nhiên và phương pháp tách kim loại
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Kết nối tri thức
- Giải Chuyên đề học tập Hóa 12 Kết nối tri thức
- Giải SBT Hóa học 12 Kết nối tri thức
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Chân trời sáng tạo (các môn học)
- Giải lớp 12 Cánh diều (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT


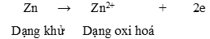
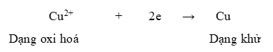



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

