Lý thuyết Muối (KHTN 8 Cánh diều Bài 12)
Với tóm tắt lý thuyết Khoa học tự nhiên 8 Bài 12: Muối sách Cánh diều hay nhất, ngắn gọn sẽ giúp học sinh lớp 8 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 8.
Lý thuyết Muối (KHTN 8 Cánh diều Bài 12)
I. Khái niệm muối
Muối là những hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+).
Ví dụ: NaCl, K2SO4, Ca3(PO4)2, NH4NO3 …
II. Tên gọi của muối
Tên gọi muối của một số acid được trình bày trong bảng sau:
Acid |
Muối |
Ví dụ |
Hydrochloric acid (HCl) |
Muối chloride |
Sodium chloride: NaCl |
Sulfuric acid (H2SO4) |
Muối sulfate |
Copper(II) sulfate: CuSO4 |
Phosphoric acid (H3PO4) |
Muối phosphate |
Potassium phosphate: K3PO4 |
Carbonic acid (H2CO3) |
Muối carbonate |
Calcium carbonate: CaCO3 |
Nitric acid (HNO3) |
Muối nitrate |
Magnesium nitrate: Mg(NO3)2 |
III. Tính tan của muối
- Có muối tan tốt trong nước như: NaCl, CuSO4, Ca(NO3)2, …
- Có muối ít tan trong nước như: CaSO4, PbCl2, …
- Có muối không tan trong nước như: CaCO3, BaSO4, AgCl, …
- Tính tan của một số muối được trình bày trong bảng tính tan sau:
Bảng tính tan trong nước của một số muối
Gốc acid |
Các kim loại |
|||||||||||
|
K I |
Na I |
Ag I |
Mg II |
Ca II |
Ba II |
Zn II |
Pb II |
Cu II |
Fe II |
Fe III |
Al III |
|
− Cl |
t |
t |
k |
t |
t |
t |
t |
i |
t |
t |
t |
t |
− NO3 |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
= SO4 |
t |
t |
i |
t |
i |
k |
t |
k |
t |
t |
t |
t |
= CO3 |
t |
t |
k |
k |
k |
k |
k |
k |
- |
k |
- |
- |
≡ PO4 |
t |
t |
k |
k |
k |
k |
k |
k |
k |
k |
k |
k |
t: chất dễ tan trong nước
k: chất không tan (độ tan nhỏ hơn 0,01 g/100 g nước).
i: chất ít tan (độ tan nhỏ hơn 1 g/100 g nước).
(-): chất không tồn tại hoặc bị nước phân huỷ.
IV. Tính chất hoá học của muối
1. Tác dụng với kim loại
Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
Ví dụ:
2AgNO3 + Cu → Cu(NO3)2 + 2Ag
Fe(NO3)2 + Cu → Cu(NO3)2 + Fe
2. Tác dụng với acid
Muối có thể tác dụng với dung dịch acid tạo thành muối mới và acid mới.
Ví dụ:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
3. Tác dụng với base
Muối có thể tác dụng với dung dịch base tạo thành muối mới và base mới.
Ví dụ:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
4. Tác dụng với muối
Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
Ví dụ:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓
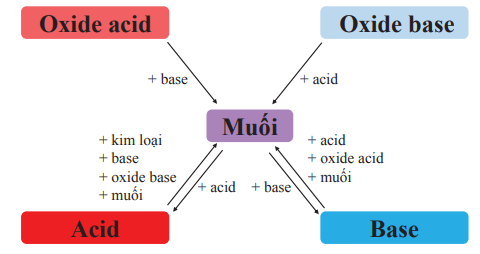
V. Mối quan hệ giữa acid, base, oxide và muối
Mối quan hệ giữa acid, base, oxide và muối được tóm tắt trong sơ đồ sau:
VI. Một số phương pháp điều chế muối
Muối có thể được tạo ra bằng các phương pháp sau:
- Cho dung dịch acid tác dụng với base. Ví dụ:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
- Cho dung dịch acid tác dụng với oxide base. Ví dụ:
3H2SO4 + Al2O3 → Al2(SO4)3 + 3H2O
- Cho dung dịch acid tác dụng với muối. Ví dụ:
2HCl + CaCO3 → CaCl2 + CO2↑ + H2O
- Cho dung dịch base tác dụng với oxide acid. Ví dụ:
2NaOH + CO2 → Na2CO3 + H2O
- Cho hai dung dịch muối tác dụng với nhau. Ví dụ:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Xem thêm tóm tắt lý thuyết Khoa học tự nhiên lớp 8 Cánh diều hay khác:
Lý thuyết KHTN 8 Bài 15: Tác dụng của chất lỏng lên vật nhúng trong nó
Lý thuyết KHTN 8 Bài 17: Áp suất trong chất lỏng và trong chất khí
Xem thêm các tài liệu học tốt lớp 8 hay khác:
- Giải sgk Khoa học tự nhiên 8 Cánh diều
- Giải SBT KHTN 8 Cánh diều
- Giải lớp 8 Cánh diều (các môn học)
- Giải lớp 8 Kết nối tri thức (các môn học)
- Giải lớp 8 Chân trời sáng tạo (các môn học)
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Giải KHTN lớp 8 Cánh diều của chúng tôi được biên soạn bám sát nội dung và hình ảnh sách giáo khoa Khoa học tự nhiên 8 Cánh diều (NXB Đại học Sư phạm).
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 8 Cánh diều (hay nhất)
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 - Cánh diều
- Giải Tiếng Anh 8 Global Success
- Giải sgk Tiếng Anh 8 Smart World
- Giải sgk Tiếng Anh 8 Friends plus
- Giải sgk Khoa học tự nhiên 8 - Cánh diều
- Giải sgk Lịch Sử 8 - Cánh diều
- Giải sgk Địa Lí 8 - Cánh diều
- Giải sgk Giáo dục công dân 8 - Cánh diều
- Giải sgk Tin học 8 - Cánh diều
- Giải sgk Công nghệ 8 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 - Cánh diều
- Giải sgk Âm nhạc 8 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

