Giải SBT Hóa học 10 trang 47 Cánh diều
Với Giải SBT Hóa học 10 trang 47 trong Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học Sách bài tập Hóa 10 Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 10 trang 47.
Giải SBT Hóa học 10 trang 47 Cánh diều
Bài 15.8 trang 47 sách bài tập Hóa học 10: Trong ngành công nghệ lọc hóa dầu, các ankan thường được loại bỏ hydrogen trong các phản ứng dehydro hóa để tạo ra những sản phẩm hydrocarbon không no có nhiều ứng dụng trong công nghiệp. Hãy tính biến thiên enthalpy chuẩn của các phản ứng sau dựa vào năng lượng liên kết. (Giá trị một số năng lượng liên kết được cho trong Phụ lục 2, SGK Hóa học 10, Cánh Diều)
a) H3C – CH2 – CH2 – CH3 → CH2 = CH – CH = CH2 + 2H2
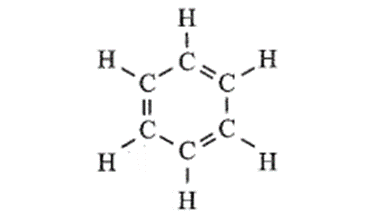
b) 6CH4 → C6H6 (1,3,5 – cyclohexatriene) + 9H2
Cho biết công thức cấu tạo của 1,3,5 – cyclohexatriene như sau:
Các phản ứng trên có thuận lợi về phương diện nhiệt hay không? Phản ứng theo chiều ngược lại có biến thiên enthalpy bằng bao nhiêu?
Lời giải:
a) H3C – CH2 – CH2 – CH3 → CH2 = CH – CH = CH2 + 2H2
b) 6CH4 → C6H6 + 9H2
Các phản ứng này không thuận lợi về phương diện nhiệt.
Phản ứng theo chiều ngược lại thuận lợi về phương diện nhiệt:
Bài 15.9 trang 47 sách bài tập Hóa học 10: Bằng cách tính biến thiên enthalpy chuẩn của quá trình sau dựa vào năng lượng liên kết, hãy chỉ ra ở điều kiện chuẩn, H3C – CH2 – OH hay H3C – O – CH3 bền hơn.
H3C – CH2 – OH (g) → H3C – O – CH3 (g)
Lời giải:
CH3CH2OH có 1 liên kết C – C; 5 liên kết C – H; 1 liên kết C – O và 1 liên kết O – H.
CH3OCH3 có 6 liên kết C – H và 2 liên kết C – O.
Quá trình đã cho có biến thiên enthalpy chuẩn là:
chứng tỏ ở điều kiện chuẩn CH3CH2OH bền hơn CH3OCH3.
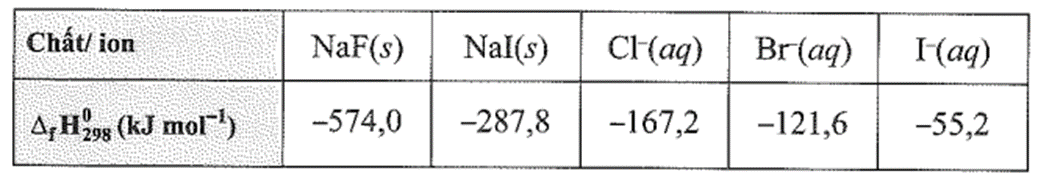
Bài 15.10 trang 47 sách bài tập Hóa học 10: Xét các phản ứng thế trong dãy halogen ở điều kiện chuẩn:
(1)
(2)
(3)
(4)
Hay còn viết:
(5)
Hay còn viết:
a) Từ các giá trị của enthapyl hình thành chuẩn, hãy tính biến thiên enthalpy chuẩn của các phản ứng thế trên.
(Các giá trị khác được cho trong Phụ lục 3, SGK Hóa học 10, Cánh Diều).
b) Nhận xét sự thuận lợi về phương diện nhiệt của các phản ứng thế trong dãy halogen. Kết quả này có phù hợp với quy luật biến đổi tính phi kim của dãy halogen trong bảng tuần hoàn các nguyên tố hóa học không?
Lời giải:
(1)
(2)
(3)
(4)
Hay còn viết:
(5)
Hay còn viết:
b) Kết quả này có phù hợp với quy luật biến đổi tính phi kim của dãy halogen trong bảng tuần hoàn các nguyên tố hóa học.
Cụ thể, các giá trị biến thiên enthalpy chuẩn đều âm thể hiện quá trình diễn ra thuận lợi về phương diện nhiệt; quy luật tính chất oxi hóa của X: halogen có tính oxi hóa mạnh đẩy được halogen có tính oxi hóa yếu hơn ra khỏi muối của nó.
Lời giải SBT Hóa 10 Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học hay khác:
- Giải SBT Hóa học 10 trang 44
- Giải SBT Hóa học 10 trang 45
- Giải SBT Hóa học 10 trang 46
- Giải SBT Hóa học 10 trang 48
Xem thêm lời giải sách bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Cánh diều
- Giải Chuyên đề Hóa học 10 Cánh diều
- Giải SBT Hóa học 10 Cánh diều
- Giải lớp 10 Cánh diều (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều

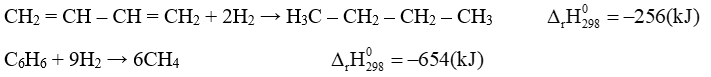



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

