Giải SBT Hóa học 10 trang 60 Cánh diều
Với Giải SBT Hóa học 10 trang 60 trong Bài 17: Nguyên tố và đơn chất halogen Sách bài tập Hóa 10 Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 10 trang 60.
Giải SBT Hóa học 10 trang 60 Cánh diều
Bài 17.17 trang 60 sách bài tập Hóa học 10: Iodine là chất rắn, ít tan trong nước, nhưng lại tan khá dễ dàng trong dung dịch potassium iodide là do phản ứng sau:
I2 (s) + KI (aq) → KI3 (aq)
Vai trò của KI trong phản ứng trên là gì?
A. Chất oxi hóa.
B. Chất khử.
C. Vừa là chất oxi hóa, vừa là chất khử.
D. Không phải là chất oxi hóa cũng không phải là chất khử.
Lời giải:
Đáp án đúng là: D
Có thể nhận thấy potassium không thay đổi số oxi hóa (+1 trong các hợp chất).
Số oxi hóa của iodine trong đơn chất và potassium iodide lần lượt là 0 và -1 và giữa chúng không có số oxi hóa trung gian.
Như vậy, trong phản ứng này không có sự thay đổi số oxi hóa của các nguyên tố, do đó không phải là phản ứng oxi hóa – khử.
Thực tế, phản ứng này là sự kết hợp giữa ion I- và phân tử I2 tạo ion I3- bằng một liên kết cho – nhận.
Trong thực tế, phản ứng này giúp chuyển iodine (I2, ít tan trong nước) thành ion triodine (I3-, tan tốt trong nước) phân tán dễ dàng vào dung dịch. Dung dịch này có tính sát khuẩn.
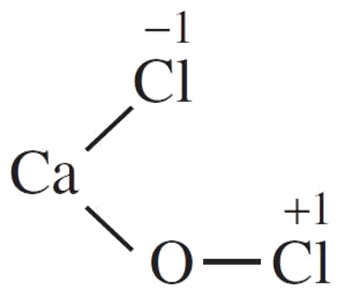
Bài 17.18 trang 60 sách bài tập Hóa học 10: Calcium chloride hypochlorite (CaOCl2) thường được dùng làm chất khử trùng bể bơi do có tính oxi hóa mạnh tương tự nước Javel. Tìm hiểu thêm về công thức cấu tạo của CaOCl2, từ đó, biết được số oxi hóa của nguyên tử chlorine trong hợp chất trên là
A. +1 và -1.
B. -1.
C. 0 và -1.
D. 0.
Lời giải:
Đáp án đúng là: A
CaOCl2 là muối hỗn tạp, được tạo nên bởi 1 cation kim loại và 2 anion gốc axit.
Công thức cấu tạo của CaOCl2 là:
Bài 17.19 trang 60 sách bài tập Hóa học 10: Xét các phản ứng:
với X lần lượt là Cl, Br, I.
Giá trị năng lượng liên kết (kJ mol-1) một số chất được cho trong Phụ lục 2, SGK Hóa học 10, Cánh Diều.
a) Hãy tính biến thiên enthalpy chuẩn của mỗi phản ứng (*).
b) Hãy sắp xếp các phản ứng (*) theo thứ tự giảm dần của nhiệt lượng tỏa ra.
Lời giải:
a) Xét các phản ứng:
Biến thiên enthalpy chuẩn được tính theo công thức:
Với phản ứng:
Cl2(g) + H2(g) → 2HCl(g)
= (243 + 436) – 2 × 431 = -183 (kJ)
Với phản ứng:
Br2(g) + H2(g) → 2HBr(g)
= (193 + 436) – 2 × 364 = -99 (kJ).
Với phản ứng:
I2(g) + H2(g) → 2HI(g)
= (151 + 436) – 2 × 297 = -7 (kJ).
b) Nhiệt lượng tỏa ra trong phản ứng của Cl2 > Br2 > I2.
Phản ứng có giá trị biến thiên enthalpy chuẩn càng âm thì tỏa nhiệt càng nhiều.
Lời giải SBT Hóa 10 Bài 17: Nguyên tố và đơn chất halogen hay khác:
- Giải SBT Hóa học 10 trang 56
- Giải SBT Hóa học 10 trang 57
- Giải SBT Hóa học 10 trang 58
- Giải SBT Hóa học 10 trang 59
- Giải SBT Hóa học 10 trang 61
Xem thêm lời giải sách bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Cánh diều
- Giải Chuyên đề Hóa học 10 Cánh diều
- Giải SBT Hóa học 10 Cánh diều
- Giải lớp 10 Cánh diều (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

