Giải SBT Hóa học 10 trang 47 Kết nối tri thức
Với Giải SBT Hóa học 10 trang 47 trong Bài 17: Biến thiên enthalpy trong các phản ứng hóa học Sách bài tập Hóa 10 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Hóa học 10 trang 47.
Giải SBT Hóa học 10 trang 47 Kết nối tri thức
Bài 17.9 trang 47 SGK Hóa học 10: Tính biến thiên enthalpy theo các phương trình phản ứng sau, biết nhiệt sinh của NH3 bằng -46 kJ/mol
N2(g) + 3H2(g) → 2NH3(g) (1)
N(g) + H2(g) → NH3(g) (2)
So sánh ∆H (1) và ∆H (2). Khi tổng hợp được 1 tấn NH3 thì nhiệt lượng tỏa ra hay thu vào là bao nhiêu? Tính theo hai phương trình phản ứng trên thì kết quả thu được giống nhau hay khác nhau.
Lời giải:
Áp dụng công thức tính:
Chú ý: Nhiệt tạo thành (nhiệt sinh) của đơn chất bằng 0
∆H (1) = 2.(-46) – 0 – 0 = -92 (kJ).
∆H (2) = (-46) – 0 – 0 = -46 (kJ).
Phản ứng tỏa nhiệt và ∆H (1) = 2.∆H (2)
Khi tông hợp 17 gam NH3 thì tỏa ra 46 kJ nhiệt lượng.
⇒ Khi tổng hợp 1 tấn NH3 thì nhiệt lượng tỏa ra ==2,7.
Tính theo 2 phương trình phản ứng đều ra kết quả giống nhau.
Bài 17.10 trang 47 SGK Hóa học 10: Cho các phản ứng sau:
CaCO3(s) → CaO + CO2(g) (1)
C(graphite) + O2 → CO2(g) (2)
Tính biến thiên enthalpy của các phản ứng trên. (Biết nhiệt sinh (kJ/mol) của CaCO3, CaO và CO2 lần lượt là -1 207, -635 và -393,5).
Lời giải:
CaCO3(s) → CaO + CO2(g) (1)
C(graphite) + O2 → CO2(g) (2)
Bài 17.11 trang 47 SGK Hóa học 10: Cho các phản ứng sau và biến thiên enthalpy chuẩn:
(1) 2NaHCO3(s) → Na2CO3(s) + H2O(l) + CO2(g) = +20,33 kJ
(2) 4NH3(g) + 3O2(g) → 2N2(g) + 6H2O(l) = -1 531 kJ
Phản ứng nào tỏa nhiệt? Phản ứng nào thu nhiệt?
Lời giải:
Phản ứng (1) có = +20,33 kJ > 0 là phản ứng thu nhiệt
Phản ứng (2) có = -1 531 kJ < 0 là phản ứng tỏa nhiệt
Bài 17.12 trang 47 SGK Hóa học 10: Phản ứng giữa khí nitrogen và oxygen chỉ xảy ra ở nhiệt độ cao (3 000oC) hoặc nhờ tia lửa điện: N2(g) + O2(g) → 2NO(g)
b) Phản ứng trên tỏa nhiệt hay thu nhiệt?
b) Bằng kiến thức về năng lượng liên kết trong phân tử các chất, hãy giải thích vì sao phản ứng trên khó xảy ra.
Lời giải:
a) Phản ứng trên chỉ xảy ra khi nhận nhiệt bên ngoài, đó là phản ứng thu nhiệt.
b) Do năng lượng liên kết trong phân tử các chất phản ứng rất lớn (N2: 945 kJ/mol, O2: 494 kJ/mol) so với sản phẩm (NO: 607 kJ/mol) nên phản ứng trên khó xảy ra.
= Eb(N2) + Eb(O2) – 2.Eb(NO)
= Eb(N≡N) + Eb(O=O) – 2.Eb(N=O)
= 945 + 494 – 2.607 = 225 kJ
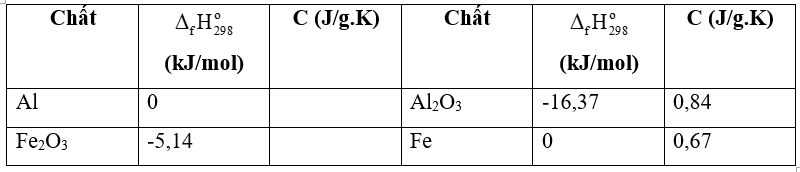
Bài 17.13 trang 47 SGK Hóa học 10: Cho phản ứng nhiệt nhôm sau:
2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s)
Biết nhiệt tạo thành, nhiệt dung của các chất (nhiệt lượng cần cung cấp để 1 kg chất đó tăng lên 1 độ) được cho trong bảng sau:
Giả thiết phản ứng xảy ra vừa đủ, hiệu suất 100%; nhiệt độ ban đầu là 25oC; nhiệt lượng tỏa ra bị thất thoát ngoài môi trường là 50%. Tính nhiệt độ đạt được trong lò phản ứng nhiệt nhôm.
Lời giải:
Xét phản ứng giữa 2 mol Al với 1 mol Fe2O3 tạo ra 1 mol Al2O3 và 2 mol Fe.
Biến thiên enthalpy của phản ứng:
= (Al2O3) + 2. (Fe) – 2. (Al) - (Fe2O3)
= 1. (-16,37) + 2.0 – 2.0 – 1.(-5,14) = -21,51 (kJ)
Nhiệt dung của sản phẩm: C = 102.0,84 + 2.56.0,67 = 160,72 (J.K-1).
Áp dụng công thức Q = m.C. ∆T
⇒ Nhiệt độ tăng lên: ∆T =
Nhiệt độ đạt được = (25 + 273) + 66,92 = 365 (K)
Lời giải SBT Hóa 10 Bài 17: Biến thiên enthalpy trong các phản ứng hóa học hay khác:
Xem thêm lời giải Sách bài tập Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
- SBT Hóa 10 Bài 18: Ôn tập chương 5
- SBT Hóa 10 Bài 19: Tốc độ phản ứng
- SBT Hóa 10 Bài 20: Ôn tập chương 6
- SBT Hóa 10 Bài 21: Nhóm halogen
- SBT Hóa 10 Bài 22: Hydrogen halide. Muối halide
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Kết nối tri thức
- Giải Chuyên đề Hóa học 10 Kết nối tri thức
- Giải SBT Hóa học 10 Kết nối tri thức
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT

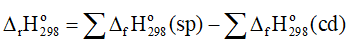

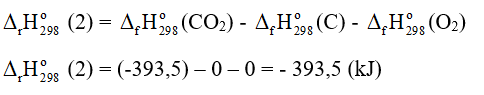



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

