Giải SBT Hóa học 10 trang 9 Kết nối tri thức
Với Giải SBT Hóa học 10 trang 9 trong Bài 3: Cấu trúc lớp vỏ electron nguyên tử Sách bài tập Hóa học lớp 10 Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa 10 trang 9.
- Bài 3.11 trang 9 SBT Hóa học 10
- Bài 3.12 trang 9 SBT Hóa học 10
- Bài 3.13 trang 9 SBT Hóa học 10
- Bài 3.14 trang 9 SBT Hóa học 10
- Bài 3.15 trang 9 SBT Hóa học 10
- Bài 3.16 trang 9 SBT Hóa học 10
- Bài 3.17 trang 9 SBT Hóa học 10
- Bài 3.18 trang 9 SBT Hóa học 10
- Bài 3.19 trang 9 SBT Hóa học 10
- Bài 3.20 trang 9 SBT Hóa học 10
- Bài 3.21 trang 9 SBT Hóa học 10
- Bài 3.22 trang 9 SBT Hóa học 10
Giải SBT Hóa học 10 trang 9 Kết nối tri thức
Bài 3.11 trang 9 SBT Hóa học 10: Phân lớp 3d có số electron tối đa là
A. 6
B. 18
C. 14
D. 10
Lời giải:
Đáp án đúng là: D
Phân lớp d có 5 AO. Mỗi AO chứa tối đa 2 electron
⇒Phân lớp 3d có số electron tối đa là 5.2 = 10 electron.
Bài 3.12 trang 9 SBT Hóa học 10: Lớp L có số phân lớp electron bằng
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án đúng là: B
Số phân lớp trong mỗi lớp bằng số thứ tự của lớp (n ≤ 4)
Phân lớp L (n = 2) có 2 phân lớp là 2s và 2p.
Bài 3.13 trang 9 SBT Hóa học 10: Lớp M có số orbital tối đa bằng
A. 3
B. 4
C. 9
D. 18
Lời giải:
Đáp án đúng là: C
Trong lớp electron thứ n có n2 AO (n ≤ 4)
Lớp M (n = 3) có 32 = 9 AO
Bài 3.14 trang 9 SBT Hóa học 10: Lớp M có số electron tối đa bằng
A. 3
B. 4
C. 9
D. 18
Lời giải:
Đáp án đúng là: D
Trong lớp electron thứ n có n2 AO (n ≤ 4)
Mỗi AO chứa tối đa 2 electron
⇒Lớp M (n = 3) có số electron tối đa bằng 2.32 =18 electron.
Bài 3.15 trang 9 SBT Hóa học 10: Các electron của nguyên tử nguyên tố X được phân bố trên ba lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
A. 6
B. 8
C. 14
D. 16
Lời giải:
Đáp án đúng là: D
Theo chiều tăng của mức năng lượng: 1s 2s 2p 3s 3p 4s …
Lớp thứ 3 có 6 electron ⇒ 2 electron được điền vào 3s và 4 electron được điền vào 3p
Cấu hình electron của X là: 1s2 2s2 2p6 3s2 3p4
Bài 3.16 trang 9 SBT Hóa học 10: Nguyên tố X có Z = 17. Electron lớp ngoài cùng của nguyên tử nguyên tố X thuộc lớp
A. K
B. L
C. M
D. N
Lời giải:
Đáp án đúng là: C
Xcó Z = 17 nên nguyên tử X có 17 electron.
- Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng:
1s 2s 2p 3s 3p 4s …
- Điền các electron vào các phân lớp electron theo nguyên lí vững bền:
1s22s22p63s23p5.
⇒ Cấu hình electron của nguyên tử X là: 1s22s22p63s23p5.
⇒ Electron lớp ngoài cùng của X thuộc lớp thứ 3 (lớp M)
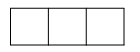
Bài 3.17 trang 9 SBT Hóa học 10: Cách biểu diễn electron trong AO nào sau đây không tuân theo nguyên lí Pauli?
Lời giải:
Đáp án đúng là: B và D
Nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên, nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước.
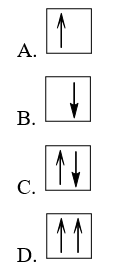
Bài 3.18 trang 9 SBT Hóa học 10: Sự phân bố electron theo ô orbital nào dưới đây là đúng?
Lời giải:
Đáp án đúng là: B
Sự phân bố electron theo ô orbital trên các lớp và phân lớp cần tuân theo nguyên lí Pauli và quy tắc Hund.
Nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
⇒ A, D sai.
+ Quy tắc Hund: Trong cùng một lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
⇒ B đúng, C sai (vì số electron độc thân chưa đạt tối đa)
Bài 3.19 trang 9 SBT Hóa học 10: Dùng ô orbital để mô tả cách sắp xếp electron trong orbital s.
Lời giải:
Nếu orbital s chỉ chứa 1 electron:
Nếu orbital s chứa 2 electron:
Chú ý: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau (nguyên lí Pauli). Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên ( ), nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước (
)
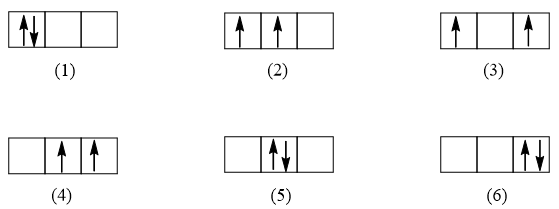
Bài 3.20 trang 9 SBT Hóa học 10: Trường hợp trong orbital p có chứa hai electron thì có những cách nào biểu diễn electron trong orbital đó? Cách nào tuân theo quy tắc Hund?
Lời giải:
Trường hợp orbital p có chứa 2 electron, có rất nhiều cách để biểu diễn 2 electron trong AOp. Ví dụ một số cách:
Tuy có nhiều cách biểu diễn nhưng chỉ có trường hợp (2) tuân theo quy tắc Hund (số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau).
Chú ý: Theo nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau. Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên ( ), nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước (
)
Bài 3.21 trang 9 SBT Hóa học 10: Nêu mối quan hệ về năng lượng của electron trên các orbital, các phân lớp, các lớp electron.
Lời giải:
Mối quan hệ về năng lượng:
- Những electron ở lớp gần hạt nhân bị hút mạnh hơn về phía hạt nhân, vì thế có năng lượng thấp hơn so với những electron ở lớp xa hạt nhân. Mức năng lượng tăng dần theo lớp electron: K < L < M < N < O < …
- Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau. Mức năng lượng tăng dần theo AO: s < p < d < f.
- Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
Bài 3.22 trang 9 SBT Hóa học 10: Cho biết tổng số electron tối đa chứa trong:
a) Phân lớp p;
b) Phân lớp d;
c) Lớp K;
d) Lớp M.
Lời giải:
Chú ý:
+ Lớp electron thứ n có n2 AO (n ≤ 4)
+ Mỗi AO chứa tối đa 2 electron
a) Phân lớp p có 3 AO px, py, pz
Mỗi AO chứa tối đa 2 electron
⇒ Tổng số electron tối đa chứa trong phân lớp p là 2.3 = 6 electron
b) Phân lớp d có 5 AO
Mỗi AO chứa tối đa 2 electron
⇒ Tổng số electron tối đa chứa trong phân lớp d là 2.5 = 10 electron
c) Lớp K (n = 1) có 12 = 1 AO.
⇒ Số electron tối đa trong lớp K là 2.1 = 2 electron.
d) Lớp M (n = 3) có 32 = 9 AO
⇒ Số electron tối đa trong lớp M là 2.9 = 18 electron.
Lời giải SBT Hóa 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử hay khác:
Xem thêm lời giải sách bài tập Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Kết nối tri thức
- Giải Chuyên đề Hóa học 10 Kết nối tri thức
- Giải SBT Hóa học 10 Kết nối tri thức
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

