Đề kiểm tra 1 tiết Hóa học 11 Học kì 1 có đáp án (Bài số 2)
Đề kiểm tra 1 tiết Hóa học 11 Học kì 1 có đáp án (Bài số 2)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Câu 1: Ở nhiệt độ thường nitơ khá trơ về mặt hoạt động là do
A. Nitơ có bán kính nguyên tử nhỏ.
B. Nitơ có độ âm điện lớn nhất trong nhóm.
C. Phân tử nitơ có liên kết ba khá bền.
D. Phân tử nitơ không phân cực.
Đáp án: C
Câu 2: Khi có tia lửa điện hoặc nhiệt đọ cao. Nitơ tác dụng trực tiếp với oxi tạo ra hợp chất X. X tiếp tục tác dụng với oxi trong không khí tạo thành hợp chất Y. Công thức của X, Y lần lượt là
A. N2O, NO. B. NO2, N2O5.
C. NO, NO2 D. N2O5, HNO3.
Đáp án: C
Câu 3: Nitơ có số oxi hóa âm trong hợp chất với nguyên tố nào sau đây ?
A. H. B. Q. C. Cl. D. F.
Đáp án: A
Câu 4: Trong phòng thí nghiệm có thể điều chế N2 bằng cách
A. nhiệt phân NaNO2. B. đun hỗn hợp NaNO2 và NH4Cl.
C. thủy phân Mg3N2. D. phân hủy khí NH3.
Đáp án: B
Câu 5: Trong phòng thí nghiệm thường điều chế HNO3 bằng phản ứng
A. NaNO3 + H2SO4(đ) → HNO3 + NaHSO4.
B. 4NO2 + 2H2O + O2 → 4HNO3.
C. N2O5 + H2O → 2HNO3.
D. 2Cu(NO3)2 + 2H2O →Cu(OH)2 + 2HNO3.
Đáp án: A
Câu 6: Hợp chất X tan trong nước tạo dung dịch không màu. Dung dịch này không tạo kết tủa với dung dịch BaCl2, khi phản ứng với NaOH tạo ra khí có mùi khai, khi phản ứng với dung dịch HCl tạo ra khí làm đục nước vôi trong và làm mất màu dung dịch thuốc tím. Chất này là
A.NH4HSO3. B. Na2SO3.
C. NH4HCO3. D. (NH4)2CO3.
Đáp án: A
Câu 7: Khi nhiệt phân, dãy muối rắn nào dưới đây đều sinh ra một khí duy nhất ?
A. KNO3 , Ca(NO3)2. B. AgNO3, Hg(NO3)2.
C. KNO3 , AgNO3. D. Ca(NO3)2, Mg(NO3)2.
Đáp án: A
Câu 8: Phản ứng nhiệt không đúng là
A. 2KNO3 →2KNO2 + O2.
B. NH4NO3 →N2 + 2H2O.
C. NH4Cl →NH3 + HCl.
D. 2NaHCO3 →NaCO3 + CO2 + H2O.
Đáp án: B
Câu 9: Đem nung các chất sau: KNO3, NH4NO3, NH4NO2, NH4Cl, Ba(HCO3)2, AgNO3, NH4HCO3, FeCO3, Cu(NO3)2. Số chất khí (không kể hơi nước) thu được là
A. 7. B. 5. C. 8. D. 6.
Đáp án: A
Câu 10: Dãy chuyển hóa dưới đây không thực hiện được ?
A. N2 →NH3 → NO →HNO3
B. NaNO2 →NaNO3 → NO2 →HNO3
C. NH4NO3 →NaNO3 →NO → NO3
D. NO →NO2 →NaNO3 →HNO3.
Đáp án: A
Câu 11: Cho P2O5 tác dụng với dung dịch NaOH thu được một dung dịch gồm hai chất. Hai chất đó có thể là
A. Na3PO4 và H3PO4 . B. NaH2PO4 và Na3PO4 .
C. Na2HPO4 và Na3PO4 . D. NaOH và Na2HPO4 .
Đáp án: C
Câu 12: Cho sơ đồ phản ứng sau :
Ca3(PO4)2 → X →Y →Ag3PO4
Cặp chất X, Y là
A. P, P2O5 . B. P, H3PO4
C. H3PO4 , K3PO4. D. P2O5 , K3PO4.
Đáp án: C
Câu 13: Phản ứng nào sau đây không xảy ra ?
A. H3PO4 + Ca(H2PO4)2 B. Na3PO4 + Ca(H2PO4)2
C. Ca(H2PO4)2 + NaOH D. Ca3(PO4)2 + H3PO4.
Đáp án: A
Câu 14: Cho sơ đồ sau : X + Y Ca3(PO4)2 + H2O, Số cặp chất X, Y thỏa mãn là
A. 6. B. 5. C. 3. D. 4.
Đáp án: A
Câu 15: Amophot là hỗn hợp các muối
A. (NH4)3PO4 và (NH4)2HPO4. B. (NH4)2HPO4 và NH4H2PO4. C. (NH4)3PO4 và KH2PO4. D. KH2PO4 và (NH4)3PO4.Đáp án: B
Câu 16: Nung một lượng NH3 trong bình kín. Sau một thời gian đưa về nhiệt độ ban đầu thấy áp suất khí trong bình tăng 1,5 lần so với áp suất ban đầu. Tỉ lệ NH3 bị phân hủy là
A. 25%. B. 33%. C. 50%. D. 67%.
Đáp án: C
2NH3 → N2 + 3H2
Áp suất trong bình sau tăng 1,5 lần so với ban đầu ⇒ (ntrước)/(nsau) = 2/3
Giả sử ban đầu có 2 mol NH3, x là số mol NH3 bị phân hủy
nsau = nNH3 dư + nN2 + nH2 = 2 – x + 0,5x + 1,5x = 3 mol
⇒ x = 1 ⇒ 50% NH3 phân hủy
Câu 17: Cho 2,3 gam Na vào 200 ml dung dịch (NH4)2SO4 1M,Đun nóng thu được V lít khí (đktc). Giá trị của V là
A. 1,12. B. 2,24. C. 3,36. D. 10,08.
Đáp án: C
nNH4+ = 0,4 mol; nOH- = nNa = 0,1 mol = 2 nH2 ⇒ nH2 = 0,05
Ta có nOH- < nNH4+ ⇒ nNH3 = nOH- = 0,1 mol
⇒ V = (0,05 + 0,1). 22,4 = 3,36 lít
Câu 18: Cho 14,8 gam Ca(OH)2 vào 150 gam dung dịch (NH4)2SO4 26,4% rồi đun nóng thu được V lít (đktc) khí X (giả sử toàn bộ khí sinh ra thoát ra khí dung dịch ). Để đốt cháy hết V lít khí X trên cần vừa đủ lượng O2 sinh ra khi nung m gam KClO3 (có xúc tác). Giá trị của m là
A. 24,5. B. 49. C. 36,75. D. 12,25.
Đáp án: A
nCa(OH)2 = 0,2 ⇒ nOH- = 0,4 mol
n(NH4)2SO4 = 0,3 mol ⇒ nNH4+ = 0,6 mol
nOH- < nNH4+ ⇒ nNH3 = 0,4 mol
4NH3 + 3O2 → 2N2 + 6H2O
nO2 = 3/4. nNH3 = 0,3 mol
KClO3 -toC→ KCl + 3/2 O2
nKClO3 = 2/3 nO2 = 0,2 mol ⇒ m = 24,5 gam
Câu 19: Cho 3 gam Al phản ứng vừa đủ với dung dịch chứa 28 gam HNO3 thu được khí X và dung dịch không chứa NH4NO3. Khí X là
A. N2. B. N2O. C. NO. D. NO2.
Đáp án: C
Số OXH của N trong khí X là N+(5-z)
nAl = 1/9 ⇒ nNO3- (muối) = 1/3
Ta có: z.(28/63 - 1/3) = 1/9z = 1/3 ⇒ z = 3 ⇒ NO
Câu 20: Cho 3,58 gam Al phản ứng vừa đủ với dung dịch chứa 28 gam HNO3 dư thu được 0,04 mol NO và 0,06 mol NO2 và dung dịch chứa m gam muối nitrat (không có NH4NO3). Giá trị của m là
A. 9,78. B. 11,02. C. 14,74. D. 17,22.
Đáp án: C
ne = 0,04.3 + 0,06.1 = 0,18 (mol)
ne = nNO3- (muối) ⇒ m = 3,58 + 62.0,18 = 14,74 (gam)
Câu 21: Nung 18,96 ham hỗn hợp X gồm Cu, Cu(NO3)2 trong bình kín không chứa không khí đến khi phản ứng hoàn toàn thu được m gam rắn Y. Để hòa tan hết Y cần dùng 400 ml dung dịch HNO3 1M thu được a mol khí NO (sản phẩm khử duy nhất). Giá trị của m và a lần lượt là
A. 12,48 và 0,08 B. 13,44 và 0,04
C. 12,48 và 0,04 D. 13,44 và 0,08
Đáp án: B
nCu = x mol; nCu(NO3)2 = y mol
64x + 188y = 18,96 gam (1)
2Cu(NO3)2 (y) -toC→ 2CuO (y) + 4NO2 + O2 (y/2 mol)
2Cu (y) + O2 (y/2) -toC→ 2CuO (y mol)
Y + HNO3 → Khí ⇒ Trong Y có Cu dư, O2 sinh ra tác dụng hết với Cu
nC dư = (x – y) mol
Y:
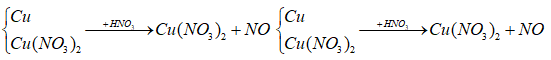
Bảo toàn e ta có: nNO = 2/3 nCu dư = 2/3(x - y)
Bảo toàn N ta có: nHNO3 = 2nCu(NO3)2 + nNO = 2(x + y) + 2/3 (x - y) = 0,4
⇒ 8/3x + 4/3y = 0,4 (2)
Từ (1)(2) ⇒ x = 0,12 mol; y = 0,06 mol
⇒ m = mCuO + mCu = 2y.80 + (x - y).64 = 13.44 gam
⇒ a = 2/3(x - y) = 0,04 mol
Câu 22: Nung 2,23 gam hỗn hợp X gồm các kim loại Fe, Al, Zn, Mg trong oxi, sau một thời gian thu được 2,71 gam hỗn hợp Y. Hòa tan hoàn toàn Y vào dung dịch HNO3 dư, thu được 0,672 lít khí NO (sản phẩm khử duy nhất, (đktc)). Số molHNO3 đã phản ứng là
A. 0,18. B. 0,15. C. 0,16. D. 0,12.
Đáp án: A
mO = 2,71 – 2,23 = 0,48 (gam) ⇒ nO = 0,03 mol ⇒ O nhận 0,06 mol e
nNO = 0,03 mol ⇒ N+5 nhận 0,09 mol e
⇒ Kim loại cho số mol e = 0,06 + 0,09 = 0,15
⇒nNO3- (muối) = 0,15
nHNO3p/ư = nNO3- (muối) + nN trong X = 0,15 + 0,04 = 0,18 mol
Câu 23: Hòa tan 19 gam Cu vào 500 ml dung dịch NaNO3 1M sau đó thêm vào 500 ml dung dịch HCl 2M. Kết thúc phản ứng thu được dung dịch X và khí NO duy nhất. Phải thêm bao nhiêu ml dung dịch NaOH 1M vào X để kết tủa hết Cu2+ ?
A. 600 ml. B. 800 ml. C. 400 ml. D. 120 ml.
Đáp án: B
nCu = 0,3mol; nNO3- = nNaNO3 = 0,5 mol; nH+ = 1 mol
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
⇒ Cu phản ứng hết; nCu2+ = nCu = 0,3 mol; nH+ dư = 0,2 mol
nOH- = 2nCu2+ + nH+ dư = 2.0,3 + 0,2= 0,8
⇒ VNaOH = 800ml
Câu 24: Nung nóng hoàn toàn 27,3 gam hỗn hợp NaNO3, Cu(NO3)2. Hỗn hợp khí thoát ra được dẫn vào nước dư thì thấy có 1,12 lít khí (đktc) khong bị hấp thụ (lượng O2 hòa tan không đáng kể). Khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
A. 9,4 gam. B. 10,3 gam. C. 14,1 gam. D. 18,8 gam.
Đáp án: D
nNaNO3 = x mol; nCu(NO3)2 = y mol
85x + 188y = 27,3 gam (1)
2NaNO3 -toC→ 2NaNO2 + O2
2Cu(NO3)2 -toC→ 2CuO + 4NO2 + O2
Khí không bị hấp thụ bởi H2O là khí oxi dư
4NO2 (2y) + O2 (y/2) + 2H2O → 4HNO3
x/2 + y/2 - y/2 = 0,05 mol ⇒ x = 0,1 mol
⇒ y = 0,1 mol ⇒ mCu(NO3)2 = 18,8 gam
Câu 25: Nhiệt phân hoàn toàn hỗn hợp x mol AgNO3 và y mol Cu(NO3)2 được hỗn hợp khí có Mtb = 42,5. Tỉ số bằng:
A. 1. B. 2. C. 3. D. 4.
Đáp án: A
2Cu(NO3)2 (y) -toC→ 2CuO + 4NO2 (2y) + O2 (y/2 mol)
2AgNO3 (x) -toC→ 2Ag + 2NO2 (x) + O2 (x/2 mol)
mNO2 + mO2 = (x + 2y). 46 + 32. (x/2 + y/2) = 62x + 108y
nNO2 + nO2 = 2y + x + x/2 + y/2 = 1,5x + 2,5y
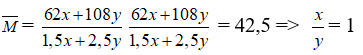
Câu 26: Cho một miếng photpho vào 600 gam dung dịch HNO3 18,9%. Phản ứng tạo H3PO4 và NO. Dung dịch sau phản ứng có tính axit và phải trung hòa bằng 3 lít dung dịch NaOH 1M. Khối lượng miếng photpho ban đầu là
A. 31 gam. B. 37,2 gam. C. 27,9 gam. D. 24,8 gam.
Đáp án: C
nHNO3 = 1,8 mol
3P (x) + 5HNO3 (5x/3) + 2H2O → 3H3PO4 (x mol) + 5NO
nHNO3dư = 1,8 – 5x/3
nNaOH = nHNO3 + 3nH3PO4 = 1,8 – 5x/3 + 3x = 3
⇒ x = 0,9 ⇒ mP = 27,9 gam
Câu 27: Cho phản ứng sau :
KMnO4 + PH3 + H2SO4 → K2SO4 + MnO2 + H3PO4 + H2O
Sau khi cân bằng phản ứng hệ số của PH3 và H2SO4 tương ứng là a và b. TỈ lệ a : b cố giá trị là
A. 5 : 4. B. 5 : 6. C. 3 : 4. D. 3 : 6.
Đáp án: C
Câu 28: Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng với 50 gam dung dịch NaOH 32%. Muối tạo thành trong dung dịch phản ứng là
A. Na2HPO4 B. Na2PO4 .
C. NaH2PO4. D. Na2HPO4 , NaH2PO4.
Đáp án: A
nP = 0,2 mol ⇒ nH3PO4 = 0,2 mol
nNaOH = 0,4 mol
nNaOH : nH3PO4 = 2: 1 => Tạo muối Na2HPO4
Câu 29: Cho a mol P2O5 vào 200 ml dung dịch NaOH 2,75M thì thu được dung dịch chứa b mol NaH2PO4 và 0,15 mol Na2HPO4. Giá trị của a và b là
A. a = 0,2 và b = 0,25. B. a = 0,4 và b = 0,25.
C. a = 0,4 và b = 0,5. D. a = 0,2 và b = 0,5.
Đáp án: A
nNaOH = 0,55 mol;
Bảo toàn Na ta có: nNa+ = nNaH2PO4 + 2nNa2HPO4 = b + 2.0,15 = 0,55
⇒ b = 0,25 mol
Bảo toàn P: a = nP2O5 = 1/2. nNaH2PO4 + 1/2. nNa2HPO4 = 0,2 mol
Câu 30: Thủy phân hoàn toàn 7,506 gam halogenua của photpho (V) thu được hỗn hợp X gồm hai axit. Để trung hòa hoàn toàn hỗn hợp X cần 240 ml dung dịch NaOH 1,2M. Halogen đó là
A. F. B. Cl. C. Br. D. I.
Đáp án: B
PX5 (x) + 3H2O → H3PO4 (x) + 5HX (5x mol)
nNaOH = 3nH3PO4 + nHX = 8x = 0,288
⇒ x = 0,036 ⇒ PX5 = 208,5 ⇒ X = 35,5 (Cl)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm Bài tập & Câu hỏi trắc nghiệm Hóa học 11 có đáp án khác:
- 15 bài tập trắc nghiệm Cacbon (có đáp án)
- 18 bài tập trắc nghiệm Hợp chất của cacbon (có đáp án)
- 15 bài tập trắc nghiệm Silic và hợp chất của silic (có đáp án)
- 15 bài tập trắc nghiệm Tính chất của cacbon, silic (có đáp án)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

